肥胖与脂肪组织重构
2016-03-21杨永玉胡长平
杨永玉,胡长平
( 1.中南大学药学院药理学系,湖南长沙 410078;2.中南大学湘雅二医院药学部,湖南长沙 410011)
肥胖与脂肪组织重构
杨永玉1,2,胡长平1
( 1.中南大学药学院药理学系,湖南长沙410078;2.中南大学湘雅二医院药学部,湖南长沙410011)
中国图书分类号: R-05; R329.52; R364.3; R364.5; R589.2
摘要:肥胖是糖尿病、动脉粥样硬化、高脂血症和癌症发生发展的主要危险因素。肥胖发生时伴随着脂肪组织的重构,主要表现为各种细胞组成和功能的改变、血管新生、细胞外基质重构和炎症细胞浸润。深入研究脂肪组织重构对肥胖的防治具有重要意义。该文就肥胖发生时脂肪组织重构的最新研究进展进行综述。
关键词:肥胖;脂肪组织重构;细胞外基质;血管新生;炎症;代谢健康型肥胖
胡长平( 1969-),男,博士,教授,博士生导师,研究方向:心血管药理学、呼吸药理学,通讯作者,E-mail: huchangping@ yahoo.com
肥胖是由于能量摄入与能量消耗失衡所导致的体内脂质过多堆积,是当今全球普遍性的公共健康问题。在过去的半个世纪,由于物质资源的极大丰富,肥胖在发达国家流行,并向发展中国家蔓延。肥胖已经成为一个世界范围的问题,以至于世界卫生组织( World Health Organization,WHO)把这种蔓延之势的现象命名为“全球性肥胖症”( globesity)[1]。肥胖是遗传因素与环境因素共同作用所导致的营养代谢症,现有的研究表明,肥胖是导致胰岛素抵抗、动脉粥样硬化、高血压、高血脂以及癌症的危险因素之一。机体能量过剩或缺乏会引起脂肪组织体积变化,动态地改变细胞组成、功能以及组织结构,称之为脂肪组织重构( adipose tissue remodeling)[2]。脂肪组织重构包括各种细胞类型的变化、血管新生、炎症细胞浸润以及细胞外基质重构。深入研究脂肪组织如何发生重构对理解肥胖相关疾病的发生以及防治提供新的思路与策略。
1 脂肪生成和脂肪组织重构
1.1脂肪组织构成脂肪组织由不同类型的细胞组成,包括脂肪细胞、前脂肪细胞、内皮细胞、神经细胞、成纤维细胞、脂肪细胞祖细胞和免疫细胞等,这些细胞被细胞外基质包裹、连接,共同构成脂肪组织。在脂肪组织中,脂肪细胞是主要的组成细胞,其他细胞如血管内皮细胞、免疫细胞和基质血管细胞在脂肪组织代谢和信号功能中有重要作用。脂肪组织由白色脂肪组织( white adipose tissue,WAT)、褐色脂肪组织( brown adipose tissue,BAT)以及米色脂肪组织( beige adipose tissue)组成。白色脂肪组织是机体存储脂质的主要位点,在机体能量平衡方面发挥重要作用。褐色脂肪组织是能量消耗、产热组织,在平衡能量代谢和对抗肥胖中起着重要作用[3]。但是褐色脂肪组织在婴儿时期含量较多,而成人只在锁骨、颈部和肩胛区有分布。米色脂肪组织具有白色脂肪组织的形态和褐色脂肪组织的功能特性。
1.2脂肪细胞的增生和肥大肥胖的发生主要与白色脂肪的过量生成有关。两个不同的机制能导致脂肪组织的体积增大,即脂肪细胞体积的增大(肥大)和脂肪细胞数目的增多(增生)。在脂肪细胞中,脂滴占整个细胞体积和重量的绝大部分。脂滴由中性的疏水性脂质如TG和胆固醇酯构成核心,外围分布有亲水性的磷脂、卵磷脂、磷脂酰乙醇胺和蛋白。在白色脂肪细胞中,TG占有主要地位。当机体能量摄入大于能量消耗时,脂肪细胞的肥大先于脂肪细胞的生成。源于食物和自身肝脏合成的自由脂肪酸( free fatty acid,FFA)与甘油形成甘油三酯( triglyceride,TG)后,被极低密度脂蛋白运输至脂肪组织。极低密度脂蛋白被上皮细胞的脂蛋白酯酶( lipoproteins lipases,LPLs)水解成为FFA和甘油,FFA被脂肪细胞摄取合成TG,存储在脂肪细胞中。TG的形成需要甘油-3-磷酸酰基转移酶( glycerol-3-phosphate acyltransferase,GPAT)、1-酰甘油-3-磷酸酰基转移酶( 1-acylglycerol-3-phosphate acyltransferase,AGPAT)和二酰甘油酰基转移酶( diacylglycerol acyltransferase,DGAT)的参与。第一步也是限速过程,是GPAT催化酰基辅酶A和甘油-3-磷酸形成1-酰甘油3磷酸。脂肪细胞表达几种GPAT的异构体,可以催化TG的合成[6]。脂肪组织也是人体内胆固醇储存的主要部位,脂肪细胞内的胆固醇绝大部分是以非酯化的形式存在,只有5%的胆固醇被酯化。脂肪细胞中胆固醇的含量与细胞大小密切相关,肥胖主要是TG过度存储的结果,同时,肥胖个体胆固醇的存量也大量增加。脂肪组织有15%-50%的细胞是前脂肪细胞,在能量过剩时它们接收胞外信号刺激分化为脂肪细胞,具有抵抗脂毒性作用[4]。如果脂肪生成的能力受限,或者由于前脂肪细胞的数量不足或者分化能力降低,已有脂肪细胞的肥大将会占有主体地位[5]。当机体能量缺乏时,TG的脂解产生FFA和甘油,脂解生成的FFA释放入血供其它组织利用,多余的FFA可被细胞重新利用,合成TG。
尽管有许多研究表明成人肥胖主要是由脂肪细胞的肥大导致,青少年肥胖是由于脂肪细胞的增生而引起。研究表明,成年早期脂肪细胞的数目相对稳定,但是脂肪细胞以每年约10%的速度更新,单个脂肪细胞的平均寿命为8. 3年。整个机体脂肪细胞的数目被严密控制,以保持机体能量平衡相对稳定。脂肪组织中的细胞类型和数量随着肥胖的发生而改变,研究发现以肥大脂肪细胞为主的脂肪组织中脂肪祖细胞的含量明显减少[7],前脂肪细胞的数目在肥胖患者脂肪组织中也明显减少。肥胖伴随着慢性炎症反应,在肥胖的发生过程中,慢性炎症使基质细胞的细胞类型和数目发生明显变化[8],其机制需要进一步研究。脂肪细胞肥大与机体代谢功能紊乱相关,脂肪组织肥大时影响脂肪细胞的分化效率,在中心性肥胖患者中,皮下前脂肪细胞的分化能力明显降低,原因可能是细胞肥大时表达过量的炎症因子,改变了前脂肪细胞的分化能力。
2 细胞外基质重构
细胞外基质( extracellular matrix,ECM)是存在于细胞之间的动态网状结构,由胶原、蛋白聚糖及糖蛋白等大分子物质组成。这些大分子物质可与细胞表面上的特异性受体结合,通过受体与细胞骨架结构直接发生联系或触发细胞内的一系列信号转导而引起不同的基因表达,从而调控细胞的生长和分化。正常情况下,ECM的产生和降解保持动态平衡,如果ECM产生增多或降解减少,可导致组织ECM积聚;反之,组织内ECM减少。脂肪细胞与其前体细胞被富含胶原、层连蛋白、纤维粘连蛋白和蛋白聚糖的ECM包裹。脂肪细胞分化需要ECM和细胞骨架的重构,以适应脂肪细胞的生长。脂肪组织纤维化降低脂肪组织的弹性,限制脂肪细胞的体积,这是脂肪组织代谢性功能紊乱的标志事件。肥胖个体脂肪组织中发现有大量的胶原沉积,过量的胶原沉积伴随着炎症细胞浸润。
脂肪组织基质重构需要纤维蛋白溶酶原、纤维蛋白溶酶、基质金属蛋白酶( matrix metalloproteinase,MMPs)、解整合素金属蛋白酶( disintegrin and metalloprotease,ADAM)和基质金属蛋白酶抑制剂( tissue inhibitor of metalloproteinase,TIMP)的参与。高脂饮食处理的小鼠脂肪组织中,随着体重的增加,Ⅰ型胶原被迅速清除和更新。Ⅵ型胶原在脂肪组织ECM中含量很高,在高脂饮食情况下,Ⅵ型胶原基因的缺失将导致脂肪细胞无拘束的膨胀,改善整体的代谢稳态[9]。组织蛋白酶( cathepsin,CTS)属木瓜蛋白酶,是一类在酸性环境中被活化的溶酶体蛋白酶,可降解ECM成分,如弹性蛋白和胶原酶。CTS S和CTS K在肥胖脂肪组织中表达升高,CTS K或CTS L基因敲除的小鼠能降低高脂饮食诱导肥胖的发生。ADAM是一类具有解聚素结构域可降解ECM的蛋白酶,其在细胞与细胞、细胞与基质、细胞融合和信号转导中具有重要作用。ADMA12转基因小鼠体重增加,血糖和血脂指标正常,说明ADMA12促进脂肪组织形成,ADMA17基因敲除降低高脂饮食诱导的小鼠体重增加,而新陈代谢旺盛。ADMATS13-/-小鼠在高脂饮食情况下体重没有变化[10]。脂肪细胞肥大引起局部脂肪组织缺氧,低氧能诱导ECM-蛋白加工酶,如赖氨酰氧化酶和脯氨酰-4-羟化酶的变化,这些酶是胶原合成的关键酶[11],它们与肥胖之间的关系,需要进一步的研究。
MMPs是由多种锌离子依赖性酶组成的能降解ECM的重要酶类,几乎能降解ECM的所有成分,如胶原、明胶、粘性蛋白、纤维粘连蛋白、蛋白多糖等。基质金属蛋白酶在肥胖个体脂肪组织中表达升高,以增加基质降解,适应由于脂肪细胞肥大造成的ECM重构。基质金属蛋白酶14( matrix metalloproteinase-14,MT1-MMP14)在调节白色脂肪形成和功能中发挥必要的作用,其在体内、体外影响脂肪细胞的分化。MT1-MMP14的突变导致脂肪组织中充满了稠密的胶原纤维,脂肪组织胶原网络重构发生障碍,脂肪细胞分化的信号通路受损[12]。脂肪组织可以分泌MMP 2,肥胖人群血浆中MMP 2浓度升高,小鼠MMP 2基因敲除降低高脂饮食诱导的体重增加。MMP 13在脂肪组织中高表达,其抑制剂CP-544439处理小鼠可抵抗高脂饮食诱导的肥胖,体外实验发现,干扰3T3-L1细胞MMP-13的基因表达降低脂肪细胞分化[13]。高脂饮食小鼠的脂肪组织中其它基质金属蛋白酶的表达也上调,如MMP3、MMP11、MMP12和MMP14,而MMP7、MMP9、MMP16和MMP24的表达下调。与MMP2,MMP14相反的是,MMP3、MMP11或MMP19基因敲除小鼠在高脂饮食下增加脂肪组织的形成[14],说明MMPs家族在肥胖发生中承担不同的作用。其它MMPs在肥胖及相关代谢疾病中的功能还需要进一步研究。
3 血管新生
血管新生( angiogenesis)是指在原有毛细血管与(或)微静脉基础上通过血管内皮细胞的增殖和迁移,形成新的分支,再扩展延生形成新的毛细血管网的过程。在健康人体中,大部分的组织在体积上没有扩张,因此血管新生处于静止状态,但是脂肪组织有明显的可塑性,在营养过剩的情况下,脂肪组织迅速膨胀。因此血管系统可通过控制血管新生以及已有血管的重构控制脂肪细胞生长、衰老和其它生理功能。脂肪组织含有丰富的血管网络,毛细血管与每个脂肪细胞直接接触。脂肪组织高度的血管化能够维持足够的血流,这是脂肪组织膨胀和维持代谢功能所必需的。这些血管给脂肪组织提供氧、营养物质、生长因子、激素,炎症细胞和骨髓干细胞用于脂肪生成和脂肪组织膨胀[15]。研究发现小鼠内脏脂肪膨胀时,血管新生先于脂肪生成。肥胖人群脂肪组织血管新生能力的降低与胰岛素抵抗相关,同时肥胖时脂肪组织中毛细血管的密度降低,而大血管的体积增加[16]。
脂肪组织血管新生由多种细胞产生的一系列促血管生成和抗血管生成因子调控。脂肪细胞、前脂肪细胞、内皮细胞和炎症细胞均能够分泌促血管生成因子。能量过剩时,脂肪细胞产生促血管内皮细胞增殖和血管生成的因子,包括血管内皮生长因子( vascular endothelial growth factor,VEGF)、碱性成纤维细胞生长因子( basic fibroblast growth factor,bFGF)、肝细胞生长因子( hepatocyte growth factor,HGF)、胰岛素样生长因子( insulin-like growth factor,IGF)、转化生长因子β( transforming growth factor beta,TGFβ)等。VEGF是调节血管新生最重要的因子,抑制VEGFR2受体能阻止高脂饮食诱导的脂肪组织血管新生和脂肪组织膨胀。相反,在脂肪组织中过表达VEGF,增加血管密度,维持正常氧浓度,防止高脂饮食诱导的肥胖和胰岛素抵抗的发生[17]。在高脂饮食诱导体重增加的早期抑制VEGF-A对VEGFR2的激活,增加系统性胰岛素抵抗。Ob/ob小鼠抑制VEGF-A-VEGFR2的激活,则降低体重,增加胰岛素敏感性,降低炎症因子表达[18]。bFGF促进血管内皮细胞生长,促进血管新生。一些脂肪细胞因子也参与血管生成的调控,如瘦素( leptin)通过上调VEGFA的表达,协同诱导血管新生。脂联素( adiponectin)在不同条件下具有促血管生成或抗血管生成的效果[19]。脂肪细胞也可以分泌一些内源性血管生成抑制因子,如血小板反应蛋白1、纤溶酶原激活物抑制剂等,说明脂肪组织血管新生表型的改变是促血管新生因子和血管生成抑制因子协同作用的结果。研究也发现,小鼠在寒冷刺激下脂肪组织发生血管新生,上调促血管生成因子VEGF的分泌,而下调血管生成抑制因子血小板反应蛋白1的分泌[20]。肥大的脂肪细胞促进血管生成因子的表达,但其释放血管生成因子的机制还不清楚。
除了脂肪细胞,其它细胞如血管内皮细胞、炎症细胞、基质细胞也对血管新生具有调节作用( Fig 1)。血管内皮细胞分泌许多因子调节脂肪生成和脂肪组织重构[21]。肥胖人群脂肪组织发生代谢炎症,脂肪组织中有大量的炎症细胞浸润。这些炎症细胞产生大量的促血管生成因子和细胞因子,如VEGFA、TNF-α、IL-6、IL-8等[15]。脂肪组织来源的基质细胞产生多种促血管生成因子,包括VEGFA、HGF、FGF2、TGF-β等,在低氧条件下,这些基质细胞分泌的VEGF增加5倍,这些因子在脂肪组织血管新生中可能发挥作用。健康人群长期饮食过量,皮下脂肪组织中ECM相关基因和血管生成基因的表达增加,但是巨噬细胞或者炎症细胞的数目没有发生变化,说明体重增加导致的基质重构和血管新生先于炎症反应[22]。
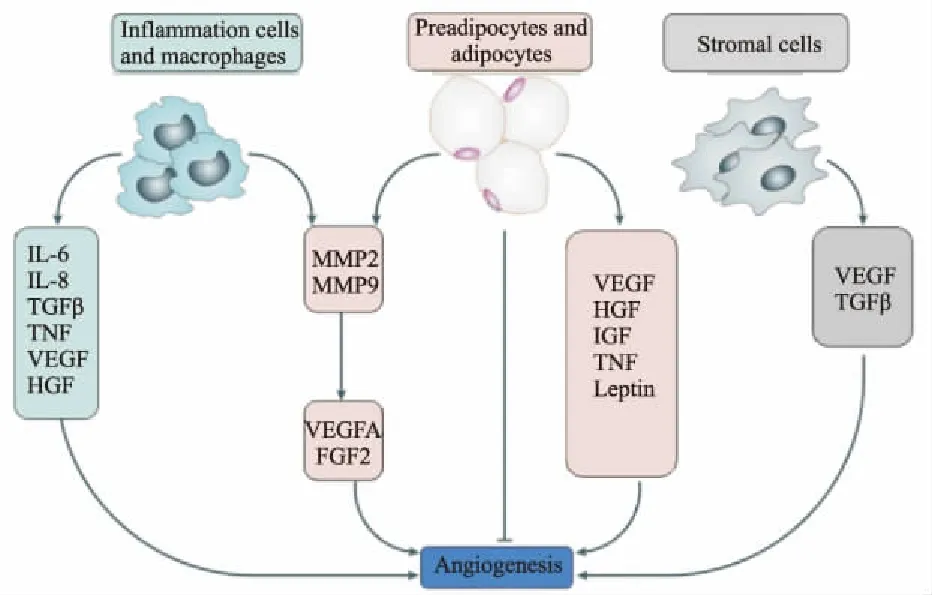
Fig 1 Adipose tissue angiogenesis
4 炎症细胞浸润
肥胖时,出现代谢性炎症反应,炎症细胞向肿胀的脂肪组织浸润是肥胖的一个重要病理现象。动物研究发现在瘦素敲除或瘦素受体敲除以及饮食诱导的肥胖小鼠中,巨噬细胞的基因表达增加。体重减轻可以减少炎症基因的表达,说明巨噬细胞的浸润是可逆的。脂肪细胞的肥大和增生导致脂肪重构,引起脂肪组织低氧、脂肪细胞死亡、脂肪细胞内分泌模式改变以及脂代谢紊乱。这些变化都可以激活巨噬细胞,促使脂肪组织招募巨噬细胞。
4.1低氧与炎症细胞浸润脂肪细胞肥大导致局部脂肪组织缺氧,ob/ob小鼠以及高脂诱导的肥胖小鼠脂肪组织处于低氧状态,这与脂肪组织重构过快,而血管生成不足有关。肥胖小鼠白色脂肪组织中低氧诱导因子和糖转运体1的表达明显高于对照组,在低氧区有F4/80巨噬细胞的存在。最直接的证据是利用针形光纤传感器测定脂肪组织中的氧分压,发现ob/ob小鼠和高脂诱导的小鼠脂肪组织中氧分压降低[23]。但是,相互矛盾的研究结果出现在人体研究中,有研究发现人腹部皮下脂肪中氧分压相比正常体重的人明显降低。而另外的研究发现在胰岛素抵抗患者脂肪组织中氧分压明显高于对照组[24],这种差异可能是人体所处的生理和病理不一致所导致的。低氧能上调炎症因子的表达,如巨噬细胞迁移抑制因子( macrophage migration inhibitory factor,MIF)、MMP2、MMP9、IL-6、PAI-1、VEGF和瘦素。体外细胞实验也发现3T3-L1脂肪细胞用低氧处理能激活NF-κB和TNF-α基因的表达。
4.2脂肪细胞死亡与炎症细胞浸润在正常人脂肪组织中,含有一小部分驻地巨噬细胞,它们通过吞噬脂肪组织中正常凋亡的脂肪细胞来更新脂肪组织,这种组织重构是机体正常的代谢过程。相比正常人群,肥胖人群脂肪组织中,巨噬细胞的数量急剧增加。脂肪细胞过度肥大代表一种代谢应激,能够引起促炎反应导致局部驻地巨噬细胞的激活。脂肪细胞肥大或高脂饮食能增加脂肪细胞的死亡,脂肪组织中几乎所有巨噬细胞(>90%)都位于死亡的脂肪细胞周围,形成“crown-like structures ( CLS)”,它们吞噬残留的脂滴,形成载脂的多核体,这也是慢性炎症的标志性特点。巨噬细胞吞噬脂质和其他的细胞成分,这些分子可能激活巨噬细胞或脂肪细胞的Toll样受体,诱导促炎因子和趋化因子的释放。CLS在内脏脂肪中的数量明显多于皮下脂肪组织,其数量与炎症水平、胰岛素抵抗、血管内皮功能紊乱相关。大网膜脂肪组织中CLS的数量与肝脏纤维炎症损伤和肝脏脂肪量有关[19]。
4.3脂肪因子与炎症细胞浸润脂肪组织也是内分泌器官,分泌各种生物活性分子。这些因子影响生理活动,包括食欲、能量消耗、胰岛素敏感性、血管功能、免疫和凝血。当机体能量过剩时,能量物质刺激脂肪细胞分泌功能紊乱,炎症因子如IL-6、MCP-1的分泌增加,尤其是MCP-1,能招募循环系统中的单核细胞浸润至脂肪组织,分化成为巨噬细胞。脂肪组织特异性的过表达MCP-1导致胰岛素抵抗,提高血浆中的FFAs,增加巨噬细胞的招募以及炎症细胞因子的表达[25]。但是,研究发现MCP-1敲除的小鼠高脂饮食后依然存在巨噬细胞的浸润,说明还有其他途径可实现炎症细胞的浸润。一旦巨噬细胞被激活,脂肪组织巨噬细胞( adipose tissue macrophages,ATMs)能通过分泌炎症细胞因子与脂肪细胞相互作用、相互影响进一步加大炎症反应,最终形成稳定的慢性炎症状态。
4.4FFA与炎症细胞浸润巨噬细胞可分为两种类型,即M1型和M2型巨噬细胞。脂多糖和Th1细胞因子IFN-γ可以诱导M1型细胞的形成,M1型巨噬细胞产生促炎细胞因子如IL-1β、IL-6和TNF-α,这是肥胖状态脂肪组织炎症细胞浸润的主要形式。另外一种是M2型巨噬细胞,表达抗炎因子F4/80、CD301,IL-10和精氨酸酶等[25]。体重正常时,脂肪组织中只有一小部分的巨噬细胞处于促炎状态( M1型),大部分的驻地巨噬细胞表现为抗炎状态( M2型)。高脂饮食诱导的肥胖脂肪组织中,脂肪组织驻地巨噬细胞的表型经历转变,由抗炎的M2型转换为促炎的M1型。肥胖时,脂肪细胞脂质代谢紊乱,胰岛素信号通路受损导致脂解速度增加,产生过量的FFA。FFA可直接诱导巨噬细胞表型的转换。FFA可激活TLR4,激活经典的炎症反应通路,炎症因子分泌增加又促进脂肪细胞的脂解反应,使局部组织FFA过载,加速巨噬细胞的集聚。另外,巨噬细胞的表型转换以及数目的增多加速脂肪组织中的炎症环境,导致脂肪组织功能紊乱。
4.5其他免疫细胞的浸润除了巨噬细胞外,脂肪组织中还存在其他的一些免疫细胞,它们也参与脂肪组织的重构,如中性粒细胞、嗜酸性粒细胞、肥大细胞和B细胞,这些细胞亦可导致炎症[26]( Fig 2)。研究发现小鼠高脂饮食诱导早期( 3 d和7 d)腹部脂肪组织中就有中性粒细胞的浸润[27]。T淋巴细胞也参与脂肪组织的重构,T淋巴细胞主要包括CD4+、CD8+T细胞、Tregs和肥大细胞,特别是CD8+T细胞在肥胖的早期阶段数量就明显增加,CD8+的激活加速脂肪组织中巨噬细胞的招募和激活,促进脂肪组织的炎症反应。相反的是,CD4+T细胞和调节性T细胞在肥胖后期降低。这些现象说明肥胖诱导的免疫细胞变化在脂肪重构及炎症反应中有重要作用。但是这些现象背后的作用及机制还需要深入的研究。肥大细胞在调节脂肪组织血管生成、T细胞招募以及细胞外基质重构中有重要作用。肥大细胞基因缺陷小鼠血清和脂肪组织中炎症因子IL-6、TNF-α、IFN-γ、MCP-1以及细胞外基质水解酶MMP-9和组织蛋白酶S的水平均降低[28]。

Fig 2 Inflammatory cells infiltration in adipose tissue
5 脂肪组织重构的双重性
脂肪重构是一个正常的生理过程,在肥胖状态下被病理性地加速。减少血管重构、产生ECM过度、增加炎症细胞的浸润和随后的促炎症反应是许多肥胖组织中常见的特征。但是,不是所有的脂肪重构都是病理性的改变。代谢健康型肥胖( metabolically healthy obese,MHO)人群就是一类特殊人群,MHO相比于同水平的肥胖人群表现出正常的代谢特征。MHO同样拥有过量的脂肪量,但是对胰岛素敏感,无糖尿病、高脂血症、高血压和慢性肾病。因此,有学者提出脂肪重构时存在两种类型的脂肪重构:健康型脂肪组织重构和病理性脂肪组织重构( Fig 3)。健康型脂肪组织重构,其增加脂肪组织量是通过招募脂肪细胞祖细胞,然后分化形成小的脂肪细胞,同时也招募一定比例其他类型的基质细胞,诱导血管新生,伴随最小化的ECM重构和炎症反应。相反,病理性的脂肪组织重构通过增加已有脂肪细胞的体积迅速地增加脂肪量,伴随高度的巨噬细胞浸润、有限的血管新生和大量的ECM纤维化[29]。病理性的脂肪组织重构与代谢性炎症有关,最终导致系统性胰岛素抵抗的发生。研究发现MHO脂肪组织中pref-1的表达明显降低,pref-1能够抑制脂肪细胞的形成,因此阻碍脂肪组织的形成。MHO人群脂肪组织中小体积脂肪细胞的数量也明显高于肥胖合并胰岛素患者[30]。
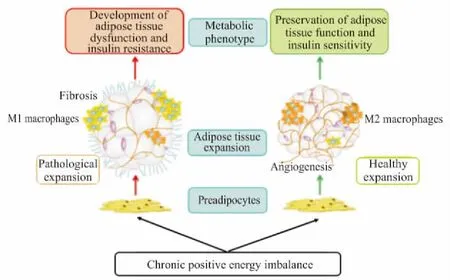
Fig 3 Healthy and pathological adipose tissue remodeling
6 结语
脂肪组织重构机制非常复杂,涉及到多种细胞、多种病理现象的变化。肥胖与胰岛素抵抗、糖尿病、高脂血症、心脑血管疾病有关,说明脂肪组织与这些疾病的发生和发展有内在的联系,但是其中的机制还不甚清楚。MHO人群的存在,说明正常的脂肪重构可避免代谢性疾病的发生,病理性的脂肪重构导致脂肪组织功能紊乱、能量代谢紊乱和炎症状态加剧。只有深入理解脂肪组织重构的分子机制才能发现新的治疗策略去预防和治疗肥胖相关的代谢性疾病。
参考文献:
[1]Hansen J C,Gilman A P,Odland J O.Is thermogenesis a significant causal factor in preventing the“globesity”epidemic[J].Med Hypotheses,2010,75( 2) : 250-6.
[2]Itoh M,Suganami T,Hachiya R,Ogawa Y.Adipose tissue remodeling as homeostatic inflammation[J].Int J Inflam,2011,2011: 720926.
[3]Yin H,Pasut A,Soleimani V D,et al.MicroRNA-133 controls brown adipose determination in skeletal muscle satellite cells by targeting Prdm16[J].Cell Met,2013,17( 2) : 210-24.
[4]Sepe A,Tchkonia T,Thomou T,et al.Aging and regional differ-ences in fat cell progenitors-a mini-review[J].Gerontology,2011,57( 1) : 66-75.
[5]Sorisky A,Molgat A S,Gagnon A.Macrophage-induced adipose tissue dysfunction and the preadipocyte: should I stay ( and differentiate) or should I go[J].Adv Nutr,2013,4( 1) : 67-75.
[6]Morgan-Bathke M,Chen L,Oberschneider E,et al.Sex and depot differences in ex vivo adipose tissue fatty acid storage and glycerol-3-phosphate acyltransferase activity[J].Am J Physiol Endocrinol Met,2015,308( 9) : E830-46.
[7]Onate B,Vilahur G,Ferrer-Lorente R,et al.The subcutaneous adipose tissue reservoir of functionally active stem cells is reduced in obese patients[J].FASEB J,2012,26( 10) : 4327-36.
[8]Suganami T,Ogawa Y.Role of chronic inflammation in adipose tissue in the pathophysiology of obesity[J].Nihon Rinsho,2013,71( 2) : 225-30.
[9]Khan T,Muise E S,Iyengar P,et al.Metabolic dysregulation and adipose tissue fibrosis: role of collagen VI[J].Mol Cell Biol,2009,29( 6) : 1575-91.
[10]Geys L,Scroyen I,Roose E,et al.ADAMTS13 deficiency in mice does not affect adipose tissue development[J].Biochim Biophys Acta,2015,1850( 7) : 1368-74.
[11]Mariman E C,Wang P.Adipocyte extracellular matrix composition,dynamics and role in obesity[J].Cell Mol Life Sci,2010,67( 8) : 1277-92.
[12]Chun T H,Inoue M,Morisaki H,et al.Genetic link between obesity and MMP14-dependent adipogenic collagen turnover[J].Diabetes,2010,59( 10) : 2484-94.
[13]Shih C L,Ajuwon K M.Inhibition of MMP-13 prevents diet-induced obesity in mice and suppresses adipogenesis in 3T3-L1 preadipocytes[J].Mol Biol Rep,2015,42( 7) : 1225-32.
[14]Bauters D,Scroyen I,Van Hul M,Lijnen H R.Gelatinase A ( MMP-2) promotes murine adipogenesis[J].Biochim Biophys Acta,2015,1850( 7) : 1449-56.
[15]Cao Y.Adipose tissue angiogenesis as a therapeutic target for obesity and metabolic diseases[J].Nat Rev Drug Discov,2010,9 ( 2) : 107-15.
[16]Martinez-Santibanez G,Lumeng C N.Macrophages and the regulation of adipose tissue remodeling[J].Annu Rev Nutr,2014,34: 57-76.
[17]Tam J,Duda D G,Perentes J Y,et al.Blockade of VEGFR2 and not VEGFR1 can limit diet-induced fat tissue expansion: role of local versus bone marrow-derived endothelial cells[J].PLoS One, 2009,4( 3) : e4974.
[18]Sun K,Wernstedt A I,Kusminski C M,et al.Dichotomous effects of VEGF-A on adipose tissue dysfunction[J].Proc Natl Acad Sci USA,2012,109( 15) : 5874-9.
[19]Lee M J,Wu Y,Fried S K.Adipose tissue remodeling in pathophysiology of obesity[J].Curr Opin Clin Nutr Metab Care,2010,13( 4) : 371-6.
[20]Xue Y,Petrovic N,Cao R,et al.Hypoxia-independent angiogenesis in adipose tissues during cold acclimation[J].Cell Met,2009,9( 1) : 99-109.
[21]Gu P,Xu A.Interplay between adipose tissue and blood vessels in obesity and vascular dysfunction[J].Rev Endocr Metab Disord,2013,14( 1) : 49-58.
[22]Alligier M,Meugnier E,Debard C,et al.Subcutaneous adipose tissue remodeling during the initial phase of weight gain induced by overfeeding in humans[J].J Clin Endocrinol Metab,2012,97 ( 2) : E183-92.
[23]Ye J,Gao Z,Yin J,He Q.Hypoxia is a potential risk factor for chronic inflammation and adiponectin reduction in adipose tissue of ob/ob and dietary obese mice[J].Am J Physiol Endocrinol Metab,2007,293( 4) : E1118-28.
[24]Goossens G H,Blaak E E.Adipose tissue oxygen tension: implications for chronic metabolic and inflammatory diseases[J].Curr Opin Clin Nutr Metab Care,2012,15( 6) : 539-46.
[25]Harford K A,Reynolds C M,Mcgillicuddy F C,Roche H M.Fats,inflammation and insulin resistance: insights to the role of macrophage and T-cell accumulation in adipose tissue[J].Proc Nutr Soc,2011,70( 4) : 408-17.
[26]Suganami T,Tanaka M,Ogawa Y.Adipose tissue inflammation and ectopic lipid accumulation[J].Endocr J,2012,59( 10) : 849-57.
[27]Elgazar-Carmon V,Rudich A,Hadad N,Levy R.Neutrophils transiently infiltrate intra-abdominal fat early in the course of highfat feeding[J].J Lipid Res,2008,49( 9) : 1894-903.
[28]Liu J,Divoux A,Sun J,et al.Genetic deficiency and pharmacological stabilization of mast cells reduce diet-induced obesity and diabetes in mice[J].Nat Med,2009,15( 8) : 940-5.
[29]Sun K,Kusminski C M,Scherer P E.Adipose tissue remodeling and obesity[J].J Clin Invest,2011,121( 6) : 2094-101.
[30]Kloting N,Fasshauer M,Dietrich A,et al.Insulink-sensitive obesity[J].Am J Physiol Endocrinol Metab,2010,299( 3) : E506-15.
Obesity and adipose tissue remodeling
YANG Yong-Yu1,2,HU Chang-Ping1
( 1.Dept of Pharmacology,School of Pharmaceutical Sciences,Central South University,Changsha 410078,China; 2.Dept of Pharmacy,Second Xiangya Hospital, Central South University,Changsha 410011,China)
Abstract:Obesity is a major risk factor for the generation and development of diabetes,atherosclerosis,hyperlipidemia and cancer.Obesity is accompanied with remodeling of adipose tissue,such as changed cell component and function,angiogenesis,extracellular matrix remodeling and infiltration of inflammatory cells.It is important for the prevention of obesity to study adipose tissue remodeling.This review summarizes recent advances in adipose tissue remodeling.
Key words:obesity; adipose tissue remodeling; extracellular matrix; angiogenesis; inflammation; metabolically healthy obese
作者简介:杨永玉( 1985-),男,博士,研究方向:肥胖与代谢性疾病,E-mail: yongyuyang@126.com;
基金项目:湖南省研究生创新课题( No CX2012B078)
收稿日期:2015-09-11,修回日期: 2015-11-15
文献标志码:A
文章编号:1001-1978( 2016) 01-0009-05
doi:10.3969/j.issn.1001-1978.2016.01.003