DJ-1蛋白对线粒体的功能调节在帕金森病中的作用
2016-03-21郭涌斐蒲小平
郭涌斐,孙 懿,赵 欣,蒲小平
(北京大学药学院分子与细胞药理学系,北京 100191)
DJ-1蛋白对线粒体的功能调节在帕金森病中的作用
郭涌斐,孙懿,赵欣,蒲小平
(北京大学药学院分子与细胞药理学系,北京100191)
中国图书分类号: R-05; R329.24; R341; R394.2; R745.702.2
摘要:线粒体功能障碍在帕金森病( Parkinson’s disease, PD)发生过程中非常重要,DJ-1蛋白可以参与线粒体的功能调节,从而维持线粒体的正常功能。DJ-1基因突变及功能丧失时,则会导致线粒体复合物I活性和线粒体膜电位降低、线粒体断裂以及线粒体自噬等状况的出现,进而损伤神经元,引发PD。该文针对DJ-1蛋白对线粒体的功能调节在PD中的作用进行简要综述。
关键词:DJ-1;线粒体;帕金森病;线粒体复合物I;线粒体自噬;氧化应激;线粒体稳态
发,E-mail: guoyongfei08@126.com;蒲小平( 1956-),女,博士,教授,博士生导师,主要研究方向:新药药理学,通讯作者,E-mail: pxp2020@126.com
帕金森病( Parkinson’s disease,PD)是一种常见的多发于老年人的神经退行性疾病,其发病率与年龄呈正相关[1]。PD临床表现的运动症状主要是静止性震颤、运动迟缓、肌强直等,此外还会出现如认知功能下降、情绪障碍等非运动症状。神经病理学特征包括是黑质以及纹状体的多巴胺( dopamine,DA)能神经元变性缺失以及路易小体( lewy body)的形成[1]。目前关于PD具体发病机制的探索仍在继续,研究证实,环境和遗传等因素与其发病有着密切的关系。现有的临床治疗只能缓解症状,却不能阻止或逆转疾病的进程。
近年来,在关于PD发病机制的探讨中,线粒体在其中的作用越来越引人注目。DJ-1基因突变与常染色体隐性的家族性PD有关,而DJ-1蛋白对于维持线粒体形态和功能又起着重要的作用。现将从DJ-1蛋白对线粒体的功能调节在PD中的作用进行综述。
1 DJ-1是PD的致病基因
DJ-1是于1997年首次被发现的丝裂原依赖性癌基因。该基因全长约24kb,位于人染色体lp36.2-lp36.3,有8个外显子,其中外显子1A和1B的mRNA被选择性剪切,因此不编码蛋白质[2]。其他2-7号外显子能编码DJ-1蛋白。DJ-1蛋白由189个氨基酸组成,含7个β折叠和9个α螺旋,并以同源二聚体的形式存在,其分子质量约20 ku,小鼠DJ-1基因与人DJ-1的基因同源性高达90%。DJ-1蛋白在外周组织、神经元以及胶质细胞中表达较多,在小脑、下丘脑和嗅球中表达更多[3]。在亚细胞定位中,部分DJ-1分布在线粒体基质和膜间隙中[2]。DJ-1蛋白的功能极其丰富,参与了机体内多种生理病理活动,包括抗氧化应激、蛋白酶活性、转录调节和信号通路调节、分子伴侣以及肿瘤生成和迁移过程等[4]。
DJ-1基因在PD人群中的突变率约为1%[5]。目前,研究人员已经发现DJ-1有11种突变,大片段缺失和点突变占主要部分。而这些突变又和常染色体隐性遗传的早发PD有关。例如在荷兰早发PD家系中发现DJ-1基因中出现一种14kb的大片段缺失,在意大利早发PD家系中发现DJ-1基因的1个L166P的点突变[6]。正常的DJ-1蛋白是以同源二聚体的形式存在,发生突变时则会以极不稳定的单体形式存在( Fig 1,2),这种单体会在泛素-蛋白酶体通路作用下被迅速降解失活,继而减弱其抗氧化应激的能力,增加了氧化应激对神经元的损伤[7]。在动物实验中发现,DJ-1基因敲除小鼠黑质部分的多巴胺能神经元反映出的氧化应激损伤有明显增强,而氧化应激损伤又与神经元死亡以及PD的发生有关。此外,研究证实,DJ-1基因敲除小鼠在氧化应激损伤之下会出现PD患者出现的视网膜形态学异常和生理机能障碍,且这种症状会随着小鼠年龄增长而持续加重[8]。
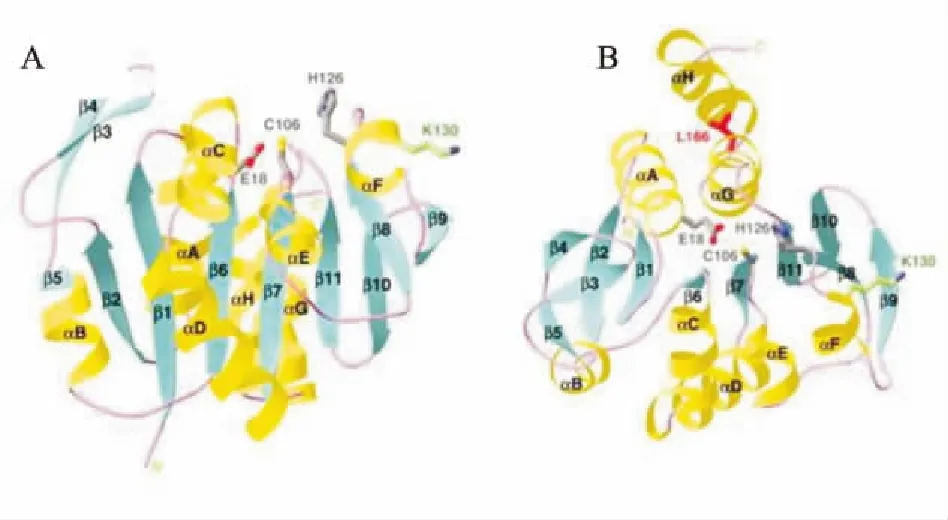
Fig 1 Structure of DJ-1 monomer
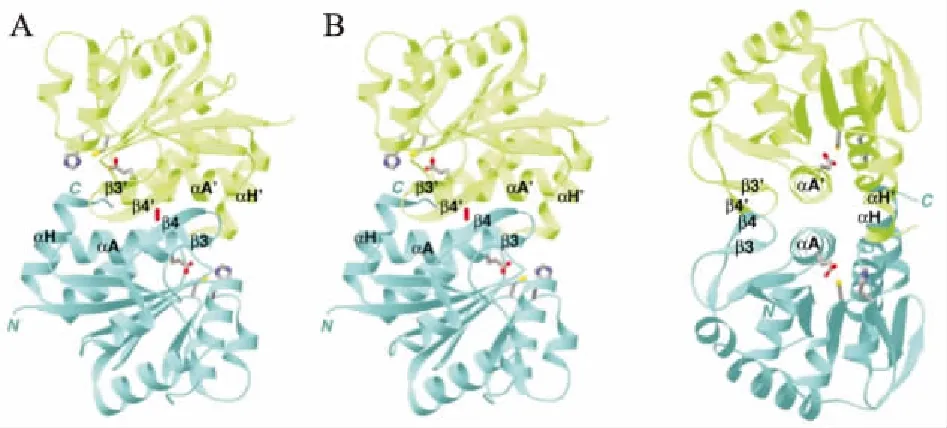
Fig 2 Structure of DJ-1 dimer[41]
2 线粒体与PD
线粒体为细胞提供“动力”,它可以通过氧化磷酸化生成ATP,为细胞正常生命活动提供能量。另外,线粒体还与维持细胞内钙稳态、信号传导、氧自由基的生成以及介导细胞凋亡密不可分[9]。线粒体功能低下与PD密切相关。研究发现,PD患者脑内及外周血细胞的线粒体能量代谢存在明显异常的表现[10],PD患者中还出现活性氧生成增多,线粒体复合物活性降低等现象。这些现象造成细胞内外离子失衡和线粒体膜电位变化,促使线粒体膜通透性转运孔开放,细胞色素C( cytochrome C,Cyt C)、凋亡诱导因子等小分子蛋白释放到细胞质,进一步激活与Caspase-9相关的凋亡途径。此外,电压依赖性Ca2 +通道在线粒体膜电位下降的刺激下开放,致使Ca2 +急剧内流,Caspase-2在细胞内Ca2 +浓度升高的情况下被激活。Caspase-9和Caspase-2使细胞凋亡下游通路进一步活化,导致线粒体膜破裂,神经细胞发生凋亡[11-12]。此外,由于线粒体蛋白在细胞质中完成合成后转运至线粒体的过程需要ATP的支持,因此当线粒体出现功能障碍时则会使ATP供应减少,从而积聚大量异常蛋白质。目前体内外实验研究表明,线粒体复合体I活性降低还能导致α-synuclein蛋白聚集及阳性包涵体产生[13],进而导致神经元的死亡。因此,线粒体形态异常与功能障碍就很有可能成为疾病发生的原因。
自从发现PD患者线粒体功能异常以来,关于引发其异常的诱因研究也不少。比如编码线粒体蛋白的基因突变能直接或间接地影响线粒体的功能从而引发家族性PD;α-synuclein等蛋白的大量异常积聚也会影响线粒体的功能,从而引发PD。影响线粒体电子传递链功能的神经毒素,如1-甲基-4-苯基-1,2,3,6-四氢吡啶( 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine chloride,MPTP)也能够引起PD的发生[14]。但是到目前为止,导致PD患者线粒体功能异常的机制还不是十分明确,DJ-1蛋白对线粒体功能的作用已成为目前PD发病机制的研究热点之一。
3 DJ-1蛋白参与调节线粒体功能
目前研究结果认为,DJ-1蛋白主要是在抗氧化应激、抗细胞凋亡以及引发自噬等方面发挥非常重要的作用[15]。DJ-1蛋白发挥功能主要是通过包括充当活性氧清除剂和自噬等在内的几种机制来实现的[16-18]。已有的研究结果显示,从PD患者和DJ-1基因敲除小鼠中发现的线粒体功能障碍主要有两种:线粒体复合物I的活性降低、线粒体膜电位降低[19-20]。DJ-1基因敲除小鼠以及细胞中还观察到断裂的线粒体[21]。虽然已经有很多关于DJ-1蛋白可作为蛋白酶和分子伴侣等发挥作用的研究,但是针对DJ-1蛋白在线粒体中的具体作用机制,目前的研究还处于初级阶段[22],本文归纳几种可能介导DJ-1蛋白参与调节线粒体功能的机制。
3.1DJ-1参与线粒体稳态的调节DJ-1蛋白和线粒体有着很密切的关系,正常情况下DJ-1蛋白主要位于细胞质,少部分存在于细胞核与线粒体中。DJ-1蛋白不仅在线粒体有分布,还能对部分线粒体相关蛋白进行转录调控。虽然DJ-1蛋白在线粒体的分布较少,但定位于线粒体的DJ-1蛋白表现出的细胞保护作用却强于定位于胞质和细胞核的DJ-1蛋白[23]。
氧化应激时,DJ-1蛋白的等电点( isoelectric point,pI)会降低,出现酸性迁移,因此可以认为DJ-1蛋白对于细胞的氧化应激具有敏感性。之前的研究发现DJ-1蛋白可作为活性氧清除剂,在体外细胞模型中能通过自身氧化清除过氧化氢[24],从而保护线粒体免受损伤。另外,在氧化应激刺激下,DJ-1蛋白不仅可以通过氧化自身的Cys106而阻止细胞凋亡通路的激活[2],还可以通过降低p53的转录活性使得Bax的蛋白表达下降,继而抑制Bax-caspases凋亡通路,达到保护线粒体功能的作用[25]。DJ-1蛋白的过表达有保护细胞的作用,它还能够使细胞对毒素的耐受程度增强,减少对线粒体的损伤。
有研究发现在氧化应激等刺激下,DJ-1蛋白会向线粒体转位[26]以保持线粒体复合物I活性,同时也发现DJ-1蛋白是直接与线粒体复合物I的亚基NDUFA4和ND1结合而共定位于线粒体内膜( Fig 3)。NDUFA4是线粒体复合物I的辅助亚基,由核基因编码并定位于线粒体内膜的外周蛋白上。ND1,即线粒体NADH脱氢酶亚基1,是在线粒体内由线粒体翻译装置合成的。此外,从NIH3T3和HEK293细胞中敲除DJ-1基因,会导致线粒体复合物I的活性下降,但线粒体仍保持其完整性。当野生型DJ-1重新导入敲除DJ-1基因的NIH3T3细胞后,结果发现,与亲代的NIH3T3细胞相比线粒体复合物I只有部分活性。这些表明DJ-1蛋白对于线粒体复合物I发挥其酶活性是必要的,但是如果仅依靠DJ-1蛋白自身则不足以保持线粒体复合物I的活性。正常的细胞或者DJ-1蛋白表达下调的细胞与再次注入的野生型DJ-1结合之后并没有刺激其线粒体复合物I活性变化,这些结果说明DJ-1蛋白无法独自转位至线粒体[27]。因为DJ-1蛋白本身没有线粒体靶向序列,需要依赖于其它蛋白向线粒体转位。研究发现,DJ-1蛋白和一些包括热休克蛋白70 ( HSP70)、CHIP( carboxy terminus of Hsc70 interacting protein)以及线粒体Hsp70/致死蛋白( Mortalin) /葡萄糖调节蛋白75 ( Grp75)的分子伴侣绑定在一起,这些蛋白可以通过自身携带的内源性线粒体靶向序列的核编码蛋白将DJ-1蛋白移到线粒体[28]。
而对于DJ-1蛋白如何保持线粒体复合物I活性的问题的解释包括:一方面DJ-1蛋白表达的下降可能会引发线粒体复合物I结构的部分变化,导致线粒体复合物I活性下降;另一方面也可能是DJ-1蛋白在线粒体复合物I的装配过程中有一定影响,从而影响线粒体复合物I活性[27]。由此可见,DJ-1蛋白通过向线粒体转位并与线粒体复合物I相互作用以维持线粒体稳态,发挥神经保护作用。
同样,当DJ-1基因发生突变或DJ-1蛋白含量下降时,细胞的抗氧化作用减弱,增加了细胞对氧化应激的敏感性,细胞内的氧化还原稳态失衡,活性氧( reactive oxygen species,ROS)大量累积,继而引发氧化应激,破坏线粒体稳态,ROS继续累积,ATP合成减少,进一步增加了对线粒体和细胞中蛋白质,脂质以及核酸的损伤[29]。
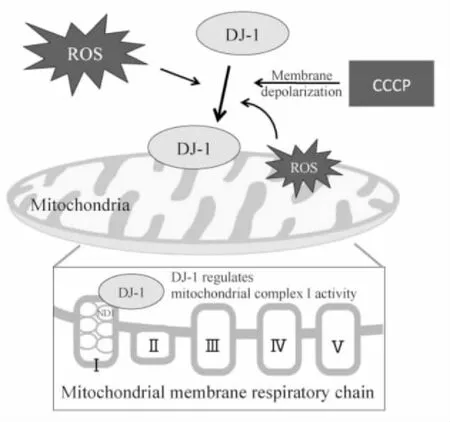
Fig 3 Proposed model of mitochondria translocation of DJ-1[42].
3.2DJ-1参与线粒体形态的调节氧化应激导致的ROS累积可以影响线粒体形态。例如过氧化氢导致的ROS累积就会让线粒体出现片段化和自噬体。这种方式引发的损伤会促使线粒体分裂形成片段,继而瓦解线粒体的网状系统。另外,DJ-1蛋白的异常表达也会引起线粒体形态的变化。例如,将人多巴胺能神经细胞M17中的DJ-1基因敲除,会使线粒体融合程度降低[30]。在异常表达的DJ-1蛋白中发现线粒体出现伸长的现象,当DJ-1蛋白发生与PD相关的R98Q、D149A和L166P突变时,观察到线粒体片段化的程度明显增加。此外,敲除DJ-1的小鼠中也观察到线粒体片段化等线粒体形态异常。由于线粒体的形态是由融合和分裂相关因子的比例调节的,当DJ-1蛋白发生异常表达时,相应的融合分裂相关因子Mfnl/2、MTP18及DLP1等就会发生变化,从而影响线粒体形态[21,31]。
3.3 DJ-1参与线粒体自噬线粒体自噬( mitophagy)是指细胞自噬过程中选择性地降解清除多余或受损的线粒体的过程[32]。ROS积聚导致线粒体中的蛋白质、核酸等受到损伤,会影响线粒体中的电子传递链的正常功能,异常的线粒体会继续产生ROS,进一步加大线粒体的损伤程度,破坏细胞稳态,甚至导致细胞死亡[33]。因此利用线粒体自噬来清除多余或受损的线粒体,对于维持线粒体质量和数量的平衡以及细胞正常的生命活动是非常必要的[34]。线粒体自噬对于能量需求很大的神经细胞来说尤为重要。已有的研究发现,线粒体自噬紊乱与细胞死亡、神经元变性等紧密相关。与PD的线粒体自噬相关的基因有α-synuclein、ERK2、Parkin、PINK1和DJ-1[35]。
研究显示,小鼠中DJ-1蛋白的过表达会提高线粒体复合体I抑制剂鱼藤酮诱发的自噬标志物Beclin-1和LC3II的表达,透射电子显微镜和共聚焦成像显示自噬标志物超微结构有所增加,小鼠体内磷酸化mTOR(自噬负调节剂)的含量也明显降低。另一方面,DJ-1蛋白的保护作用可被PI3K ( phosphoinositol 3-kinase)和自噬抑制剂3-MA( 3-methyladenine)阻断,这些结果可以说明DJ-1蛋白能够促进线粒体自噬,与此同时DJ-1过表达小鼠神经细胞损伤也有所降低,说明DJ-1是通过促进线粒体自噬从而减少神经细胞损伤的[29]。在许多PD患者中,存在DJ-1基因突变,DJ-1蛋白缺失时导致氧化应激增加,Parkin聚集和线粒体自噬增多,细胞氧化功能存在障碍,而增加DJ-1蛋白的表达可以抑制Parkin向线粒体聚集[36]。
DJ-1在自噬中的作用仍有争议,目前大部分研究集中于线粒体自噬。当线粒体膜电位降低,DJ-1蛋白向线粒体转位从而引发线粒体自噬,继而清除被损坏的线粒体[30-31]。尽管DJ-1保护线粒体的功能已被广泛研究,但与线粒体自噬相关的机制仍不是非常明确。
综上所述,目前认为PD发病机制涉及线粒体功能障碍、氧化应激等[14,37],其中线粒体功能障碍是中心环节[38]。DJ-1是机体内一种重要的蛋白,发挥着神经保护作用[39]。DJ-1蛋白在线粒体中是以二聚体的形式发挥功能的,如果DJ-1基因发生突变,迁移至线粒体的DJ-1蛋白为单体(如L166P和M26I)[26],或者其他原因导致DJ-1蛋白功能缺失时,就会导致线粒体膜电位降低以及线粒体片段化等,也会使线粒体产生功能障碍或者引发氧化应激,而线粒体功能障碍及氧化应激等对线粒体的损伤与PD的发生和发展过程又存在密切联系[40]。DJ-1蛋白可通过自身氧化、调节抗氧化基因的转录,激活信号通路,阻止线粒体损伤所致的细胞凋亡及与某些蛋白质相互作用而发挥保护细胞免受氧化应激损伤的作用。针对DJ-1蛋白参与调节线粒体功能部分,主要从维持线粒体稳态、参与线粒体形态调节以及线粒体自噬方面进行陈述。深入探讨DJ-1蛋白通过调节线粒体功能而保护神经元的作用机制,不仅有助于阐明PD的发病机制,也可以为PD治疗中可能出现的潜在药物作用靶点提供依据,因此意义深远。
参考文献:
[1]熊珮,陈忻,张楠.帕金森病病理机制及中药防治帕金森病实验研究进展[J].中国中药杂志,2012,37( 5) : 686-91.
[1]Xiong P,Chen X,Zhang N.Advance in studies on pathological mechanism of Parkinson's disease and traditional Chinese medicine experiments in prevention and treatment of Parkinson's disease[J].Chin J Chin Mater Med,2012,37( 5) : 686-91.
[2]贾娇坤,鲁玲玲,杨慧.DJ-1抗氧化应激相关机制及其与帕金森发病的关系[J].解剖科学进展,2012,18( 5) : 473-7.
[2]Jia J K,Lu L L,Yang H.The mechanism of DJ-1 against oxidative stress and its roles in the pathogenesis of Parkinson's disease [J].Prog Anatom Sci,2012,18( 5) : 473-7.
[3]杨辉,左伋,刘雯.Parkin、PINK1、DJ-1和线粒体功能障碍与帕金森病[J].生命科学,2010,22( 10) : 1009-12.
[3]Yang H,Zuo J,Liu W.Parkin,PINK1,DJ-1 and mitochondria dysfunction with Parkinson’s disease[J].Chin Bull Life Sci,2010,22( 10) : 1009-12.
[4]Ariga H,Takahashi-Niki K,Kato I,et al.Neuroprotective function of DJ-1 in Parkinson’s disease[J].Oxid Med Cell Longev,2013,2013: 683920.
[5]Bonifati V,Oostra B A,Heutink P.Linking DJ-1 to neurodegeneration offers novel insights for understanding the pathogenesis of Parkinsons disease[J].J Mol Med,2004,82( 3) : 163-74.
[6]Bonifati V,Rizzu P,van Baren M J,et al.Mutations in the DJ-1 gene associated with autosomal recessive early-onset parkinsonism [J].Sci,2003,299( 5604) : 256-9.
[7]姜明,段春礼,杨慧.PARK基因家族与帕金森病研究进展[J].生命科学进展,2015,46( 2) : 133-6.
[7]Jiang M,Duan C L,Yang H.Advance in studies on PARK family and Parkinson's disease[J].Prog Physiol Sci,2015,46( 2) : 133 -6.
[8]Bonilha V L,Bell B A,Rayborn M E,et al.Loss of DJ-1 elicits retinal abnormalities,visual dysfunction,and increased oxidative stress in mice[J].Exp Eye Res,2015,139: 22-36.
[9]仇万山,陈亦江.线粒体结构、功能和常用研究方法[J].国际麻醉学与复苏杂志,2007,28( 3) : 282-5.
[9]Chou W S,Chen Y J.The structure and function of mitochondria and its usual research methods[J].Int J Anesth Resus,2007,28 ( 3) : 282-5.
[10]Arduíno D M,Esteves A R,Oliveira C R,et al.Mitochondrial metabolism modulation: a new therapeutic approach for Parkinson's disease[J].CNS Neurol Disord Drug Targets,2010,9( 1) : 105 -19.
[11]Perl A,Nagy G,Gergely P,et al.Apoptosis and mitochondrial dysfunction in lymphocytes of patients with systemic lupus erythematosus[J].Methods Mol Med,2004,102: 87-114.
[12]Annunziato L,Amoroso S,Pannaccione A,et al.Apoptosis induced in neuronal cells by oxidative stress: role played by caspases and intracellular calcium ions[J].Toxicol Lett,2003,139( 2-3) : 125-33.
[13]Lenaz G,Baracca A,Fato R,et al.Mitochondrial complex I: structure,function,and implications in neurodegeneration[J].Ital J Biochem,2006,55( 3-4) : 232-53.
[14]李晓秀,杜冠华.线粒体功能障碍与帕金森病[J].中国药学杂志,2009,44( 17) : 1284-6.
[14]Li X X,Du G H.Mitochondrial dysfunction and Parkinson's disease[J].Chin Pharm J,2009,44( 17) : 1284-6.
[15]Kahle P J,Waak J,Gasser T.DJ-1 and prevention of oxidative stress in Parkinson’s disease and other age-related disorders[J].Free Radic Biol Med,2009,47( 10) : 1354-61.
[16]Yokota T,Sugawara K,Ito K,et al.Down regulation of DJ-1 enhances cell death by oxidative stress,ER stress,and proteasome inhibition[J].Biochem Biophys Res Commun,2003,312( 4) : 1342-8.
[17]Xu J,Zhong N,Wang H,et al.The Parkinson’s disease-associated DJ-1 protein is a transcriptional co-activator that protects against neuronal apoptosis[J].Hum Mol Genet,2005,14( 9) : 1231-41.
[18]Li H M,Niki T,Taira T,et al.Association of DJ-1 with chaperones and enhanced association and colocalization with mitochondrial HSP70 by oxidative stress[J].Free Radic Res,2005,39( 10) : 1091-9.
[19]Orth M,Schapira A H.Mitochondrial involvement in Parkinson’s disease[J].Neurochem Inter,2002,40( 6) : 533-41.
[20]Giaime E,Yamaguchi H,Gautier C A,et al.Loss of DJ-1 does not affect mitochondrial respiration but increases ROS production and mitochondrial permeability transition pore opening[J].PLoS One,2012,7( 7) : e40501.
[21]Wang X,Petrie T G,Liu Y,et al.Parkinson’s disease-associated DJ-1 mutations impair mitochondrial dynamics and cause mitochondrial dysfunction[J].J Neurochem,2012,121( 5) : 830-9.
[22]Gautier V,Le H T,Malki A,et al.YajL,the prokaryotic homolog of the Parkinsonism-associated protein DJ-1,protects cells against protein sulfenylation[J].J Mol Biol,2012,421( 4-5) : 662-70.
[23]Junn E,Jang W H,Zhao X,et al.Mitochondrial localization of DJ-1 leads to enhanced neuroprotection[J].J Neurosci Res,2009,87: 123-9.
[24]Taira T,Saito Y,Niki T,et al.DJ-1 has a role in antioxidative stress to pretect cell death[J].EMBO Rep,2004,5( 2) : 213-8.
[25]Fan J,Ren H,Jia N,et al.DJ-1 decreases Bax expression through repressing p53 Transcriptional activity[J].J Biol Chem,2008,283( 7) : 4022-30.
[26]Maita C,Maita H,Iguchi-Ariga S M,Ariqa H.Monomer DJ-1 and its N-terminal sequence are necessary for mitochondrial localization of DJ-1 mutants[J].PLoS One,2013,8( 1) : e54087.
[27]Hayashi T,Ishimori C,Takahashi-Niki K,et al.DJ-1 binds to mitochondrial complex I and maintains its activity[J].Biochem Biophys Res Commun,2009,390( 3) : 667-72.
[28]Li H M,Niki T,Taira T,et al.Association of DJ-1 with chaperones and enhanced oxidative medicine and cellular longevity 7 association and colocalization with mitochondrial Hsp70 by oxidative stress[J].Free Radic Res,2005,39( 10) : 1091-9.
[29]Krebiehl G,Ruckerbauer S,Burbulla L F,et al.Reduced basal autophagy and impaired mitochondrial dynamics due to loss of Parkinson's disease-associated protein DJ-1[J].PLoS One,2010,5 ( 2) : e9367.
[30]Thomas K J,McCoy M K,Blackinton J,et al.DJ-1 acts in parallel to the PINK1/parkin pathway to control mitochondrial function and autophagy[J].Hum Mol Genet,2011,20( 1) : 40-50.
[31]Heo J Y,Park J H,Kim S J,et al.DJ-1 null dopaminergic neuronal cells exhibit defects in mitochondrial function and structure: involvement of mitochondrial complex I assembly[J].PLoS One,2012,7( 3) : e32629.
[32]Pickrell A M,Youle R J.The roles of PINK1,Parkin,and mitochondrial fidelity in Parkinson’s disease[J].Neuron,2015,85 ( 2) : 257-73.
[33]Kim I,Rodriguez -Enriquez S,Lemasters J J.Selective degradation of mitochondria by mitophagy[J].Arch Biochem Biophys,2007,462( 2) : 245-53.
[34]Lemasters J J.Selective mitochondrial autophagy,or mitophagy,as a targeted defense against oxidative stress,mitochondrial dysfunction,and aging[J].Rejuvenation Res,2005,8( 1) : 3-5.
[35]Chu C T.Diversity in the regulation of autophagy and mitophagy: lessons from Parkinson’s disease[J].Parkinsons Dis,2011,2011: 789431.
[36]Joselin A P,Hewitt S J,Callaghan S M,et al.ROS-dependent regulation of Parkin and DJ-1 localization during oxidative stress in neurons[J].Hum Mol Genet,2012,21( 22) : 4888-903.
[37]马敬红,邹海强,陈彪.DJ-1基因与帕金森病[J].基因医学与临床,2006,26: 46-50.
[37]Ma J H,Zou H Q,Chen B.DJ-1 gene and Parkinson disease[J].Basic Clin Med,2006,26: 46-50.
[38]Hunter R L,Dragicevic N,Seifert K,et al.Inflammation induces mitochondrial dysfunction and dopaminergic neurodegeneration in the nigrostriatal system[J].J Neurochem,2007,100: 1375-86.
[39]Gao H,Yang W,Qi Z,et al.DJ-1 protects dopaminergic neurons against rotenone-induced apoptosis by enhancing ERK-dependent mitophagy[J].J Mol Biol,2012,423( 2) : 232-48.
[40]Koopman W J,Nijtmans L G,Dieteren C E,et al.Mammalian mitochondrial complex I : biogenesis,regulation,and reactive oxygen species generation[J].Antioxid Redox Signal,2010,12 ( 2) : 1431-70.
[41]Xiao Tao,Liang Tong.Crystal structure of human DJ-1,a protein associated with early onset Parkinson’s disease[J].J Biol Chem,2003,278( 33) : 31372-9.
[42]Takahashi-Niki K,Niki T,Iguchi-Ariga S,et al.Function of DJ-1 in mitochondria[J].Yakugaku Zasshi,2012,132( 10) : 1105-10.
◇论著◇
DJ-1 regulates the function of mitochondria in Parkinson’s disease
GUO Yong-fei,SUN Yi,ZHAO Xin,PU Xiao-ping
( Dept of Molecular and Cellular Pharmacology,School of Pharmaceutical Science,Peking university,Beijing 100191,China)
Abstract:Mitochondrial dysfunction plays an important role in the process of PD,DJ-1 participates in regulating the function of mitochondria,which has an effect on the protection of mitochondria.DJ-1 mutations can lead to the decrease of the activity of mitochondrial complexⅠ,the decrease of mitochondrial membrane potential and then mitochondrial fragmention and mitophagy,and then further damage neurons and trigger PD.This review presents the role of DJ-1 in regulating the function of the mitochondria in the pathogenesis of Parkinson's disease( PD).
Key words:DJ-1; mitochondria; Parkinson’s disease; mitochondrial complex I; mitophagy; oxidative stress; mitochondrial homeostasis
作者简介:郭涌斐( 1989-),女,硕士生,研究方向:帕金森病新药研
基金项目:国家重大科学仪器设备开发专项资助项目( No 2013YQ 030651) ;国家重大新药创制重大专项资助项目( No 2012ZX09103201-042) ;国家自然科学青年基金项目( No 81202937)
收稿日期:2015-09-22,修回日期: 2015-11-03
文献标志码:A
文章编号:1001-1978( 2016) 01-0022-05
doi:10.3969/j.issn.1001-1978.2016.01.006