依普利酮下调SGK-1表达抑制梗阻性肾病细胞增殖的研究
2016-03-21吴丽敏陈立祥梁丽娟刘少伟熊云昭许庆友
吴丽敏,陈立祥,梁丽娟,王 筝,王 淼,刘少伟,熊云昭,王 萱,许庆友
( 1.河北医科大学研究生学院,河北石家庄 050091;2.河北中医学院中西医结合学院内科教研室,河北省中西医结合肝肾病重点实验室,河北石家庄 050091)
依普利酮下调SGK-1表达抑制梗阻性肾病细胞增殖的研究
吴丽敏1,2,陈立祥1,梁丽娟1,王筝2,王淼1,刘少伟2,熊云昭1,王萱1,许庆友1,2
( 1.河北医科大学研究生学院,河北石家庄050091;2.河北中医学院中西医结合学院内科教研室,河北省中西医结合肝肾病重点实验室,河北石家庄050091)
关键词:依普利酮;肾间质纤维化;细胞增殖; UUO; PCNA; SGK-1; TGF-β1
许庆友( 1958-),男,博士,教授,主任医师,博士生导师,研究方向:肾脏病中西医结合临床及基础,通讯作者,Tel: 0311-89926298,E-mail: qingyouxu@ sohu.com
肾间质纤维化( RIF)是各种慢性肾脏疾病发展到终末期肾衰竭的共同病理改变[1]。其主要病理特点为脏器萎缩、细胞外基质( ECM)过度积聚和细胞增生。研究表明,血清糖皮质激素诱导蛋白激酶1( SGK-1)、转化生长因子β1( TGF-β1)等致纤维化因子在醛固酮的诱导下促进细胞增殖及ECM积聚,造成肾脏硬化[2-3]。
本实验采用单侧输尿管结扎梗阻大鼠模型,激活肾素-血管紧张素-醛固酮( RAAS)系统,诱导醛固酮活化致肾间质纤维化。观察其阻断剂依普利酮对细胞增殖标志物增殖细胞核抗原( PCNA)、血清糖皮质激素诱导蛋白激酶1( SGK-1)、转化生长因子β1( TGF-β1)的调控作用,探讨依普利酮拮抗醛固酮活化所致肾间质纤维化的可能作用机制。
1 材料与方法
1.1实验动物及分组选用清洁级♀Wistar大鼠36只,体质量( 200±20) g,购自河北医科大学动物实验中心,随机分为假手术组、UUO组及依普利酮组( n =12)。
1.2药物、试剂和主要仪器依普利酮为美国Pfizer公司产品,日本Research Diets.Inc公司根据动物进食量及药物用量( 100 mg·kg-1·d-1)按1. 25 g·kg-1加入饲料中; PCNA抗体选用Epitomics产品; SGK-1抗体选用Affbiotech产品; TGF-β1、GAPDH抗体均选用Bioworld Technology产品;电泳仪及电泳槽(北京六一公司),OLYMPUS VANOX PM-10AD型显微照相仪(日本OLYMPUS公司),LEICA RM 2245型石蜡切片机(德国LEICA上海分公司)。
1.3造模方法及给药实验动物适应性喂养1周后,复制梗阻性肾病模型,10%水合氯醛注射麻醉,于腹部左侧切开,游离左侧输尿管,于输尿管上1/3处和中1/3处结扎后切断并缝合,假手术组仅游离输尿管。治疗组给以大鼠依普利酮100 mg·kg-1·d-1。治疗10 d后摘取左侧肾脏,4%多聚甲醛中固定、石蜡包埋,切片行常规HE、Masson及免疫组化染色;剩余组织-70℃保存用于Western blot检测蛋白表达。
1.4观察指标及方法
1.4.1 HE、Masson染色观察肾脏组织形态学改变
1.4.2免疫组化检测PCNA、SGK-1、TGF-β1表达采用SABC法检测,一抗浓度均为1∶100。
1.4.3 Western blot检测PCNA、SGK-1、TGF-β1蛋白表达冰冻肾组织100mg加裂解液(含蛋白酶抑制剂) 0. 4 mL,提取蛋白并测定含量;取样品上样蛋白20μg,电泳后转膜,5%脱脂牛奶封闭,加入一抗SGK-1、PCNA、GAPDH抗体( 1∶1000),TGF-β1抗体( 1∶500),4℃过夜,清洗3次,加入兔二抗( 1∶20 000)孵育后显影,与所得内参进行校正后比较。
1.5统计学方法数据资料结果采用SPSS17. 0统计软件进行统计分析。采用单因素方差分析( Oneway ANOVA),数值变量以±s表示。
2 结果
2.1各组大鼠肾脏组织病理学改变HE染色结果假手术组肾脏偶见炎性细胞浸润,间质无水肿,小管无扩张,上皮细胞排列整齐; UUO组大鼠肾脏有大量炎性细胞浸润,肾小管扩张明显,上皮细胞脱落;依普利酮组远端小管扩张程度及上皮细胞脱落与UUO组大致相同,但炎性细胞浸润较UUO组明显减少( Fig 1)。Masson染色结果:假手术组大鼠肾脏间质中可见少量胶原纤维成分表达,肾小管和肾小球基底膜结构清晰。UUO组肾小管间质中有大量胶原纤维成分沉积,肾脏结构紊乱。依普利酮组胶原纤维成分表达与假手术组相比增多,与UUO组相比胶原纤维成分明显减少( Fig 2)。
2.2肾组织PCNA的免疫组化检测PCNA在假手术组中仅有少量表达,见于肾小管。模型组阳性细胞明显增多,以肾小管上皮细胞及间质表达为甚;依普利酮组与模型组相比,PCNA阳性细胞数明显减少,主要见于肾小管( Fig 3)。
2.3肾组织SGK-1及TGF-β1的表达假手术组SGK-1及TGF-β1呈弱表达,主要表达于肾小管上皮细胞,SGK-1以远端小管为主;模型组中SGK-1及TGF-β1表达明显增强,主要见于肾小管上皮及间质细胞:依普利酮组SGK-1及TGF-β1表达范围及强度较模型组均明显减弱( Fig 4、5)。
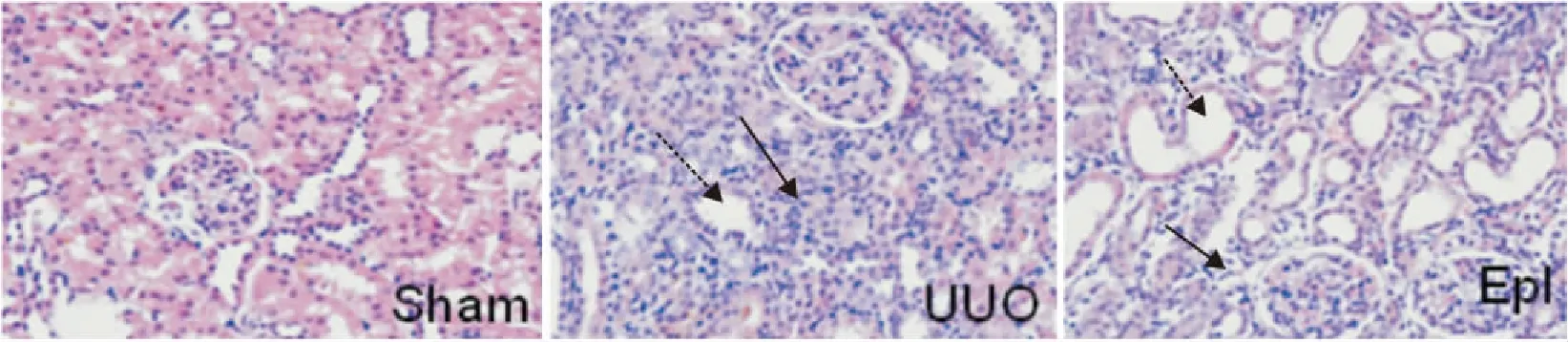
Fig 1 HE staining of kidney in rats with UUO(×200)
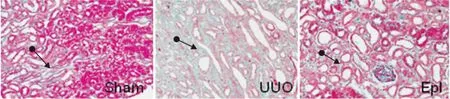
Fig 2 Masson staining of kidney in rats with UUO(×200)

Fig 3 Expression of PCNA in UUO rats with immunohistochemistry (×200)

Fig 4 Expression of SGK-1 in UUO rats with immunohistochemistry(×100)

Fig 5 Expression of TGF-β1in UUO rats with immunohistochemistry(×200)
2.4肾组织PCNA、SGK-1及TGF-β1的蛋白表达
采用Western blot检测肾组织PCNA、SGK-1及TGF-β1蛋白表达,结果显示模型组PCNA、SGK-1及TGF-β1表达与假手术组相比明显增强,差异有统计学意义( P<0. 01) ;依普利酮组的表达与模型组相比明显减弱,差异有统计学意义( P<0. 05),见Tab 1、Fig 6。
Tab 1 The protein expression of PCNA,SGK-1,TGF-β1in UUO rats with Western blot (±s,n =3)

Tab 1 The protein expression of PCNA,SGK-1,TGF-β1in UUO rats with Western blot (±s,n =3)
**P<0. 01 vs sham;△P<0. 05 vs UUO
Group PCNA/GAPDH SGK-1/GAPDH TGF-β1/GAPDH Sham 0.4579±0.0458 0.4608±0.1561 0.0826±0.0166 UUO 1.1113±0.1922** 1.5957±0.2680** 0.7216±0.0792**Epl 0.6479±0.2075△ 1.0605±0.2224△ 0.3 680±0.0656△

Fig 6 Expression of PCNA,SGK-1,TGF-β1in UUO rats with Western blot
3 讨论
慢性肾衰竭是所有慢性肾脏疾病发展的最终结局,其病理改变是肾间质纤维化。肾间质纤维化常伴有肾小管萎缩、间质炎性细胞浸润、成纤维细胞聚集以及间质基质沉积等特征性病理改变。随着对RAAS系统的深入了解,研究证实RAAS的激活是引起慢性肾脏病的重要因素之一[4],醛固酮作为RAAS系统的重要效应分子,可作为独立危险因素直接参与慢性肾脏疾病的进展[5]。新的研究发现,醛固酮除可调节肾脏电解质及水的排泄外,也参与炎性损伤、氧化应激、胶原沉积等多种病理反应[6]。细胞增殖及ECM的沉积是导致肾小球硬化和间质纤维化的重要因素之一。细胞增殖多出现在ECM沉积之前,并持续存在于ECM的沉积及肾间质纤维化发展过程中[7],故抑制醛固酮活化诱导的肾小管上皮细胞及间质细胞增殖作用可相对减少ECM的沉积,减缓肾间质纤维化进程,对于减缓慢性肾脏病的进展具有重大意义。
PCNA在肾脏病的进展中反映着细胞的增殖状态,有研究表明UUO术后3d肾脏PCNA表达明显增强[8],我们的研究也发现梗阻24 h后PCNA阳性细胞开始增多并持续于整个实验(结果待发表),主要以上皮细胞及间质细胞为主,增殖的细胞分泌细胞外基质参与纤维化的进展。故有效抑制细胞增殖对减缓肾间质纤维化具有重要作用。
细胞增殖与多种血管活性物质及细胞生长因子等有关,以往对Ang II较为重视,近几年通过对醛固酮的深入研究,醛固酮活化在肾脏病的损伤中有着更为重要的意义,醛固酮活化的作用途径有多种,其中SGK-1途径在炎性损伤中发挥着重要作用。SGK-1的经典作用是对肾小管中钠离子代谢的调节。此外SGK-1是重要的细胞内信号转导通路及细胞磷酸化级联反应的功能性交汇点,研究表明醛固酮可刺激SGK-1介导肾脏炎症反应及纤维化[9]。在梗阻性肾病大鼠实验中,醛固酮活化诱导SGK-1在肾组织中表达增强[10-11],导致氧化应激、炎性损伤,并上调促纤维化因子CTGF的表达,引起MMPs/TIMPs的失衡,加速脏器纤维化进程[12]。故SGK-1目前被认为是醛固酮促脏器纤维化、氧化应激及炎性损伤的主要效应介质[13]。亦有研究表明梗阻性肾病动物中肾小管上皮细胞的表型转化与SGK-1的上调密切相关,敲除SGK-1基因可减轻UUO诱导的细胞表型转化[11]。SGK-1主要参与细胞内信号传导,与NF-кB的活化密切相关,有研究提示醛固酮可通过SGK-1诱导大鼠系膜细胞促纤维化因子CTGF分泌及NF-κB的活化[14]。醛固酮活化诱导的炎性损伤可通过SGK-1/NF-κB信号通路促纤维化,故SGK-1在醛固酮促纤维化中发挥着重要作用[15]。本研究主要观察醛固酮诱导的细胞增殖以及信号传导,结果显示梗阻性肾病诱导的醛固酮活化通过SGK-1通路刺激肾小管上皮细胞增殖,参与纤维化的进展,给予依普利酮治疗后,细胞增殖得以抑制,其作用与下调SGK-1相关。
此外,经典途径TGF-β1作为重要的致纤维化细胞生长因子,对细胞增殖的作用依然存在,其高表达是Ang II还是醛固酮诱导尚需进一步证实,但通过抑制醛固酮活性,可以同时下调其表达,抑制细胞的增殖,减轻纤维化病变。
新型盐皮质激素受体阻断剂依普利酮与螺内酯相比,具有高度选择性,可竞争性抑制盐皮质激素受体与醛固酮的结合,从而阻止醛固酮受体复合物的形成及活化所诱导的肾间质纤维化进程。对肾脏具有一定的保护作用[9、16]。已有实验证实,依普利酮可有效抑制醛固酮的活化,抑制细胞增殖和细胞外基质过度分泌,保护肾功能[17-18]。本实验主要通过采用UUO方式复制肾间质纤维化模型,激活RAAS系统,诱导醛固酮活化上调SGK-1表达介导肾小管上皮细胞增殖作用,研究其阻断剂依普利酮可通过下调SGK-1表达抑制梗阻性肾病细胞增殖从而达到减轻肾间质纤维化的作用。之前我们曾观察依普利酮通过下调TNF-α、NF-κB抑制细胞表型转化,减轻肾间质纤维化的作用[16],这次研究以细胞增殖为重点,观察醛固酮活化上调SGK-1表达对细胞增殖标记物增殖细胞核抗原( PCNA)的作用。结果显示依普利酮可通过下调SGK-1、TGF-β1的表达,抑制细胞的增殖及ECM的沉积,从而减缓肾间质纤维化的进程,减轻肾脏损伤。
(致谢:衷心感谢河北省中西医结合肝肾病重点实验室各位老师的支持与帮助。)
参考文献:
[1]Eddy A A.Molecular basis of renal fibrosis[J].Pediatr Nephrol,2000,15( 3-4) : 290-301.
[2]Rafiq K,Hitomi H,Nakano D,Nishivama A.Pathophysiological roles of aldosterone and mineralocorticoid receptor in the kidney [J].J Pharmacol Sci,2011,115( 1) : 1-7.
[3]Yang J,Liu Y.Dissection of key events in tubular epithelial to myofibroblast transition and its implications in renal interstitial fibrosis[J].Am J Pathol,2001,159( 4) : 1465-75.
[4]Kolesnyk I,Struijk D G,Dekker F W,et al.Effects of angiotensinconverting enzyme inhibitors and angiotensinⅡreceptor blockers in patients with chronic kidney disease[J].Neth J Med,2010,68( 1) : 15-23.
[5]Bolignano D,Palmer S C,Navaneethan S D,et al.Aldosterone antagonists for preventing the progression of chronic kidney disease [J].Cochrane Database Syst Rev,2014,Apr 29; 4: CD007004.
[6]崔艳,陈晓,安惠霞,等.醛固酮与肾脏炎症的研究进展[J].中国中西医结合肾病杂志,2012,13( 10) : 932-4.
[6]Cui Y,Chen X,An H X,et al.The research progress of aldosterone and kidney inflammation[J].Chin J Integ Trad Western Nephrol,2012,13( 10) : 932-4.
[7]韩琳,秦建国,陈志强,等.鳖甲煎丸对肾间质纤维化大鼠细胞增殖的影响[J].北京中医药大学学报,2009,32( 7) : 457-61.
[7]Han L,Qin J G,Chen Z Q,et al.Influence of Bie jia jian pills on cell proliferation in rats with renal interstitial fibrosis[J].J Beijing Univ Tradit Chin Med,2009,32( 7) : 457-61.
[8]董健平,陈香美,师锁柱,等.金属蛋白酶组织抑制剂1在大鼠肾小管间质损害中的表达及其意义[J].中华肾脏病杂志,2002,18( 4) : 275-9.
[8]Dong J P,Chen X M,Shi S Z,et al.Role of TIMP-1 expression in renal tubulointerstital lesion induced by unilateral ureteral obstruction[J].Chin J Nephrol,2002,18( 4) : 275-9.
[9]Terada Y,Kuwana H,Kobayashi T,et al.Aldosterone stimulated SGK 1 activity mediates profibrotic signaling in the mesangium[J].J Am Soc Nephrol,2008,19( 2) : 298-309.
[10]王筝,梁丽娟,王聪慧,等.肾络通对梗阻性肾病大鼠炎性介质及血清糖皮质激素诱导蛋白激酶1表达的影响[J].中医杂志,2014,55( 1) : 53-6.
[10]Wang Z,Liang L J,Wang C H,et al.Effects of shenluotong on inflammatory mediators and serum glucocorticoid-induced protein kinase 1 in rats with obstructive nephropathy[J].J TCM,2014,55 ( 1) : 53-6.
[11]Cheng J Z,Truong L D,Wu X Q,et al.Serum and glucocorticoidregulated kinase 1 is upregulated following unilateral ureteral obstruction causing epithelial-mesenchymal transition[J].Kidney Int,2010,78( 7) : 668-78.
[12]Martín-Fernández B,de las Heras N,Miana M,et al.Structural,functional,and molecular alterations produced by aldosterone plus salt in rat heart: association with enhanced serum and glucocorticoid-regulated kinase-1 expression[J].J Cardiovasc Pharmacol,2011,57( 1) : 114-21.
[13]Martín-Fernández B,de las Heras N,Miana M,et al.Spironolactone prevents alterations associated with cardiac hypertrophy produced by isoproterenol in rats: involvement of serum-and glucocorticoid-regulated kinase type 1[J].Exp Physiol,2012,97( 6) : 710 -8.
[14]Terada Y,Ueda S,Hamada K,et al.Aldosterone stimulates nuclear factor-kappa B activity and transcription of intercellular adhesion molecule-1 and connective tissue growth factor in rat mesangial cells via serum-and glucocorticoid-inducible protein kinase-1[J].Clin Exp Nephrol,2012,16( 1) : 81-8.
[15]Samavat S,Ahmadpoor P,Samadian F.Aldosterone,hypertension,and beyond[J].Iran J Kidney Dis,2011,5( 2) : 71-6.
[16]梁丽娟,王筝,王蕊,等.依普利酮下调TNF-α、NF-κB抑制细胞表型转化的研究[J].中国药理学通报,2013,29( 11) : 1553 -7.
[16]Liang L J,Wang Z,Wang R,et al.Inhibitory effects of eplerenone on epithelial-mesenchymal transformation via down-regulated TNF-α and NF-κB in rats with unilateral ureteral obstruction[J].Chin Pharmacol Bull,2013,29( 11) : 1553-7.
[17]孙东云,许庆友,王香婷,等.依普利酮抑制细胞增殖拮抗急性环孢素A肾损伤的研究[J].中国药理学通报,2011,27( 12) : 1678-82.
[17]Sun D Y,Xu Q Y,Wang X T,et al.Inhibitory effect of eplerenone on cell proliferation in acute cyclosporine nephrotoxicity [J].Chin Pharmacol Bull,2011,27( 12) : 1678-82.
[18]Chen H,Sun F,Zhong X,et al.Eplerenone-mediated aldosterone blockade prevents renal fibrosis by reducing renal inflammation,interstitial cell proliferation and oxidative stress[J].Kidney Blood Press Res,2013,37( 6) : 557-66.
Inhibitory effects of eplerenone on cell proliferation via down-regulated SGK-1 pathway in rats with unilateral ureteral obstruction
WU Li-min1,2,CHEN Li-xiang1,LIANG Li-juan1,WANG Zheng2,WANG Miao1,LIU Shao-wei2,XIONG Yun-zhao1,WANG Xuan1,XU Qing-you1,2
( 1.Hebei Medical University Graduate School,Shijiazhuang 050091,China; 2.College of Integrated Chinese and Western Medicine,Hebei University of Chinese Medicine,Hebei Key Laboratory of Integrative Medicine on Liver-kidney patterns,Shijiazhuang 050091,China)
Abstract:AimTo observe the effect of mineralocorticoid receptor blockade eplerenone on cell proliferation in obstructed kidney of rats.Methods Renal interstitial fibrotic animals were made with unilateral ureteral obstruction ( UUO) and treated with eplerenone100 mg ·kg-1·d-1.The kidneys were harvested on the 10th day and proliferating cell nuclear antigen ( PCNA),serum and glucocorticoid induced kinase-1 ( SGK-1) and transforming growth factor-β1 ( TGF-β1) were detected with immunohistochemistry and Western blot.ResultsRenal histopathology showed large quantities extracellular matrix ( ECM) accumulation in kidney with UUO,large numbers of inflammatory cells infiltrated in renal interstitium,renal tubular expansion and exfoliation of epithelial cells.The cell proliferation and ECM accumulation were inhibited in eplerenone treated rats significantly.Immunohistochemistry and Western blot showed that expressions of PCNA,SGK-1 and TGF-β1were significantly up-regulated with UUO and down-regulated by eplerenone.ConclusionEplerenone plays the role in inhibiting the cell proliferation and reducing ECM accumulation by down-regulating expression of SGK-1 pathway in rats with unilateral ureteral obstruction.
Key words:eplerenone; renal interstitial fibrosis; cell proliferation; UUO; PCNA; SGK-1; TGF-β1
作者简介:吴丽敏( 1989-),女,硕士生,研究方向:肾脏病中西医结合临床及基础,Tel: 0311-89926298,E-mail: 916952722 @ qq.com;
基金项目:国家自然科学基金资助项目( No 81273684,81473652),河北省自然科学基金资助项目( No H2015423009)
收稿日期:2015-09-06,修回日期: 2015-11-26
文献标志码:A
文章编号:1001-1978( 2016) 01-0069-05中国图书分类号: R-332; R322.61; R341; R692.39; R977. 6摘要:目的观察盐皮质激素受体阻断剂依普利酮抑制梗阻性实验动物肾脏细胞增殖的作用及机制。方法结扎大鼠单侧输尿管( UUO)制备肾间质纤维化动物模型,给予依普利酮100 mg·kg-1·d-1治疗,10 d后摘取肾脏,观察大鼠肾脏组织病理改变。采用免疫组化、Western blot方法检测增殖细胞核抗原( PCNA)、血清糖皮质激素诱导蛋白激酶1 ( SGK-1)、转化生长因子-β1( TGF-β1)的表达。结果肾脏病理显示,UUO组大鼠肾脏有明显的细胞外基质( ECM)积聚,有大量炎性细胞浸润,肾小管扩张明显,上皮细胞脱落,依普利酮可明显减轻其细胞增殖及ECM的沉积;免疫组化和Western blot结果显示,UUO组大鼠肾脏PCNA、SGK-1、TGF-β1表达明显增强;依普利酮可下调其表达。结论依普利酮可通过下调SGK-1的表达,抑制梗阻性肾病细胞增殖,减少ECM的沉积,减缓肾脏纤维化的进程,减轻肾脏损伤。
doi:10.3969/j.issn.1001-1978.2016.01.015