灰毡毛忍冬花蕾提取物及其两种主要皂苷的溶血性研究
2016-03-21汪宏锦王红玉吴俊杰徐晓玉
汪宏锦,王红玉,何 然,吴俊杰,徐晓玉
(西南大学药学院&中医药学院,重庆市药效评价工程技术研究中心,西南大学中药研究所,重庆 400715)
灰毡毛忍冬花蕾提取物及其两种主要皂苷的溶血性研究
汪宏锦,王红玉,何然,吴俊杰,徐晓玉
(西南大学药学院&中医药学院,重庆市药效评价工程技术研究中心,西南大学中药研究所,重庆400715)
中国图书分类号: R-332; R282.71; R284.1; R331.122; R973
摘要:目的评价灰毡毛忍冬花蕾提取物、灰毡毛忍冬皂苷乙与川续断皂苷乙的体内外溶血作用。方法采用肉眼观察法和紫外分光光度法,观察灰毡毛忍冬花蕾提取物、灰毡毛忍冬皂苷乙与川续断皂苷乙浓度梯度为5、10、20、30、40、50、60、70、80、90、100 mg·L-1的溶液在体外对2%兔红细胞悬浮液的溶血反应;采用血液生化指标测定方法,分别检测灰毡毛忍冬花蕾提取物2. 275 g·kg-1(生药)和1. 137 g· kg-1(生药)组、灰毡毛忍冬皂苷乙0. 110 g·kg-1和0. 055 g ·kg-1组、川续断皂苷乙0. 020 g·kg-1和0. 010 g·kg-1组以及生理盐水组,在小鼠尾静脉给药前及连续给药7 d后,血液中红细胞数、网织红细胞数、血红蛋白含量。结果在体外溶血试验中,各给药组溶血率均<5%,与对照组相比均未见明显的溶血现象( P>0. 05) ;在体内溶血试验中,各组小鼠用药前后,血液红细胞数、网织红细胞数、血红蛋白含量均处于正常范围内,且其数值在给药前后无差异( P>0. 05)。结论在本试验条件下,灰毡毛忍冬花蕾提取物、灰毡毛忍冬皂苷乙与川续断皂苷乙,在体外和体内试验均未导致溶血。
关键词:灰毡毛忍冬花蕾;灰毡毛忍冬皂苷乙;川续断皂苷乙;溶血;肉眼观察法;分光光度法
徐晓玉( 1958-),女,教授,博士生导师,研究方向:中药药理与新药开发,通讯作者,Tel: 023-68250765,E-mail: xuxiaoyu@ swu.edu.cn
灰毡毛忍冬( Lonicera macranthoides Hand.-Mazz.)系忍冬科忍冬属的植物,其花蕾为《中华人民共和国药典》2005版以来收载的山银花药材第一植物来源。灰毡毛忍冬花蕾性甘、寒;归肺、心、胃经,有清热解毒,疏散风热的功效[1],具有抑菌抗病毒[2-4]、解热抗炎[5-7]、保肝利胆[8-9]、免疫调节[4]
等药理作用,有很大的临床药用价值。灰毡毛忍冬花蕾的主要化学成分为有机酸类、皂苷类、黄酮类等,其中所含皂苷以灰毡毛忍冬皂苷乙( macranthoidinB,mB)和川续断皂苷乙( dipsacosideB,dB)最具代表性[10]。因为其含量丰富,两种皂苷的总含量通常达到5%以上,目前被作为2010年版《中华人民共和国药典》区别于忍冬的主要鉴定成分。
研究显示,部分药材的皂苷在血管内给药时具有溶血的特点[11]。1984年贵州省药材公司王玉英等在《中药材科技》第2期上曾报道过“灰毡毛忍冬蒸晒品无溶血性,而生晒品有溶血性。如作注射液原料,必须采用蒸晒品”[12]。自此,灰毡毛忍冬一直被认为具有溶血作用,但课题组查遍了近30年来能查到的所有资料,未见任何有关灰毡毛忍冬溶血性的其他报道。为了弄清这一问题的客观情况,本试验采用2种方法,对灰毡毛忍冬花蕾提取物及其所含的两种主要皂苷(灰毡毛忍冬皂苷乙、川续断皂苷乙)是否具有溶血特性,在体内外进行了研究,以期为灰毡毛忍冬花蕾的正确认识和合理使用提供参考。
1 仪器与材料
1.1仪器EL204电子天平(上海梅特勒-托利多仪器有限公司),7DL-40B普通离心机(上海安亭科学仪器厂),UV3010紫外分光光度计(日本高新),SHH-150L生化培养箱(重庆永生试验仪器厂),XSZ-H双目生物显微镜(重庆光电)等。
1.2动物新西兰大白兔10只,♀♂各半,体质量2~3 kg( SPF级,质量合格证号: 0003225) ; KM小鼠70只,♀♂各半,体质量18~22 g( SPF级,质量合格证号: 0003222)。两种动物均购于重庆市中药研究院实验动物研究所(生产许可证号: 2012-0006)。饲养于西南大学药学院SPF级实验动物中心(实验动物使用许可证号: SYXK(渝) 2009-0002)。
1.3试剂与药品自制灰毡毛忍冬花蕾提取物,灰毡毛忍冬干燥选花花蕾来源于重庆秀山,批号: 20140628,经西南大学齐红艺教授鉴定为忍冬科忍冬属植物灰毡毛忍冬的干燥花蕾。该花蕾的产地加工方法为:采用蒸汽杀青热风干燥机( JYH150型,重庆市农科院农机研究所研制生产)加工,采收24h内120℃蒸汽杀青5 min,80℃干燥35 min。将灰毡毛忍冬花蕾粉碎,过60目筛,称取一定量粉末于锥形瓶中,加适量70%乙醇,物料比为1∶8,70℃下回流提取4. 5 h,抽滤,滤液真空冷冻干燥得到提取物,备用。1 g提取物相当于生药量187. 5 g。
灰毡毛忍冬皂苷乙标准品(纯度98%,上海源叶生物科技有限公司,ZM0510BC13) ;川续断皂苷乙标准品(纯度98%,上海源叶生物科技有限公司,KS0905CA14) ;红细胞稀释液测试盒( 100 mL/瓶,C037)、网织红细胞计数液(含网织红细胞染色储备液,16mL/瓶;网织红细胞染色稀释液,60 mL/瓶,C043)及氰化高铁血红蛋白测试盒( 1 mL/支,C021),均购于南京建成生物工程研究所;蒸馏水、生理盐水等。
2 方法
2.1体外溶血试验
2.1.1体积分数0. 02的红细胞悬浮液制备心脏取血法取兔血2~3 mL,放入烧杯中用脱脂棉球棒轻微搅拌5~10 min,除去纤维蛋白原,使之成为脱纤血液。加入0. 9%氯化钠溶液约10倍量,摇匀,1 200 r·min-1离心15 min,除去上清液,沉淀的红细胞再用0. 9%氯化钠溶液按上述方法洗涤2~3次,至上清液不显红色为止。将所得红细胞溶液用0. 9%氯化钠溶液配成体积分数0. 02的红细胞混悬液(每100 mL混悬液含红细胞溶液2 mL),待用[13]。
2.1.2供试溶液制备分别用灰毡毛忍冬花蕾提取物( hH)、灰毡毛忍冬皂苷乙( mB)、川续断皂苷乙( dB)标品以生理盐水配成100 mg·L-1的母液,再用生理盐水稀释成5、10、20、30、40、50、60、70、80、90 mg·L-1的梯度浓度溶液,备用。
2.1.3肉眼观察法3种药物每种分别取洁净试管13只,进行编号: 1号管为阴性对照管(生理盐水),2号管为阳性对照管(蒸馏水),3~13号管为供试品管(不同浓度药物)。每管均加入2%红细胞悬液2. 5 mL后,1号管再加入生理盐水2. 5 mL,2号管再加入蒸馏水2. 5 mL,3~13号管再分别加入生理盐水2. 2 mL和不同浓度的受试物0. 3 mL,使每管溶液总量均为5 mL。混匀后,立即置于37℃± 0. 5℃的恒温箱中进行温育,开始每隔15 min观察1次,1 h后,每隔1 h观察1次,观察3 h。
2.1.4分光光度法①最大吸收波长的确定:取蒸馏水2. 5 mL,加入2%红细胞悬液2. 5 mL,混匀,置于37℃恒温水浴箱中保温30 min后,取出后离心5 min( r =1 500 r·min-1),吸取上清液在紫外分光光度计上扫描,以0. 9%氯化钠溶液为对照,确定最大吸收波长为545 nm[13-14]。②离心时间及转速的确定:取生理盐水2. 5 mL,加入2%红细胞悬液2. 5 mL作为阴性对照,37℃温育30 min,分别以1 500、2 000、2 500、3 000 r·min-1的转速离心5、10、15 min,取上清液于最大吸收波长545 nm处测定吸光度[14]。结果见Fig 1。可见,吸光度随时间以及转速的增加呈下降趋势,故确定离心时间为5 min,转速为3 000 r·min-1( Fig 1)。③检测步骤: 3种药物分别取洁净试管13只,进行编号,1号管为阴性对照管(生理盐水),2号管为阳性对照管(蒸馏水),3~13号管为供试品管(不同浓度药物)。每管均加入2%红细胞悬液2. 5 mL后,1号管再加入生理盐水2. 5 mL,2号管再加入蒸馏水2. 5 mL,3~13号管再分别加入生理盐水2. 2 mL和不同浓度的受试物0. 3 mL,使每管溶液总量均为5 mL。混匀后,立即置于37℃±0. 5℃的恒温箱中进行温育,开始每隔15 min观察1次,1 h后,每隔1 h观察1次,观察3 h。3 h后将各管溶液离心,取上清,在分光光度计上,最大吸收波长处以生理盐水为空白读取各管的OD值。④结果判断:用下式计算各试验管的溶血率%。
溶血率/% = ( ODt-ODnc) /( ODpc-ODnc)× 100%。式中,ODt:试验管吸光度; ODnc:阴性对照管吸光度; ODpc:阳性对照管吸光度。参考评价标准:溶血率>5%表明有溶血发生[13],并进行统计学处理。
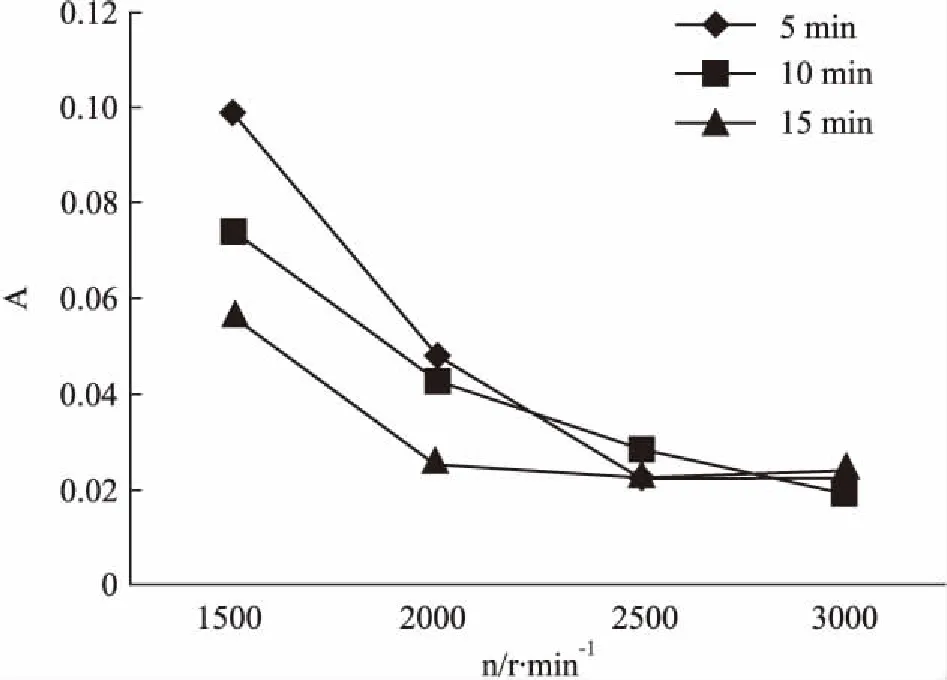
Fig 1 Absorbance changes in different rotate speed and centrifugation time
2.2体内溶血试验
2.2.1动物分组及给药KM小鼠70只,适应性喂养1周后,进行随机分组。设灰毡毛忍冬花蕾提取物2. 275 g·kg-1(生药量)组,1. 137 g·kg-1(生药量)组;灰毡毛忍冬皂苷乙0. 110、0. 055 g·kg-1组;川续断皂苷乙0. 020、0. 010 g·kg-1组;生理盐水组。每组10只。提取物以生理盐水分别稀释成75. 8、37. 9 g·L-1;灰毡毛忍冬皂苷乙以生理盐水分别稀释成3. 60、1. 80 g·L-1;川续断皂苷乙以生理盐水分别稀释成0. 66、0. 33 g·L-1。尾静脉给药[0. 1 mL·( 10 g)-1·d-1[15]],连续给药7 d。
2.2.2红细胞计数参考文献方法[16],于给药前,末次给药后30 min断尾取血,准确吸取10 μL,将其加入2 mL稀释液中,充分混匀,用计数板在显微镜下计数。
2.2.3网织红细胞计数参考文献方法[16],于给药前,末次给药后30 min断尾取血,处理,显微镜下观察,用计数板计数1 000个红细胞中网织红细胞数目。
2.2.4血红蛋白含量测定参考文献方法[16],于给药前,末次给药后30 min断尾取血,准确吸取10 μL,加入到2. 5 mL HICN稀释液中,回洗3次,混匀后静置5 min,分光光度计用蒸馏水调零,540 nm处测定各管吸光度A值,血红蛋白含量( g·L-1) = A×367. 7。
2.3统计处理方法溶血指标的检查结果统计采用百分率表示;所有试验均重复3次。试验数据用SPSS 17. 0软件进行单因素方差分析,统计结果以±s表示。
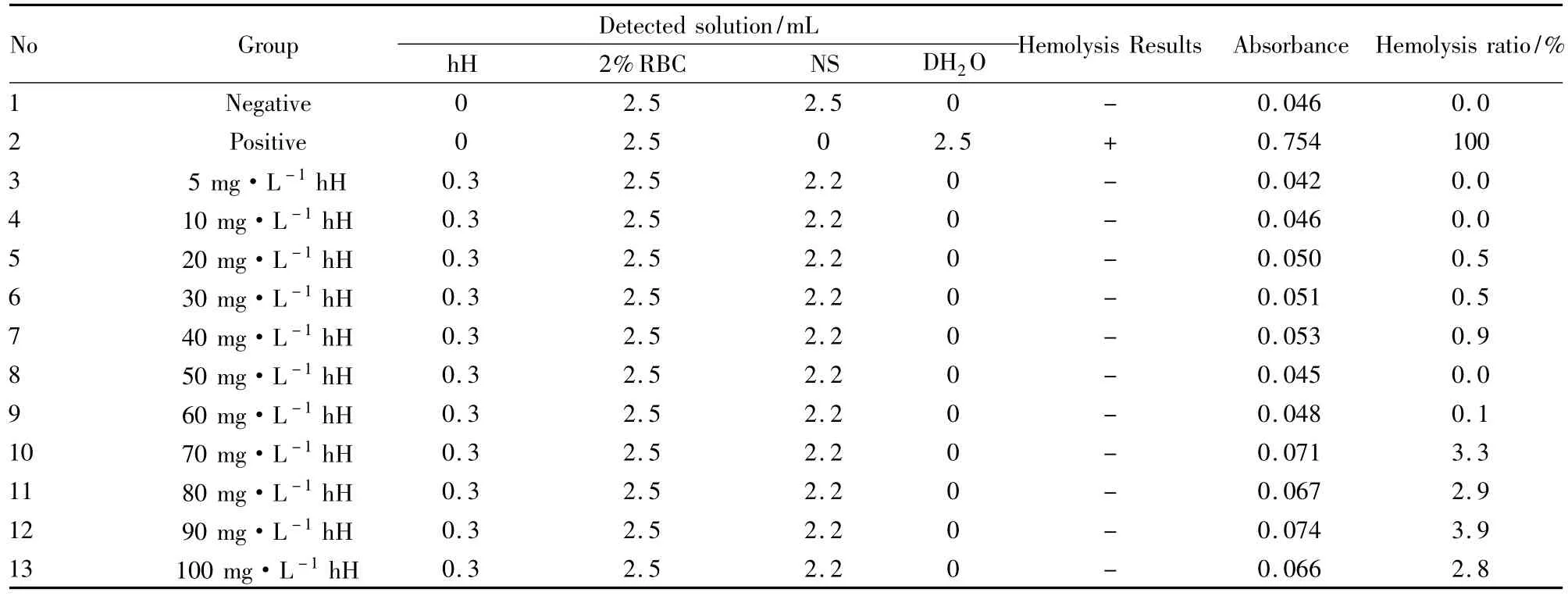
Tab 1 Hemolysis test of extracts from Lonicera macranthoides flower bud in vitro( visual inspection and Spectrophotometry test)
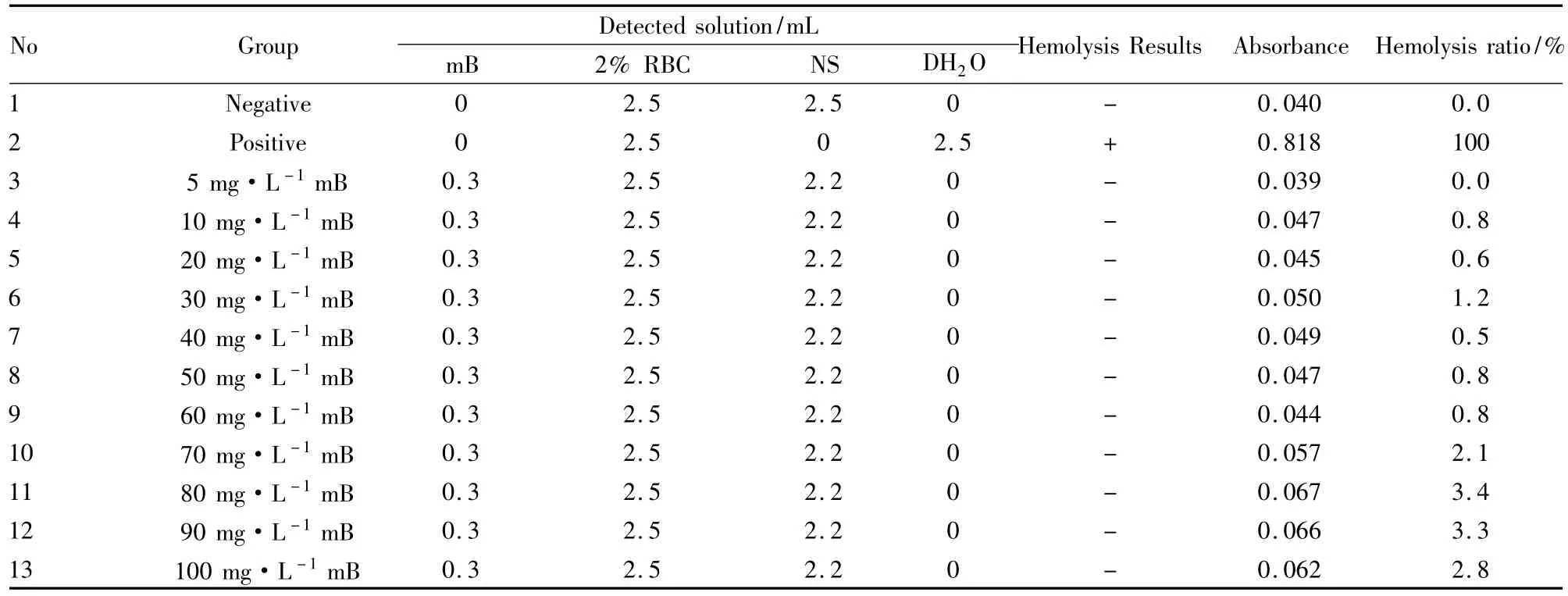
Tab 2 Hemolysis test of macranthoidinB in vitro( visual inspection and Spectrophotometry test)
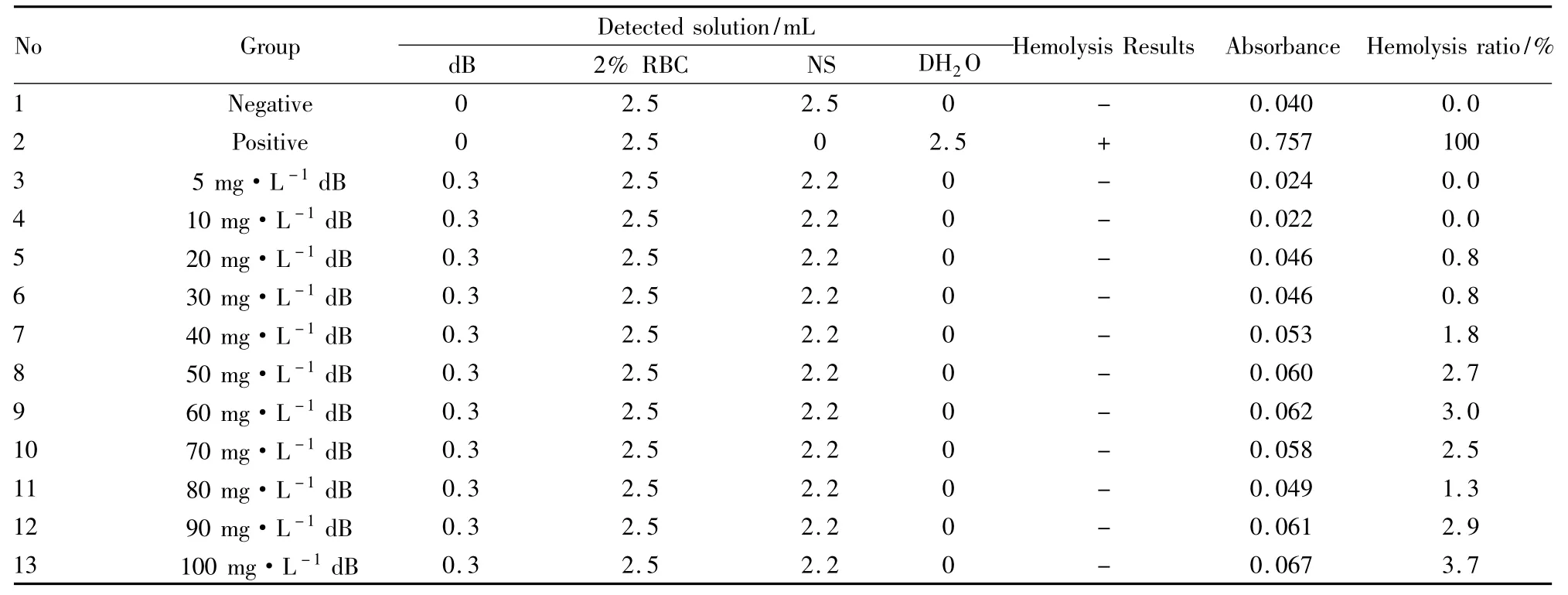
Tab 3 Hemolysis test of DipsacosideB in vitro( visual inspection and Spectrophotometry test)
Tab 4 Average values of RBC,RET and MCHC before and after mice respectively treated with extracts from Lonicera macranthoides flower bud,MacranthoidinB and DipsacosideB(±s,n =10)
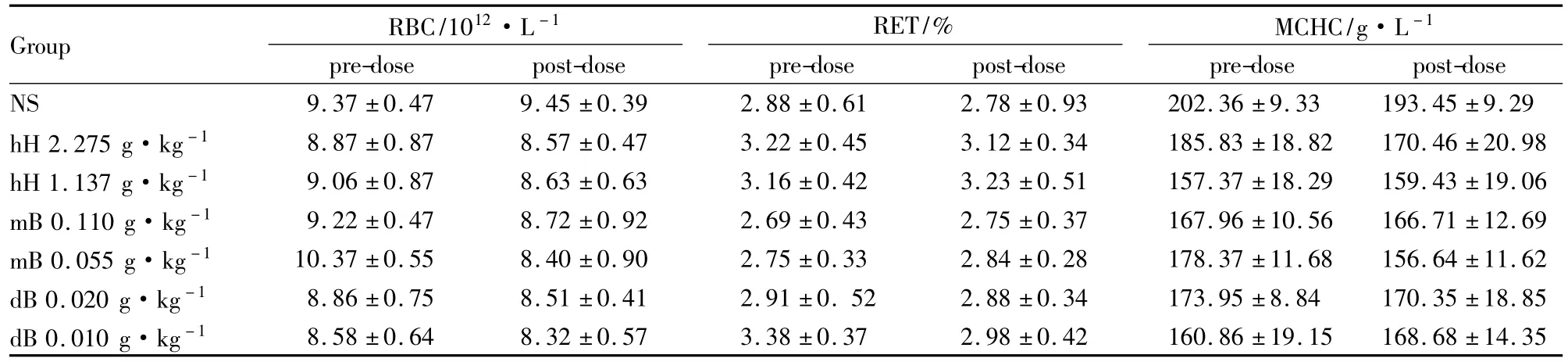
Tab 4 Average values of RBC,RET and MCHC before and after mice respectively treated with extracts from Lonicera macranthoides flower bud,MacranthoidinB and DipsacosideB(±s,n =10)
Group RBC/1012·L-1RET/%MCHC/g·L-1pre-dose post-dose NS 9.37±0.47 9.45±0.39 2.88±0.61 2.78±0.93 2 pre-dose post-dose pre-dose post-dose 02.36±9.33 193.45±9.29 hH 2.275 g·kg-1 8.87±0.87 8.57±0.47 3.22±0.45 3.12±0.34 185.83±18.82 170.46±20.98 hH 1.137 g·kg-1 9.06±0.87 8.63±0.63 3.16±0.42 3.23±0.51 157.37±18.29 159.43±19.06 mB 0.110 g·kg-1 9.22±0.47 8.72±0.92 2.69±0.43 2.75±0.37 167.96±10.56 166.71±12.69 mB 0.055 g·kg-1 10.37±0.55 8.40±0.90 2.75±0.33 2.84±0.28 178.37±11.68 156.64±11.62 dB 0.020 g·kg-1 8.86±0.75 8.51±0.41 2.91±0.52 2.88±0.34 173.95±8.84 170.35±18.85 dB 0.010 g·kg-1 8.58±0.64__________ 8.32±0.57___________3_________________________________ .38±0.37_2.98±0.42_160.86±19.15______ 168.68±______14.35
3 结果
3.1体外溶血试验结果结果表明,灰毡毛忍冬花蕾提取物( hH)、灰毡毛忍冬皂苷乙( mB)与川续断皂苷乙( dB)的各浓度体外溶血试验中,均未观察到溶血现象;各给药组致体外红细胞溶血率均低于5%,也无明显的剂量依存关系。见Tab 1、2、3。按照《中药、天然药物局部刺激性和溶血性研究技术指导原则》的判定标准,体外红细胞溶血率低于5%说明无溶血发生[13]。
3.2体内溶血试验结果灰毡毛忍冬花蕾提取物( hH)、灰毡毛忍冬皂苷乙( mB)与川续断皂苷乙( dB)的体内溶血试验表明,供试物对小鼠血液学指标无明显影响,给药前与给药后各组小鼠的红细胞数、网织红细胞数、血红蛋白含量平均值均在正常范围(红细胞数: 7. 7~12. 5×1012·L-1;网织红细胞数: 2. 15%~5. 87%;血红蛋白: 100~210 g· L-1)[16],见Tab 4。
4 讨论
4.1皂苷溶血性与糖链数目、苷元种类及基团酸碱性等有关皂苷导致溶血,多是因为皂苷能与胆固醇结合生成不溶性的分子复合物[17]。当皂苷水溶液与红细胞相接触时,红细胞壁上的胆固醇与皂苷结合,生成不溶性的复合物沉淀,血红细胞的正常渗透性遭到破坏,使红细胞内渗透压增加而发生崩解,从而导致溶血现象[18]。皂苷溶血活性还和糖链数目有关,许多双糖链皂苷无溶血作用,但单糖链皂苷溶血作用明显[19]。但并非所有皂苷都具有溶血现象,例如以含三萜皂苷为主的人参总皂苷没有溶血作用,但经过分离后,其中以原人参三醇及齐墩果酸为苷元的人参皂苷则具有明显的溶血作用,而以人参二醇为苷元的人参皂苷则具有抗溶血作用[17]。另外,皂苷的溶血性也与皂苷中所含基团酸碱性有关,酸性皂苷溶血作用大于中性皂苷[20-21]。灰毡毛忍冬皂苷乙与川续断皂苷乙均为常春藤皂苷元的双糖链皂苷,理论上不具有溶血作用。
4.2有关“灰毡毛忍冬皂苷具有溶血作用”问题查无实据历史的有关报道并没有涉及到皂苷问题。1984年贵州省药材公司王玉英等在《中药材科技》第2期报道有关研究结果的全文如下“①五种材料的LD50顺序为:密银花<济银花<(灰毡毛忍冬)蒸晒品<(灰毡毛忍冬)生晒品<贵州商品。可见灰毡毛忍冬的毒性虽较密银花、济银花稍大,但蒸晒品或生晒品均小于贵州山银花,因而是安全的。②灰毡毛忍冬蒸晒品无溶血性,而生晒品有溶血性。如作注射液原料,必须采用蒸晒。③对灰毡毛忍冬的蒸晒品与生晒品进行比较,前者的毒性比后者小;前者无溶血性而后者有溶血性。故产地加工应采用蒸晒法。”该文主要强调加工规范,没有将灰毡毛忍冬的两种皂苷与溶血性相联系,没有进行任何成分、机制方面的研究。近30年来也未见类似报道,有关灰毡毛忍冬皂苷具有溶血作用的问题查无实据。
4.3本试验结果未发现灰毡毛忍冬及其两种主要皂苷的溶血作用本研究采用山银花野生资源保护地,亦是山银花最大种植加工生产地——重庆秀山所产灰毡毛忍冬为研究对象。该县自2006年以来在全县推广使用特别研制的银花产地加工“蒸汽杀青热风干燥机”,目前有蒸汽杀青热风干燥机148台覆盖全县30.1万亩种植基地,药材加工规范,质量统一,具有代表性。本研究以《中药、天然药物刺激性和溶血性研究的指导原则》为规范,进行了体外试验,分光光度法与肉眼观察法结果均表明,灰毡毛忍冬花蕾提取物、灰毡毛忍冬皂苷乙与川续断皂苷乙在一定浓度范围内( 5~100 mg·L-1)均没有溶血作用,且查阅文献未发现有报道三萜皂苷溶血作用与浓度有关。在模拟溶血反应长期毒性试验方法进行给药7 d的体内溶血试验中,各给药组给药前后红细胞数、网织红细胞数、血红蛋白含量均处于正常范围内[16],且各组给药前后的数值没有差异性( P>0. 05)。由此得出,经产地蒸汽杀青后干燥(或蒸晒法)加工制成的灰毡毛忍冬花蕾混合提取物,以及灰毡毛忍冬皂苷乙和川续断皂苷乙均不会导致溶血。
(致谢:本试验在西南大学药学院分子药理实验室、重庆市药效评价工程技术研究中心和西南大学中药研究所完成。感谢实验室各位老师的帮助与支持! )
参考文献:
[1]国家药典委员会编,中华人民共和国药典[S].一部.2010年版.北京:化学工业出版社,2010: 28
[1]National Pharmacopoeia Committee.Chinese pharmacopoeia[S].2010.Beijing: Chemical Industry Press,2010: 28.
[2]王芳,高松.金银花、山银花药理学研究现状[J].辽宁中医药大学学报,2013,15( 4) : 237-9.
[2]Wang F,Gao S.Current research status of pharmacology of Honeysuckle and Lonicera Confusa[J].J Liaoning Univer TCM,2013,15( 4) : 237-9.
[3]李永梅,李莉,柏川,等.金银花的抗腺病毒作用研究[J].华西药学杂志,2001,16( 5) : 327-9.
[3]Li Y M,Li L,Bai C,et al.Effect of extracts from Honeysuckle flower on anti-adenovirus[J].West China J Pharm Sci,2001,16 ( 5) : 327-9.
[4]张小娜,唐清,侯敏,等.灰毡毛忍冬与忍冬的药理作用比较研究[J].中国药理学通报,2012,28( 11) : 1582-5.
[4]Zhang X N,Tang Q,Hou M,et al.Comparison of the pharmacological effects between L.macranthoides Hand.-Mazz and Lonicera japonica Thunb[J].Chin Pharmacol Bull,2012,28( 11) : 1582 -5.
[5]张小娜,童杰,周衍晶,徐晓玉.忍冬属药材药效成分及药理作用研究进展[J].中国药理学通报,2014,30( 8) : 1049-54.
[5]Zhang X N,Tong J,Zhou Y J,Xu X Y.Studies on medicinal ingredients and pharmacological effects of Lonicera[J].Chin Pharmacol Bull,2014,30( 8) : 1049-54.
[6]雷志钧,周日宝,曾嵘,贺又舜.灰毡毛忍冬与正品金银花解热作用的比较研究[J].湖南中医药大学学报,2005,25 ( 5) : 14-5.
[6]Lei Z J,Zhou R B,Zeng R,He Y S.Comparative experiments on antipyretic effect between Lonicera macrathodes Hands Mazz.and the certified Flos Lonicera[J].J TCM Univer Hunan,2005,25 ( 5) : 14-5.
[7]杨斌,丘岳,王柳萍,张锡流.广西山银花绿原酸体外抗炎作用及分子机制研究[J].中国药理学通报,2009,25( 4) : 542 -5.
[7]Yang B,Qiu Y,Wang L P,Zhang X L.Studies on the anti-inflamm atory molecular mechanism of chlorogenic acid extracted from Lonicera confusa DC in vitro[J].Chin Pharmacol Bull,2009,25( 4) : 542-5.
[8]时京珍,陈秀芬,宛蕾.黄褐毛忍冬和灰毡毛忍冬几种成分对大、小鼠化学性肝损伤的保护作用[J].中国中药杂志,1999,24( 6) : 363-4.
[8]Shi J Z,Chen X F,Wan L.Hepatoprotective effect of several constituents of lonicera fulvotomentosa Hsu et S.C.Cheng,and L.macranthoide Hand.-Mazz.on CCl4and D-Galactosamine induced liver injuries in nice and rats[J].China J Chin Materia Med,1999,24( 6) : 363-4.
[9]郭菁菁,杨秀芬.黄酮类化合物对动物实验性肝损伤保护作用的研究进展[J].中国药理学通报,2008,24( 1) : 5-10.
[9]Guo J J,Yang X F.Research progress of the protective effece of flavanoids on experimental liver injury of animals[J].Chin Pharmacol Bull,2008,24( 1) : 5-10..
[10]茅青,曹东,贾宪生.灰毡毛忍冬化学成分的研究[J].药学学报,1993,28( 4) : 273-81.
[10]Mao Q,Cao D,Jiao X S.Studies on the chemical constituents of lonicera macranthoides Hand.-Mazz[J].Acta Pharm Sin,1993,28( 4) : 273-81.
[11]Carelli M,Biazzi E,Panara F,et al.Medicago truncatula CYP716A12 is a multifunctional oxidase involved in the biosynthe-sis of hemolytic saponins[J].Plant Cell Online,2011,23( 8) : 3070-81.
[12]王玉英,常思勤,李元庆,吴庆先.灰毡毛忍冬的质量研究(Ⅲ)—不同的产地加工方法对毒性及溶血性的影响[J].中药材,1984,7( 2) : 17-8.
[12]Wang Y Y,Chang S Q,Li Y Q,Wu Q X.Quality analysis of L.macranthoides Hand.-Mazz(Ⅲ)—The effect for toxicity and hemolysis by different origin processing methods[J].J Chin Med Mater,1984,7( 2) : 17-8.
[13]GPT4-1.《中药、天然药物刺激性和溶血性研究的技术指导原则》课题研究组.中药、天然药物局部刺激性和溶血性研究技术指导原则[S].2005: 22-5.
[13]GPT4-1.Technical guidelines for stimulating and hemolysis studies of traditional Chinese medicine,natural drugs[S].2005: 22-5.
[14]柯正方.中药注射剂溶血检查的两种方法比较[J].中国药品标准,2011,12( 3) : 216-9.
[14]Ke Z F.The comparison of two hemolysis test methods of Traditional Chinese Medicine injections[J].Drug Stand China,2011,12( 3) : 216-9.
[15]王琴,杨洋,马强,等.葛根素注射液致体内外溶血反应及其机制研究[J].中华中医药杂志,2011,26( 5) : 1114-8.
[15]Wang Q,Yang Y,Ma Q,et al.Study on mechanism of hemolysis induced by puerarin injection[J].China J Tradit Chin Med Pharm,2011,26( 5) : 1114-8.
[16]徐叔云,卞如濂,陈修.药理试验方法学[M].第3版.北京:人民卫生出版社,2002: 1247-50,1873-80.
[16]Xu S Y,Bian R L,Chen X.The methodology of pharmacological experiment[M].3th ed.Beijing: People’s Medical Publishing House,2002: 1247-50,1873-80.
[17]吴立军.天然药物化学[M].第4版.北京:人民卫生出版社,2006: 293.
[17]Wu L J.Natural Pharmaceutical Chemistry[M].4th ed.Beijing: People’s Medical Publishing House,2006: 293.
[18]Bangham A,Horne R,Glauert A,et al.Action of saponin on biological cell membranes[J].Nature,1963,196( 4858) : 952-5.
[19]Haruna M,Tanaka M,Sugimoto T,et al.Alteration of Na+permeability in human erythrocytes as studied by 23 Na-NMR and inhibition of the kidney Na+,K+-ATPase activities with saponins: interaction of Gleditsia saponins with human erythrocyte membranes [J].Bioorg Med Chem Lett,1995,5( 8) : 827-30.
[20]Wang Y B,Zhang Y C,Zhu Z Y,et al.Exploration of the correlation between the structure,hemolytic activity,and cytotoxicity of steroid saponins[J].Bioorg Med Chem,2007,15( 7) : 2528-32.
[21]沈放,杨黎江,彭永芳,等.重楼皂苷类化合物溶血作用研究[J].时珍国医国药,2010,21( 9) : 2280-1.
[21]Shen F,Yang L J,Peng Y F,et al.Hemolysis studies of Polyphyllin compound[J].Lishizhen Med Mater Med Res,2010,21 ( 9) : 2280-1.
On hemolysis of extracts of Lonicera Macranthoides flower bud and two saponins
WANG Hong-jin,WANG Hong-yu,HE Ran,WU Jun-jie,XU Xiao-yu
( College of Pharmaceutical Sciences,Southwest University,Chongqing Engineering Research Center for Pharmacodynamics Evaluation,Chongqing 400715,China)
Abstract:AimTo figure out whether Lonicera macranthoides could induce hemolysis.Methods In vitro,macroscopic observation and spectrophotometry were used to observe whether the solutions of extracts from Lonicera macranthoides,MacranthoidinB and DipsacosideB could induce hemolysis in 2% red cell suspension of New Zealand white rabbits.And the three tested materials were prepared in concentration gradient of 5,10,20,30,40,50,60,70,80,90,100 mg· L-1; and in vivo,mice were respectively treated with MacranthoidinB ( 0. 110 g·kg-1,0. 055 g·kg-1),DipsacosideB( 0. 020 g·kg-1,0. 010 g·kg-1),extracts ( 2. 275 g·kg-1,1. 137 g·kg-1,crude drugs) once per day for 7 days,and all of the tested doses depended on the clinical doses.Then,RBC,RET and MCHC before and after administration were tested.ResultsThe hemolytic ratio in each treated group was below 5% in vitro.And in vivo,the three materials did not induce hemolysis and had no significant influence on RBC,RET and MCHC( P>0. 05).Conclusions Extracts from flower bud of Lonicera macranthoides,MacranthoidinB and DipsacosideB,have not caused hemolysis in vivo and in vitro in this research.
Key words:flower bud of Lonicera macranthoides; MacranthoidinB; DipsacosideB; hemolysis; visual inspection; spectrophotometry test
作者简介:汪宏锦( 1994-),男,研究方向:中药药理与新药开发,E-mail: sudazxwhj@ live.com;
基金项目:重庆市应用开发计划项目( No cstc2014yykkfA80023) ;重庆市121科技示范工程( No cstc2014fazktjcsf80038) ;秀山金银花产业开发项目。
收稿日期:2015-09-14,修回日期: 2015-11-29
文献标志码:A
文章编号:1001-1978( 2016) 01-0043-06
doi:10.3969/j.issn.1001-1978.2016.01.010