阿瑞匹坦预防胃癌术后化疗恶心呕吐反应68例临床观察
2016-03-17钱志英
石 林, 钱志英, 徐 霞, 周 斌, 袁 渊, 沈 波
论 著
阿瑞匹坦预防胃癌术后化疗恶心呕吐反应68例临床观察
石 林, 钱志英, 徐 霞, 周 斌, 袁 渊, 沈 波
目的 探讨阿瑞匹坦预防胃癌术后患者行含奥沙利铂化疗方案所致的恶心呕吐的临床疗效及不良反应。方法 选取2014年4月至2016年6月江苏省肿瘤医院收治的接受含奥沙利铂方案化疗2周期的胃癌术后患者68例为研究对象。化疗第一周期使用帕洛诺司琼+地塞米松二联方案预防呕吐,第二周期使用阿瑞匹坦+帕洛诺司琼+地塞米松三联方案预防呕吐。记录患者化疗开始后7天的恶心呕吐情况;使用视觉模拟评分法(VAS)进行生活质量评估。结果 化疗第一周期后有67.6%患者呕吐达到完全缓解,化疗第二周期后有85.3%的患者呕吐达到完全缓解(P<0.01)。在延迟性呕吐预防效果的比较中,二联方案呕吐控制率为70.6%,加入阿瑞匹坦后提高到92.6%(P<0.01)。第二周期化疗后VAS评分(92.3)明显高于第一周期化疗后的89.2(P<0.01)。结论 胃癌术后患者使用阿瑞匹坦+帕洛诺司琼+地塞米松预防含奥沙利铂化疗方案化疗所致恶心呕吐的疗效良好,能提高患者的生存质量。
阿瑞匹坦; 奥沙利铂; 胃癌; 术后化疗; 呕吐; 化疗反应
化疗诱导的恶心呕吐(chemotherapy-induced nausea and vomiting,CINV) 是化疗最常见的不良反应之一,可导致脱水、电解质失衡和营养不良,并对患者的心理和社会功能造成明显损害,严重影响患者的生活质量和治疗依从性[1-2]。由于胃部分或全部切除,使得胃癌术后患者对化疗的耐受性大大下降,更容易出现CINV,成为术后辅助化疗无法完成的重要原因,并影响患者的预后[3]。含奥沙利铂的方案是胃癌术后化疗的推荐方案[4],为中度致吐性方案[5],使用含5-羟色胺3(5-hydroxytryptamine, 5-HT3) 受体拮抗剂联合糖皮质激素的二联方案可预防呕吐,但仍有部分患者的CINV难以控制[6]。阿瑞匹坦是神经激肽1( Neurokinin-1,NK-1)受体拮抗剂,可以阻断NK-1的作用,通过中枢机制抑制CINV。阿瑞匹坦、5-HT3 受体拮抗剂和糖皮质激素的三联疗法被推荐用于接受高致吐性或有选择性的中度致吐性方案化疗的患者[5]。本研究通过观察在原有的帕洛诺司琼联合地塞米松的基础上加用阿瑞匹坦预防胃癌术后化疗CINV,评价阿瑞匹坦的疗效及不良反应。
1 资料与方法
1.1 研究对象 2014年4月至2016年6月我院收治的有组织病理学明确诊断的胃癌术后患者。纳入标准:年龄>18岁;术后>3周;化疗方案为含奥沙利铂的中度致吐性方案,包括奥沙利铂联合替吉奥(SOX)、奥沙利铂联合卡培他滨(XELOX)、奥沙利铂联合多西他赛(DP)、奥沙利铂联合紫杉醇(TP)。其中:奥沙利铂135 mg/m2,卡培他滨1 250 mg/m2,每日2次,连用2周,休息1周;替吉奥80 mg/m2/d,每日2次,连用2周,休息1周;多西他赛75 mg/m2,每3周1次;紫杉醇175 mg/m2,每3周1次,分周剂量使用。美国东部肿瘤协作组(ECOG)体力状态评分≤2分。排除:既往接受过化疗;同步放疗;化疗前1周内发生过恶心呕吐;其他任何原因引起的顽固性呕吐者;术后出现胃肠梗阻;伴中枢神经系统转移;血糖控制不佳的糖尿病患者。
1.2 方法 所有患者先后接受同方案化疗二周期,第一周期使用5-HT3 受体拮抗剂(帕洛诺司琼)+地塞米松预防呕吐,第二周期使用阿瑞匹坦+帕洛诺司琼+地塞米松预防呕吐。阿瑞匹坦的用法用量:化疗前1 h口服125 mg,化疗第2、3天早晨口服80 mg;帕诺洛司琼:0.25 mg静脉推注,第1天化疗前30 min;地塞米松:第1天化疗前30 min口服12 mg,第2~3天口服8 mg。记录患者化疗开始后7天的恶心呕吐情况;使用视觉模拟评分法(visual analog scale,VAS)(0~100 mm)进行生活质量评估。
1.3 疗效判断 主要观察指标:两周期化疗后呕吐的完全缓解率(CR)以及急性呕吐(化疗开始后0~24 h)和迟发性呕吐(化疗开始后24~120 h)的完全缓解率。完全缓解定义为无呕吐发生且未予挽救性止吐治疗。次要观察目标:生活质量评分及不良反应。生活质量评分由视觉模拟评估后,测量划线的长度,取相应数字为得分;患者的不良反应参照国家癌症研究所制定的常见不良事件评价标准(CTCAE)4.0进行评估。
1.4 统计学分析 采用SPSS 19.0统计软件进行统计学分析。计量资料组间比较采用独立样本t检验或方差分析,计数资料组间比较采用卡方检验。以P<0.05为差异有统计学意义。
2 结果
2.1 病例一般资料 共收集到68例胃癌术后首次化疗患者,其中男45例,女23例,年龄31~71岁,中位年龄59岁。手术方式:全胃切除32例(47.1%),远端胃切除29例(42.6%),近端胃切除7例(10.3%)。临床分期:Ⅱa期、Ⅱb期、Ⅲa期、Ⅲb期及Ⅲc期患者数分别为5(7.4%)、15(22.1%)、20(29.5%)、23(33.8%)及5(7.4%)例。术后病理:86.8%(59例)为腺癌,9例为印戒细胞癌(13.2%)。化疗方案:SOX 31例(45.6%),XELOX 23例(33.8%),DP/TP 14例(20.6%)。
2.2 止吐效果 所有患者皆完成了两周期化疗。第一周期有46例(67.6%)达到完全缓解,第二周期有58例(85.3%)达到完全缓解,完全缓解率比第一周期提高了17.7%(P<0.01,表1)。在两组延迟性呕吐预防效果的比较中,接受二联预防呕吐的患者完全控制率为70.6%,在加入阿瑞匹坦后提高到92.6%(P<0.01,表1)。急性期呕吐的控制率两组分别为85.3%及91.2%(P=0.219,表1)。
2.3 生活质量评分 第一周期化疗结束后VAS评分为89.2(88.1~90.3),第二周期化疗结束后VAS评分为92.3(90.9~93.6),两周期化疗后的VAS评分比较差异具有统计学意义(P<0.01)。
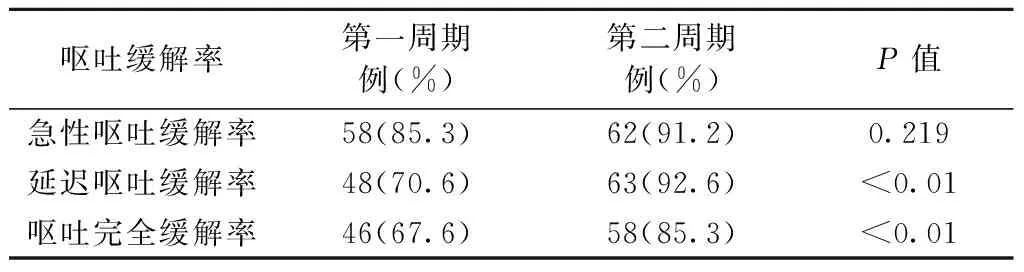
表1 68例化疗两周期间预防性呕吐治疗疗效的比较(n=68)
2.4 影响预防呕吐效果的危险因素 选择患者的年龄、性别、肿瘤分期、手术方式及化疗方案等基本临床特征与患者呕吐控制情况进行分层分析发现,年龄及手术方式为全胃或近端胃切除术是呕吐发生的高危因素(P=0.014,P=0.037,P=0.043),而性别、肿瘤分期及化疗方案不是呕吐发生的高危因素(P=0.058;P=1.377;P=0.479)。
2.5 两组不良反应的比较 两周期化疗后都能观察到预防呕吐后出现的临床常见不良反应,如乏力、便秘、头痛及食欲下降,其中第二周期较第一周期不良反应发生率有增加的是乏力,从21例增加到32例,但差异无统计学意义(P>0.05)。其他的不良反应发生率前后基本一致,且未观察到与阿瑞匹坦相关的特殊的不良反应。
3 讨论
化疗导致的恶心和呕吐是癌症化疗患者所面临的重要问题,胃癌患者由于手术切除了部分或全部胃组织,化疗耐受性更差,CINV更为常见。控制不佳的CINV常导致化疗方案被迫调整,治疗计划无法完成,甚至中断治疗[3]。因此,预防CINV成为胃癌术后化疗的重要课题。
既往的临床研究中指出,在没有使用阿瑞匹坦的情况下,随着化疗周期数的增加,患者出现恶心呕吐的几率也随之升高。虽然这种现象的机制不明,但提出可能与呕吐通道激活相关。因此主张随着化疗的重复,预防恶心呕吐的强度应相应加强[7]。在本研究中,第一周期化疗前接受二联止吐治疗后,有67.6%的患者未出现恶心呕吐,而在第二周期化疗前加入阿瑞匹坦后呕吐CR率升至 85.3%,间接反映出阿瑞匹坦的预防呕吐效能。研究发现,在既往化疗中出现恶心呕吐的患者,在后续的化疗中更容易出现恶心呕吐,并且更难以控制。因此而提出,患者在化疗的开始接受足够强度的预防呕吐治疗相比出现恶心呕吐后再使用解救治疗显得更为明智[8]。Iihara等[9]报道阿瑞匹坦可降低接受中度致吐性方案化疗的患者的呕吐发生,并可作为发生CINV患者解救方案或后续化疗的强化预防呕吐方案。本研究结果也显示出相同的结果。此外,在延迟性呕吐缓解率方面,加用阿瑞匹坦后疗效更好(P<0.01),但在急性呕吐的预防效果上,虽然第二周期完全缓解率比第一周期提高了5.9%,但差异无统计学意义(P=0.219)。合理的解释是帕洛诺司琼联合地塞米松对于急性呕吐的预防能力已经足够强大,即使加入阿瑞匹坦,提升空间也非常有限[10]。
在患者生活质量方面,本研究通过VAS法计算得到第二周期化疗后患者生活质量评分高于第一周期化疗后(P<0.01)。这是因为阿瑞匹坦加入后,CINV发生率下降,患者化疗的耐受性和依从性增加,生活质量提高,从而保证了化疗的顺利进行。
另外,本研究将患者的年龄、性别、肿瘤分期、手术方式以及化疗方案与CINV的发生进行分层分析发现,年龄及手术方式可能是接受含奥沙利铂方案化疗的胃癌术后患者发生CINV的高危因素。目前的共识认为年轻的女性患者更容易出现CINV[11],但本研究结果显示性别不是发生CINV的高危因素(P=0.058),这可能与纳入观察的病例数不足有关。本研究显示近端胃切除和全胃切除的患者CINV发生的可能性更高(P=0.047),而接受远端胃切除术的患者未达到统计学差异(P=0.674)。这是因为全胃切除或近端胃切除的患者,胃的生理结构及周围解剖位置发生改变,不但丧失了储食功能,而且缺乏自我调节的机制,耐受性下降,容易出现消化道反应。特别是近端胃切除的患者,贲门缺失、食管反流,发生恶心和呕吐更为常见[3]。因此,对胃癌术后的年轻患者,特别是接受了近端胃切除术或全胃切除术的患者,应在化疗的开始接受足够强度的预防呕吐治疗,但仍可能出现难以控制的CINV。
在本研究中,患者两周期化疗后的便秘、头痛、食欲下降的发生情况基本一致,虽然患者在加用阿瑞匹坦后发生乏力的情况有所增加,但这可能与患者已经经历了一周期的化疗而出现体力下降有关。Ruhlmann等[12]研究结果显示阿瑞匹坦具有良好的安全性。本研究中也未观察到与阿瑞匹坦相关的特殊不良反应。阿瑞匹坦的不足之处在于其为口服制剂,胃癌术后患者的口服给药依从性稍差。
总而言之,阿瑞匹坦、帕诺洛司琼和地塞米松三药联合方案预防化疗性恶心呕吐的效果特别是延迟性呕吐方面优于帕洛诺司琼联合地塞米松的两药联合方案。鉴于本研究样本量小,还需要更大样本多中心的临床实验加以验证。
[1] SCHNELL F M. Chemotherapy-induced nausea and vomiting: the importance of acute antiemetic control[J].Oncologist,2003,8(2):187-198.
[2] LOHR L. Chemotherapy-induced nausea and vomitin[J].Cancer J, 2008,14(2):85-93.
[3] 欧阳洋,欧阳植庭,夏绪东.胃癌手术患者预后的多因素分析[J].中国普通外科杂志,2010,19(10):1061-1064.
[4] CUNINGHA D,STARLING N,RAO S,et al.Capecitabine and oxaliplatin for advanced esophagogastric cancer[J].N Engl J Med,2008,358(1):36-46.
[5] BASCH E, PRESTRUD A A, HESKETH P J, et al. Antiemetics: American Society of Clinical Oncology clinical practice guideline update[J].J Clin Oncol,2011,29(31):4189-4198.
[6] JIN Y,SUN W,GU D,et al.Comparative efficacy and safety of palonosetron with the first 5-HT3 receptor antagonists for the chemotherapy-induced nausea and vomiting: a meta-analysis[J]. Eur J Cancer Care, 2013,22(1):41-50.
[7] SOUKOP M, MCQUADE B, HUNTER E, et al. Ondansetron compared with metoclopramide in the control of emesis and quality of life during repeated chemotherapy for breast cancer[J].Oncology,1992,49(4):295-304.
[8] SIGSGAARD T, HERRSTEDT J, ANDERSEN L J, et al. Granisetron compared with prednisolone plus metopimazine as anti-emetic prophylaxis during multiple cycles of moderately emetogenic chemotherapy[J]. Br J Cancer,1999,80(3-4):412-418.
[9] IIHARA H, ISHIHARA M, FUJII H, et al. Comparison of the control of nausea and vomiting among several moderately emetic-risk chemotherapy regimens[J].J Cancer,2016, 7(5):569-575.
[10] MURAKAMI M, HASHIMOTO H, YAMAGUCHI K, et al. Effectiveness of palonosetron for preventing delayed chemotherapy-induced nausea and vomiting following moderately emetogenic chemotherapy in patients with gastroin-testinal cancer[J].Support Care Cancer,2014,22(4):905-909.
[11] TANIOKA M, KITAO A, MATSUMOTO K, et al. A randomised, placebo-controlled, double-blind study of aprepitant in nondrinking women younger than 70 years receiving moderately emetogenic chemotherapy[J]. Br J Cancer,2013,109(4):859-865.
[12] RUHLMANN C H, HERRSTEDT J. Safety evaluation of aprepitant for the prevention of chemotherapy-induced nausea and vomiting[J]. Expert Opin Drug Saf, 2011, 10(3): 449-462.
Objective To observe the clinical efficacy and adverse reactions of aprepitant in the prevention of nausea and vomiting induced by oxplatin-based adjuvant chemotherapy in gastric cancer patients.Methods 68 surgical gastric cancer patients who received oxplatin-based chemotherapy in Jiangsu Cancer Hospital from April,2014 to June,2016,were treated with doublet antiemetic therapy with dexamethasone and a 5-HT3 receptor antagonist during the first cycle of chemotherapy. Aprepitant was then added during the second cycle of chemotherapy. The primary endpoint was overall complete response rate, defined as no vomiting and no rescue therapy during the 7 day after administration of chemotherapy. The functional living index-emesis was adopted to assess patients’ quality of life with VAS.Results The overall complete response rate was significantly improved in the second cycle (85.3 %)compared with the first cycle (67.6%,P<0.01). Improvement was also observed in the delayed phase 92.6% VS 70.6% , but not in the acute phase. The FLIE score of aprepitant group and control group were 92.3% and 89.2 (P<0.01) respectively.Conclusion Subsequent addition of aprepitant significantly improved the overall complete response rate in gastic patients receiving a second cycle of oxplatin-based adjuvant chemotherapy.
Aprepitant; Oxplatin; Gastric cancer; Chemotherapy; Nausea and vomiting; Chemotherapy adverse reation
吴阶平基金(320.6750.13231)
210009 江苏 南京, 南京医科大学附属江苏省肿瘤医院 肿瘤内科
石 林,男,硕士研究生,主治医师,从事肿瘤内科临床研究,E-mail:13913897957@163.com
沈 波,男,博士,主任医师,专攻消化道肿瘤及肺癌临床研究,E-mail:13913910555@126.com
10.3969/j.issn.1674-4136.2016.06.011
1674-4136(2016)06-0388-04
2016-09-12][本文编辑:李筱蕾]
Antiemetic effect of aprepitant for chemotherapy-induced nausea and vomiting in 68 adjuvant chemotherapy gastric cancer patientsSHILin,QIANZhiying,XUXia,ZHOUBin,YUANYuan,SHENBo.(DepartmentofMedicalOncology,JiangsuCancerHospital,Nanjing210009,China)
Correspongdingauthor:SHENBo,E-mail:13913910555@126.com
