奥曲肽对人结肠癌细胞抑制及凋亡的影响
2016-03-17龙建武徐志广
龙建武, 王 松, 徐志广
论 著
奥曲肽对人结肠癌细胞抑制及凋亡的影响
龙建武, 王 松, 徐志广
目的 观察奥曲肽抑制人结肠癌SW620细胞增殖并诱导其凋亡的作用。方法 奥曲肽作用于体外培养的SW620细胞后,通过MTT比色法测定细胞增殖抑制作用;采用AO/EB染色荧光显微镜观察奥曲肽诱导SW620细胞凋亡后的形态学改变;应用流式细胞术(FCM)分析细胞凋亡率。结果 奥曲肽作用SW620细胞后,MTT检测显示细胞增殖活性受到明显抑制,且呈一定浓度依赖性;AO/EB染色可见典型凋亡小体,PI染色流式法显示细胞凋亡率明显上升。结论 奥曲肽具有抑制体外培养人结肠癌SW620细胞增殖,并有效诱导其凋亡作用。
奥曲肽; 结肠癌; 细胞增殖; 细胞凋亡
目前,生物治疗正日益受到重视。探索新型、低毒、高效抗肿瘤药物正成为当今肿瘤治疗研究领域的新热点。已有相关研究发现生长抑素及类似物对消化系实体肿瘤具有较好的抑制作用[1-2]。奥曲肽作为经典的生长抑素类似物已广泛应用于临床。本研究通过观察奥曲肽对体外人结肠癌SW620细胞增殖和凋亡的影响,为未来奥曲肽抗肿瘤应用提供实验依据。
1 材料与方法
1.1 药物与试剂 奥曲肽注射液(OCT,1 ml:0.1 mg/支,C49H66N10O10S2)购自诺华制药公司;5-氟尿嘧啶(5-FU,10 ml:0.25 mg/支,C4H3FN2O2)购自上海旭东海普药业公司;细胞培养基及胰酶购自美国Gibco公司;新生小牛血清由杭州四季青生物公司提供;MTT粉购自美国Sigma公司;AO、EB染液均为美国Sigma公司产品。
1.2 细胞与细胞培养 人结肠癌SW620细胞购自上海中科院,用含10%胎牛血清的细胞培养液在5%CO2、饱合湿度及37℃条件下培养箱中培养,1~2天传代1次。
1.3 MTT比色法测定细胞增殖与抑制率 收集对数生长期细胞以细胞密度5 000个/孔接种在96孔培养板内培育4 h,贴壁后加入20 μl的DDP及不同浓度奥曲肽,使其终浓度分别为10-12mol/L(M)、10-10M、10-8M、10-6M,加入等体积PBS做阴性对照,阳性对照组加入10-6M 5-FU。各组设3个复孔,分别培育24、48和72 h,各孔加5 mg/ml MTT液20 μl孵育5 h后吸去培养基,接着加100 μl DMSO震荡12 min后,酶联免疫检测仪在570 nm波长处测定各孔的吸光度A值,计算细胞增殖抑制率IR:IR%=(1-实验组A值/空白组A值)×100%。以上实验均重复3次。
1.4 AO/EB染色后荧光显微镜观察细胞凋亡后形态学改变 收集细胞3 000个/孔接种于6孔培养板内孵育约4 h,贴壁后加药处理,使奥曲肽终浓度分别为10-10M、10-8M、10-6M,并加入同体积PBS作对照,再放回培养箱中继续孵育48 h后加入2 μl AO储存液混匀后继续培育5 min,荧光显微镜下观察AO染色内皮细胞形态改变并拍照。PBS洗涤后再加入2 μl EB储存液混匀孵育5 min,再次观察原AO染色视野细胞区域的细胞形态并拍照。由3~5人从200个细胞中计数凋亡的细胞个数,凋亡指数=(早期+晚期凋亡细胞)/200×100%。每组设3个复孔,实验均重复3次。
1.5 流式细胞仪分析细胞凋亡 收集对数生长期细胞以细胞密度5×105个/孔接种6孔培养板中,细胞周期同步化处理后,加药处理使奥曲肽终浓度分别为10-10M、10-8M、10-6M,并加同体积PBS作对照,培育48 h后收集细胞于EP管1 000 r/min中离心5 min,去上清液并PBS洗涤3次,75%乙醇4 ℃固定24 h。上机检测前PPS再洗涤2次去固定,核糖核酸酶液5 μl消化RNA后经碘化丙啶染液避光染色30 min,目尼龙网过滤后上机检测细胞凋亡变化。
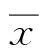
2 结果
2.1 MTT比色检测奥曲肽对SW620细胞增殖活性的抑制作用 结果显示,10-12M、10-10M、10-8M、10-6M奥曲肽处理SW620细胞24 h后,其抑制率分别为3.85%、10.81%、18.29%、20.03%;处理48 h后分别为6.34%、18.65%、34.38%、38.97%;处理72 h后分别为7.78%、20.86%、38.30%、41.42%。
各浓度组A值经方差分析,与空白组相比,除10-12M组外,其余3组差异均有统计学意义(P<0.05);各组间两两比较显示,10-6M与10-8M组间差异无统计学意义(P>0.05),其他各组间比较均有统计学意义(P<0.05)。各时段组A值经方差分析显示,24 h和48 h组间比较差异具有统计学意义(P<0.05),48 h和72 h组间比较差异无统计学意义(P>0.05)。不同浓度奥曲肽处理SW620细胞不同时段后,增殖活性抑制作用结果见表1。

表1 MTT检测各组SW620细胞的增殖抑制率
注:与空白组比较:(1)代表P<0.05,(2)代表P>0.05;10-6M与10-8M 相比:(3)代表P>0.05;48 h与72 h相比:(4)代表P>0.05;5-FU与各组比较:(5)代表P<0.05。
2.2 AO/EB染色荧光显微镜观察奥曲肽对SW620细胞凋亡的形态学影响 镜下可见到4 种形态迥异的细胞。正常活细胞:胞核染色后呈浅绿色的正常圆形结构;凋亡早期细胞:胞核染色后呈绿色的皱缩状或碎片状;凋亡晚期细胞:胞核染色后呈橙红色或橘红色的固缩团块状或圆珠状;非凋亡的正常死亡细胞:胞核染色后呈橙红或橘红色的圆形团块状结构。荧光显微镜下空白组及10-10M,10-8M和10-6M组的细胞形态见图1(彩图见本刊电子版)。凋亡指数分别为0.2%±0.8%,21.8%±6.4%,34.9%±9.6%,41.5%±10.8%。随药物浓度升高,凋亡率有增加趋势。经统计,各浓度奥曲肽组与空白对照组比较,差异均有统计学意义(均P<0.05),表明10-10M,10-8M,10-6M的奥曲肽均能诱导SW620细胞凋亡。

图1 不同浓度奥曲肽对SW620细胞凋亡的影响(彩图见本刊电子版)
2.3 PI染色流式细胞仪分析SW620细胞凋亡 为进一步研究奥曲肽对SW620细胞凋亡诱导情况,我们通过流式细胞术对细胞凋亡进行了分析检测。结果显示:10-10M,10-8M和10-6M作用于SW620细胞48 h后,其细胞凋亡率分别是:20.9%±0.5%,33.6%±0.6%和56.7%±0.7%;与0.8%的空白组相比,差异有统计学意义(P<0.05)(图2),表明奥曲肽可诱导SW620细胞凋亡,并呈浓度依赖性。
3 讨论
结肠癌是我国常见恶性肿瘤。以往治疗以手术切除为主,近年来随着辅助化疗的广泛应用,化疗在结肠癌的治疗中起着重要作用,但是,化疗药物的耐药问题及毒副作用也日益凸现。因此,迫切需要开发新型、高效、毒副作用小的抗肿瘤药物。
药物抑制细胞增殖活性并诱导其凋亡是除手术外的最重要治疗手段。基础研究已显示生长抑素及其类似物对消化道实体肿瘤如肝癌[3]、胃癌[4]、大肠癌[5-6]、胆道癌[7-8]、胰腺癌[9]等均具有抑制作用,故而成为近年来的研究热点。奥曲肽是人工合成并早已应用于临床的八肽生长抑素类似物,最近已有关于奥曲肽在肿瘤靶向治疗方面研究的报道[10]。
我们前期研究中,以MTT法检测发现奥曲肽在10-10M以上能抑制人结肠癌细胞SW480的增殖,且在一定浓度范围(10-10M~10-8M)呈现浓度依赖性,在10-8M时对SW480细胞的增殖抑制作用最强(约35%)[11]。本次研究首先通过MTT法分别从量效和时效两方面检测奥曲肽对SW620细胞增殖的影响,结果显示,奥曲肽能显著抑制体外培养的SW620细胞增殖,且在10-12M~10-8M浓度范围内增殖抑制作用呈浓度依赖性,但当浓度超过10-8M后,抑制作用并没有随浓度增高而增强;同时,结果还显示其抑制作用在48 h内呈时间依赖性,但超过48 h后,其增殖抑制作用并没有随作用时间延长而增强。这可能与奥曲肽和SW620细胞膜上特异的生长抑素受体结合方式、作用持续时间及受体饱和特性等因素有关[12]。
接着本试验又分别通过两种不同的检测方法评估奥曲肽诱导人结肠癌SW620细胞凋亡的作用及强度。荧光显微镜下AO可穿透完整胞膜的细胞后嵌入该细胞核的DNA内并发出绿色荧光,而EB则只能穿透胞膜受损的细胞,且嵌入该细胞核的DNA后呈现橙红色荧光。此外,凋亡细胞的胞核明显固缩,呈团块状或碎片状,染色明显增强,荧光也更明亮;而非凋亡细胞的胞核无皱缩,呈圆形,荧光深浅也不一样。由此应用AO/EB染色法荧光显微镜观察奥曲肽处理SW620细胞48 h后,荧光显微镜下见较多核染色质着绿色呈皱缩状或碎片状的早期凋亡细胞(VA)和核染色质着橙红色或橘红色并呈固缩团块状或圆珠状晚期凋亡细胞(NVA),而空白对照组细胞荧光显微镜下见胞质和核呈绿色,核形态正常,未见凋亡细胞。随后又采用流式细胞技术进一步证实奥曲肽具有诱导SW620细胞凋亡的作用。
所谓凋亡,即指于特定时空发生、严格受机体调控的细胞“自杀”行为,和细胞分化受阻及恶性增殖一样,不仅维持机体的稳定性,而且在肿瘤发生、发展、侵袭转移及治疗中发挥极其重要的作用,凋亡调控异常与大多数的恶性肿瘤发生有着紧密联系。已证实肿瘤的发生与正常细胞凋亡失控及细胞凋亡与增殖失衡有密切相关。细胞凋亡调控主要由相关的凋亡基因及其编码的蛋白产物决定,比如caspase3、bcl-2家族[13]等基因。有报道GSK-3β与消化道肿瘤细胞的凋亡作用非常密切[14]。本课题奥曲肽诱导SW620细胞凋亡可能与GSK-3β级联反应激活这些凋亡相关基因有关。
细胞凋亡与肿瘤发生及侵袭转移密切相关[15],因此,临床研究许多可诱导肿瘤细胞凋亡的化疗药物,但肿瘤细胞对化疗药物的敏感及耐药性同样受到凋亡机制的制约。凋亡诱导可能是不同化疗药物发挥抗肿瘤作用的共同作用机理之一。因此,药物抑制及凋亡诱导是未来化疗药物治疗恶性肿瘤的主要作用方式之一。尽管本研究显示奥曲肽诱导结肠癌SW620细胞凋亡指数不高,但可以为开发人结肠癌治疗新型候选药物提供实验和理论依据。
[1] MAHIPAL A, SHIBATA D, SIEGEL E, et al. Phase I trial of combination of FOLFIRI and pasireotide, a somatostatin analogue, in advanced gastrointestinal malignancies[J]. Invest New Drugs, 2015,33(5):1093-1099.
[2] CHEN J S, LIANG Q M, LI H S, et al. Octreotide inhibits growth of colonic cancer SW480 cells by modulating the Wnt/P-catenin pathway[J]. Pharmazie, 2009, 64(2):126-131.
[3] ABDEL-HAMID N M, MOHAFEZ O M, NAZMY M H, et al. The effect of co-administration of Lawsonia inermis extract and octreotide on experimental hepatocellular carcinoma[J]. Environ Health Prev Med, 2015, 20(3):195-203.
[4] SHI X, LI X, CHEN L ,et al. Analysis of somatostatin receptors and somatostatin promoter methylation in human gastric cancer[J]. Oncol Lett, 2013, 6(6):1794-1798.
[5] WANG S, BAO Z, LIANG Q M, et al. Octreotide stimulates somatostatin receptor-induced apoptosis of SW480 colon cancer cells by activation of glycogen synthase kinase-3β, A Wnt/β-catenin pathway modulator[J]. Hepatogastroenterology, 2013, 60(127):1639-1646.
[6] 龙建武, 梁庆模, 周筱筠, 等. 奥曲肽诱导人结肠癌细胞凋亡与细胞周期的影响及机制[J]. 中国普通外科杂志, 2015,24(4):532-537.
[7] 陈有挺, 周智, 石铮, 等. 奥曲肽对人胆管癌QBC939裸鼠种植瘤的抑制作用[J].中国普通外科杂志,2012,21(8):952-956.
[8] GUO R S, SHI P D, ZHOU J,et al. Somatostatin receptors 3, 4 and 5 play important roles in gallbladder cancer[J].Asian Pac J Cancer Prev, 2013,14(7):4071-4075.
[9] CRAWFORD H C.Somatostatin receptor subtype 2 as pancreatic tumorigenesis suppressor: identification of a new targetable signaling node[J]. Gastroenterology, 2015,148(7):1279-1281.
[10] ZHANG H Y, XU W Q,WANG Y W,et al. Tumor targeted delivery of octreotide-periplogenin conjugate: Synthesis, in vitro and in vivo evaluation[J]. Int J Pharm, 2016, 502(1-2):98-106.
[11] 肖忠盛,王松,梁庆模,等.奥曲肽对结肠癌SW480细胞Wnt通路β-catenin/TCF及下游靶基因表达的影响[J].中国肿瘤外科杂志,2013,5(6):366-370.
[12] SABET A, NAGARAJAH J, DOGAN A S,et al. Does PRRT with standard activities of 177Lu-octreotate really achieve relevant somatostatin receptor saturation in target tumor lesions insights from intra-therapeutic receptor imaging in patients with metastatic gastroenteropancreatic neuroendocrine tumors[J]. EJNMMI Res, 2013,3(1):82.
[13] LUANPITPONG S, CHANVORACHOTE P, STEHLIK C,et al.Regulation of apoptosis by Bcl-2 cysteine oxidation in human lung epithelial cells[J].Mol Biol Cell,2013,24(6): 858-869.
[14] 王艳丽, 高青, 谢霞. 糖原合酶激酶3-β对胃癌细胞生长的影响及其机制[J]. 肿瘤防治研究, 2009, 36(8):647-650.
[15] 欧阳高亮,李祺福,洪水根.细胞凋亡与肿瘤的发生发展和治疗[M]. 国外医学肿瘤学分册, 2000,27 (5): 266-268.
The influence of octreotide on inhibition and apoptosis in human colon cancer cells
LONGJianwu,WANGSong,XUZhiguang.
(DepartmentofGeneralSurgery,AffiliatedNanhuaHospital,UniversityofSouthChina,Hengyang420002,China)
LONGJianwu,E-mail:longjianwu0918@126.com
Objective To investigate the effects of octreotide on proliferation inhibition and apoptosis in human colon cancer cells.Methods Human colon cancer SW620 cells were exposed to octreotide, the proliferation inhibition in SW620 were measured by MTT colometric assay, the morphological change of apoptotic SW620 induced by octreotide were observed by Fluorescence microscope after Acridine orang/ ethidium bromide (AO/EB) staining, and the apoptosis rate of SW620 were analyzed by flow cytometry(FCM).Results In SW620 cells after conducting octreotide treatment, MTT assay showed a significantly inhibiting effect on proliferation in SW620 cells in a concentration-dependent manner, typical apoptotic bodies were obeserved by AO/EB staining fluorescence microscope, and the FCM indicated that the apoptosis rates were significantly increased. Conclusion Octreotide had a significant function in inhibiting proliferation and effectively inducing apoptosis in SW620 cells.
Octreotide; Colonic cancer; Proliferation; Apoptosis
湖南省衡阳市科技基金资助项目(2015KJ66)
421002 湖南 衡阳 南华大学附属南华医院 普外科
/通讯作者: 龙建武,男,主治医师,主要从事结直肠肿瘤的基础研究和临床工作,E-mail: longjianwu0918@126.com
10.3969/j.issn.1674-4136.2016.06.007
1674-4136(2016)06-0373-04
2016-06-11][本文编辑:李 庆]
