术前免疫性肠内营养在结直肠癌患者术后免疫及康复水平中的作用
2016-03-17赵东峰朱海涛马大伟
赵东峰, 朱海涛, 马大伟, 周 斌
论 著
术前免疫性肠内营养在结直肠癌患者术后免疫及康复水平中的作用
赵东峰, 朱海涛, 马大伟, 周 斌
目的 探讨术前早期免疫性肠内营养的应用在结直肠癌患者术后恢复中的价值。方法 将2013年7月至2015年12月江苏省肿瘤医院收治的60例结直肠癌患者随机分为3组,于术前7 d开始分别给予免疫性肠内营养(IMN)、标准肠内营养(SE)、肠外营养(TPN)治疗,观察不同组患者术后肿瘤组织中浸润性淋巴细胞(TILs)数目变化及患者恢复情况、营养状态。结果 3种营养模式下术后肿瘤标本组织中CD4+及CD8+的浸润数量均有不同程度的增加。相较于其他两组,IMN组肿瘤组织中浸润性CD8+增加的比率显著升高(P<0.05)。CD16+的浸润数量在TPN组中有不同程度的增加,但在SE及IMN组中的改变无统计学意义(P>0.05)。CD56+也以IMN组的增加最为显著。在预后方面,IMN组血清营养指标、术后并发症发生率及康复状况均优于其他两组。结论 术前早期免疫性肠内营养的应用可提升TILs的状态,促进结直肠癌患者术后恢复。
免疫性肠内营养; 结直肠癌; 肿瘤浸润性淋巴细胞; 免疫反应
结直肠癌的5年生存率徘徊在60%[1]左右,治疗模式仍为手术治疗为主,放化疗及靶向治疗相结合的综合治疗。T淋巴细胞作为细胞免疫的主要单位,被认为与肿瘤的预后相关[2-4]。而营养不良、免疫功能低下是导致结直肠癌患者手术后生活质量下降,预后不佳的重要因素。研究表明:肿瘤浸润性淋巴细胞(TILs)的水平与结直肠癌的预后相关[5-7]。本研究对结直肠癌患者术前应用免疫性肠内营养(immunonutrition,IMN),观察肿瘤组织中的TILs浸润水平、术后恢复情况、营养状况及免疫功能,探索术前免疫性肠内营养对结直肠癌患者术后早期康复及抗肿瘤的价值。
1 资料与方法
1.1 研究对象 2013年7月至2015年12月在江苏省肿瘤医院普外科初治,影像学及肠镜病理活检诊断为结直肠腺癌的患者,经营养风险筛查存在营养风险,但可耐受肿瘤根治性手术负荷。剔除临床发现有维生素或微量元素摄入缺陷;有糖尿病等代谢障碍病史;肝肾功能严重异常;存在心脑血管意外风险,不能耐受手术者;有免疫抑制药物服用者。本实验经江苏省肿瘤医院伦理委员会同意,与入组患者签订知情同意书。
1.2 实验分组 共入选符合条件患者60例,其中男性42例,女性18例;平均年龄(62.79±11.66)岁。采用随机区组设计分配表法,同时参照患者意愿、经济条件随机分配为3组,每组20例,分别为免疫性肠内营养(IMN)组、标准肠内营养(SE)组、肠外营养(TPN)组。不同营养模式下的年龄分布差异无统计学意义(P>0.05)。
1.3 营养配制 通过物理测量及生物实验室指标对所有患者进行营养评估。根据营养评估状况以Harris-Benedict方程式计算能量需求。所有营养疗法均包含相同的能量及含氮量,具体的营养组成见表1。
1.4 营养摄入方法 各组患者均于术前7 d开始按照上述营养配置给予营养支持治疗。能量密度均为4.184 kJ/kg。TPN组:1 440 ml全合一营养液(华瑞制药有限公司)经中心静脉置管输注,持续使用至术后7 d;IMN组:免疫增强型肠内营养剂(瑞能,TPF-T)口服,术后24 h经鼻肠管持续缓慢泵入至术后7 d;SE组:口服肠内营养剂(瑞素,TP),术后24 h经鼻肠管持续缓慢泵入至术后7 d。所有患者均在肠道恢复通气后改用经口饮食。
1.5 手术资料 所有患者于营养疗法7日后行肿瘤根治性切除术。手术方式包括开腹结直肠癌根治术,腹腔镜结直肠癌根治术。
1.6 TILs细胞表达检测 收集营养疗法前肠镜活检肿瘤组织及手术切除标本肿瘤组织,予孵化抗体后,显微镜下观察营养疗法前后各组肿瘤组织中CD4+,CD8+,CD16+,CD56+的表达水平。具体方法:以100%乙醇、二甲苯混合液孵化标本组织12 h,去石蜡化;以3%过氧化氢溶液抗组织内在氧化,高温微波炉处理,加速抗原复性;以1 mmol/L EDTA稀释液处理10 min,加速CD4+抗原复原,10 mmol/L柠檬酸缓冲液稀释液处理10 min,加速CD8+,CD16+,CD56+抗原活性恢复。室温冷却,蒸馏水、磷酸盐缓冲液洗涤,以封闭液封闭10 min;在温室、PBS条件下,孵育CD4+,CD16+一抗60 min,CD8+,CD56+一抗30 min,以达到抗原抗体充分结合;室温下孵育二抗-生物素抗体20 min,置于含链霉素的辣根过氧化物酶缓冲液10 min;PBS洗涤,充分暴露于3-氨基-9乙基咔唑稀释液15 min,PBS保存后用于显微镜下分析。
1.7 TILs细胞分析及预后指标对比分析 高倍镜下观察经染色后具有淋巴细胞形态的细胞并进行计数;分析营养疗法前后不同营养模式下肿瘤组织中CD4+,CD8+,CD16+,CD56+的表达差异。观察营养疗法前、术后第1天和术后第7天患者的血清白蛋白、前白蛋白及免疫蛋白IgG、IgA水平;对比不同营养模式下各组患者术后血清营养指标、免疫指标及住院天数的差异。
1.8 统计学方法 数据分析采用SPSS 16.0软件。术前与术后各项数据比较采用独立样本t检验;不同组别间数据分析采用卡方检验;P<0.05认为差异具有统计学意义。
2 结果
2.1 营养治疗前后患者肿瘤组织中TILs细胞浸润水平的对比 由表2可见,60例患者切除之肿瘤组织中CD4+,CD8+浸润水平均较营养疗法前有所提高,其中又以IMN组增加最为显著。且由于CD8+浸润水平的显著提高,CD4+/CD8+比值在各组中均有下降。CD16+细胞浸润水平营养疗法后在IMN,TPN组中均有增加,以IMN组增加明显,而SE组营养疗法前后CD16+细胞表达差异无统计学意义。CD56+细胞浸润水平在各种营养模式下均有增加,仍以IMN组的增加程度最为显著。
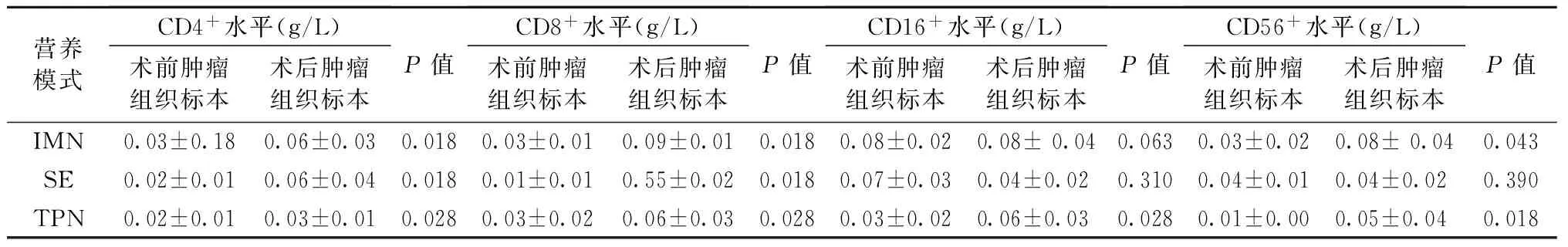
表2 不同营养治疗前后肿瘤组织中TILs细胞浸润水平的比较
2.2 不同营养模式下患者术后血清白蛋白、前白蛋白水平的对比 各组患者术后第1天血清白蛋白、前白蛋白与术前相比均有不同程度的降低,差异有统计学意义(P<0.05);组间对比提示术后第1天IMN组患者营养状况好于其他两组;术后第7天各组患者血清营养指标均表现为回升趋势(P<0.05),组间对比发现IMN组患者血清营养指标仍较其他两组有优势(表3)。

表3 不同营养模式下患者术后营养状态比较
注:(1)血清前白蛋白术后第1天IMN/SE,P=0.030;IMN/TPN,P=0.028;术后第7天IMN/SE,P=0.020;IMN/TPN,P=0.010。(2)血清白蛋白术后第1天IMN/SE,P=0.024,IMN/TPN,P=0.022;术后第7天IMN/SE,P=0.026;IMN/TPN;P=0.020。
2.3 不同营养模式下术后血清免疫水平对比 3组患者血清免疫球蛋白水平在术后第1天均有不同程度的下降,差异有统计学意义(P<0.05),组间对比显示IMN组患者免疫水平维持在较平稳状态。术后第7天各组免疫球蛋白水平均回升,组间对比表明IMN更有利患者术后免疫水平的提高(表4)。

表4 不同营养模式患者术后免疫水平比较
注:IgG水平组间分析IMN/SE为P=0.240,IMN/TPN为P=0.032;术后第7天IMN/SE为P=0.030,IMN/TPN为P=0.022。IgA水平组间分析,术后第1天IMN/SE为P=0.080,IMN/TPN为P=0.041;术后第7天IMN/SE为P=0.031,IMN/TPN为P=0.024。
3 讨论
研究表明在结直肠癌发生的早期,癌细胞发生免疫逃逸与免疫规避是导致肿瘤不可控生长及促进残余肿瘤细胞加速生长的重要原因[5]。因此,加强肿瘤免疫应答的治疗策略有望达到抑制肿瘤复发转移的目的。TILs的存在与结直肠癌患者的总生存率(OS)及无病生存率(DFS)相关[6-7]。Yoshida等[8]观察在结直肠癌组织中CD56+,NKT细胞的密度越高,淋巴结转移的几率越小,患者的生存期也越长。Li等[9]通过对比分析发现,在实验组胃肠肿瘤患者术前早期使用西咪替丁,患者肿瘤组织中的TILs水平明显高于对照组。鉴于TILs在结直肠癌预后方面的显著作用,有效的提高TILs的水平可能有助于结直肠癌的临床治疗[10-11]。
结直肠癌患者常合并营养不良,有30%~90%的结直肠癌患者存在蛋白质与热量的失衡,而能量的缺失进一步加剧了免疫功能的低下,因此营养治疗是结直肠癌患者临床治疗中的重要手段[12]。合理的营养疗法具有提高免疫监控的能力;精氨酸、ω-3脂肪酸、谷氨酸及核苷酸等免疫复合物的利用能够增加免疫功能[13-16]。左旋精氨酸具有刺激T淋巴细胞生长及增加生长激素分泌的功能;同时,左旋精氨酸亦作为巨噬细胞、多核形淋巴细胞、血管内皮细胞等细胞内一氧化氮(NO)合成的主要供氮源[17]。NO复合物可阻止肿瘤细胞从毛细管道侵入组织器官,且内源性NO的表达水平与肿瘤细胞的凋亡相关。另一种免疫营养组分ω-3脂肪酸是机体内抗炎因子如前列腺素、环前列腺素、白三烯的重要合成前体[2]。
本实验对60例结直肠癌患者术前7 d起分别实施不同营养模式治疗,对比营养支持治疗前活检标本与肿瘤切除组织中的TILs表达量发现,营养治疗后TILs表达量均有增加,且以添加了左旋精氨酸、ω-3脂肪酸的免疫性肠内营养组患者中增加最为显著(P<0.05)。且CD16+,CD56+的表达在免疫性肠内营养组中均高于其他两组。因此术前免疫性肠内营养的应用有利于CD4+, CD8+, CD16+,CD56+细胞的浸润,改善结直肠癌患者的预后。
术前肠内营养可促进肿瘤组织及外周血中TILs水平提高已达成共识[18-19],但目前对营养模式的选择仍未有统一的标准。我们认为,术前早期使用免疫性肠内营养治疗,可较好提升TILs的状态,促进结直肠癌患者术后恢复。但其对结直肠癌患者远期生存等的影响,有待于更长时间、更多病例的观察比较结果加以证实。
[1] MILLER K D, SIEGEL R L, LIN C C, et al. Cancer treatment and survivorship statistics, 2016[J]. CA Cancer J Clini, 2016, 66(4):271-289.
[2] KLEK S, SZYBINSKI P, SZCZEPANEK K. Perioperative immunonutrition in surgical cancer patients: a summary of a decade of research[J]. World J Surg, 2014, 38(4):803-812.
[3] MOYA P, SORIANO-IRIGARAY L, RAMIREZ J M, et al. Perioperative Standard Oral Nutrition Supplements Versus Immunonutrition in Patients Undergoing Colorectal Resection in an Enhanced Recovery (ERAS) Protocol: A Multicenter Randomized Clinical Trial (SONVI Study)[J]. Medicine, 2016, 95(21):e3704.
[4] GRIMBLE R F. Immunonutrition[J]. Curr Opin Gastroenterol, 2005, 21(2):216-222.
[5] ORDEMANN J, JACOBI C A, BRAUMANN C, et al. Immunomodulatory changes in patients with colorectal cancer[J]. Int J Colorectal Dis, 2002, 17(1):37-41.
[6] GALON J, COSTES A, SANCHEZ-CABO F, et al. Type, density, and location of immune cells within human colorectal tumors predict clinical outcome[J].Science,2006, 313(5795):1960-1964.
[7] WANG D L, LIU Y Y, GU Y L, et al. Increased number of forkhead box P3+ tumor-infiltrating lymphocytes correlates with high preoperative albumin level and better survival in patients with stage II or III colorectal cancer[J]. Tumor Biol, 2015, 36(7):5407-5414.
[8] YOSHIDA N, KINUGASA T, MIYOSHI H, et al. A High RORγT/CD3 Ratio is a Strong Prognostic Factor for Postoperative Survival in Advanced Colorectal Cancer: Analysis of Helper T Cell Lymphocytes (Th1, Th2, Th17 and Regulatory T Cells)[J]. Ann Surg Oncol, 2016, 23(3):919-927.
[9] LI Y, YANG G L, YUAN H Y, et al. Effects of perioperative cimetidine administration on peripheral blood lymphocytes and tumor infiltrating lymphocytes in patients with gastrointestinal cancer: results of a randomized controlled clinical trial[J]. Hepatogastroenterology,2005,52(62):504-508.
[10] TENG F, MU D, MENG X, et al. Tumor infiltrating lymphocytes (TILs) before and after neoadjuvant chemoradiotherapy and its clinical utility for rectal cancer[J]. Am J Cancer Res, 2015, 5(6):2064-2074.
[11] GOODEN M J,DE BOCK G H, LEFFERS N, et al.The prognostic influence of tumour-infiltrating lymphocytes in cancer: a systematic review with meta-analysis[J]. Br J Cancer, 2011, 105(1):93-103.
[12] NITENBERG G, RAYNARD B. Nutritional support of the cancer patient: issues and dilemmas[J]. Crit Rev Oncol Hematol, 2000, 34(3):137-168.
[13] Ordemann J, Jacobi C A, Braumann C, et al. Immunomodulatory changes in patients with colorectal cancer[J]. Int J Colorectal Dis, 2002, 17(1):37-41.
[14] SCHNEIDER H, ATKINSON S W. Immunonutrition-fact or fad[J]. J Nutri Health Aging, 2000, 4(2):120-123.
[15] KORETZ R L. Immunonutrition: fact, fantasy, and future[J]. Curr Gastroenterol Rep, 2002, 4(4):332-337.
[16] MC COWEN K C, BISTRIAN B R. Immunonutrition: problematic or problem solving?[J]. Am J of Clin Nutr, 2003, 77(4):764-770.
[17] BRAGA M, GIANOTTI L, VIGNALI A, et al. Preoperative oral arginine and n-3 fatty acid supplementation improves the immunometabolic host response and outcome after colorectal resection for cancer[J]. Surgery, 2002, 132(5):805-814.
[18] OHTANI H. Focus on TILs: prognostic significance of tumor infiltrating lymphocytes in human colorectal cancer[J]. Cancer Immun,2007,7:4.
[19] MENON A G, JANSSEN-VAN RHIJN C M, MORREAU H, et al. Immune system and prognosis in colorectal cancer: a detailed immunohistochemical analysis[J]. Lab Invest, 2004, 84(4):493-501.
Superiority of postoperative immune and recovery level of preoperative immunonutrition regimen in colorectal cancer patients
ZHAODongfeng1,ZHUHaitao2,MADawei3,ZHOUBin2.
( 1.DepartmentofGeneralSurgery,PeixianPeople’sHospital,Xuzhou221000,China; 2.DepartmentofGeneralSurgery,JiangsuCancerHospital,Nanjing210009,China; 3.DepartmentofPathology,JiangsuCancerHospital,Nanjing210009,China)
ZHOUBin,E-mail:zbjszl@126.com
Objective Explore postoperative immune and recovery value of preoperative immunonutrition regimen in colorectal patients.Methods 60 colorectal cancer patients were randomly divided into three groups during July,2013 to Dec,2015 and treated with immunonutrition(IMN), standard enteral(SE), total parental nutrition(TPN) regimens respectively. Comparative analysis was used to evaluate the TILs level and rehabilitation condition of patients between different groups.Results Significant increases of TILs counts were be found in each group after nutrition regimen, especially the CD4+, CD8+cells. A remarkable augmentation rate of CD8+cells in IMN group.CD16+cells infiltration within tumor after nutrition were significantly increased in TPN groups. CD56+cells infiltration was significantly increased in IMN group.Patients who fed with IMN showed better nutritional status and rehabilitation condition than the others at post-operation.Conclusions Early preoperative application of immunonutrition in colorectal cancer patients could contribute to the infiltration of TILs in , as a result of accelerating the course of convalescence.
Preoperative immunonutrition; Colorectal cancer; Tumor infiltrative lymphocytes; Immune response
江苏省卫计委保健科研项目 (BJ14020)
221600 江苏 沛县, 沛县人民医院 普外科(赵东峰); 210009 江苏 南京,江苏省肿瘤医院 普外科(朱海涛,周 斌),病理科(马大伟)
赵东峰,男,主治医师,研究方向:胃肠肿瘤的临床治疗,E-mail:57374942@qq.com
周 斌,男,医学硕士,主治医师,研究方向:胃肠肿瘤的临床与基础研究,E-mail:zbjszl@126.com
10.3969/j.issn.1674-4136.2016.06.009
1674-4136(2016)06-0381-04
2016-10-07][本文编辑:李筱蕾]
