pFOXO1A与胃癌临床病理特征相关性研究
2016-03-17胡晓莉刘雅恬王建红彭春雷张珣磊
胡晓莉, 刘雅恬, 王建红, 何 松, 彭春雷, 张珣磊
论 著
pFOXO1A与胃癌临床病理特征相关性研究
胡晓莉, 刘雅恬, 王建红, 何 松, 彭春雷, 张珣磊
目的 测定FOXO1A丝氨酸-256和丝氨酸-329磷酸化位点在胃癌组织标本中的表达,分析其与胃癌临床病理特征之间的关系。方法 采用免疫组化法检测141例胃腺癌手术标本中FOXO1A丝氨酸-256(s256)和丝氨酸-329(s329)磷酸化位点的表达,分析其与患者年龄、性别、肿瘤分化程度、神经侵犯、临床分期、淋巴结转移之间的关系。结果 在胃癌组织中,pFOXO1A s256位点阳性率为97.1%,s329位点阳性率为85.1%。s256与s329位点磷酸化的表达在4组患者(阴性组、+阳性组、++阳性组及+++阳性组)之间差异有统计学意义(P<0.05)。且在++及+++阳性组中,s256与s329位点磷酸化的表达强度呈显著相关(r2= 0.272,P<0.05)。s256位点的表达与肿瘤发生部位有关,贲门区肿瘤患者++~+++阳性率为84.6%(P<0.05)。s329位点的表达与患者年龄有关,60岁以上患者s329位点阳性率及表达强度显著增高(P<0.05)。结论 s256及s329位点的磷酸化可能在正常细胞向恶性细胞转化的过程中扮演了重要角色。s256磷酸化高表达有可能在贲门部位肿瘤的形成、发展中起到重要的作用。s329磷酸化高表达与患者年龄有关。
FOXO1A; 丝氨酸-256; 丝氨酸-329; 胃癌; 临床病理特征
胃癌的发生发展是典型的多因素参与、多步骤转化的过程,常常表现为慢性炎症刺激到不典型增生再到癌变的过程,期间涉及多个癌基因、抑癌基因的活化及失活。转录因子是控制基因表达的蛋白质分子,通过靶基因的表达对机体的发育、分化、代谢等起调节作用。2000年开始,FORKHEAD转录因子正式统一命名[1]。随着研究的深入,发现FORKHEAD转录因子的表达水平(活性)与人类肿瘤的发生和发展存在一定的关系,尤其是FOXO亚家族。人类FOXO1A蛋白中,含有3个高度保守的磷酸化位点,分别是苏氨酸-24,丝氨酸-256和丝氨酸-329,是其区别于其他叉头蛋白的重要特征[2]。体外试验及细胞实验均表明这3个位点可以被PKB磷酸化。磷酸化后的FOXO1A 转录因子转移至胞质内,阻碍凋亡前靶基因的转录[3],导致存在遗传学缺陷的细胞逃脱免疫监视,最终导致肿瘤的发生。本研究采用免疫组化方法测定FOXO1A磷酸化蛋白在胃癌组织标本中的表达,分析pFOXO1A与患者年龄、性别、肿瘤部位和临床分期等病理特征之间的相关性。
1 资料与方法
1.1 临床资料 收集2009年12月至2016年1月在南通大学附属肿瘤医院行胃癌手术的141例患者,分类统计患者年龄、性别、肿瘤部位、分化程度、神经侵犯、脉管浸润、淋巴结转移、浸润深度、UICC分期等临床资料。
1.2 pFOXO1A的免疫组化检测 pFOXO1A(s256和s329)抗体购自艾博抗(上海)贸易有限公司,采用免疫组化SP法分别就FOXO1A的两个磷酸化位点(s256和s329)对患者肿瘤组织切片进行检测。pFOXO1A免疫组化染色结果由两位经验丰富的病理科医生单盲独立判定,判定结果一致时纳入研究对象。具体评价方式如下:胞质有粽黄色颗粒沉着为阳性染色;阳性细胞数≤10%为阴性,>10%为阳性,+阳性细胞数10%~50%,++阳性细胞数50%~70%,+++阳性细胞数>70%。
1.3 统计学方法 所有数据应用SPSS 18.0统计软件处理,FOXO1As256位点表达和s329位点表达阳性率与各临床资料参数间的比较采用χ2检验,P<0.05则认为差异具有统计学意义。两者表达一致性检验采用配对t检验。两者表达强度联系采用相关性分析。P<0.05则认为差异具有统计学意义。
2 结果
2.1 胃癌组织中pFOXO1A(s256和s329)的表达 光镜下可见,在高分化腺癌中,阳性染色颗粒位于细胞核和细胞质中;在低分化腺癌中,阳性染色主要集中在细胞质中。在141例患者中,pFOXO1A s256位点阳性137例(97.1%),阴性4例(2.9%);s329位点阳性120例(85.1%),阴性21例(14.9%)。其中s256位点+44例,++53例,+++40例;s329位点+60例,++27例,+++33例,s256与s329位点磷酸化的表达在4组患者(阴性组、+阳性组、++阳性组及+++阳性组)之间有统计学差异(P<0.05,表1),且在++及+++阳性患者组中,s256与s329位点磷酸化的表达强度呈显著正相关(r2=0.272,P<0.05,图1)。
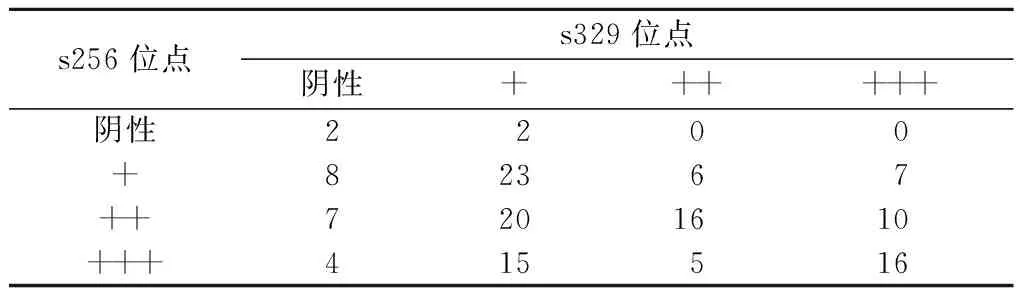
表1 胃癌组织中pFOXO1As256及s329位点的表达
注:s256和s329位点磷酸化的表达在4组患者中的比较(阴性组、+阳性组、++阳性组及+++阳性组),P<0.05。

图1 47例++~+++阳性患者 s256和s329位点磷酸化表达强度的相关性
2.2 胃癌组织中FOXO1As256及s329位点的表达与临床病理特征的相关性免疫组化 结果表明,在胃癌组织中pFOXO1A的表达与患者性别、肿瘤浸润深度、分化程度、临床分期和淋巴结转移均无关。其中,s256位点的表达与肿瘤发生部位有关,与胃体、胃窦区相比,贲门区肿瘤++~+++阳性66例(84.6%,P<0.05,表2)。s329位点的表达与患者年龄有关,60岁以上患者s329位点阳性率及表达强度显著增高(P<0.05,表2)。
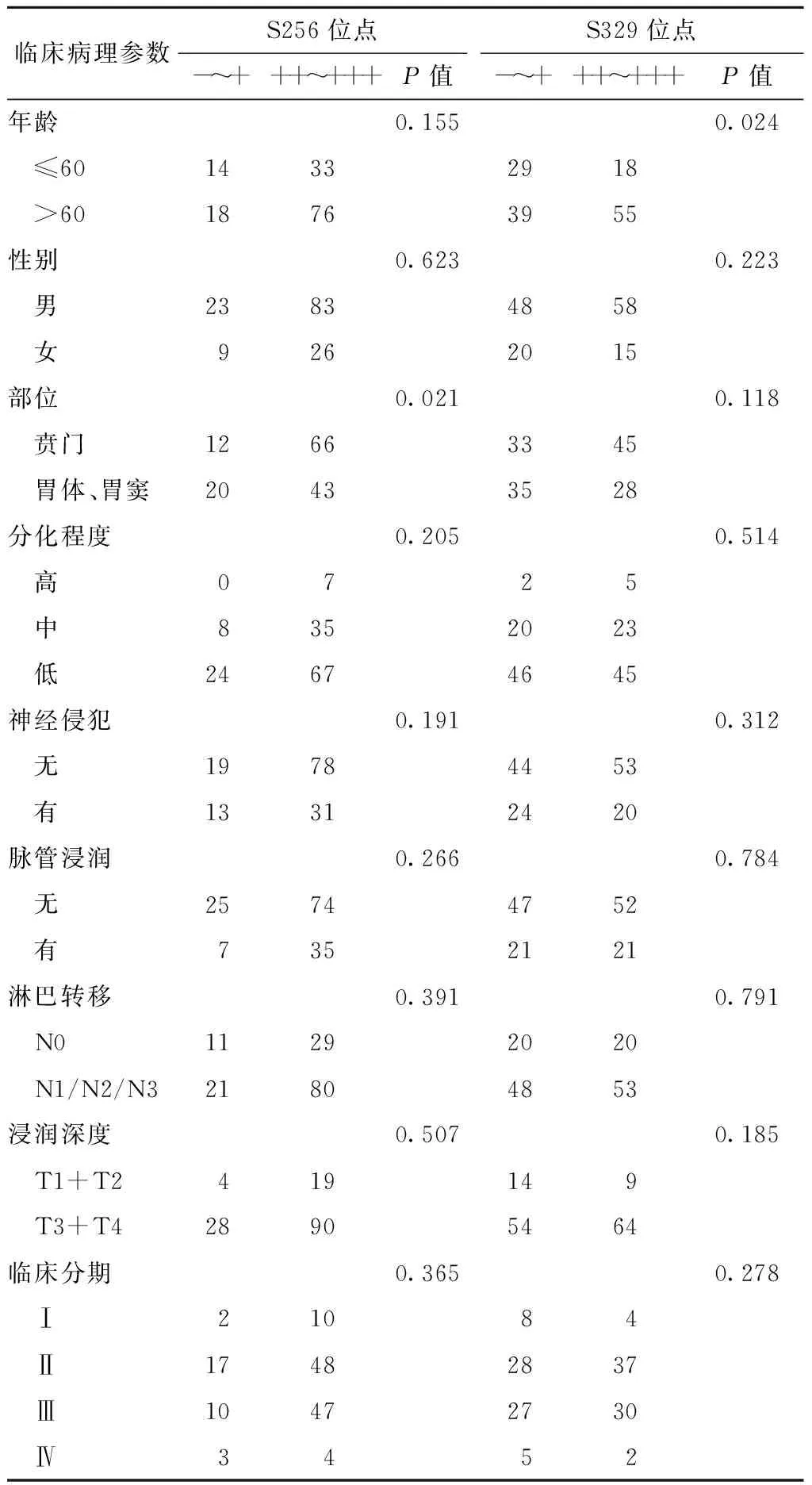
表2 胃癌组织中FOXO1As256及s329位点的表达 与临床病理参数的关系(n=141)
3 讨论
1989年,人们在果蝇中发现了第一个FORKHEAD转录因子,目前这一转录因子在人类细胞中已有17个亚家族(FOXA~Q),FOXO属于其中之一,具有FOX结构域[4]。研究表明,FOXO转录因子的活性受到多方面调节,有基因表达水平、翻译后修饰、蛋白质的稳定性、蛋白质-蛋白质相互作用等[5]。其中磷酸化/去磷酸化和乙酰化/去乙酰化修饰可以调节FOXO蛋白分子的亚细胞定位以及转录活性。磷酸化/去磷酸化的改变可以实现FOXO蛋白的亚细胞定位,磷酸化的FOXO蛋白被排出细胞核外,从而抑制其转录活性,这是FOXO转录活性受到负性调节的主要机制。同时,FOXO蛋白磷酸化修饰有多种蛋白激酶的参与,他们主要包括SGK、CK1、AKT/PKB、DYRK1A和Ral等,而且细胞内多种信号途径可激活这些特异的蛋白激酶[6]。研究还发现FOXO蛋白分子磷酸化及其亚细胞定位可导致FOXO蛋白的功能下降,从而促进肿瘤的发生与发展[7]。丝氨酸-256磷酸化是抑制FKHR转录激活的重要因素,是苏氨酸-24/丝氨酸-329磷酸化的前提,在FOXO1A多步骤的磷酸化过程中扮演重要角色[2]。苏氨酸-24/丝氨酸-329磷酸化是导致FOXO蛋白从细胞核中移至细胞质的关键原因,同样从另外一方面调节FKHR的功能活性。这些研究表明了FOXO蛋白3个磷酸化位点的各自作用及相互关系。
文献报道,FOXO磷酸化、亚细胞定位在许多实体瘤中被发现,包括肺癌、肝癌、胃癌、乳腺癌等。深入研究发现FOXO3A的磷酸化与乳腺癌的低生存率相关[8],FOXO1A的磷酸化水平在Ⅳ期非小细胞肺癌患者中显著升高[9]。进一步研究显示FOXO直接调控小窝蛋白-1(caveolin-1)的表达[10],而小窝蛋白-1与肿瘤的发生密切相关[11],其表达增加了部分原发性肿瘤如肺腺癌和食管鳞癌的发生和转移。研究还显示FOXO可调控肿瘤坏死因子受体相关的死亡结构域(TNF receptor-associated death domain,TRADD)靶基因表达[12],在化疗药物诱导FOXO1A活化的肺腺癌细胞和纤维肉瘤细胞中,可导致TRADD表达下降,使肿瘤细胞发生凋亡[13]。Bim属于Bcl-2家族成员,具有促凋亡活性作用,是FOXO调控的靶基因,研究发现FOXO1A、FOXO3A及其靶蛋白Bim在9种乳腺癌细胞中均有表达,上调FOXO3A的表达方法可以提高Bim mRNA和蛋白质水平,直接诱导乳腺癌细胞凋亡[14]。
Kim等[15]研究首次表明pFOXO1A表达与胃癌发生有关。该研究显示FOXO1A通过介导细胞周期停滞促进胃癌发生,同时发现pFOXO1A在胃癌的发生中是早发、频发事件。在胃癌组织中,FOXO1A主要在细胞质中表达,但在高分化腺癌中细胞核、细胞质均可被染色,而在正常胃黏膜、低分化腺癌中不表达或低表达。在对各项临床病理指标的分析中,pFOXO1A表达与淋巴结的转移和浸润也相关[15-16],而与患者的年龄、性别、肿瘤部位及是否远处转移等尚无确定的关系。周英姿等[17]报道FOXO1与胃癌细胞分化程度相关,肿瘤分化程度越低FOXO1的表达也越低。
在本研究中,FOXO1As256位点的磷酸化在整个样本中表达阳性率达到97.1%,而在s329位点的磷酸化表达阳性率达到85.1%,表明这两个位点的磷酸化与胃癌可能存在密切关系。同时s256磷酸化与s329磷酸化表达的强度具有相关性,且s256磷酸化的表达阳性率高于s329磷酸化的表达。
在本研究中,贲门部位肿瘤的s256磷酸化高表达的比例明显高于其他部位胃癌,表明s256的磷酸化有可能在贲门部位肿瘤的形成、发展中起重要作用。我们下一步将扩大贲门部位胃癌病例的研究,为贲门癌的诊断、个体化治疗提供新的思路。本研究还发现s329磷酸化在>60岁的患者中发生的比例更高,提示其表达可能与年龄有关。
[1] KAESTNER K H,KNOCHEL W,MARTINEZ D E.Unified nomenclature for the winged helix forkhead transcription factors[J].Genes Dev,2000,14(2):142-146.
[2] GUO S,RENA G,CICHY S,et al.Phosphorylation of serine 256 by protein kinase B disrupts transactivation by FKHR and mediates effects of insulin on insulin-like growth factor-binding protein-1 promoter activity through a conserved insulin response sequence[J].J Biol Chem,1999,274(24):17184-17192.
[3] CHONG Z Z,MAIESE K.Erythropoietin involves the phosphatidylinositol 3-kinase pathway,14-3-3 protein and FOXO3a nuclear trafficking to preserve endothelial cell integrity[J].Br J Pharmacol,2007,150(7):839-850.
[4] CLARK K L,HALAY E D,LA I E, et al.Co-crystal structure of the HNF-3 fork head DNA-recognition motif resembles histone H5[J].Nature,1993,364(6436):412-420.
[5] VAN DER HORST A,DE VRIES-SMITS A M,BRENKMAN A B,et al.FOXO4 transcriptional activity is regulated by monoubiquitination and USP7HAUSP[J].Nature Cell Biology,2006, 8(10):1064-1073.
[6] BARTHEL A,SCHMOLL D,UNTERMAN T G.Foxo proteins in insulin action and metabolism[J].Trends Endocrinol Metab,2005,16(4):183-189.
[7] ZHAO X, GAN L, PAN H, et al.Multip le elements regulate nuclearcytoplasmic shuttling of FOXO1:characterization of phosphorylation and 14-3-3-dependent and independent mechanisms[J].Biochem J,2004,378(Pt 3):839-849.
[8] HU M C,LEE D F,XIA W,et al.IkappaB kinase promotes tumorigenesis through inhibition of forkhead FOXO3a[J].Cell,2004,117(2):225-237.
[9] SOURBIER C, LINDNER V, LANG H,et al.The phosphoinositide 3-kinaseAkt pathway: a new target in human renal cell carcinoma therapy[J].Cancer Res,2006,66(10):5130-5142.
[10] VAN DEN HEUVEL A P,SCHULZE A,BURGERING B M.Direct control of caveolin-1 by FOXO transcription factors[J].Biochem J,2005,385(Pt 3):795-802.
[11] Ho C C,Huang P H,Huang H Y,et al.Up-regulated caveolin-1 accentuates the metastasis capability of lung adenocarcinoma by inducing filopodia formation[J].Am J Pathol,2002,161(5):1647-1656.
[12] YANG J Y,HUNG M C.A new fork for clinical application: targeting forkhead transcription factors in cancer[J].Clin Cancer Res,2009,15(3):752-757.
[13] ROKUDAI S,FUJITA N,KITAHARA O,et al.Involvement of FKHR-dependent TRADD in chemotherapeutic drug-induced apoptosis[J].Mol Cell Biol,2002,22(24):8695-8708.
[14] SUNTERS A,MADUREIRA P A,POMERANZ K M,et al.Paclitaxel-induced nuclear translocation of FOXO3a in breast cancer cells is mediated by c-Jun NH2-terminal kinase and Akt[J].Cancer Res,2006,66(1):212-220.
[15] KIM J H,KIM M K,LEE H E,et al.Constitutive phosphorylation of the FOXO1A transcription factor as a prognostic variable in gastric cancer[J].Modern Pathology,2007,20(8):835-842.
[16] YANG L.Incidence and mortality of gastric cancer in China[J].World J Gastroenterol,2006,12(1):17-20.
[17] 周英姿,张友元,桂律,等.FOXO1A及FLASH在胃癌组织中的表达及其意义[J].肿瘤防治研究,2010,37(6):675-678.
Correlation between phosphorylation of FOXO1A and clinicopathological features of gastric
HUXiaoli1,WANGJie2,WANGJianghong1,HESong3,PENGChunlei1,ZHANGXunlei1.
(1.DepartmentofMedicalOncology,NantongUniversityAffiliateTumorHospital,Nantong226361,China;2.DepartmentofScientificResearch,JiangsuCancerHospital,Nanjing210009,China; 3.DepartmentofPathology,NantongUniversityAffiliateTumorHospital,Nantong226361,China)
WANGJianghong,E-mail:wjh-ywk@163.com
Objective To investigate the expression of phosphorylation of Serine 256 and Serine 329 in FOXO1A in gastric cancer tissues, and to analyze the relationship between them and clinicopathological features of gastric cancer.Methods The expressions of phosphorylation of Serine 256 and Serine 329 in FOXO1A in 141 cases of gastric cancer tissues, were detected using immunohistochemistry assay.The relationships between the expression of phosphorylation of Serine 256 and Serine 329 in FOXO1A and age,gender, differentiation, nerve invasion, disease stage, and lymphoid node metastasis were analyzed. Results The positive rate of pFOXO1A s256 was 97.1% in gastric cancer tissues and 85.1% in s329 loci.The expression of s256 and s329 phosphorylation was significantly different between the four groups (negative group,+ positive group,++ positive group and +++ positive group) (P<0.05).And in the ++ and +++ positive groups,there was a significant correlation between s256 and s329 phosphorylation (r2=0.272,P<0.05). The expression of s256 locus was associated with tumor location, and the positive rate of ++~+++ in patients with cardiac cancer was 84.6% (P<0.05). The expression of s329 was correlated with the age of the patients. The positive rate and the expression intensity of s329 were significantly higher in the patients over 60 years old (P<0.05).Conclusions Phosphorylation of Serine 256 and Serine 329 may play an important role in the transition of normal gastric cells to malignant cells. Serine 256 phosphorylation may play an important role in the formation and development of carcinoma of cardia.High phosphorylation of Serine 329 was associated with patient age.
FOXO1A; Serine 256; Serine 329; Gastric carcinoma; Clinicopathological features
国家自然科学基金资助项目(81501977);南通市应用研究科技计划项目(BK2012071)
226361 江苏 南通,南通大学附属肿瘤医院 肿瘤内科(胡晓莉,王建红,彭春雷,张珣磊); 210009 江苏 南京,江苏省肿瘤医院 放疗科(刘雅恬); 226361 江苏 南通,南通大学附属肿瘤医院 病理科(何 松)
胡晓莉,女,主治医师,研究方向:消化道肿瘤的化疗,E-mail:happy-hxl@163.com
共同第一作者: 刘雅恬,女,主治医师,研究方向:胸腔肿瘤的放射治疗,E-mail:10567438@qq.com
王建红,男,主任医师,研究方向:消化道肿瘤的防治,E-mail:wjh-ywk@163.com
10.3969/j.issn.1674-4136.2016.06.003
1674-4136(2016)06-0357-04
2016-06-02][本文编辑:钦 嫣]
