乳腺浸润性微乳头状癌耐药机制研究
2016-03-17王丹丹杨苏晋唐金海
王丹丹, 陈 秀, 杨苏晋, 付 丽, 唐金海
论 著
乳腺浸润性微乳头状癌耐药机制研究
王丹丹, 陈 秀, 杨苏晋, 付 丽, 唐金海
目的 探讨miRNAs在紫杉醇耐药的乳腺浸润性微乳头状癌中的影响。方法 收集2011年1月至2014年12月年天津市肿瘤医院11例乳腺浸润性微乳头状癌(invasive micropapillary carcinoma,IMPC)患者的组织切片,实时荧光定量PCR法检测其中miRNAs的表达。采用TargetScan和mi RDB预测miRNAs下游靶基因。结果 根据前期研究结果筛选出13个耐药相关的miRNAs,其中与紫杉醇敏感的IMPC相比,miR-744-5p在紫杉类耐药IMPC中的表达水平升高了(t=-2.650,P=0.029),差异有统计学意义。通过生物信息学分析预测发现,miR-744-5p可能通过调节CPFS4,Upf1和PP2A等靶基因影响紫杉醇耐药。结论 miR-744-5p可能参与调节IMPC的紫杉醇耐药,并可能成为其分子标记物。
miRNA; 浸润性微乳头状癌; 紫杉醇; 耐药
浸润性微乳头状癌(invasive micropapillary carcinoma,IMPC)是2003年WHO在乳腺上皮肿瘤分类中新增的一种类型,是一种少见的乳腺癌类型[1]。IMPC在光镜下癌巢呈显著的微乳头状,由细网状的间质分隔开来,且与间质间由空隙分离。IMPC的发病率低,但对淋巴结侵袭能力强,淋巴结转移发生率高,临床预后差[2]。虽然在手术、化疗、放疗和内分泌等综合治疗下IMPC患者的预后得到了很好的改善,但是仍有一部分患者由于对化疗药的耐药使疾病进展,且其潜在的耐药分子机制尚不清楚。
微RNA(microRNA,miRNA)是一类内源性的高度保守的非编码小RNA,其通过与靶基因的3’端非编码区域(3’-untranslation region,3’UTR)结合抑制靶基因的表达[3]。近年来,越来越多的研究发现,miRNAs在肿瘤的增殖、凋亡、耐药、侵袭和转移等生物学中发挥了重要的作用[4-5]。因此,为了进一步探讨miRNAs与IMPC耐药机制间的关系,我们对11例IMPC乳腺癌患者的病理组织进行miRNAs检测,并对其中潜在的耐药机制进行研究。
1 资料和方法
1.1 临床资料 11例石蜡组织切片取自2011年1月至2014年12月天津市肿瘤医院乳腺病理科。实验中涉及到的人乳腺癌组织标本及临床资料通过天津市肿瘤医院伦理委员会批准,并与患者签署了知情同意书。
1.2 乳腺癌石蜡组织标本 将获得的乳腺癌组织样本浸泡在10%福尔马林溶液中5~10 h,随后进行脱水和石蜡包埋,最终制成石蜡包埋组织。同时,由两位病理科主任医师利用HE染色切片,在光镜下划定出每个样本中IMPC肿瘤细胞的比例。最后根据药敏试验结果将标本分为药物敏感组(4例)和药物不敏感组(7例)。
1.3 主要试剂与仪器 总RNA提取试剂盒购自life公司;逆转录、Real-time PCR试剂盒购自日本TaKaRa公司;miRNAs引物合成自南京天为公司;NanoDrop2000紫外分光光度计购自美国Thermo公司;实时荧光定量扩增仪购自美国BIO-RAD公司。
1.4 实时定量PCR法(RT-qPCR)检测miRNAs表达 按照Ambion石蜡组织总RNA提取试剂盒的说明,首先进行脱蜡步骤,即将3片10 μm厚的FFPE切片浸泡在100%二甲苯中30 min,100%、85%、75%的梯度乙醇中各15 min。其次,根据HE染色切片的IMPC细胞的范围进行刮片,以消除其他细胞成分对结果的影响。随后,经过蛋白酶降解、纯化、洗脱等步骤后,得到石蜡组织中的总RNA。用NanoDrop2000分光光度计鉴定RNA的质量。对提取出的总RNA按照life加尾法试剂盒进行反转录,然后以cDNA为模板,采用SYBR Green PCR试剂盒进行实时荧光定量PCR检测,每个样本设置3个复孔,U6作为内参基因。miRNAs反转录引物序列见表1。以2-ΔΔCt法计算miRNAs的相对表达量。

表1 miRNAs引物序列
1.5 靶基因预测 通过Target Scan(Release 7.0,http://www.targetscan.org)和mi RDB(Version5.0,http://www.mirdb.org)生物信息学在线软件预测miRNA的靶基因。因为不同的预测软件采用了不同的预测靶基因的算法,为了增加预测结果的准确性,本研究取两个软件得到的靶基因交集。
1.6 统计学方法 使用SPSS 22.0 统计软件进行数据分析,数据以s表示,两组之间比较用t检验,P<0.05提示差异有统计学意义。
2 结果
2.1 miRNAs在石蜡组织切片中的表达 本研究根据实验室前期研究结果筛选出13个与耐药相关的miRNAs[6]。RT-qPCR结果证实,与紫杉类敏感的IMPC比,其中miR-744-5p在紫杉类耐药IMPC中的表达水平升高了(t=-2.650,P=0.029,表2),差异有统计学意义。
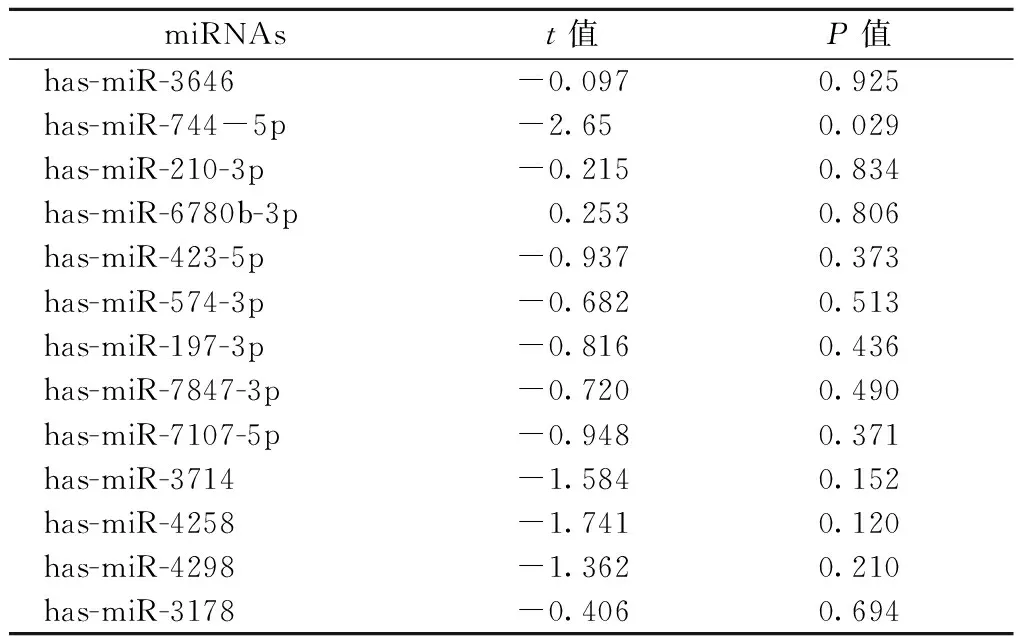
表2 耐药组与非耐药组miRNAs表达的差异
2.2 生物信息学软件分析 通过Target Scan和mi RDB生物学分析,如图1所示,miR-744-5p存在3个潜在的靶基因,即Cleavage and polyadenylation specificity factor 4 (CPFS4),Upf1和Protein phosphatase 2A(PP2A)。
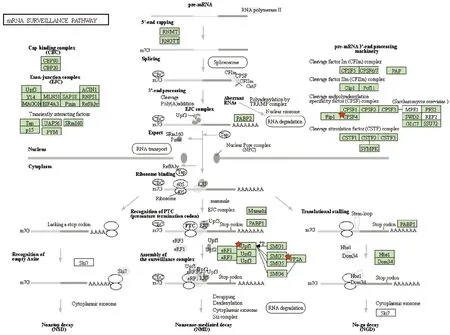
图1 生物信息学分析预测
3 讨论
乳腺癌是全球威胁女性健康最常见的恶性肿瘤之一,其发病率呈逐年上升趋势[7]。化疗是其主要的治疗方式之一。紫杉醇是乳腺癌辅助化疗的一线药物,其主要通过影响微管蛋白聚合,使细胞在进行有丝分裂时不能形成纺锤体和纺锤丝,进而抑制了细胞分裂和增殖[8]。IMPC作为乳腺癌的一种特殊类型,其较差的临床预后,又伴随着肿瘤细胞产生化疗耐药性,常常导致治疗失败。因此找出紫杉醇耐药的标志物以及逆转其耐药,对于IMPC的治疗具有重要的意义。近年来,有研究证实miRNAs参与了肿瘤耐药的形成[9-10],这为肿瘤的耐药机制研究提供了新的思路和启发。
研究表明,miR-744-5p的异常表达参与了调节鼻咽癌[11]、肺癌[11]和胰腺癌[12]等肿瘤的发生发展。但是,在IMPC耐药中尚未见报道。本研究发现,在与耐药相关的13个miRNAs中,miR-744-5p在紫杉醇耐药的IMPC中显著上调,提示其在IMPC对紫杉醇耐药中起重要作用。进一步对miR-744-5p靶基因进行预测分析发现,CPFS4,Upf1和PP2A很可能是该miRNA异常表达导致耐药的关键基因。Tang等[13]研究揭示,CBP (CREB-binding protein)通过靶向CPSF4通路调节肺癌的发生。Saul 等[14]证实,Upf1在hnRNPE2/miR-328通路中起到关键的作用。Kaur等[15]发现,Protein phosphatase methylesterase-1 (PME-1) 抑制PP2A的表达改变肿瘤的增殖、侵袭、转移和耐药。另外,在多种肿瘤中发现PME-1还促进MAPK/ERK and AKT等通路。这也为我们后期的IMPC耐药的研究提供了理论基础。
本研究发现,在紫杉醇耐药的IMPC中,miR-744-5p的表达有显著差异,其可能与多个靶基因存在密切关系。当然,单个miRNA可能作用于多个靶基因,一个基因也可能受到多个靶基因调控,因此不能排除有其他miRNAs协同影响IMPC的耐药。另外,由于IMPC发生率低,我们收集的样本例数有限,后续需要继续扩大样本量证实。同时,我们也需要在体内、体外实验中进一步的证实miR-744-5p与其靶基因的相互关系。
总之,本研究首次发现miR-744-5p与IMPC紫杉醇耐药的相关性,并找出了其潜在的3个靶基因,即CPFS4,Upf1和PP2A。miR-744-5p可能成为IMPC耐药的分子标志物,并可能通过抑制其表达逆转耐药。但本研究局限于样本例数和生物学分析,因此能否将实验结论应用于临床有待进一步研究,尤其需要通过开展大规模、多中心的前瞻性临床研究来证实。
[1] BÖCKER W. WHO classification of breast tumors and tumors of the female genital organs: pathology and genetics[J]. Verh Dtsch Ges Pathol, 2002, 86:116-119.
[2] FU L, IKUO M, FU X Y, et.al. Relationship between biologic behavior and morphologic features of invasive micropapillary carcinoma of the breast[J]. Zhonghua Bing Li Xue Za Zhi, 2004, 33(1):21-25.
[3] BARTEL D P. MicroRNAs: target recognition and regulatory functions [J]. Cell, 2009, 136(2):215-233.
[4] CHEN X, ZHONG S L, LU P, et al. miR-4443 Participates in the Malignancy of Breast Cancer[J]. PloS one,2016, 11(8):e0160780.
[5] WANG D D, LI J, SHA H H, et al. miR-222 confers the resistance of breast cancer cells to Adriamycin through suppression of p27kip1 expression [J]. Gene, 2016, 590(1):44-50.
[6] ZHONG S, CHEN X, WANG D, et al. MicroRNA expression profiles of drug-resistance breast cancer cells and their exosomes [J]. Oncotarget, 2016, 7(15):19601-19609.
[7] TORRE L A, BRAY F, SIEGEL R L, et al.Global cancer statistics,2012[J].CA Cancer J Clin,2015,65(2):87-108.
[8] LOCATELLI M A, AFTIMOS P, DEES E C, et al. Phase I study of the gamma secretase inhibitor PF-03084014 in combination with docetaxel in patients with advanced triple-negative breast cancer[J]. Oncotarget, 2016, doi:10.18632/oncotarget.13727.
[9] ZENG L P,HU Z M,LI K, et al.miR-222 attenuates cisplatin-induced cell death by targeting the PPP2R2A/Akt/mTOR Axis in bladder cancer cells[J].J Cell Mol Med,2016, 20(3):559-567.
[10] SOHN W, KIM J, KANG S H, et al.Serum exosomal microRNAs as novel biomarkers for hepatocellular carcinoma[J]. Exp Mol Med,2015, 47: e184.doi: 10.1038/emm.2015.68.
[11] YU Q, ZHANG F, DU Z, et al.Up-regulation of serum miR-744 predicts poor prognosis in patients with nasopharyngeal carcinoma[J]. Int J Clin Exp Med, 2015, 8(8):13296-13302.
[12] MIYAMAE M,KOMATSU S,ICHIKAWA D,et al.Plasma microRNA profiles: identification of miR-744 as a novel diagnostic and prognostic biomarker in pancreatic cancer[J]. Br J Cancer,2015, 113(10):1467-1476.
[13] TANG Z, YU W, ZHANG C, et al. CREB-binding protein regulates lung cancer growth by targeting MAPK and CPSF4 signaling pathway[J]. Mol Oncol, 2016, 10(2):317-329.
[14] SAUL M J,STEIN S,GREZ M,et al. UPF1 regulates myeloid cell functions and S100A9 expression by the hnRNP E2/miRNA-328 balance[J].Sci Rep, 2016, 6:31995.
[15] KAUR A, WESTERMARCK J. Regulation of protein phosphatase 2A (PP2A) tumor suppressor function by PME-1[J]. Biochem Soc Trans,2016, 44(6):1683-1693.
The mechanism of drug resistance in invasive papillary carcinoma of the breast
WANGDandan1,CHENXiu1,YANGSujin1,FULi2,TANGJinhai1.
(1.DepartmentofGeneralSurgery,TheFirstAffiliatedHospital,NanjingMedicalUniversity,Nanjing, 210029,China; 2.DepartmentofBreastCancerPathologyandResearchLaboratory,NationalClinicalResearchCenterforCancer,TianjinMedicalUniversityCancerInstituteandHospital,Tianjin300041,China)
TANGJinhai,E-mail:jinhaitangjsch@163.com;FULi,E-mail:fulijyb@hotmail.com
Objective To investigate the effect of miRNAs on chemosensitivity of invasive papillary carcinoma (IMPC). Methods 11 IMPC examples were got from Tianjin Cancer Hospital from 2011 to 2014. The expressions of miRNAs were tested by real time fluorescence quantitative PCR (RT-qPCR) and target genes were predicted with TargetScan and mi RDB databases. Results According to our previous study, we selected 13 miRNAs related to chemoresistance, and found that miR-744-5p was significantly upregulated in IMPC with paclitaxel resistance (t=-2.650, p=0.029). After bioinfomatic analysis, CPFS4,Upf1 and PP2A were detected to be potential target genes of miR-744-5p. Conclusion miR-744-5p may participate in regulation of paclitaxel resistance in IMPC, furthermore, it would be the promising biomarker of IMPC chemoresistance.
miRNAs; IMPC; Docetaxel; Resistance
国家高技术研究发展计划(2014AA020604);国家自然科学基金(81272358)
210029 江苏 南京,南京医科大学第一附属医院 普外科(王丹丹,陈 秀,杨苏晋,唐金海);300041 天津,天津医科大学附属天津市肿瘤医院 乳腺病理科(付 丽)
王丹丹,女,硕士研究生在读,研究方向:乳腺癌的分子机制研究,E-mail:dandanw92@163.com
共同第一作者: 陈 秀,女,硕士研究生在读,研究方向:乳腺癌的分子机制研究,E-mail:xiuchen92@163.com
唐金海,男,主任医师,教授,研究方向:乳腺肿瘤的综合治疗,E-mail:jinhaitangjsch@163.com
共同通讯作者: 付 丽,女,主任医师,教授,研究方向:乳腺肿瘤病理与精准医疗,E-mail:fulijyb@hotmail.com
10.3969/j.issn.1674-4136.2016.06.002
1674-4136(2016)06-0353-04
2016-12-02][本文编辑:李筱蕾]
