APETX2对氯化锂-匹鲁卡品诱导痫性发作大鼠的影响及机制探究
2016-03-16陈康康玉琪王艳梁静静卢祖能何小华朱帆肖哲曼
陈康 康玉琪 王艳 梁静静 卢祖能 何小华 朱帆 肖哲曼
430060 武汉,武汉大学人民医院神经内科[陈康 康玉琪 王艳 梁静静 卢祖能 肖哲曼(通信作者)];武汉大学基础学院病原生物学系(朱帆);武汉大学基础医学院病理学与病理生理学系(何小华)
APETX2对氯化锂-匹鲁卡品诱导痫性发作大鼠的影响及机制探究
陈康康玉琪王艳梁静静卢祖能何小华朱帆肖哲曼
430060武汉,武汉大学人民医院神经内科[陈康康玉琪王艳梁静静卢祖能肖哲曼(通信作者)];武汉大学基础学院病原生物学系(朱帆);武汉大学基础医学院病理学与病理生理学系(何小华)
【摘要】目的探索APETX2对氯化锂-匹鲁卡品诱导痫性发作大鼠的行为学影响及可能的机制。方法成年雄性SPF级SD大鼠18只,侧脑室置管后随机分为:癫痫组(9只)、APETx2组(9只),癫痫造模后观察2组癫痫大发作潜伏期及发作强度;APETx2处理原代培养海马神经元,动态观察其对钙成像的影响。结果APETx2组的SD大鼠癫痫潜伏期延长,大发作程度减轻;APETx2处理原代培养海马神经元钙内流下降。结论APETx2可抑制氯化锂-匹鲁卡品诱导SD大鼠痫性发作,减少酸诱导海马神经元钙离子浓度增加可能为机制之一。
【关键词】APETx2癫痫行为学钙成像海马
据WHO报道,世界上约有5000万癫痫患者,30%的新确诊癫痫儿童和成人患者使用抗癫痫药物不能完全控制癫痫发作,30%的儿童患者和40%的成人患者需要长期服药或者服药依然不能控制而成为难治性癫痫[1]。癫痫发病机制的探讨及治疗手段的寻求,一直是神经科学研究的热点。自2001年Biagini G[2〗[2]。但目前关于ASICs的研究并不完全清楚,特别是ASIC3在癫痫中的研究较少,为明确ASIC3在癫痫发作中的作用,本研究通过ASIC3特异性阻断海葵毒素APETx2,观察其对氯化锂-匹鲁卡品诱导癫痫发作SD大鼠的行为学以及海马神经元功能的影响。
1材料与方法
1.1实验对象200~230 g雄性SD大鼠18只;新生SD大鼠4只。
1.2主要试剂转铁蛋白(sigma);Glutamax(sigma);B-27(sigma);牛胰岛素(Amresco);FBS(Gibico)胰蛋白酶;APETx2(smartox)。
1.3主要仪器设备离心机(六一);大鼠脑立体定位仪(瑞沃德)。
1.4侧脑室置管
在武汉大学实验动物中心购买雄性SD大鼠200 g左右,给予充足食物和水分,保持适宜温度、湿度和昼夜节律,使其适应环境4~7 d;置管当天选取200~230 g大鼠,10%水合氯醛,350 mg/kg腹腔注射,30 s~3 min倒地后即可开始侧脑室置管手术。符合麻醉要求的SD大鼠置于手术台上,取俯卧位,四肢张开;手术器械75%酒精浸泡消毒,去掉头顶毛发,75%酒精消毒皮肤,前囟位置大概位于大鼠的双眼与双耳交叉连线处,以交点为中心正中剪开头皮约1.5 cm,逐层分离直至暴露颅骨,可见矢状缝和冠状缝,两者相交之处既是前囟点(Bregma);将大鼠固定于立体定位仪上,调整门齿杆位置,齿杆前上缘低于耳杆中心3.3 mm使前囟呈水平位,以前囟点(Bregma)为原点,测量前囟点(Bregma)与后囟点(lambda)距离,以0.9cm为标准,穿刺点的位置和深度据此标准按比例进行折算调整;选取穿刺点位置:Bregma点后(AP)0.8 mm, 矢状缝右侧(L)1.5 mm,标记后使用牙科手电钻钻孔,孔径1 mm,勿伤及硬脑膜及脑组织,以免出血。将套管垂直插入脑中,此时无液体流出,502胶水固定底座于颅骨上,固化后在底座周围均涂上适量502胶水,勿将胶水流向周围组织,胶水固化后缝合皮肤,皮肤缝合处涂上一层红霉素软膏,以防伤口及颅内感染;大鼠单笼饲养,给予充足食物和水分,饲养5~7 d,渡过手术应激期即可癫痫造模。
1.5癫痫模型制备,大鼠行为学观察
癫痫造模前1 d腹腔注射1.25%氯化锂125 mg/kg,给予氯化锂18~24 h内侧脑室给予毒素,毒素和匹鲁卡品溶剂均为PBS(Phosphate Buffered Saline,pH=7.4);侧脑室给药时将大鼠固定在大鼠固定器中,待其安静后将内芯管插入套管中,可见清亮脑脊液从内芯管缓慢流出,说明内芯管进入侧脑室,将内芯管接上微量注射器,缓慢给药,3 min给完,停留3 min缓慢拔去内芯,1 min拔出;半小时后腹腔给予1%匹鲁卡品35 mg/kg,观察并记录其行为学变化,主要包括竖毛、血泪、咀嚼、点头、上肢抽搐、直立、倒地、强直;按发作程度按Racine分级给分:0分为0级,没反应;1分为1级,少动;2分为2级,点头;3分为3级,上肢抽动;4分为4级,直立;5分为5级,摔倒;6分为6级,强直-阵挛或死亡。给药方式(表1)。按Racine分级标准,达到4级双下肢直立即达到大鼠癫痫大发作,从给予腹腔注射匹鲁卡品到SD大鼠癫痫发作达到4级这段时间,即是癫痫大发作潜伏期。潜伏期可反映癫痫的易感性或癫痫“阈值”:潜伏期越短,癫痫易感性越强,阈值越低。记录各组潜伏期数值,由于侧脑室给予APETx2后部分大鼠癫痫达不到4级,将还未大发作的时间记为我们的观察时间120 min。从腹腔注射匹鲁卡品计时120 min,大鼠在观察期间达到的最高Racine得分为大鼠在观察期间的癫痫发作最高等级,作为大鼠癫痫发作强度指标,反映癫痫发作的严重程度,得分越高,发作程度越重。

表1 癫痫造模给药方式
1.6细胞培养及钙离子成像
1.6.1培养板的预处理
培养前2 h将玻片用0.1 mg/mL多聚赖氨酸包被10 min,吸除,自然晾干,用PBS漂洗2次,置于培养箱中备用。
1.6.2海马神经元的分离、种植和培养
在武汉大学实验动物中心购买新生SD大鼠(24 h内出生),使用75%酒精消毒后断头,将头转移至超净台内75%酒精中浸泡2~3 s,将头迅速转移至预冷的PBS玻璃培养皿中漂洗,剪开头皮,暴露未骨化颅骨,剥离颅骨,将整个脑部分离出颅后转移至另一个预冷的PBS玻璃培养皿中,使用弯头眼科镊从扣带回处进入侧脑室,向后分离掀开海马上方皮层,暴露海马,海马呈白色新月形,离断海马足端,同样方法暴露对侧海马,可见两侧海马在穹窿连合处联系,夹起穹窿连合即可将两侧海马一同取出,以上操作均在冰上进行;取海马加入1.5 mLEP管中,显微剪剪碎,转移至0.125%胰蛋白酶的4 mL离心管中,37 ℃水浴消化,10 min后加10%血清的培养基停止消化,将组织吹打散开,100 g离心沉淀细胞,去上清,加种植液后吹打重悬,将细胞均匀种植在24孔板中 包被的盖玻片上,每孔加60 uL悬液,细胞密度在105~106/cm2以内,置于37 ℃、5% CO2细胞培养箱中贴壁,6 h后补加种植液200 uL,24 h后使用维持液1/2换液,以后每3 d 1/2换液;种植液:50 mL MEM、10 mg NaHCO3、 5 mg转铁蛋白、0.5 mL Glutamax、1.25 mg胰岛素、5 mL FBS;维持液:100 mL MEM、20 mg NaHCO3、10 mg转铁蛋白、0.25 mL Glutamax、2 mL B27、5 mL FBS。培养至6~8天时处理。
1.6.3海马神经元钙成像
细胞外液配制(mM):NaCl 150,KCl 5,MgCl2·6H2O 1,CaCl22,Glucose 10,HEPES 10,用Tris-OH将pH调至6.0、7.4;标准脑脊液配制(mM):NaCl 150,KCl 5,MgCl2·6H2O 1,CaCl22,Glucose 10,HEPES 10,用Tris-OH将pH调至7.4。细胞培养至6~8天,吸出24孔板中培养基,用标准脑脊液清洗3次,然后用4 uM flou8(AAT Bioquest)标准脑脊液37 ℃孵育30 min进行钙染料负载;标准脑脊液清洗3次,洗去多余钙染料,最后用标准脑脊液37 ℃稳定孵育30 min,取出玻片固定在共聚焦皿中,共聚焦皿中加入200 uL pH 7.4细胞外液,将共聚焦皿放在活细胞工作站的移动平台上的卡槽中,在倒置荧光显微镜下选好细胞区域,在494 nn激发波长下517 nn的发射波长处的荧光强度可实时反映细胞内钙离子浓度的变化;采用细胞旁给药法,使细胞外液pH在7.4和6.0间切换;细胞内钙离子荧光净升高值(△F)为钙离子荧光峰值减去静息期钙离子荧光值(F),△F/F即可反映胞内钙离子水平的变化。培养至6~8 d原代培养海马神经元进行钙成像,当细胞外液pH调整为6.0时,观察到不同浓度APETx2细胞内钙离子水平变化,图3所示。
1.7统计学处理
2结果
2.1APETX2对SD大鼠痫性发作潜伏期的影响
2组潜伏期分别为癫痫组(n=9):(22.65±1.613)min;APETX2组(n=9):(67.73±13.19)min。2组均符合正态分布(单样本k-s检验P=0.144),但方差不齐(F=66.87,DFn=8,Dfd=8,P<0.000 1),故使用校正t检验比较2组潜伏期:2组潜伏期差异显著(P=0.009 5)(图1),即APETx2可延长癫痫大发作潜伏期,降低癫痫的易感性,提高癫痫阈值。

图1 2组癫痫大发作潜伏期癫痫组潜伏期(n=9)为(22.65±1.613)min;APETX2组潜伏期(n=9)为(67.73±13.19)min;校正t检验:P值=0.0095,两组间比较具有统计学差异
2.2APETX2对SD大鼠痫性发作强度的影响
2组Racine得分均值分别为癫痫组Racine分级得分(n=9)为(5.333±0.235 7)分;APETx2组(n=9)为(3.556±0.337 9)分;符合正态分布和方差齐性,2组间癫痫发作严重程度具有统计学差异(P<0.05)。

图2 2组Racine分级得分均值比较,癫痫组Racine分级得分(n=9)为(5.333±0.2357)分;APETx2组Racine分级得分(n=9)为(3.556±0.3379)分;与癫痫组比较,*P<0.05
2.3APETX2对海马神经元胞内钙离子水平的影响
经过计算得到胞内钙离子浓度ΔF/F:对照组为0.525 4±0.079 73,APETx2 0.1 uM组为0.378 2±0.103 9,APETx2 0.2 uM组为0.343 1±0.041 12,APETx2 1 uM组为0.154 0±0.033 31,APETx2 2 uM组为0。单因素方差分析(P<0.001),2组间t检验:海马组vs APETx2 0.2 uM组(P>0.05);海马组vs APETx2 1 uM组(P=0.012 4);海马组vs APETx2 2 uM组(P<0.01)(图3~4)。
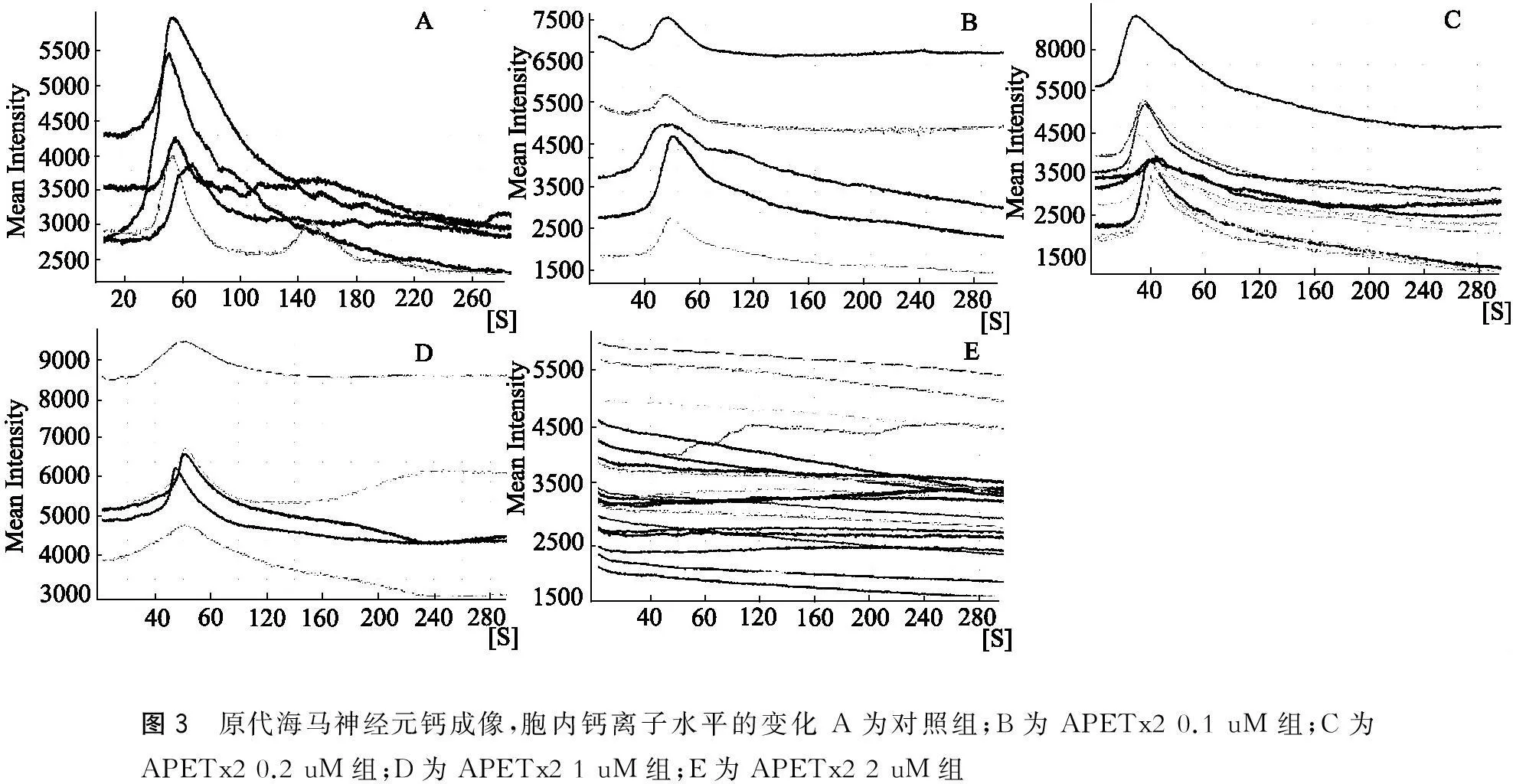
图3 原代海马神经元钙成像,胞内钙离子水平的变化A为对照组;B为APETx20.1uM组;C为APETx20.2uM组;D为APETx21uM组;E为APETx22uM组
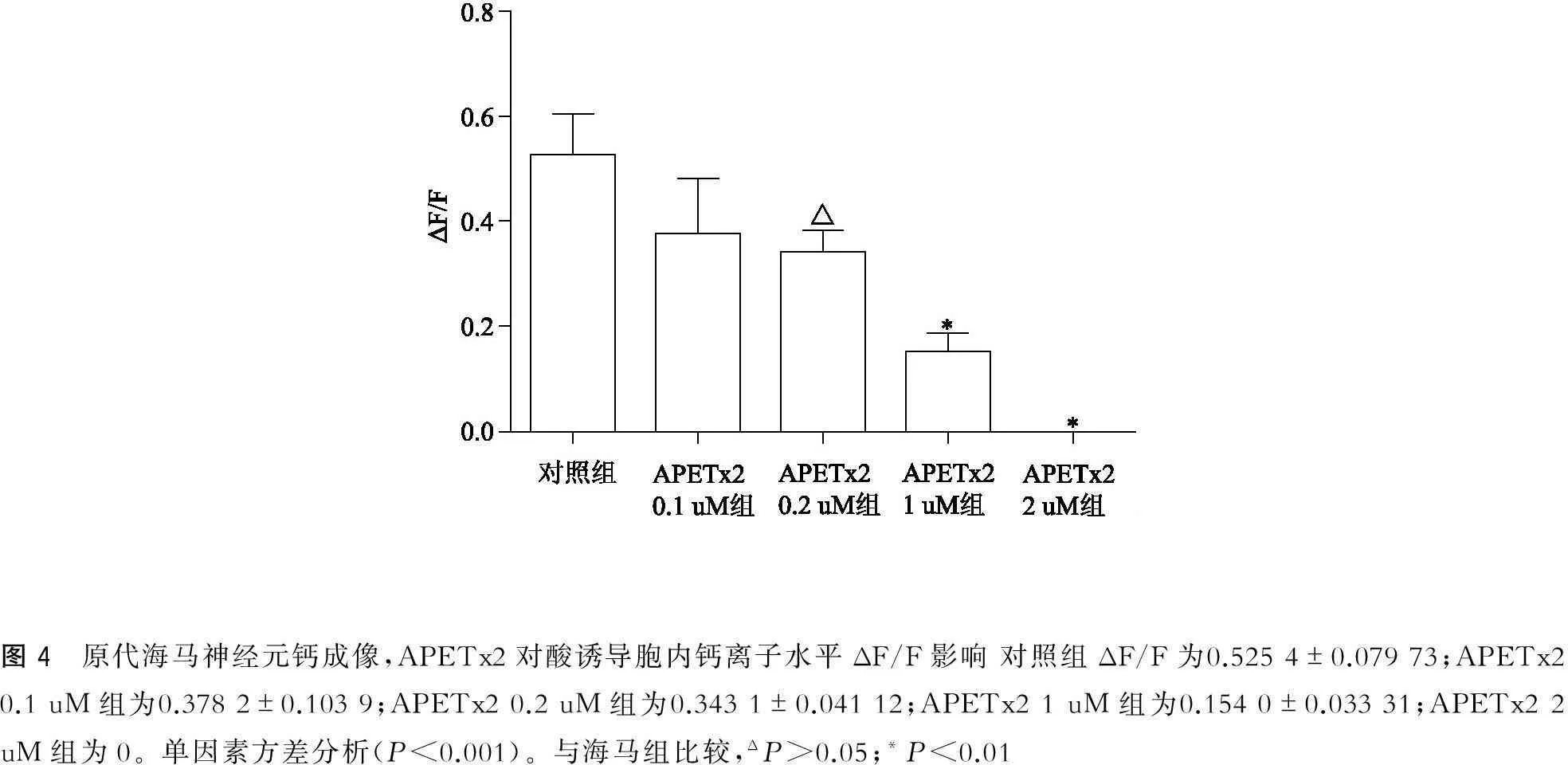
图4 原代海马神经元钙成像,APETx2对酸诱导胞内钙离子水平ΔF/F影响对照组ΔF/F为0.5254±0.07973;APETx20.1uM组为0.3782±0.1039;APETx20.2uM组为0.3431±0.04112;APETx21uM组为0.1540±0.03331;APETx22uM组为0。单因素方差分析(P<0.001)。与海马组比较,ΔP>0.05;*P<0.01
3讨论
癫痫是最常见的慢性脑部疾病之一[3]。癫痫占全球疾病负担的0.75%,WHO已将癫痫作为重大的公共卫生问题[1]。其中颞叶癫痫(TLE)是一种较为常见的局灶性癫痫,70%~80%的患者可发展成为难治性癫痫[4]。颞叶癫痫的病理变化主要有海马硬化及其他病理改变如肿瘤、血管畸形,外伤瘢痕、皮质异位症、发育不良及其他非特异性改变[5]。由于海马的解剖结构和血供的特殊性,其神经兴奋阈值较低,缺血缺氧耐受性差,80%的TLE致痫灶位于颞叶海马,故颞叶癫痫又称为海马癫痫。癫痫的发病机制非常复杂,痫性放电的起始、传播及终止的任一环节均可影响癫痫的发生。氯化锂-匹罗卡品模型与人类颞叶癫痫TLE有着相似的发病形式和分子病理学改变,可用来模拟人类颞叶癫痫TLE模型[6]。
神经元的强烈兴奋和癫痫活动时脑内pH值显著降低时ASICs的激活可能在癫痫的发生维持中有着重要作用[7-10]。酸敏感离子通道(ASICs)是氢离子(质子)配体门控钠通道,属于ENaC(Epithelial sodium channels)/DEG(Degenerins)通道家族,目前研究已发现其4个基因编码的6种亚型,分别是:ASIC1a,ASIC1b,ASIC2a,ASIC2b,ASIC3和 ASIC4。ASIC3是所有ASICs家族中对细胞外pH变化最敏感的,其中位pH仅为6.7[]11。ASIC3还是其家族中唯一一个能产生持续性稳态电流的离子通道[12]。目前已经发现4种ASIC3异聚体[13-14]ASIC1a/ASIC3、ASIC1b/ASIC3、ASIC2a/ASIC3和ASIC3/ASIC2b。ASIC1a、ASIC2a、ASIC2b、ASIC3在海马中均发现有表达,ASIC1b/ASIC3认为主要在外周神经系统参与疼痛调节。Du等[15]在垂体中发现ASIC1b表达,Cao等[16]发现ASIC1b脑干中表达,目前ASIC1b在海马中的表达还未得到证实。ASIC2b作为亚基构成 ASICs异聚体,能够改变离子通道的特性,形成特异性的电流[]17。阿米洛利是ASICs非特异性的阻断,可直接阻断ASICs;PcTX1是ASIC1a特异性的抑制剂,通过门控的调节离子通道对H+的亲和性来改变其失活状态[18]。APETx2 能够可逆性的抑制大鼠ASIC3电流,其中ASIC3/ASIC3中位浓度为63 nM;ASIC2b/ASIC3的中位浓度为117 nM;ASIC1b/ASIC3的中位浓度为0.9 μM;ASIC1a/ASIC3的中位浓度为2 μM;APETx2对ASIC2a-ASIC3无效[19]。
关于癫痫与ASICs的研究目前并不多,梁静静[20]、陈熙明[21]动物实验发现,激活ASIC1a、ASIC3通道可以加重大鼠癫痫发作,而抑制ASIC1a、ASIC3通道可以抑制大鼠癫痫发作。提示ASIC1a或ASIC3可能与癫痫发作起始有关。Biagini G等[2]研究发现,在氯化锂-匹罗卡品诱发的癫痫持续状态动物模型中,ASIC1a 的mRNA在CA1-2区表达降低。Xiong ZG等[22]动物实验中通过脑电图发现,侧脑室注射 PcTX1能够减少红藻氨酸癫痫模型鼠的癫痫活动,在红藻氨酸和戊四氮癫痫模型大鼠癫痫发作程度和易感性均下降;在海马脑片上,持续灌注阿米洛利或者PcTX1能够降低高频电刺激或者无Mg+液体诱发的癫痫样活动的幅度和频率。Ziemann AE等[23]通过脑电图、脑片研究发现敲除 ASIC1a基因小鼠癫痫发作强度增加,癫痫持续状态时间延长,但大发作潜伏期不改变;激活ASIC1a时癫痫发作强度降低,癫痫持续状态时间缩短,大发作潜伏期依然不变。Lin SH等[24]对2000-2014年间ASICs基因敲除进行系统的回顾性研究,ASIC1有3种敲除模型,ASIC3有6种敲除模型,但与癫痫研究相关的只有Ziemann AE的ASIC1a敲除模型。2015年Lin SH等[25]ASIC4敲除模型未发现其对癫痫的影响;作为ASIC4敲除的对照,其进行ASIC1a敲除实验也证实ASIC1a可终止癫痫发作。针对PCTx1与ASIC1a knockout对癫痫发作影响差异,我们推断,PCTx1不能像敲除ASIC1a那样,可以抑制所有ASIC1a的同聚体或异聚体,Chen等[26]发现PcTx1还可激活ASIC1b;同时,ASIC3在其中也发挥了重要作用,因为两者均未考虑ASIC3在癫痫中的作用。故我们通过ASIC3特异性阻断剂探索ASIC3在癫痫中的作用,发现APETx2可抑制氯化锂-匹鲁卡品诱导的癫发作,不论是发作潜伏期,还是发作强度都有明显抑制效果;同时,我们对原代培养的神经元进行钙成像实验,钙成像可以反映一群神经细胞电生理活性,也可看到单个细胞在这群细胞中的行为学变化,有点有面,这一点脑片和单细胞膜片钳是无法比拟的。通过钙成像我们发现APETx2浓度较低时抑制海马神经元钙内流作用较差,其抑制作用随浓度增加而加强,对ASIC3的同聚体或异聚体抑制程度加大、种类增多,故我们认为大剂量APETx2可减少酸诱导的钙内流,降低海马区神经兴奋性,而这种作用可能是ASIC3的同聚体或异聚体所介导的。APETx2通过抑制海马神经元ASIC3同聚体或异聚体介导的离子内流,一方面可以提升膜内外电位差,从而降低海马区神经细胞兴奋性;另一方面减少钙作为信使介导一系列病理生理反应,稳定细胞状态,最终,稳定海马区细胞的痫性放电,达到抗癫痫效果。Cao等[27]研究发现,APETx2使急性大鼠癫痫模型的潜伏期缩短,发作强度增加,这与我们的研究结果不同,Cao等的模型和给药与我们有两处重要的差异,其匹鲁卡品剂量为50 mg/kg,我们实验中发现,30 mg/kg即可引发大鼠癫痫Racine 4级以上发作,我们使用剂量为35 mg/kg;我们侧脑室APETx2的剂量要比Cao高,两者综合的效果,我们不仅抑制了抑制性的中间神经元ASIC3,我们还可能抑制海马区大部分兴奋性的神经细胞群上的ASIC3。故我们猜想,在ASIC3敲除的动物模型的癫痫易感性会下降,发作潜伏期延长和发作强度下降,需要进行证实以验证我们的猜想。有趣的是,Cao等发现的颞叶癫痫患者中ASIC3无论是mRNA还是蛋白表达均增加,大鼠慢性癫痫模型中ASIC3表达也增加,也进一步验证ASIC3是参与癫痫的启动或维持的。
综上所述,APETx2可抑制氯化锂-匹鲁卡品诱导SD大鼠痫性发作,减少酸诱导海马神经元钙离子浓度增加,提升海马区癫痫“阈值”,抑制癫痫的起始及维持。ASIC3或者ASIC3的异聚体可能参与了癫痫的启动或维持。
本研究不足之处,癫痫发作程度依靠行为学评定,简单直观,能配合的脑电图更有说服力;APETx2对ASIC3同聚体和异聚体都有阻断作用,ASIC1a-ASIC3、ASIC2a-ASIC3和ASIC3-ASIC2b、ASIC3-ASIC3在癫痫中谁起主导作用未能明确。故后续研究中可通过电生理手段、基因打靶等技术的应用进行完善以探究癫痫机制,为抗癫痫治疗提供准确靶点。
参考文献
[1]Who. Epilepsy Fact Sheet no 999[R].May 2015.
[2]BIAGINI G, BABINSKI K, AVOLI M, et al. Regional and subunit-specific downregulation of acid-sensing ion channels in the pilocarpine model of epilepsy[J]. Neurobiology of Disease, 2001, 8(1): 45-58.
[3]VEZZANI A, FRENCH J, BARTFAI T, et al. The role of inflammation in epilepsy[J]. Nature Reviews Neurology, 2011, 7(1): 31-40.
[4]SCHMIDT D, L SCHER W. Drug resistance in epilepsy: putative neurobiologic and clinical mechanisms[J]. Epilepsia, 2005, 46(6): 858-877.
[5]KUTLU G, BILIR E, ERDEM A, et al. Temporal lobe ictal behavioral patterns in hippocampal sclerosis and other structural abnormalities[J]. Epilepsy & Behavior: E&B, 2005, 6(3): 353-359.
[6]MAJORES M, SCHOCH S, LIE Ailing, et al. Molecular neuropathology of temporal lobe epilepsy: complementary approaches in animal models and human disease tissue[J]. Epilepsia, 2007, 48(Suppl 2): 4-12.
[7]SIESJ BK, KATSURA K, MELLERG RD P, et al. Acidosis-related brain damage[J]. Progress in Brain Research, 1993, 96: 23-48.
[8]BASSILANA F, CHAMPIGNY G, WALDMANN R, et al. The acid-sensitive Ionic Channel subunit ASIC and the mammalian degenerin MDEG form a heteromultimeric H+-gated Na+ Channel with novel properties[J]. The Journal of Biological Chemistry, 1997, 272(46): 28819-28822.
[9]VUKICEVIC M, KELLENBERGER S. Modulatory effects of acid-sensing ion channels on action potential Generation in hippocampal neurons[J]. American Journal of Physiology-Cell Physiology, 2004, 287(3): C682-C690.
[10]WU Long-jun, DUAN Bo, MEI Yi-de, et al. Characterization of acid-sensing ion channels in dorsal Horn neurons of rat spinal cord[J]. The Journal of Biological Chemistry, 2004, 279(42): 43716-43724.
[11]SUTHERLAND SP, BENSON CJ, ADELMAN JP, et al. Acid-sensing ion Channel 3 matches the acid-gated current in cardiac ischemia-sensing neurons[J]. Proceedings of the National Academy of Sciences of the United States of America, 2001, 98(2): 711-716.
[12]YAGI J, WENK HN, NAVES LA, et al. Sustained currents through ASIC3 ion channels at the modest pH changes that occur during myocardial ischemia[J]. Circulation Research, 2006, 99(5): 501-509.
[13]KUSAMA Nobuyoshi, GAUTAM M, HARDING AM, et al. Acid-sensing ion channels (ASICs) are differentially modulated by anions dependent on their subunit composition[J]. American Journal of Physiology-Cell Physiology, 2013, 304(1): C89-101.
[14]CHEN Xuanmao, PAUKERT M, KADURIN I, et al. Strong modulation by RFamide neuropeptides of the ASIC1b/3 heteromer in competition with extracellular Calcium[J]. Neuropharmacology, 2006, 50(8): 964-974.
[15]DU Jianyang, REZNIKOV LR, WELSH MJ. Expression and activity of acid-sensing ion channels in the mouse anterior pituitary[J]. PLOS One, 2014, 9(12): e115310.
[16]CAO Xing-ling, CHEN Qi, ZHOU Hua, et al. Expression of acid-sensing ion channels in neurons of trapezoid body and lateral paragigantocellular nuclei in rat brain, and effects of intermittent hypoxia on their expression[J]. Sichuan da xue xue bao. Yi xue Ban, 2009, 40(4): 662-666.
[17]GR NDER S, GEISSLER HS, B SSLER EL, et al. A new member of acid-sensing ion channels from pituitary gland[J]. NeuroReport, 2000, 11(8): 1607-1611.
[18]CHEN Xuanmao, KALBACHER H, GR NDER S. The tarantula toxin psalmotoxin 1 inhibits acid-sensing ion Channel (ASIC) 1a by increasing its apparent H+ affinity[J]. The Journal of General Physiology, 2005, 126(1): 71-79.
[19]DIOCHOT S, BARON A, RASH LD, et al. A new sea anemone peptide, APETx2, inhibits ASIC3, a major acid-sensitive Channel in sensory neurons[J]. The EMBO Journal, 2004, 23(7): 1516-1525.
[20]梁静静,冯莹,陈谦学,等.酸感受离子通道激活/抑制对大鼠痫性发作的影响[J].中华实验外科杂志,2012,29(8):1566-1568.
[21]陈煦明,梁静静,潘松青,等.酸感受离子通道及钠氢泵基因表达在痫性发作中的作用研究[J].神经疾病与精神卫生,2013,13(5):440-443.
[22]XIONG Zhi-gang, PIGNATARO G, LI Minghua, et al. Acid-sensing ion channels (ASICs) as pharmacological targets for neurodegenerative diseases[J]. Current Opinion in Pharmacology, 2008, 8(1): 25-32.
[23]ZIEMANN AE, SCHNIZLER MK, ALBERT GW, et al. Seizure termination by acidosis depends on ASIC1a[J]. Nature Neuroscience, 2008, 11(7): 816-822.
[24]LIN SH, SUN WH, CHEN CC. Genetic exploration of the role of acid-sensing ion channels[J]. Neuropharmacology, 2015, 94: 99-118.
[25]LIN SH, CHIEN YC, CHIANG WW, et al. Genetic mapping of ASIC4 and contrasting phenotype to ASIC1a in modulating innate fear and anxiety[J]. The European Journal of Neuroscience, 2015, 41(12): 1553-1568.
[26]CHEN Xuanmao, KALBACHER H, GR NDER S. Interaction of acid-sensing ion Channel (ASIC) 1 with the tarantula toxin psalmotoxin 1 is state dependent[J]. The Journal of General Physiology, 2006, 127(3): 267-276.
[27]CAO Qingqing, WANG Wei, GU Juan, et al. Elevated expression of Acid-Sensing ion Channel 3 inhibits epilepsy via activation of interneurons[J]. Molecular Neurobiology, 2016, 53(1): 485-498.
【DOI】10.3969/j.issn.1007-0478.2016.01.008
Effects of APETX2 on ethology of rat seizures induced by lithium chloride - pilocarpine induced and its mechanism explorationChenKang,KangYuqi,WangYan,etal.DepartmentofNeurology,RenminHospitalofWuhanUniversity,Wuhan430060
【Abstract】ObjectiveTo study the effects of APETX2 on ethology of lithium chloride-pilocarpine induced seizures rat and possible mechanism. MethodsAdult male Specific pathogen Free Sprague Dawley rats (n=18) were randomly divided into two groups after lateral ventricle intubating: APETX2 group (n=9) and control group (n=9). The latencies and severity of epileptic seizure were compared between two groups after building epileptic model. The effects of APETX2 on calcium imaging about primary hippocampal neurons were dynamically observed. ResultsAPETX2 obviously prolonged the latencies of epileptic seizure and reduced seizure degree. Primary hippocampal neurons' calcium imaging inflowing decreased significantly in APETX2 group. ConclusionAPETX2 can inhibit lithium chloride-pilocarpine induced rat seizures. One of its mechanisms may be that APETX2 reduced calcium ion concentration enhancement induced by acid in hippocampal neurons.
【Key words】APETX2EpilepsyEthologyCalcium imagingHippocampus
【中图分类号】R742.1
【文献标识码】A
【文章编号】1007-0478(2016)01-0030-06
基金项目:国家自然科学基金(81471133);湖北省自然科学基金(2014CFB734)
(2015-06-30收稿2015-07-27修回)
