丹参川芎嗪注射液对Aβ损伤的PC12细胞保护作用及机制研究
2016-03-16严钢莉李朝武聂海岭黎逢光成勇毛高峰方煌魏海燕谢军
严钢莉 李朝武 聂海岭 黎逢光 成勇 毛高峰 方煌 魏海燕 谢军
430012 武汉,解放军161医院神经内科
丹参川芎嗪注射液对Aβ损伤的PC12细胞保护作用及机制研究
严钢莉李朝武聂海岭黎逢光成勇毛高峰方煌魏海燕谢军
430012武汉,解放军161医院神经内科
【摘要】目的探讨丹参川芎嗪注射液对Aβ损伤的PC12细胞可能的保护作用及机制。方法将PC12细胞分为5组:空白对照组(未加任何处理药物)、Aβ诱导组(20 μmol/L Aβ处理组)和预处理组(分别加入浓度为5 ml/L、10 ml/L、20 ml/L的丹参川芎嗪注射液孵育24 h后加20 μmol/L Aβ),通过CCK-8法检测细胞增殖活性,流式细胞术(FCM)检测细胞凋亡率,Hoechst 33258染色观察PC12细胞核的改变,荧光分光光度计测定LDH、SOD、GSH及caspase-3活性水平,免疫组织化学方法观察细胞色素C(Cyt-C)蛋白释放水平,Western Blot检测Bcl-2的表达水平。结果丹参川芎嗪注射液(5、10、20 ml/L)预处理对Aβ诱导的PC12细胞损伤有较好的保护作用,其保护作用随着药物浓度的增加而增强。它能增加Aβ损伤的PC12细胞增殖活力,减少Aβ诱导的PC12细胞凋亡,降低细胞核凝聚现象,抑制Aβ损伤的PC12细胞LDH释放,增强SOD和GSH活性,促进Cyt-C在细胞内表达,降低caspase-3活性,促进Bcl-2的表达。结论丹参川芎嗪注射液对Aβ诱导的PC12细胞损伤具有与线粒体通路相关的保护作用,其保护作用与它抑制细胞凋亡、抗氧化应激、维持线粒体正常功能、抑制caspase-3的激活、促进抗凋亡因子Bcl-2的表达有关。
【关键词】丹参川芎嗪注射液AβPC12细胞凋亡神经保护
阿尔兹海默病(Alzheimer,s disease,AD)是较常见的中老年神经系统退行性疾病,主要表现为进行性记忆能力下降、认知功能障碍和精神行为的异常,严重影响患者的生活质量。AD在老年期痴呆中发病率最高,约占痴呆患者的50%~60%。随着人口老龄化的加速,AD的发病率呈逐年上升趋势[1]。
尸检发现,AD患者脑内神经细胞出现大量凋亡、神经元细胞外老年斑沉积和胞内神经元纤维缠结(neurofibrillary tangles,NFT),其主要是由于β-淀粉样蛋白(β amyloid protein, Aβ)、自由基、兴奋性氨基酸、神经毒素、Ca2+超载、炎症等有害因子的共同作用所致[2-3]。因此,国内外均有将Aβ诱导具有神经元细胞特性的PC12细胞作为病体外AD细胞模型[4]。
近年国内有报道证实川芎嗪、丹参素均具有神经保护作用,可参与神经组织修复。川芎嗪的化学结构为四甲基吡嗪(TMP),可透过血脑屏障,通过阻滞钙离子通道、清除氧自由基、影响内皮素和NO合成等对中枢神经系统产生多种作用,具有扩张血管、抑制血小板聚集、改善微循环、抗脂质氧化等作用[5-6]。丹参素可改善脑损伤所致的线粒体氧化磷酸化功能障碍,抑制脑损伤对线粒体的损害;丹参素还可以稳定线粒体膜电位(MMP),调节神经元的能量代谢抑制其凋亡[7-8]。
本研究拟以Aβ诱导PC12细胞损伤建立AD细胞模型,通过细胞生物学、分子生物学等实验技术进行深入研究,探讨丹参川芎嗪注射液对Aβ诱导PC12细胞损伤的可能保护作用及机制,为AD防治提供新的治疗途径。
1材料与方法
1.1试剂
丹参川芎嗪注射液(贵州拜特制药有限公司,含盐酸川芎嗪100 mg与丹参素2 mg);Aβ25-35(美国Sigma公司),-20℃保存,使用前7 d用去离子水配置(终浓度1 mmol/L)置于37℃水浴箱孵育;高糖培养基(DMEM)、胎牛血清(FBS)(美国Gibco公司);AnnexinV-FITC、PI(碘化丙啶)、CCK-8、Hoechst 33258(上海碧云天生物公司);LDH、SOD、GSH测试盒、caspase-3试剂盒(上海宸凛生物公司),Cyt-C抗体、Bc1-2抗体、GAPDH抗体(艾博抗上海贸易有限公司)。
1.2细胞培养及处理
PC12细胞为大鼠肾上腺嗜铬细胞瘤细胞株,购于中国科学院上海细胞生物学研究所,使用含10% FBS+100 U/ml青霉素的DMEM 5% CO237℃培养箱孵育。待细胞在培养皿内生长密度达单层70%,0.25%胰蛋白酶常规消化,细胞传代培养。按实验要求确定细胞的接种密度。PC12细胞分组如下:(1)空白对照组未加任何处理药物;(2)Aβ诱导组加入Aβ 20 μmol/L处理;(3)预处理组分别加入终浓度为5、10、20 ml/L的丹参川芎嗪注射液孵育24 h后再加入Aβ 20 μmol/L。同批实验,每组设置3个复孔。所有的实验在相同的条件下重复3次。
1.3细胞增殖活力测定
CCK-8测定各组细胞活力。取对数生长期细胞,以1.6×103/孔种植于96孔板。细胞分组处理后,每孔加入1 ul的CCK-8溶液,37℃下孵育1 h,酶联免疫检测仪570 nm处测量每孔的吸光度值。细胞活力以与空白组相比的百分比表示。
1.4FCM检测
PC12细胞以2.5×105/mL的密度接种于60 mm培养皿,分组处理后收集,1500 r/min离心7 min,弃上清,预冷的PBS溶液冲洗沉淀2次,将细胞密度调整为1×106/mL;70%冰乙醇悬浮细胞4℃固定过夜,1500 r/min 4℃离心10 min,PBS冲洗沉淀2次,细胞重新悬浮于1 mL的结合缓冲液,加入AnnexinV-FITC 10 μL、PI 5 μL,4℃避光孵育30 min,即刻上机检测。PI用氩离子激发荧光,激发光波波长488 nm,发射光波波长大于630 nm,流式细胞仪检测分析。
1.5细胞核染色检测
PC12细胞接种于盖玻片,按分组要求处理,预冷的PBS漂洗细胞2次,4%多聚甲醛 4℃包埋45 min,PBS冲洗后加入Hoechst 33258溶液(10 μg/mL),室温避光放置5 min,用含抗荧光衰退功能的介质包埋,荧光显微镜观察拍照。正常的细胞核为弥漫且均匀的低强度荧光;凋亡的细胞核为浓染致密的固缩形态或者发出颗粒样荧光。凋亡率=凋亡细胞/总细胞数×100%。
1.6LDH、SOD、GSH活力测定
PC12细胞按1~2×105/孔接种于24孔板中,分组处理后PBS冲洗,1500 r/min离心7 min,收集细胞,预冷的PBS冲洗,悬浮于0.5 ml的缓冲液,4℃ 3000 r/min离心17 min。取上层液,使用全自动定量酶标仪分别在波长440 nm、550 nm、412 nm处进行LDH、SOD及GSH活力测定,活力值使用标准曲线计算。
1.7caspase-3 酶活性检测
按照Caspase-3试剂盒说明书操作。细胞分组处理后收集细胞,悬浮于细胞裂解缓冲液(25 μL/106个细胞),冰上裂解10 min,4℃ 15000 r/min离心17 min,50 μL上清液、148 μL结合缓冲液(含DMSO 2 μL、0.1 mM DTT 10 μL)、2 μL DEVD-pNA(caspase-3显色底物)混合后加入96孔黑板,避光孵育4 h。酶标仪于波长405 nm处检测吸光光度值。
1.8Cyt-C免疫细胞化学染色
PC12细胞常规爬片、药物处理后,用预冷的PBS漂洗细胞3 min×2次,再次清洗、固定及封闭,加入1∶100的一抗,4℃过夜。用辣根过氧化物酶标记的1∶100的二抗室温孵育30 min,PBS冲洗3 min×3次;加入SABC复合物37℃孵育15 min,PBS冲洗3 min×3次;DAB显色后使用苏木素复染、乙醇梯度脱水、二甲苯透明,最后封片观察。光镜下观察。
1.9Western blotting
各组细胞裂解后提取总蛋白,根据申能博彩BCA法测定蛋白水平,蛋白进行定量后将上样蛋白配置为每孔70 ug/10 uL。SDS-PAGE凝胶电泳分离,转膜,脱脂牛奶封闭,室温封闭1 h,加入一抗(1∶500),4℃过夜。第2 d加入二抗HRP(1∶500),室温1 h,洗涤3次后,使用ABI Veriti显影、拍照。
1.10统计学处理
2结果
2.1丹参川芎嗪注射液对Aβ引起的PC12细胞增殖活力的影响
与未处理的空白组(空白对照组)PC12细胞比较,5、10、15、20、25、30 μmol/L剂量组细胞活力分别下降了19.3%、30.4%、56.5%、26.9%、19.7%(P<0.05)(图1A)。与Aβ组比较,5、10、20 ml/L丹参川芎嗪注射液预处理组(预处理组)细胞活性分别上升16.2%、30.4%、36.6%(P<0.05)(图2)。
2.2丹参川芎嗪注射液对Aβ损伤的PC12细胞凋亡率的影响
空白对照组大多为正常活细胞,凋亡细胞占16.8%;Aβ 15 μmol/L处理后凋亡细胞增加至56.4%(P<0.05);丹参川芎嗪注射液(5、10、20 ml/L)预处理组凋亡细胞数目减少,分别为34.0% (P<0.05)、23.2%(P>0.05)和19.2%(P>0.05)。与Aβ诱导组比较,丹参川芎嗪注射液(5、10、20 ml/L)预处理组凋亡率分别增加22.4%、33.2%、37.2%(P<0.05)(图2)。

图1 PC12细胞活力 A为不同浓度Aβ对PC12细胞活力影响;B为不同水平丹参川芎嗪注射液对Aβ损伤的PC12细胞活力影响;与空白对照组比较,*P<0.05;与Aβ诱导组比较,#P<0.05

图2 PC12细胞凋亡率 与空白对照组比较,*P<0.05,与空白对照组比较,ΔP>0.05;与Aβ诱导组比较,#P<0.05
2.3丹参川芎嗪注射液对Aβ损伤的PC12细胞核的影响
空白对照组细胞保持正常活性细胞的细胞核状态(图3A);Aβ诱导组中大多数PC12细胞发生凋亡,出现细胞核凝聚、DNA断裂 (图3B)。丹参川芎嗪注射液预处理组(10 ml/L)PC12细胞核凝聚现象较Aβ诱导组明显减弱,即凋亡细胞减少,活性细胞数目增多(图3C)。
2.4丹参川芎嗪注射液对Aβ损伤的PC12细胞的LDH、GSH、SOD活力的影响
与空白对照组比较,Aβ诱导组LDH释放增加,SOD、GSH活性下降,P<0.05;与Aβ诱导组比较,丹参川芎嗪注射液(5、10、20 ml/L)预处理组LDH释放减少,而SOD和GSH活性明显升高,且该改变与丹参川芎嗪注射液水平有关(P<0.05)(图4)。
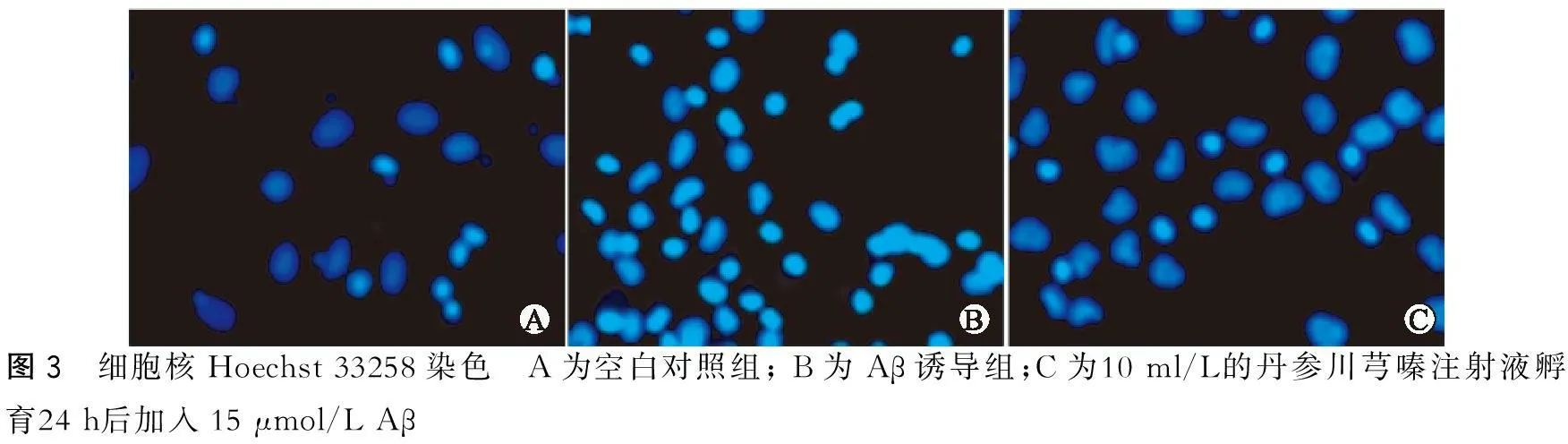
图3 细胞核Hoechst33258染色 A为空白对照组;B为Aβ诱导组;C为10ml/L的丹参川芎嗪注射液孵育24h后加入15μmol/LAβ
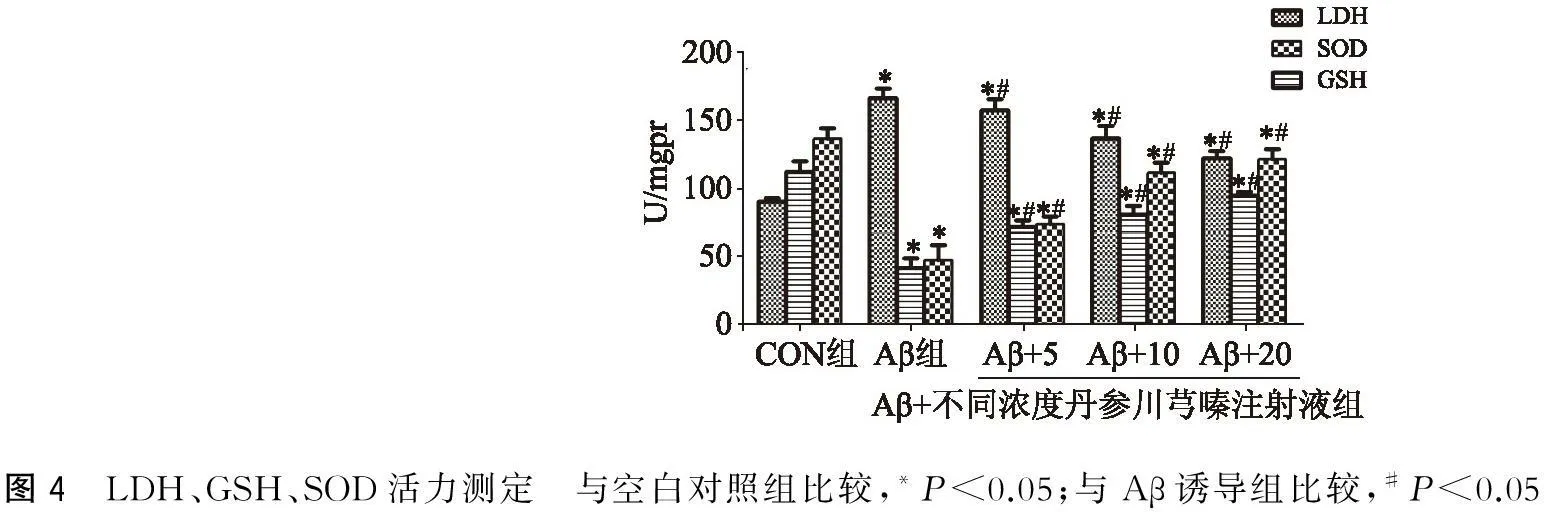
图4 LDH、GSH、SOD活力测定 与空白对照组比较,*P<0.05;与Aβ诱导组比较,#P<0.05
2.5丹参川芎嗪注射液对Aβ损伤的PC12细胞Cyt-C免疫活性影响
空白对照组细胞形态良好,Cyt-C免疫化学染色呈淡棕黄色,均匀分布于胞质及突起内;Aβ诱导组部分细胞变圆、皱缩,Cyt-C在细胞内表达增强,呈深棕黄色;相对于Aβ诱导组,丹参川芎嗪注射液预处理组Cyt-C在细胞内着色变浅,细胞形态结构也有改善(图5)。
2.6丹参川芎嗪注射液对Aβ损伤的PC12细胞caspase-3活性的影响
与空白对照组比较,Aβ诱导组、丹参川芎嗪注射液(5、10 ml/L)预处理组细胞caspase-3活性升高(P<0.05),丹参川芎嗪注射液(20 ml/L)预处理组细胞caspase-3活性变化不显著(P>0.05)。与Aβ诱导组比较,丹参川芎嗪注射液(5、10、20 ml/L)预处理组细胞caspase-3活性明显下降(P<0.05),且下降程度与丹参川芎嗪水平有关(图6)。

图5 Cyt-C免疫组织化学化染色 A为空白对照组;B为Aβ诱导组;C为10ml/L的丹参川芎嗪注射液孵育24h后加入15umol/LAβ
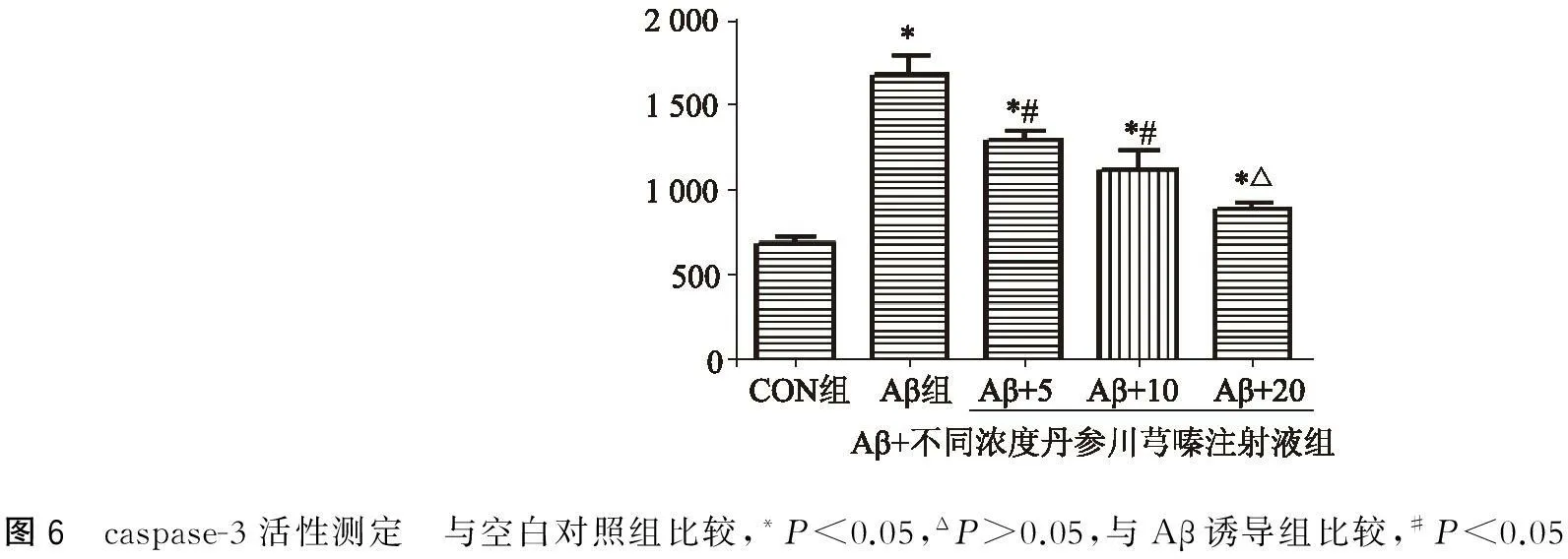
图6 caspase-3活性测定 与空白对照组比较,*P<0.05,ΔP>0.05,与Aβ诱导组比较,#P<0.05
2.7丹参川芎嗪注射液对Aβ损伤的PC12细胞Bcl-2的影响
与空白对照组比较,Aβ诱导组和丹参川芎嗪预处理组Bcl-2的表达水平均出现下降(P<0.05)。与Aβ诱导组比较,丹参川芎嗪注射液(5 ml/L)预处理组Bcl-2的表达水平差异不明显(P>0.05);丹参川芎嗪注射液(10、20 ml/L)预处理组Bcl-2的表达水平显著增加,其增加幅度随丹参川芎嗪注射液的药物水平增加而增加(P<0.05)(图7)。
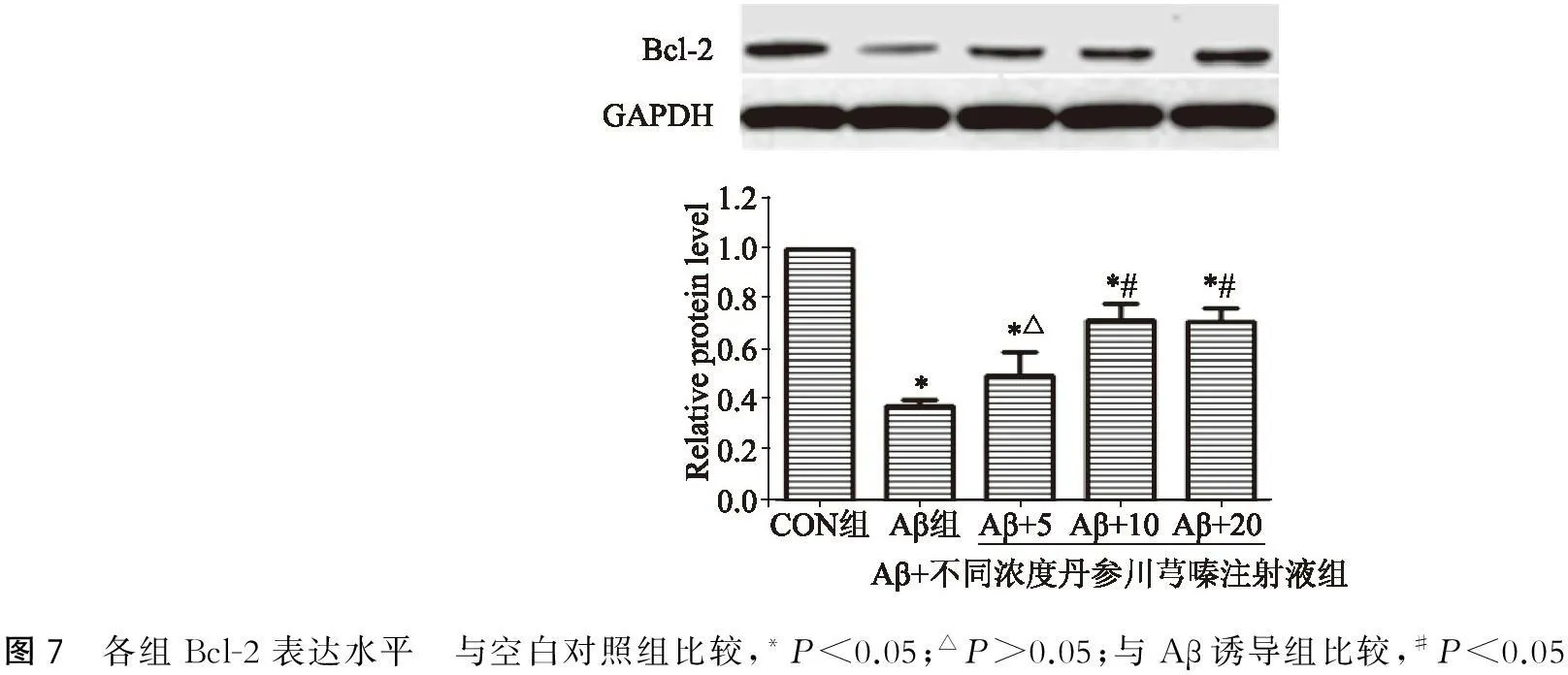
图7 各组Bcl-2表达水平 与空白对照组比较,*P<0.05;△P>0.05;与Aβ诱导组比较,#P<0.05
3讨论
尽管近些年来生物化学、分子生物学、流行病学、遗传学等学科发展使我们更进一步认识AD,但对AD的病因和发病机理还存在很多不明因素。通常认为AD是多基因遗传疾病,发病原因与年龄、性别、能量代谢障碍、免疫功能异常、内分泌、感染等遗传和环境因素有关。在各种AD发病学中β淀粉样蛋白学说、氧化应激学说、神经递质代谢障碍学说是AD发生发展普遍公认的机制。最近研究提示,Aβ可与N-甲基-D-天冬氨酸受体(N-methyl-D-aspartic acid receptor, NMDA受体)结合,从神经细胞外转运到胞内,再与A单体装配形成寡聚体Aβ,进一步促进tau蛋白的过度磷酸化和神经原纤维缠结(neurofibrillary tangles,NFT),引起胞内Ca2+超载、线粒体氧化损伤及氧化应激[9-11]。
本实验结果发现与Aβ诱导组比较,丹参川芎嗪注射液孵育后细胞增殖活力增加、凋亡减少,表明Aβ诱导的细胞损伤受到丹参川芎嗪注射液的抑制。同时本研究发现丹参川芎嗪注射液孵育后受损细胞的SOD、GSH活性提高,而LDH的释放减少。该结果表明丹参川芎嗪注射液的神经元保护作用与细胞内的氧化应激反应相关联,其可以激活细胞内的抗氧化系统的防御反应,清除异常增多的活性氧成分。
很多研究显示,在神经退行性疾病患者的海马区存在有caspases蛋白的活化。Caspases为半胱氨酸蛋白酶家族,在启动神经元异常凋亡途径中有重要影响,因此是AD发病的主要途径之一[12-13],其中Caspase-3被认为是促进细胞死亡的较为常见的细胞内蛋白酶。内源性内质网和线粒体的凋亡途径亦在细胞凋亡过程中起其关键性作用[14-15]。多种刺激因子如淀粉样蛋白β、肿瘤坏死因子α、活性氧、化学治疗、DNA损伤剂和辐射等均能损伤线粒体,增加线粒体膜通透性(MOMP),促进因子如Cyt-C、Omi等从线粒体内释放到细胞液,直接或间接启动Caspases相关凋亡途径[16-18]。Bcl-2家族是线粒体凋亡的重要调控因子。Bcl-2能改变MOMP,减少凋亡促进因子的释放[19];Bcl-2能降低BAX介导的Cyt-C释放、抑制Caspase激活、抑制凋亡诱导蛋白(AIF)从线粒体转移到细胞核[20-21]。同时Bcl-2还能促进氧化应激下的DNA修复[22]。因此,本研究可以认为抑制Caspases激活、促进凋亡抑制蛋白Bcl-2的高表达可减少细胞凋亡,促进受损神经元细胞的功能恢复。
本研究发现,Aβ损伤PC12细胞后Caspase-3活性明显增强,细胞核出现凝聚,Cyt-C表达增强,而丹参川芎嗪注射液预处理后Caspase-3活性被显著抑制,细胞核凝聚现象改善,Cyt-C表达减少,凋亡抑制因子Bcl-2的表达量随着丹参川芎嗪注射液水平增加而增加。该结果说明丹参川芎嗪注射液预处理对PC12细胞的神经保护作用可能通过抑制Caspases-3活性、改善MMOP、促进Bcl-2表达等途径实现。
综上所述,丹参川芎嗪注射液具有强大的抗氧化、抗凋亡活性,对Aβ诱导的神经元损伤有着多重的保护作用,也许可以用来治疗如AD等神经变性疾病。
参考文献
[1]Bames DE,Yaffe K.The projected effect of risk factor reduction on Alzheimer’s disease prevalence[J].Lancet Neurol,2011,10(9):819-828.
[2]Matveev SV,Spielmann HP,Metts BM,et al.A distinct subfraction of Aβ is responsible for the high-affinity Pittsburgh compound B-binding site in Alzheimer’s disease brain[J].J Neurochem,2014,131(3):356-368.
[3]Veerhuis R.Histological and direct evidence for the role of complement in the neuroinflammation of AD[J].Curr Alzheimer Res,2011,8(1):34-58.
[4]Ma B,Meng X,Wang J,et al.Notoginsenoside R1 attenuates amyloid-β-induced damage in neurons by inhibiting reactive Oxygen species and modulating MAPK activation[J].Int Immunopharmacol,2014,22(1):151-159.
[5]温旭敏,魏涛,白利萍,等.川芎嗪对H2O2诱导PC12细胞凋亡的保护作用研究[J].中国药物与临床,2013,13(1):25-27.
[6]纳鑫,汪雪兰,皮荣标.川芎嗪对中枢神经系统的药理作用及其机制的研究进展[J].中药新药与临床药理,2008,19(1):77-80.
[7]殷明伟,王利枝,蒋燕,等.七味中药对酒精致PC12细胞保护作用的研究[J].时珍国医国药,2012,23(7):1602-1604.
[8]Meng XF,Zou XJ,Peng B,et al.Inhibition of ethanol-induced toxicity by tanshinone IIA in PC12 cells[J].Acta Pharmacol Sin,2006,27(6):659-664.
[9]Salazar-Weber NL,Smith JP.Copper inhibits NMDA Receptor-lndependent LTP and modulates the Paired-Pulse ratio after LTP in mouse hippocampal slices[J].Int J Alzheimers Dis,2011,2011:864753.
[10]Chohan MO,Iqbal K.From tau to toxicity: emerging roles of NMDA receptor in Alzheimer's disease[J].J Alzheimers Dis,2006,10(1):81-87.
[11]Pohanka M.Alzheimer′s disease and oxidative stress:a review[J].Curr Med Chem,2013,21(3):356-364.
[12]Lee S,Shea TB.Caspase-mediated truncation of tau potentiates aggregation[J].Int J Alzheimers Dis,2012:731063.
[13]Rohn TT,Head E.Caspase activation in Alzheimer's disease: early to rise and late to bed[J].Rev Neurosci,2008,19(6):383-393.
[14]Luo DJ,Feng Q,Wang ZH,et al.Knockdown of phosphotyrosyl phosphatase activator induces apoptosis via mitochondrial pathway and the attenuation by simultaneous tau hyperphosphorylation[J].J Neurochem,2014,130(6):816-825.
[15]Yan MH,Wang X,Zhu X.Mitochondrial defects and oxidative stress in Alzheimer disease and Parkinson disease[J].Free Radic Biol Med,2013,62:90-101.
[16]Krajewski S,Bodrug S,Krajewska M,et al.Immunohistochemical analysis of Mcl-1 protein in human tissues. Differential regulation of Mcl-1 and Bcl-2 protein production suggests a unique role for Mcl-1 in control of programmed cell death in vivo[J].Am J Pathol,1995,146(6):1309-1319.
[17]Naderi J,Somayajulu-Nitu M,Mukerji A,et al.Water-soluble formulation of Coenzyme Q10 inhibits Bax-induced destabilization of mitochondria in mammalian cells[J].Apoptosis,2006,11(8):1359-1369.
[18]Verma YK,Gangenahalli GU,Singh VK,et al.Cell death regulation by B-cell lymphoma protein[J].Apoptosis,2006,11(4):459-471.
[19]Liu J,Li ZS,Wan XJ,et al.Expression and function of apoptosis-related genes Bcl-2/Bax and Fas/Fas L in the course of stress ulcer[J].Zhonghua Yi Xue Za Zhi,2003,83(6):504-509.
[20]Cui S,Sun Y,Liu C.Effect of bushenyisui formula on brain tissue apoptosis and Bcl-2 in beta-amyloid protein-induced Alzheimer's disease rat models[J].Journal of Traditional Chinese Medicine,2012,32(4):646-650.
[21]Onyango I,Khan S,Miller B,et al.Mitochondrial genomic contribution to mitochondrial dysfunction in Alzheimer's disease[J].J Alzheimers Dis,2006,9(2):183-193.
[22]Onyango I,Khan S,Miller B,et al.Mitochondrial genomic contribution to mitochondrial dysfunction in Alzheimer's disease[J].J Alzheimers Dis,2006,9(2):183-193.
(2015-09-07收稿)
【DOI】10.3969/j.issn.1007-0478.2016.01.005
Protective effects and mechanism of salvia and TMP injection on Aβ-induced injury in PC12 cellsYanGangli,LiChaowu,NieHailing,etal.DepartmentofNeurology,TheChinesePLA161thHospital,Wuhan430012
【Abstract】ObjectiveTo observe the possible protective effect and mechanism of Salvia and TMP injection on Aβ-induced injury in PC12 cells.MethodsPC12 cells were divided into five groups: control gruop, Aβ-induced Injury in PC12 cells (Treatment with 20 μmol/L Aβ alone); Pretreatment group ( Pretreatment with 5ml/L, 10ml/L, 20 ml/L Salvia and TMP Injection on Aβ-induced Injury in PC12 cells). Then the cell viability was measured by CKK-8, apoptotic rate was measured by flow cytometry, variation of nucleus was measured by Hoechst33258 dye, and the vitality of LDH, SOD, GSH and caspase-3 were measured by the kits, respectively. Immunohistochemical method was used to observe Cyt-C protein release. And western blot was used to detecting Bcl-2 protein expression.ResultsSalvia and TMP injection (5,10,20 μmol/L) pretreatment can protect the PC12 cells injuried by Aβ which protective effect was increased with higher drug concentration. Salvia and TMP injection can promote cells proliferation, reduces apoptosis and nuclei condensation, inhibit LDH release, increase SOD, GSH activation, decrease caspase-3 activation, help Cyt-C and Bcl-2 generation.ConclusionSalvia and TMP injection have neuroprotective effect of PC12 cells induced by Aβ which was related with anti-oxidative stress, maintenance of mitochondrial function, improvement of the anti-apoptotic factor Bcl-2 and inhibition of caspase-3 activation. Salvia and TMP injection may be used to cure neurodegenerative disease such as AD.
【Key words】Alvia and TMP injectionAβPC12 cellsApoptosisNeuroprotection
【中图分类号】R741
【文献标识码】A
【文章编号】1007-0478(2016)01-0015-06
基金项目:湖北省卫计委科研基金资助项目(批准号WJ2015MB130)
