蜡样芽孢杆菌培养条件的优化及其溶藻方式的研究*
2016-03-13李文利刘征宇陆雅雅章忠辉李晓晖
李文利 刘征宇 陆雅雅 章忠辉 李晓晖
(上海海洋大学上海水产品加工及贮藏工程技术研究中心,上海 201306)
水体富营养化导致蓝藻水华的爆发日趋频繁,严重破坏了水生生态系统,危及人类和水生生物的健康。常用的除藻方法包括物理法、化学法和生物法[1-2]。物理法除藻最为方便可行,效果也比较显著,对于紧急处理时有很好的成效,但成本过高,治标不治本;化学法除藻通过向水体中投加化学药剂,能快速杀死藻细胞,但大多数化学药剂有毒,易造成二次污染;生物法除藻是目前来说操作最简单、成本最低、对环境最安全的方法[3-5]。溶藻细菌是一类能通过直接接触藻细胞或间接分泌胞外代谢产物来抑制藻类生长,甚至溶解藻细胞、杀死藻类的细菌的统称[6]。溶藻细菌治理蓝藻水华是生物除藻的一种方式[7-8]。
本研究从太湖水华水域分离得到一株蜡样芽孢杆菌(Bacilluscereus),是一种有效的溶藻细菌。在单因素实验的基础上,进行响应面实验设计,通过优化培养温度、转速、装瓶量、接种量、发酵时间等培养条件,并根据实际情况进行调整,得到蜡样芽孢杆菌的最佳培养条件,从而提高溶藻细菌培养液对铜绿微囊藻905(Microcystisaeruginosa905)的清除能力。
1 材料与方法
1.1 材 料
1.1.1 藻种和菌种
铜绿微囊藻905购自中国科学院野生生物种质库——淡水藻种库,转种到新鲜的BG11培养基后在温度为25 ℃、光照强度为2 000 lx、光暗比为14 h∶10 h的条件下培养[9]。
蜡样芽孢杆菌从太湖水华水域分离得到并经鉴定确认。
1.1.2 培养基
蔗糖6.5 g/L、酵母膏13 g/L、NaCl 0.5 g/L、K3PO40.5 g/L、MgSO4·3H2O 0.5 g/L、FeSO4·7H2O 0.2 g/L、CaCl20.15 g/L、MnSO40.5 g/L,调pH=8.2。
1.1.3 主要仪器
智能型光照培养箱(SPX-250PG);紫外—可见分光光度计(SQ-UV2300);光学显微镜(奥林巴斯,CX21);多管架自动平衡离心机(TDZ5-WS)等。
1.2 方 法
1.2.1 溶藻实验
蜡样芽孢杆菌经过营养琼脂活化后接种在新鲜的培养基中,在37 ℃、180 r/min的条件下发酵12 h。发酵液经4 000 r/min离心10 min后,取上清液0.5 mL与对数生长期的铜绿微囊藻905藻液4.5 mL混合,同时取0.5 mL无菌的培养基与生长对数期的铜绿微囊藻905藻液4.5 mL混合后作为对照(T0),放置在温度为25 ℃、光照强度为2 000 lx、光暗比为14 h∶10 h的条件下培养5 d。
1.2.2 铜绿微囊藻905生物量的测定
用光学显微镜视野计数法测定铜绿微囊藻905的藻细胞浓度[10]。
铜绿微囊藻905中含有叶绿素a,因此在超声振荡的条件下使铜绿微囊藻905藻细胞破碎释放出叶绿素a,也可以用叶绿素a的浓度间接表征铜绿微囊藻905的生物量。叶绿素a的测定方法:用丙酮在低温黑暗条件下萃取待测培养液12 h后离心,取上清液分别在 630、647、664、750 nm波长下测定吸光度,根据式(1)计算叶绿素a的浓度[11]。
c=11.85(A664-A750)-1.54(A647-A750)-0.08(A630-A750)
(1)
式中,c为叶绿素a的质量浓度,mg/L;A630、A647、A664、A750分别为630、647、664、750 nm波长下的吸光度。
通过清除率来评价蜡样芽孢杆菌的溶藻效率,计算公式见式(2)。
η=(1-ce/cc)×100%
(2)
式中,η为藻细胞或叶绿素a的清除率,%;ce为实验组的藻细胞浓度或叶绿素a质量浓度,单位根据实际情况确定;cc为对照组的藻细胞浓度或叶绿素a质量浓度,单位根据实际情况确定。
1.2.3 单因素实验
将活化好的蜡样芽孢杆菌接种在250 mL锥形瓶中培养,对培养温度、转速、装瓶量、接种量、发酵时间进行单因素实验。研究培养温度对叶绿素a清除率的影响时,控制转速为180 r/min、装瓶量为50 mL、接种量为4%、发酵时间为12 h,培养温度设置为27、32、37、42、47 ℃;研究转速对叶绿素a清除率的影响时,控制培养温度为37 ℃、装瓶量为50 mL、接种量为4%、发酵时间为12 h,转速设置为60、100、140、180、220 r/min;研究装瓶量对叶绿素a清除率的影响时,控制培养温度为37 ℃、转速为180 r/min、接种量为4%、发酵时间为12 h,装瓶量设置为25、50、75、100、125 mL;研究接种量对叶绿素a清除率的影响时,控制培养温度为37 ℃、转速为180 r/min、装瓶量为50 mL、发酵时间为12 h,接种量设置为2%、4%、6%、8%、10%;研究发酵时间对叶绿素a清除率的影响时,控制培养温度为37 ℃、转速为180 r/min、装瓶量为50 mL、接种量为4%,发酵时间设置为4、6、8、10、12 h。
1.2.4 响应面实验设计
在单因素实验的基础上,选择培养温度(X1)、转速(X2)和发酵时间(X3)3个主要因素再进一步采用Box-Behnken中心组合设计进行3因素3水平响应面实验,综合考虑因素间的交互作用。利用Design-Export 8.0软件,根据Box-Behnken中心组合设计原理设计的因素水平表见表1。

表1 因素与水平表
1.2.5 蜡样芽孢杆菌的溶藻方式探究
为探讨蜡样芽孢杆菌的溶藻方式,对其培养液进行如下处理:(1)用 121 ℃、103.4 kPa高温高压灭菌20 min,记为T1;(2)用0.2 μm滤膜过滤,记为T2;(3)用12 000 r/min的转速离心1 min,记为T3;(4) 用250 W超声振荡15 min,记为T4;(5)不做任何处理,记为T5。将上述处理的培养液再按照1.2.1的溶藻实验进行溶藻方式探究[12]。
2 结 果
2.1 蜡样芽孢杆菌培养条件的单因素优化
蜡样芽孢杆菌培养条件的单因素优化实验结果如图1所示。由图1(a)可见,37 ℃时蜡样芽孢杆菌对铜绿微囊藻905的叶绿素a清除率最高达92.30%,温度过高或过低都会影响溶藻效果;图1(b)显示,转速为60~180 r/min时,蜡样芽孢杆菌对铜绿微囊藻905的叶绿素a清除率随转速的升高而升高,180 r/min时叶绿素a清除率达到最高(89.92%),转速为220 r/min时叶绿素a清除率反而有所降低;装瓶量通过影响发酵过程的通气量而影响蜡样芽孢杆菌对铜绿微囊藻905的叶绿素a清除率,图1(c)结果显示,当装瓶量为75 mL时叶绿素a清除率最高(90.53%);从图1(d)可以看出,蜡样芽孢杆菌接种量为2%(体积分数,下同)~6%时,铜绿微囊藻905的叶绿素a清除率随接种量增加而升高,当接种量达到6%以后,叶绿素a清除率基本保持不变;图1(e)为发酵时间对铜绿微囊藻905的叶绿素a清除率的影响,随着发酵时间的延长叶绿素a清除率先升高后降低,发酵时间为8 h时叶绿素a清除率最高(91.97%)。
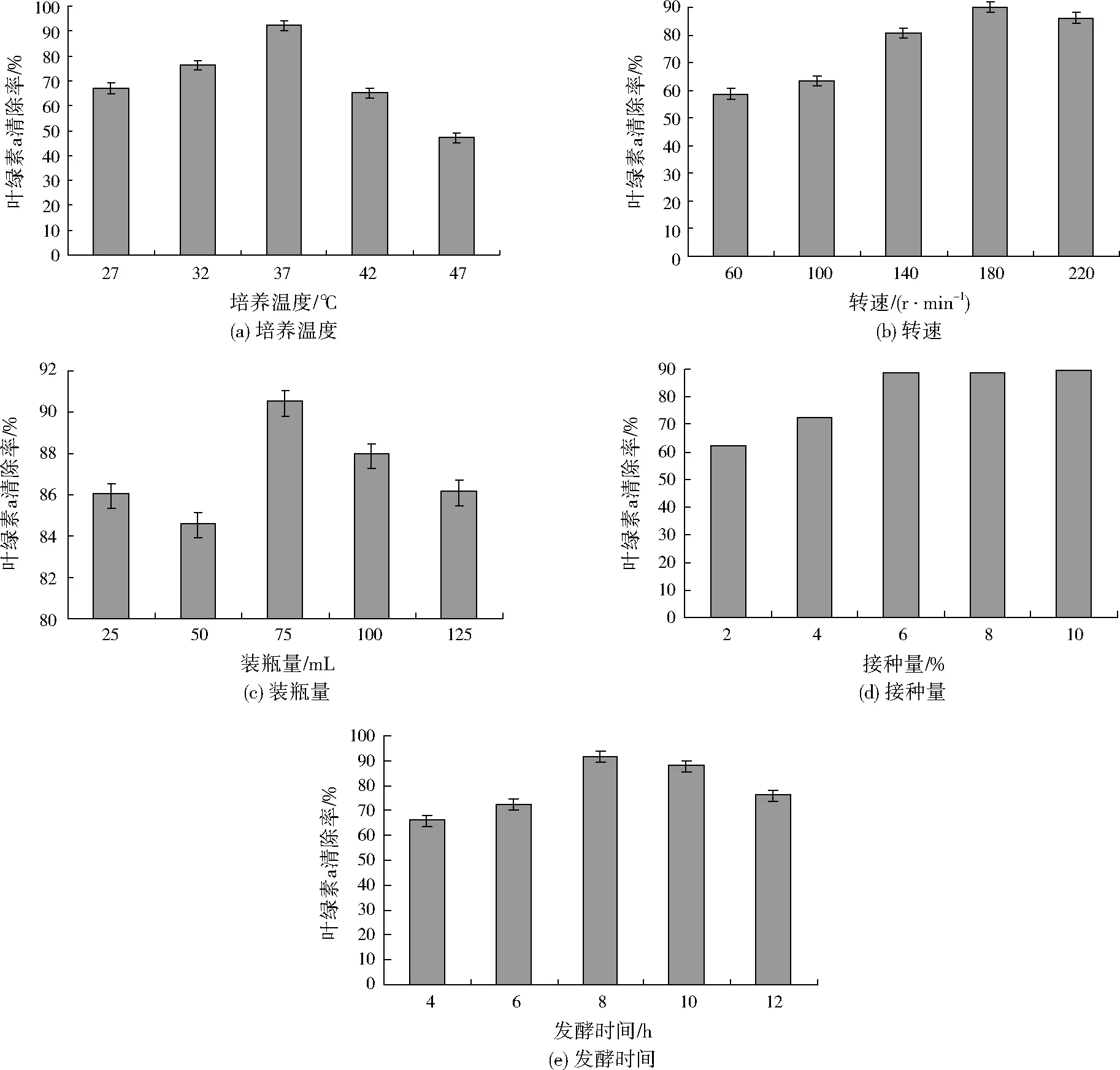
图1 单因素实验结果Fig.1 The results of the single factor experiments
根据单因素实验结果,蜡样芽孢杆菌在培养温度为37 ℃、转速为180 r/min、装瓶量为75 mL、接种量为6%、发酵时间为8 h的条件下对叶绿素a的清除率最高。
2.2 响应面实验设计与结果
响应面实验设计及相应叶绿素a清除率结果见表2,以叶绿素a清除率(Y)为因变量得到二次回归方程如式(3)所示,并对各变量的回归系数进行显著性分析(见表3)。

(3)
从表4可知,响应面实验设计得到的回归模型P<0.000 1,失拟的P=0.681 3,因此回归模型高度显著(P≤0.05),但失拟检验不显著(P>0.05);蜡样芽孢杆菌菌株培养条件优化的回归模型的校正决定系数R2(adj)为0.939 8,说明模型能解释约93.98%的总变异;决定系数R2为0.968 3,说明模型拟合程度良好,误差较小,可以用来分析和预测蜡样芽孢杆菌培养条件的优化情况。
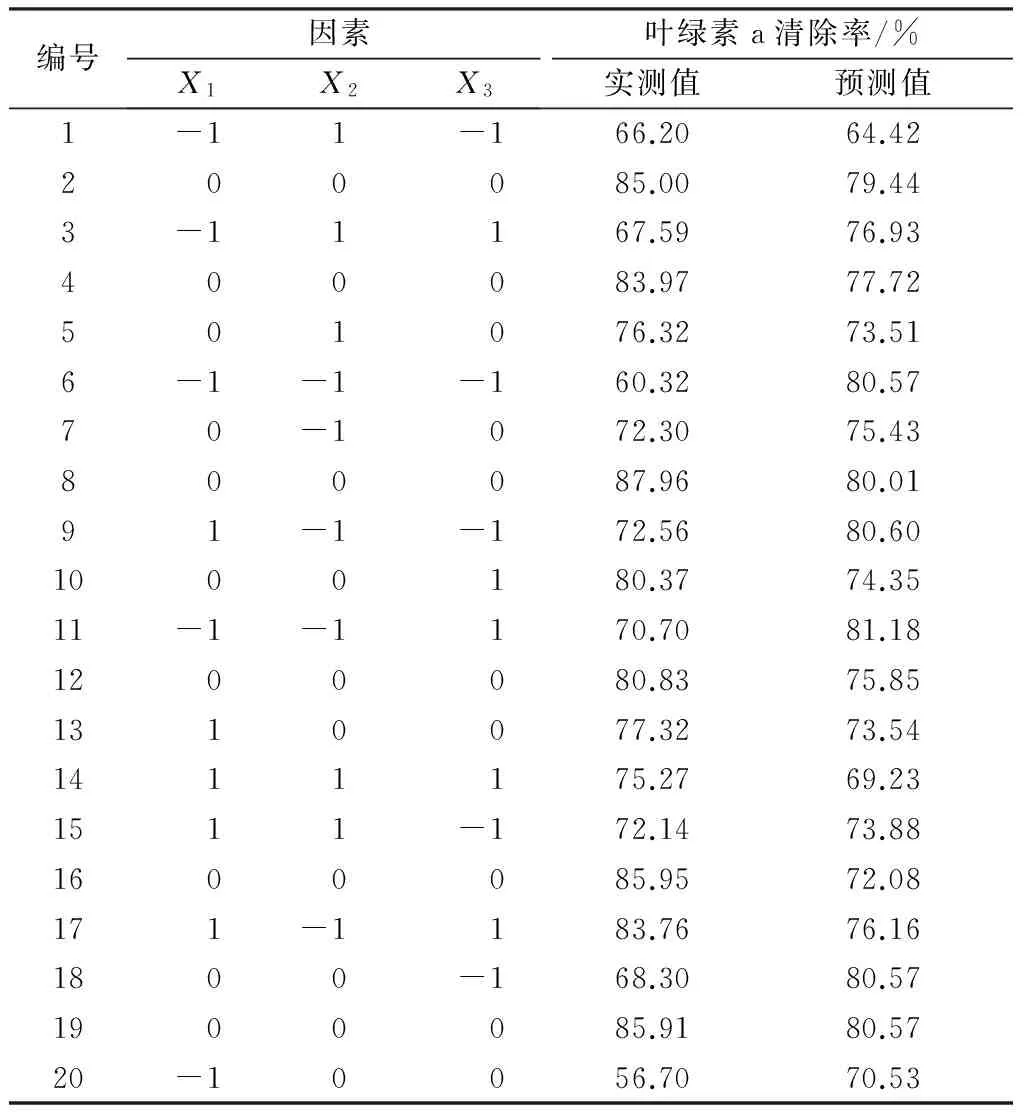
表2 响应面实验设计及相应叶绿素a清除率结果
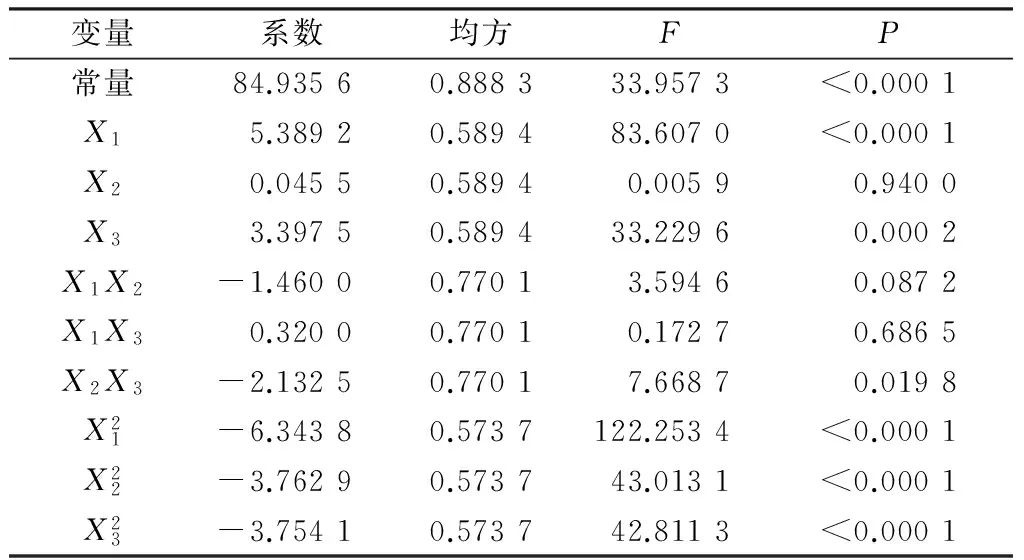
表3 回归系数的显著性分析
最终,Design-Expert 8.0软件的预测结果为:培养温度39.35 ℃,转速170.40 r/min,发酵时间9.08 h。考虑到实际条件的可控制性,把最佳培养条件修正为:接种量6%、装瓶量75 mL、培养温度39 ℃、转速170 r/min、发酵时间为9 h,此时叶绿素a清除率为86.72%。
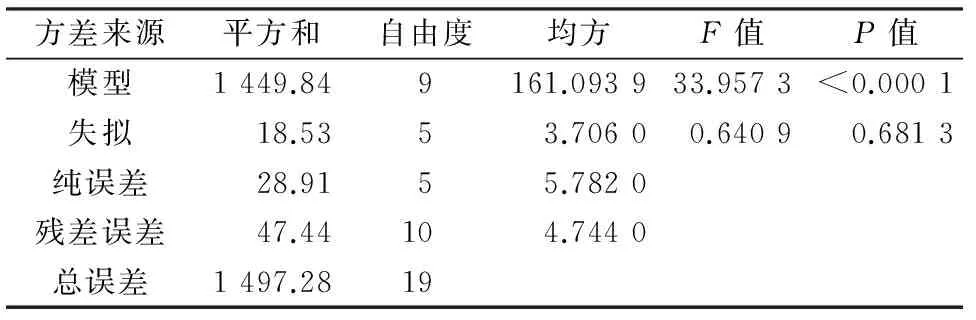
表4 回归模型的方差分析1)
注:1)模型R2(adj)=0.939 8,R2=0.968 3。
2.3 蜡样芽孢杆菌的溶藻方式探究
溶藻方式的探究结果见表5,除T4的藻细胞清除率较低外,T1~T3处理方式与T5几乎没有差别,而蜡状芽孢杆菌耐高温性较差,经高温处理后细胞已经失活[13],由此可以初步判断蜡状芽孢杆菌可能通过分泌一种耐高温的代谢产物或是细胞外物质来抑制铜绿微囊藻905的生长,溶藻方式属于间接溶藻,超声振荡可能会破坏这种代谢产物或细胞外物质。

表5 溶藻方式的研究结果
3 讨 论
微囊藻是蓝藻水华的优势藻类,其中以铜绿微囊藻最具代表性,会产生对人体有害的微囊藻毒素[14]。利用溶藻细菌治理蓝藻水华已经成为研究的热点和趋势。溶藻细菌的溶藻方式分为直接溶藻和间接溶藻[15-16]。直接溶藻是指溶藻细菌与藻细胞直接接触,通过破坏藻细胞的结构达到溶藻效果;间接溶藻是指溶藻细菌通过分泌代谢产物或细胞外物质来抑制藻类的生长,如抗生素、多肽、蛋白质等。崔亚青等[17]从太湖水域分离得到一株水单胞菌属的溶藻细菌,菌体无溶藻作用,主要是通过代谢产物达到溶藻的效果,与本研究发现的蜡样芽胞杆菌的溶藻方式一致,属于间接溶藻细菌,但其溶藻效果不稳定、溶藻效率较低。微生物生长和代谢与很多因素有关,如培养温度、发酵时间、接种量等[18]。因此,徐长安等[19]对溶藻细菌的培养温度、发酵时间、接种量等发酵条件进行了单因素优化实验,结果发现,发酵条件对溶藻效果影响显著。许珂等[20]利用单因素实验和正交实验对溶藻细菌的发酵条件进行优化,溶藻效率提高了10倍。因此,对溶藻细菌培养条件进行优化是必要的。
4 结 论
蜡样芽胞杆菌的最佳培养条件为培养温度39 ℃、转速170 r/min、装瓶量75 mL、接种量6%、发酵时间为9 h,叶绿素a清除效率可达86.72%;通过溶藻方式的探究,可以初步判断蜡样芽孢杆菌是通过分泌一种耐高温的代谢产物或是细胞外物质来抑制铜绿微囊藻905生长的,溶藻方式属于间接溶藻,超声波处理可能会破坏这种代谢产物或细胞外物质。
[1] 刘勇,黄志宇,陆屹,等.水体富营养化及其防治措施研究进展[J].玉溪师范学院学报,2004,20(8):63-65.
[2] BRICKER S B,LONGSTAFF B,DENNISON W,et al.Effects of nutrient enrichment in the nation’s estuaries:a decade of change[J].Harmful Algae,2008,8(1):21-32.
[3] CHEN Yuwei,QIN Baoqiang,TEUBNER K,et al.Long-term dynamics of phytoplankton assemblages:microcystis-domination in Lake Taihu,a large shallow lake in China[J].Journal of Plankton Research,2003,25(4):445-453.
[4] GANNON D,MCCABE E,CAMILLERI S A,et al.Effects ofKareniabrevisharmful algal blooms on near shore fish communities in southwest Florida[J].Marine Ecology Progress,2009,378(12):171-186.
[5] CARMICHAEL W.A world overview - one-hundred-twenty-seven years of research on toxic bacterial - where do we go from here?[J].Advances in Experimental Medicine and Biology,2011,10(7):2643-2654.
[6] WANG Ganlin,LI Junsheng,CHANG Bing,et al.Monitoring bacterial-dominant algal blooms in eutrophicated Taihu Lake in China with synthetic aperture radar images[J].Chinese Journal of Oceanology and Immunology,2015,33(1):139-148.
[7] CHEN Jun,XIE Ping,MA Zhinei,et al.A systematic study on spatial and seasonal patterns of eight taste and odor compounds with relation to various biotic and abiotic parameters in Gonghu Bay of Lake Taihu,China[J].Science of the Total Environment,2010,409(2):314-325.
[8] BALL A,WILLIAMS M,VINCENT D,et al.Algal growth control by a barley straw extract[J].Bioresource Technology,2001,77(2):177-181.
[9] HU Xi,LIU Yunguo,ZENG Guangming,et al.Effects of limonene stress on the growth of and microcystin release by the freshwater cyanobacteriumMicrocystisaeruginosaFACHB-905[J].Ecotoxicology and Environmental Safety,2014,105(1):121-127.
[10] 常显波,张鹏,杨启霞,等.一株高效溶藻放线菌的分离及溶藻特性的研究[J].安徽农业科学,2012,40(23):11545-11546.
[11] TIAN Chuan,LIU Xianglong,TAN Jing,et al.Isolation,identification and characterization of an algicidal bacterium from Lake Taihu and preliminary studies on its algicidal compounds[J].Journal of Environmental Sciences,2012,24(10):1823-1831.
[12] GUMBO J,CLOETE T.The mechanism ofMicrocystisaeruginosadeath upon exposure toBacillusmycoides[J].Physics and Chemistry of the Earth,2011,36(4):881-886.
[13] 何月英,曾德年,胡仕凤,等.蜡状芽孢杆菌的分离培养与鉴定[J].湖南农业大学学报,2005,31(2):203-205.
[14] 孔繁翔,高光.大型浅水富营养化湖泊中蓝藻水华形成机理的思考[J].生态学报,2005,25(3):589-595.
[15] 魏雅冬,王双侠,戴明,等.溶藻细菌溶藻活性物质的研究进展[J].黑龙江科学,2011,2(3):45-47.
[16] WEN M C,FU S S,SHI Y S.Novel L-amino acid oxidase with algicidal activity against toxic cyanobacteriumMicrocystisaeruginosasynthesized by a bacteriumAquimarinasp.[J].Enzyme and Microbial Technology,2011,49(4):372-379.
[17] 崔亚青,雍晓雨,张风革,等.一株溶藻细菌的分离鉴定及溶藻效果[J].应用与环境生物学报,2012,18(5):752-760.
[18] 肖海群.脂肪酶产生菌的选育及其发酵条件的研究[D].南昌:南昌大学,2007.
[19] 徐长安,罗秀针,俞超超.海洋源生防细菌LHB02的筛选、鉴定及其抑菌谱检测[J].海洋与湖沼,2011,42(2):284-288.
[20] 许珂,吴刚,余文平,等.溶藻细菌W5培养条件优化及发酵培养[J].环境科学与技术,2009,32(2):12-15.
