化学淋洗对铅锌复合污染土壤微生物与酶活性的影响研究*
2016-03-13苏耀明陈志良谭映宇雷国建方晓航
苏耀明 陈志良# 谭映宇 雷国建 方晓航
(1.环境保护部华南环境科学研究所,广东 广州 510655;2.浙江省环境保护科学设计研究院,浙江 杭州 310007)
土壤微生物在土壤环境中发挥着重要作用[1]。由于土壤矿物和微生物的相互作用可改变矿物表面性质和微生物酶活性,进而影响土壤肥力等环境效应[2]。因此,土壤微生物及其酶活性可以反映土壤质量、土壤肥力的演变,并可用作评价土壤健康的生物指标[3-4]。重金属污染土壤修复会导致土壤微生物、酶活性发生重要变化。在重金属污染土壤修复技术中,化学淋洗被认为是一种修复能力很高的技术。乙二胺四乙酸二钠(EDTA-Na2)是一种常用的淋洗剂,对大多数重金属均有较好的螯合作用。但是EDTA-Na2单剂(以下简称单剂)不能有效解决土壤中多种重金属复合污染的问题,还会对土壤理化性质产生不可逆转的破坏作用。近年来,采用EDTA-Na2与不同类型的表面活性剂混合作为淋洗剂的研究较多[5-7]。茶皂素作为一种天然的生物表面活性剂,因其毒性低、可生物降解、生产成本低等优点而越来越受到关注[8]。本研究比较了超纯水单剂、EDTA-Na2与茶皂素混合剂(以下简称混合剂)作为淋洗剂,对铅锌复合污染土壤化学淋洗后土壤微生物与酶活性的影响。
1 材料与方法
1.1 土壤样本采集
实验用土壤样本采自某铅锌矿尾矿库区污染土壤,分上层(0~30 cm)、中层(30~60 cm)、下层(60~100 cm)分别采样,并分袋装好。土壤样本在实验室自然风干,剔除其中的植物残体、石块、沙粒等杂物,磨碎后过2 mm尼龙筛,保存备用。
1.2 实验设计
土壤淋洗装置由加药装置、淋洗柱和淋洗液接受盒3部分组成。其中加药装置包括加药桶和计量泵,控制淋洗液的流量。淋洗柱采用优质有机玻璃圆管制成,柱体内径为25 cm,高为130 cm,底部用厚度为2 cm的有机玻璃网格板支撑并进行防水设计,柱身从底部开始每隔10 cm设置土壤样品采样孔,位于上层、中层、下层的采样孔采集的土壤样品混合后进行分析。淋洗液接受盒为40 cm×35 cm×30 cm的有机玻璃长方体盒。将1.1中采集的下层、中层、上层土壤样本依次由下往上填充,每层填充厚度为30 cm。淋洗剂由加药装置从淋洗柱上方进行加药。
单剂的EDTA-Na2摩尔浓度为0.09 mol/L,pH调节为3.0±0.1。混合剂的EDTA-Na2摩尔浓度为0.04 mol/L,按溶液质量的1%添加茶皂素,pH调节为4.0±0.1。同时,用超纯水作为对照淋洗剂。淋洗剂流量控制为12 L/h,每间隔1 h在淋洗柱采样孔中分层采集土柱中的土壤样品,测定土壤微生物和酶活性及其他指标。
1.3 分析方法
称取10 g土壤样本置于50 mL烧杯中,加入25 mL超纯水,搅拌混匀5 min,静置60 min后用校正过的pH计(PHSP-3F型)测定土壤pH。
土壤中的铅、锌浓度采用HF-HClO4-HNO3法消解,火焰原子吸收分光光度计(岛津AA-7000)测定;土壤有机质根据《土壤检测 第6部分:土壤有机质的测定》(NY/T 1121.6—2006)的要求测定;速效磷根据《酸性土壤有效磷的测定》(NY/T 1121.7—2006)方法测定;硝态氮采用酚二磺酸比色法测定。
土壤真菌、细菌、放线菌、微生物总量等微生物指标以及过氧化氢酶、脲酶、蔗糖酶等土壤酶活性指标根据《土壤微生物生物量测定方法及其应用》[9]的方法测定。
2 结果与讨论
2.1 土壤样本铅、锌污染状况
土壤样本中铅和锌的浓度及超标倍数如表1所示。所采集的上层、中层、下层土壤样本铅、锌浓度均超过了《土壤环境质量标准》(GB 15618—1995)的二级标准(pH<6.5)。不同深度的土壤样本铅、锌浓度表现为从上层到下层逐渐降低的趋势。上层铅超标倍数为3.14倍,锌超标倍数为3.19倍。因此,以下研究主要针对上层土壤。
2.2 化学淋洗对土壤理化性质的影响
上层土壤样品的pH、有机质、速效磷和硝态氮经超纯水、单剂和混合剂化学淋洗后的变化情况如表2所示。
从表2可见,超纯水淋洗后土壤pH升高,由4.26变为5.36,而单剂和混合剂淋洗后pH分别降低到3.25和3.78;有机质的变化情况表现为超纯水淋洗后有机质由3.1 g/kg降低为2.9 g/kg,而单剂和混合剂淋洗后土壤有机质升高到了3.8、4.6 g/kg;速效磷的变化情况表现为3种淋洗剂均导致速效磷有所降低;3种淋洗剂也使土壤中的硝态氮均有降低。
2.3 化学淋洗对铅、锌的去除效果对比
化学淋洗后上层土壤样品中铅、锌去除率的变化分别见图1和图2。

表1 土壤样本中铅、锌污染状况
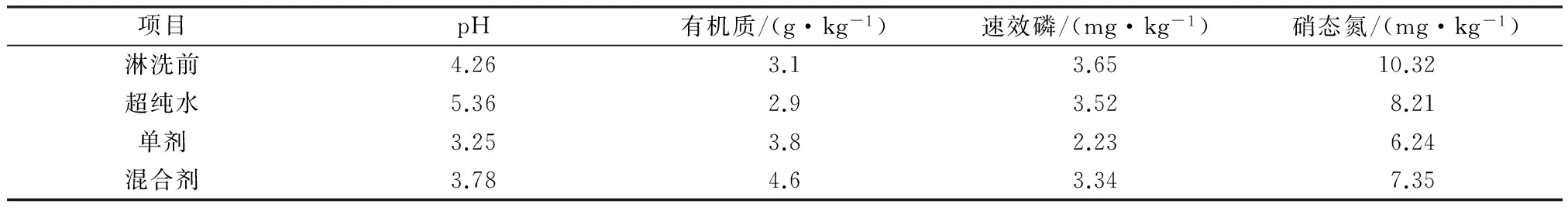
表2 淋洗剂对上层土壤样品理化性质量的影响
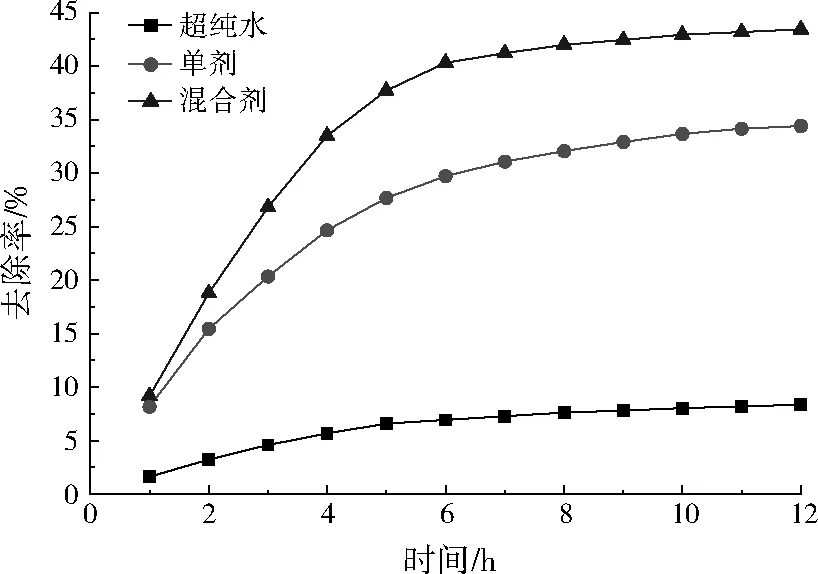
图1 化学淋洗对土壤中铅的去除率Fig.1 The removal rate of Pb in soil by chemical washing
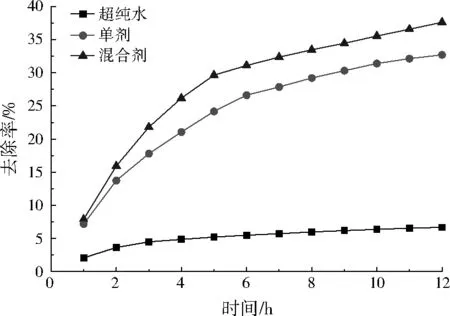
图2 化学淋洗对土壤中锌的去除率Fig.2 The removal rate of Zn in soil by chemical washing
从图1可以看出,超纯水对土壤中铅的淋洗效果较差,去除率小于10%。单剂对土壤中铅的去除率在前6 h提升明显,6 h后去除率基本稳定在30%左右,至12 h时去除率最高达到34.41%。在相同处理时间的条件下,混合剂比单剂的去除率更高,并且混合剂的稳定时间更短。混合剂对土壤中铅的去除率在前5 h即达到了37.71%,12 h时去除率最高可达到43.44%。
从图2可以看出,超纯水对土壤中锌的淋洗效果也差,去除率小于10%。单剂对土壤中锌的去除率在6 h时达到26.62%,提升趋势显著,此后去除率提升趋于平缓,12 h时去除率最大达到32.70%。混合剂对土壤中锌的去除率在6 h时为31.10%,明显高于单剂,6 h后去除率提升变慢但仍有提升,12 h时达到最大为37.62%。
2.4 化学淋洗对土壤微生物的影响
土壤微生物作为土壤的重要组成部分,可以很好地反映土壤中各种生物化学过程的动向和强度[10]。土壤微生物可以敏感地反映土壤环境的微小变化,很多研究表明,土壤微生物与动、植物相比对重金属污染更具敏感性[11]。超纯水、单剂和混合剂对土柱中土壤化学淋洗后,上层土壤样品中真菌、细菌、放线菌、微生物总量的变化如图3所示。
化学淋洗前真菌生物量为5.2×104cfu/g,超纯水淋洗后土壤中真菌生物量降低到4.7×104cfu/g,变化不大;单剂、混合剂淋洗后土壤中真菌生物量显著增加,尤其是混合剂淋洗后真菌生物量提高了近30倍,达到1.7×106cfu/g。
化学淋洗对土壤细菌的影响表现为:超纯水淋洗后土壤中细菌生物量从9.7×105cfu/g升高到了1.1×106cfu/g,影响不大;单剂淋洗后土壤中细菌生物量急剧下降至1.0×105cfu/g,说明EDTA-Na2淋洗对土壤细菌的影响较大;混合剂淋洗后的细菌生物量略有升高,说明添加茶皂素能有效缓解EDTA-Na2对细菌的影响。
放线菌的生物量变化与真菌和细菌均不相同。超纯水淋洗后放线菌生物量增加,单剂对放线菌生物量的变化影响不大,而混合剂淋洗后放线菌生物量急剧减少。混合剂淋洗对放线菌生物量减少的原因分析,可能是由于真菌竞争性生长,抑制了放线菌。
微生物总量的变化与细菌基本一致。因此,EDTA-Na2中适量添加茶皂素不仅可以提高重金属的去除率,还能有效改善土壤微生物的生物量。
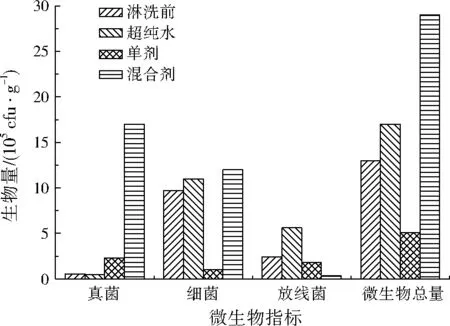
图3 化学淋洗对土壤中微生物生物量的影响Fig.3 Effect of chemical washing on the biomass of micro-organisms in soil
2.5 化学淋洗对土壤酶活性的影响
超纯水、单剂、混合剂对土柱中土壤化学淋洗后,上层土壤样品中过氧化氢酶、脲酶、蔗糖酶的变化情况如表3所示。

表3 化学淋洗对土壤酶活性的影响
过氧化氢酶是参与土壤中物质和能量转化的一种重要的氧化还原酶,能促进生物代谢中间产物过氧化氢的分解,缓解其对生物的毒害作用。过氧化氢酶活性在一定程度上反映了土壤生物化学过程氧化还原能力的大小。与淋洗前相比,超纯水淋洗后过氧化氢酶略有升高;混合剂淋洗后过氧化氢酶活性略有降低;单剂淋洗后过氧化氢酶的活性急剧下降。对比单剂和混合剂对过氧化氢酶活性的影响可知,茶皂素可以很好地缓解EDTA-Na2对过氧化氢酶活性的影响。
脲酶的作用是催化进入土壤的尿素迅速分解成二氧化碳和氨,所以脲酶活性过高对土壤肥力和作物生长是不利的。从表3来看,只有混合剂淋洗后脲酶活性是降低的,超纯水和单剂淋洗后脲酶活性略有提高,但是3种淋洗剂对土壤中脲酶活性影响都不大。
蔗糖酶可以把土壤中的蔗糖分子分解成能够被植物和微生物利用的葡萄糖和果糖,其活性反映了土壤有机碳的累积与分解转化规律。从表3可以看出,单剂和混合剂淋洗后蔗糖酶活性提高,特别是混合剂淋洗后蔗糖酶活性大大提高。
相关研究表明,土壤酶活性与土壤微生物、土壤污染状况和土壤理化性质等因素有关[12-13]。综合分析不同淋洗剂淋洗前后土壤酶活性的变化可以发现:超纯水淋洗可以增加土壤湿度,但由于对土壤中重金属去除率较差,土壤酶活性仍然受到抑制作用,因此土壤酶活性变化不明显;单剂淋洗后重金属浓度降低,土壤脲酶和蔗糖酶活性略有提升,但由于淋洗后土壤pH下降,过氧化氢酶活性明显受到抑制;由于茶皂素可以为微生物提供营养,因此真菌等微生物的生物量明显增加,由于土壤中的酶很大一部分是由土壤微生物分泌的,因此混合剂淋洗后土壤酶活性明显提升。
3 结 论
(1) 在相同处理条件下,混合剂对铅和锌的去除率比单剂高。混合剂对土壤中铅的去除率最高达到43.44%,对锌的去除率最高为37.62%。
(2) 化学淋洗对土壤微生物影响表现为:单剂能在一定程度上促进土壤中的真菌生长,混合剂中的茶皂素能进一步增加土壤中真菌的生物量;单剂导致细菌生物量显著下降,但混合剂能缓解EDTA-Na2对细菌的影响;微生物总量与细菌的变化规律基本一致;单剂对放线菌的影响不大,但超纯水能促进放线菌生物量的增加,而混合剂导致放线菌生物量减少。
(3) 单剂对过氧化氢酶活性有抑制作用,但混合剂中的茶皂素可以缓解EDTA-Na2对过氧化氢酶活性的影响;3种淋洗剂均对土壤中脲酶活性影响不大;单剂和混合剂都能提高蔗糖酶活性,尤其是混合剂。
[1] 宋长青,吴金水,陆雅海,等.中国土壤微生物学研究10年回顾[J].地球科学进展,2013,28(10):1087-1105.
[2] DIACONO M,MONTEMURRO F.Long term effects of organic amendment on soil fertility:a review[J].Agronomy for Sustainable Development,2010,30(2):401-422.
[3] NIELSEN U N,AYRES E,WALL D H,et al.Soil biodiversity and carbon cycling:a review and synthesis of studies examining diversity function relationships[J].European Journal of Soil Science,2011,62(1):105-116.
[4] LESSARD I,RENELLA G,SAUVÉ S,et al.Metal toxicity assessment in soils using enzymatic activity:can water be used as a surrogate buffer?[J].Soil Biology and Biochemistry,2013,57(3):256-263.
[5] DERMONT G,BERGERON M,MERCIER G,et al.Soil washing for metal removal:a review of physical/chemical technologies and field applications[J].Journal of Hazardous Materials,2008,152(1):1-31.
[6] MAKINO T,SUGAHARA K,SAKURAI Y,et al.Remediation of cadmium contamination in paddy soils by washing with chemicals:selection of washing chemicals[J].Environmental Pollution,2006,144(1):2-10.
[7] 赵娜,崔岩山,付彧,等.乙二胺四乙酸(EDTA)和乙二胺二琥珀酸(EDDS)对污染土壤中Cd、Pb的浸提效果及其风险评估[J].环境化学,2011,30(5):958-963.
[8] 曲蛟,罗春秋,丛俏,等.表面活性剂对土壤中重金属清洗及有效态的影响[J].环境化学,2012,31(5):620-624.
[9] 吴金水.土壤微生物生物量测定方法及其应用[M].北京:气象出版社,2006.
[10] 杜瑞英,柏珺,王诗忠,等.多金属污染土壤中微生物群落功能对麻疯树化学联合修复的响应[J].环境科学学报,2011,31(3):2369-2376.
[11] 马莹,骆永明,滕应,等.内生细菌强化重金属污染土壤植物修复研究进展[J].土壤学报,2013,50(1):195-202.
[12] 和文祥,朱铭莪,张一平.土壤酶与重金属关系的研究现状[J].土壤与环境,2000,9(2):139-142.
[13] 丁菡,胡海波,王人潮.半干旱区土壤酶活性与其理化及微生物的关系[J].南京林业大学学报(自然科学版),2007,31(2):13-18.
