河口水体中溶解性物质对氟喹诺酮光解速率常数的影响*
2016-03-13崔飞飞乔显亮张亚南陈景文
崔飞飞 乔显亮 罗 翔 张亚南 谢 晴 陈景文
(大连理工大学环境学院,工业生态与环境工程教育部重点实验室,辽宁 大连 116024)
氟喹诺酮(FQs)作为一类使用量很大的高效广谱抗生素,在水产、畜牧养殖和人类医疗中广泛应用,已成为一类新型的环境微污染物而备受关注[1]。据报道,在渤海湾和海河的表层水中,FQs的检出率分别达到55.5%、100.0%[2]。欧洲和东南亚地区的淡水中也有FQs被检出,检出质量浓度为0.5~6 500.0 ng/L[3]。由于FQs的持续大量使用和排放,使其在环境中持续存在,表现出“假”持久性[4],[5]35,并且可以诱导抗药细菌和人体抗性基因(qnrS)[6]的产生,对生态环境和人体健康构成威胁。
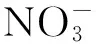

图1 9种FQs的分子结构Fig.1 Molecular structures of 9 FQs
1 材料与方法
1.1 实验材料
9种FQs为诺氟沙星、恩诺沙星、沙拉沙星、达氟沙星、马波沙星、洛美沙星、氧氟沙星、左氧氟沙星和巴洛沙星,纯度均大于98%,其分子结构如图1所示。苏旺尼河富里酸(SRFA)购于国际腐殖酸协会,碳的质量分数为52.44%。乙腈和三氟乙酸均购于美国Tedia公司,纯度为色谱纯。NaCl、NaNO3等其他药品纯度均大于99%。
1.2 水样采集
水样采自山东东营黄河河口,采样点位置如图2所示。1#、2#、3#、4#、5#采样点的经纬度分别为(37°45′39.89″N,119°9′58.31″E)、(37°46′4.76″N,119°11′43.16″E)、(37°46′21.52″N,119°13′39.13″E)、(37°46′51.86″N,119°16′27.03″E)、(37°47′0.11″N,119°20′3.70″E)。为避免水样保存过程中发生光解,采用棕色瓶保存水样。运回实验室后,水样过0.22 μm滤膜以去除颗粒物和浮游生物等,转移至塑料瓶中于-20 ℃条件下冷冻,一个月内完成实验,实验前在4 ℃条件下融化备用。

图2 采样点位置示意图Fig.2 Sketch map of sampling sites
1.3 分析方法
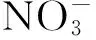
9种FQs的浓度采用Agilent 1260高效液相色谱(HPLC)仪测定。色谱条件如下:ZORBAX SB-C18色谱柱(2.1 mm×150.0 mm, 3.5 μm),柱温为30 ℃,进样量为30 μL,用二极管阵列检测器检测,流动相为乙腈和pH=2.4的三氟乙酸水溶液,测定每种FQs的乙腈∶三氟乙酸水溶液(体积比,下同)和检测波长如表2所示。

表1 水样的基本理化性质
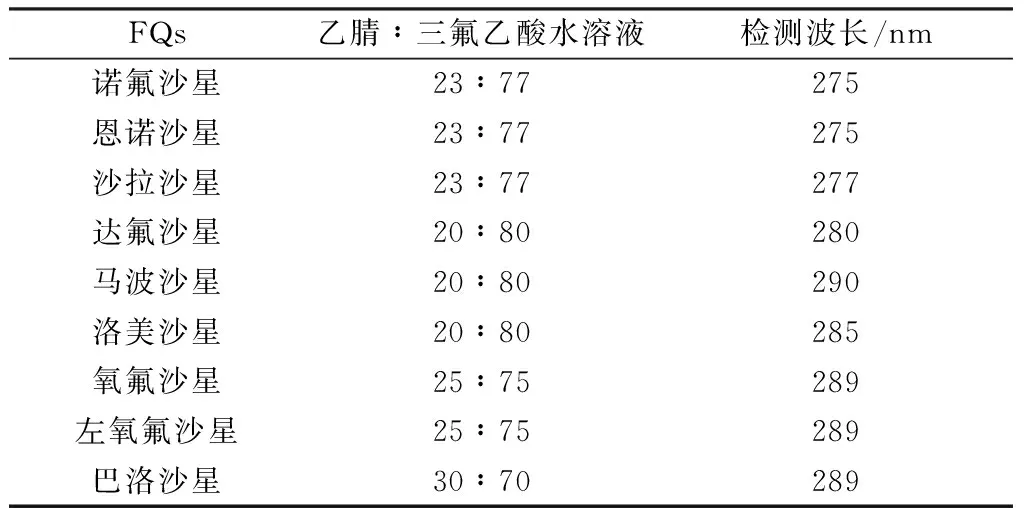
表2 9种FQs的HPLC分析条件
1.4 光解动力学实验
光解反应液共配制9组,每组分别用1#~5#的水样配制1种FQs的加标摩尔溶液,加标摩尔浓度为5 μmol/L。
以1 kW氙灯(滤去290 nm以下的紫外光)作为光源,光解实验在XPA-1型旋转式反应器中进行,反应液置于石英试管中,控制温度为(25±1) ℃。分别进行9种FQs的光解动力学实验,每组实验测定1种FQs的光解速率常数,根据不同FQs的光解速率快慢,巴洛沙星、氧氟沙星、左氧氟沙星、沙拉沙星、恩诺沙星、诺氟沙星、达氟沙星、马波沙星和洛美沙星的取样时间间隔分别为120.0、30.0、30.0、15.0、10.0、10.0、5.0、3.0、0.5 min,直至接近反应终点。采用一级动力学方程(见式(1))拟合得到光解速率常数,并根据式(2)计算半减期。每组实验重复3次,光解速率常数取3次重复实验的平均值,同时实验中设置暗对照以考察水解和生物降解对目标物降解的影响[10]。
ln(c0/ct)=kt+b
(1)
(2)
式中:c0、ct分别为FQs的初始摩尔浓度和t时刻摩尔浓度,μmol/L;k为光解速率常数,min-1;t为光解时间,min;b为常数;t1/2为半减期,min。
1.5 中心组合实验
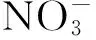
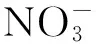
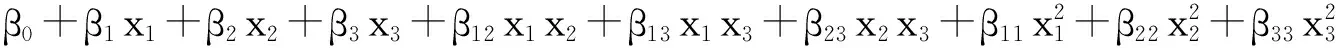
(3)
式中:β0、β1、β2、β3、β12、β13、β23、β11、β22、β33分别为各项系数,可以评估x1、x2、x33个因素及其复合效应对光解速率常数的影响。

表3 因素与水平表
2 结果与讨论
2.1 FQs在黄河河口水样中的光解速率常数

表4 9种FQs的光解速率常数
Cl-的光解机制主要有:(1)通过淬灭反应体系中的·OH,抑制污染物的光解[13];(2)通过淬灭污染物的激发态,抑制污染物的光解[14];(3)与反应体系中的·OH反应生成Cl·和Cl2·-,促进污染物的光解[15]。据葛林科[5]79报道,FQs可以发生·OH参与的自敏化光解,当反应体系中有低浓度的Cl-存在时,Cl-可能通过淬灭反应体系中的·OH而抑制巴洛沙星的光解。但本研究发现,当Cl-浓度较高时,Cl-对巴洛沙星的光解过程影响不再是简单的线性关系,而是其二次项对巴洛沙星的光解过程具有促进作用。

表5 中心组合实验设计及相应光解速率常数
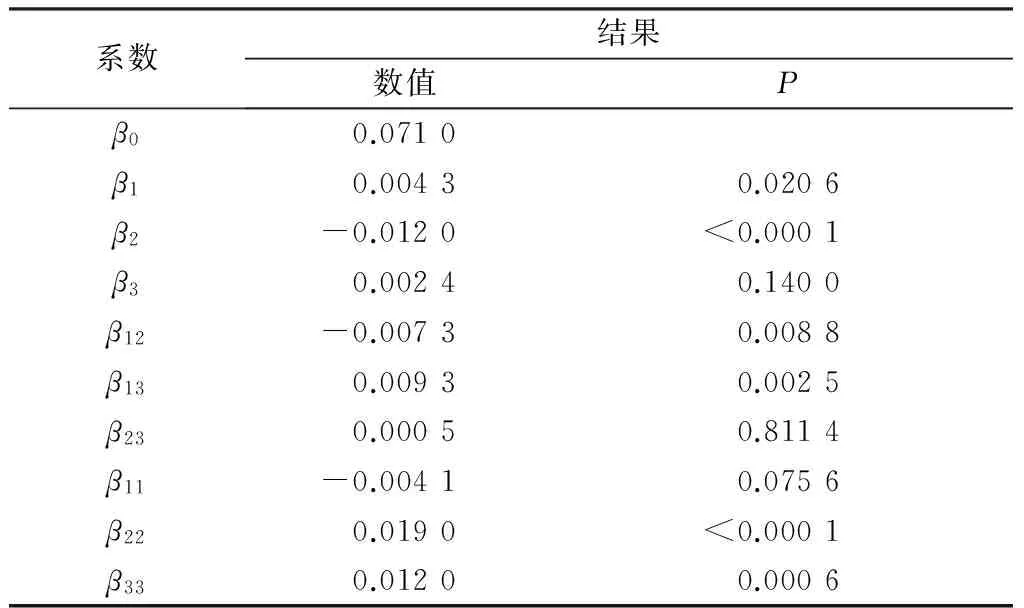
表6 各项系数及显著性分析
DOM的光解机制主要有:(1)通过光敏化作用产生活性物质,促进污染物的光解[19-21];(2)通过光屏蔽作用抑制污染物的光解[22];(3)通过淬灭污染物的激发态或活性物质(·OH、1O2和O2·-),抑制污染物的降解[23]。本研究中,DOM线性项对巴洛沙星的光解影响不显著,而DOM的二次项对巴洛沙星的光解具有一定的促进效应,其复杂的影响可能与DOM本身的组成和结构复杂性有关,有待进一步研究。
3 结 论
(1) 9种FQs的水解和生物降解等过程可以忽略不计,其在河口水样中的光解过程都可以用一级动力学方程来描述,但速率常数差异很大。其中,洛美沙星的光解速率常数最大,巴洛沙星的光解速率常数最小,因此巴洛沙星可能的环境风险最大。
[1] WEI Xiaoxuan,CHEN Jingwen,XIE Qing,et al.Distinct photolytic mechanisms and products for different dissociation species of ciprofloxacin[J].Environmental Science & Technology,2013,47(9):4284-4290.
[2] ZOU Shichun,XU Weihai,ZHANG Ruijie,et al.Occurrence and distribution of antibiotics in coastal water of the Bohai Bay,China:impacts of river discharge and aquaculture activities[J].Environmental Pollution,2011,159(10):2913-2920.
[3] VAN DOORSLAER X,DEWULF J,VAN LANGENHOVE H,et al.Fluoroquinolone antibiotics:an emerging class of environmental micropollutants[J].Science of the Total Environment,2014,500/501:250-269.
[4] BU Qingwei,WANG Bin,HUANG Jun,et al.Pharmaceuticals and personal care products in the aquatic environment in China:a review[J].Journal of Hazardous Materials,2013,262:189-211.
[5] 葛林科.水中溶解性物质对氯霉素类和氟喹诺酮类抗生素光降解的影响[D].大连:大连理工大学,2009.
[6] RODRIGUEZ MOZAZ S,CHAMORRO S,MARTI E,et al.Occurrence of antibiotics and antibiotic resistance genes in hospital and urban wastewaters and their impact on the receiving river[J].Water Research,2015,69:234-242.
[7] LI Yang,NIU Junfeng,WANG Wenlong.Photolysis of enrofloxacin in aqueous systems under simulated sunlight irradiation:kinetics,mechanism and toxicity of photolysis products[J].Chemosphere,2011,85(5):892-897.
[8] 葛林科,陈景文,张思玉,等.水中氟喹诺酮类抗生素加替沙星的光降解[J].科学通报,2010,55(11):996-1001.
[9] ARAKI T,KAWAI Y,OHTA I,et al.Photochemical behavior of sitafloxacin,fluoroquinolone antibiotic,in an aqueous solution[J].Chemical and Pharmaceutical Bulletin,2002,50(2):229-234.
[10] FISHER J M,REESE J G,PELLECHIA P J,et al.Role of Fe(Ⅲ),phosphate,dissolved organic matter,and nitrate during the photodegradation of domoic acid in the marine environment[J].Environment Science &Technology,2006,40(7):2200-2205.
[11] CUNNINGHAM V L,CONSTABLE D J C,HANNAH R E.Environmental risk assessment of paroxetine[J].Environment Science & Technology,2004,38(12):3351-3359.
[12] SORTINO S,DE GUIDI G,GIUFFRIDA S.Drastic photochemical stabilization of lomefloxacin through selective and efficient self-incorporation of its cationic form in anionic sodium dodecyl sulfate (SDS) micelles[J].New Journal of Chemistry,2001,25(2):197-199.
[13] LIU Hui,ZHAO Huimin,QUAN Xie,et al.Formation of chlorinated intermediate from bisphenol A in surface saline water under simulated solar light irradiation[J].Environmental Science & Technology,2009,43(20):7712-7717.
[14] JAMMOUL A,DUMAS S,D’ANNA B,et al.Photoinduced oxidation of sea salt halides by aromatic ketones:a source of halogenated radicals[J].Atmospheric Chemistry and Physics,2009,9(13):4229-4237.
[15] CHIRON S,MINERO C,VIONE D.Photodegradation processes of the antiepileptic drug carbamazepine,relevant to estuarine waters[J].Environmental Science & Technology,2006,40(19):5977-5983.
[16] NELIEU S,PERREAU F,BONNEMOY F,et al.Sunlight nitrate-induced photodegradation of chlorotoluron:evidence of the process in aquatic mesocosms[J].Environmental Science & Technology,2009,43(9):3148-3154.
[17] ZHAI Guangshu,LIU Jingfu,HE Bin,et al.Ultraviolet degradation of methyltins:elucidating the mechanism by identification of a detected new intermediary product and investigating the kinetics at various environmental conditions[J].Chemosphere,2008,72(3):389-399.
[18] GOLDSTONE J V,PULLIN M J,BERTILSSON S,et al.Reactions of hydroxyl radical with humic substances:bleaching,mineralization,and production of bioavailable carbon substrates[J].Environmental Science & Technology,2002,36(3):364-372.
[19] GE Linke,CHEN Jingwen,QIAO Xianliang,et al.Light-source-dependent effects of main water constituents on photodegradation of phenicol antibiotics:mechanism and kinetics[J].Environmental Science & Technology,2009,43(9):3101-3107.
[20] GE Linke,CHEN Jingwen,WEI Xiaoxuan,et al.Aquatic photochemistry of fluoroquinolone antibiotics:kinetics,pathways,and multivariate effects of main water constituents[J].Environmental Science & Technology,2010,44(7):2400-2405.
[21] WERNER J,CHINTAPALLI M,LUNDEEN R,et al.Environmental photochemistry of tylosin:efficient,reversible photoisomerization to a less-active isomer,followed by photolysis[J].Journal of Agricultural and Food Chemistry,2007,55(17):7062-7068.
[22] 尉小旋,陈景文,王如冰,等.氧氟沙星和诺氟沙星的水环境光化学转化:pH值及溶解性物质的影响[J].环境化学,2015,34(3):448-454.
[23] WENK J,VON GUNTEN U,CANONICA S.Effect of dissolved organic matter on the transformation of contaminants induced by excited triplet states and the hydroxyl radical[J].Environment Science & Technology,2011,45(4):1334-1340.
