乙型肝炎病毒核心抗体定量与定性测定比较
2016-03-10张青叶
乙型肝炎病毒核心抗体定量与定性测定比较
张青叶
关键词:化学发光微粒子免疫检测法;酶联免疫法;乙型肝炎病毒核心抗体;定量;定性
乙型肝炎是严重危害人类健康的传染病。乙型肝炎病毒(HBV)感染呈世界性分布。我国是HBV感染的高发区,慢性感染者有1亿多人[1]。HBV血清标志物的检测对乙型肝炎的诊断、疗效观察及预后判断具有非常重要的意义。乙型肝炎核心抗体检测可提示当前或以往HBV感染,乙型肝炎病毒核心抗体(抗-HBc)浓度的高低可反映病毒感染的状态,高浓度提示乙型肝炎急性感染。慢性乙型肝炎呈现抗-HBc持续高浓度[2]。抗-HBc在急性HBV感染出现乙型肝炎表面抗原(HBsAg)后不久便可在血清中检测到,在HBsAg消失后和可检测到乙型肝炎表面抗体(抗-HBs)之前,都将持续存在。在缺乏其他HBV标志物相关信息的情况下,检测到抗-HBc可能代表HBV活动性感染或感染可能已缓解。所以抗-HBc是HBV感染和潜在感染的唯一血清学标志物[3]。国内临床实验室最常用的HBV感染者的血清学标志物的检测主要依靠酶联免疫吸附试验法。而有研究显示,根据HBV抗原抗体模式难以准确地判断病毒复制程度及其传染性的强弱,因此也应对HBV血清标志物做定量分析。
1对象与方法
1.1对象选取住院乙型肝炎病人410例,分别进行酶联免疫法和化学发光微粒子免疫检测法。
1.2方法
1.2.1酶联免疫法本研究采用的酶联免疫法为酶联免疫吸附试验(ELISA),仪器为Addcare ELISA1100,试剂为上海科华生物工程股份有限公司抗-HBc试剂盒。其原理是利用自动化仪器与酶联免疫法结合完成测定。它采用基因工程重组乙型肝炎病毒核心抗原(HBcAg)包被反应板,加入待测样本,同时加入抗-HBc-HRP,与抗原形成竞争结合。若待测样本中抗-HBc含量高,则抗-HBc-HRP结合少,加入四甲基联苯胺(TMB)底物时显色淡,反之显色深。
1.2.2化学发光微粒子免疫检测法(chemiluminesent microparticle immuno assay,CMIA)采用的仪器为ARCHITECT i2000,试剂为ARCHITECT原装抗-HBc试剂盒及质控品、校准品,其原理是利用重组乙型肝炎核心抗原包被微粒子以检测Anti-HBc。采用两步免疫测定法:首先利用待测样本与项目稀释液、样本稀释液和重组乙型肝炎核心抗原包被的顺磁性微粒子混合,样本中存在的抗-HBc与乙型肝炎核心抗原包被的顺磁性微粒子结合,然后洗涤反应结合物,再加入抗-人吖啶酯标记结合物使其结合;再次洗涤后加入预激发液和激发液使其发生化学反应,测定产生的化学反应的相对发光单位(RLUS)。血清中抗-HBc含量与RLUS值成正比。通过比较反应中的化学发光信号和ARCHITECT抗-HBc校准生成的临界值,确定血清中是否存在抗-HBc。化学发光信号大于或等于Cutoff信号可视为呈反应性。
2结果(见表1)
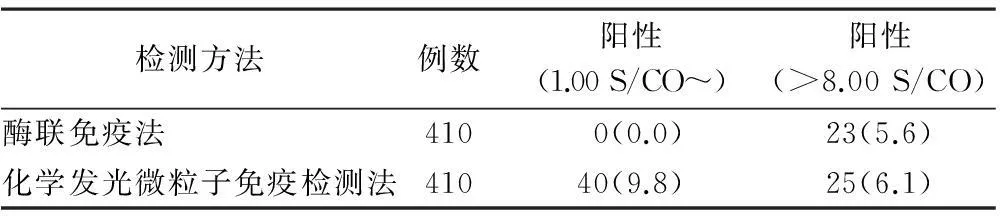
表1 两种检测方法的抗-HBc阳性结果 例(%)
3讨论
表1结果显示,410例样本中抗-HBc浓度值1.00 S/CO ~8.00 S/CO时酶联免疫法检测率为0;>8.00S/CO时也有2例未检出。因此,酶联免疫法检测率较低,很容易造成漏检。这可能是由于其受到方法学的限制,不能用于定量测定,对于微量样本的检出有局限性;而且操作过程中受多种因素影响,如内源性补体、甲胎蛋白、类风湿因子、自身抗体和外源性物质的干扰,如乳糜、溶血血清,试剂盒质量,洗板的质量等,致使其检测准确度降低,甚至出现假阴性结果,难以准确判断病毒复制程度及其传染性,无法判断治疗效果。但由于酶联免疫法有着方法简单、成本低廉、易于操作、适用于批量标本检测的特点,目前仍被大量应用于对HBV血清学标志物定性或半定性分析。
化学发光微粒子免疫检测法是新一代超微量分析法。由于其化学发光剂发光稳定、持续时间长[4],可定量检测血清中HBV抗原抗体的浓度,其原理先进、标记物简单高效、线形范围宽、特异性强、精密度高、自动化程度高、检测速度快且结果准确,可以有效防止漏检;能准确评估HBV蛋白合成水平,从而能评估HBV感染后病情转归及抗病毒治疗效果等。样本可以随时测定,便于临床更好、更快地掌握病人信息,以采取措施防止其发展成为乙型肝炎或慢性病毒携带者,同时也可为注射乙型肝炎疫苗提供指导。
参考文献:
[1]杨旭,罗红雨,张永红,等.乙型肝炎病毒载量与抗原抗体模式的关系[J].中华肝脏病杂志,2002,10(4):269-271.
[2]Heijtink RA,Kruining J,Honkoop P,etal.Serum HbeAg quantitation during antiviral therapy for chronic hepatitis B[J].J Med Virol,1997,53(3):282-287.
[3]骆抗先.乙型肝炎基础和临床[M].第2版.北京:人民卫生出版社,2001:207-336.
[4]Nahed Ismail,Geoffrey E,Fish,etal.Smith laboratory evaluation of a fully automated chemiluminescence immunoassay for rapid detection of HBsAg,antibodies to HBsAg,and antibodies to hepatitis C virus[J].J Clin Microbiol,2004,42(2):610-617.
(本文编辑崔晓芳)
(收稿日期:2015-06-24;修回日期:2016-01-28)
作者简介张青叶,副主任检验师,本科,单位:030001,山西医科大学第一医院。
中图分类号:R47
文献标识码:C
doi:10.3969/j.issn.1009-6493.2016.06.052
文章编号:1009-6493(2016)02C-0766-02
