阿特拉津引起卵泡发育不良的分子机制
2016-03-10赵本正李俊玮林丹萍谭文溪
牛 潼,索 琪,刘 剑,赵本正,李俊玮,林丹萍,谭文溪*,李 娜
(1.吉林大学临床医学院,吉林 长春130021;2.吉林大学第二医院;3.吉林大学护理学院;4.长春中医药大学)
阿特拉津引起卵泡发育不良的分子机制
牛潼1,索琪2,刘剑2,赵本正1,李俊玮1,林丹萍3,谭文溪2*,李娜4*
(1.吉林大学临床医学院,吉林 长春130021;2.吉林大学第二医院;3.吉林大学护理学院;4.长春中医药大学)
摘要:目的观察阿特拉津(ATR)处理后大鼠卵巢组织中ATM、P-ATM、CHEK1、P-CHEK1、P53及P-P53的含量,探讨ATR引起卵泡发育不良的可能机制。方法以玉米油溶解ATR,将32只雌性Wistar大鼠随机分为0 mg·kg-1、5 mg·kg-1、25 mg·kg-1和125 mg·kg-1ATR剂量组,灌胃给予相应剂量ATR,1次/d,共28 d,于第29 d处死动物取卵巢组织提取总蛋白,Western blot方法检测卵巢组织蛋白中DNA损伤通路相关蛋白的表达及磷酸化水平。结果与对照组比较,ATR处理组大鼠卵巢组织中ATM水平显著下降,其中以25 mg·kg-1组下降最为明显(P<0.01);P-ATM水平呈剂量依赖性显著升高(P<0.05)。与对照组比较,25 mg·kg-1和125 mg·kg-1ATR组大鼠卵巢组织中CHEK1水平下调(P<0.05),以125 mg·kg-1组水平最低;25 mg·kg-1和125 mg·kg-1组P-CHEK1水平明显增高(P<0.05),以125 mg·kg-1组最为显著。与对照组比较,ATR处理后各组大鼠卵巢组织中P53水平明显降低(P<0.01或P<0.05),该效应具有剂量依赖性;25 mg·kg-1和125 mg·kg-1组P-P53水平增高(P<0.05),以25 mg·kg-1组升高最为明显。结论ATR可通过激活ATM信号通路,活化其下游的P53及CHEK检验点,从而阻碍细胞周期,并导致闭锁卵泡的发生。
关键词:阿特拉津;卵巢;细胞周期;ATM信号通路
(ChinJLabDiagn,2016,20:0194)
阿特拉津(atrazine,ATR)又名莠去津,化学名称2-氯-4-乙胺基-6-异丙胺基-1,3,5-三嗪,是全球应用最为广泛,使用量最大的除草剂之一。ATR属于低毒性除草剂,但可在环境中长久存在,对土壤、水体等自然媒介造成严重污染[1,2],并在动物体内蓄积,导致多系统生物毒性,故引起人们越来越多的重视。有研究[3-7]表明,ATR的生物学毒性主要见于神经系统、内分泌系统、免疫系统以及生殖系统。我们在前期研究[8]中发现,ATR可引起卵巢组织中大型闭锁卵泡增加,并且氧化应激反应增强。但是氧化应激损伤导致卵泡发育不良的分子机制尚不明确。本研究通过检测ATR处理后大鼠卵巢组织中ATM、P-ATM、CHEK1、P-CHEK1、P53及P-P53的水平,探讨ATR导致的氧化应激引起卵泡发育不良的可能机制。
1材料与方法
1.1实验动物与试剂4周龄雌性Wistar大鼠32只,购于吉林大学白求恩医学院实验动物中心,饲养于恒定温度(22-25℃)、恒定湿度(40%-50%)环境中,标准饲料和水自由食用。ATR购于美国 Sigma 公司,纯度为 98.99%,以玉米油溶解,4℃保存备用。ATM、P-ATM、CHEK1、P-CHEK1、P53及P-P53 兔抗鼠单克隆抗体购自美国Proteintech Group公司。
1.2动物分组及给药将32只雌性Wistar大鼠随机分为0 mg·kg-1、5 mg·kg-1、25 mg·kg-1和125 mg·kg-1剂量组,每组8只。以玉米油溶解ATR,每日灌胃给予相应剂量,连续28日,观察大鼠一般状态、饮食及活动情况,每4 d称量大鼠体重并根据体重调整给药量。
1.3组织标本的取材处理实验动物连续给药28天,于第29天麻醉状态下腹主动脉取血处死动物,快速取出卵巢组织并冻存于-80℃冰箱,用于提取总蛋白。
1.4Western blot方法检测DNA损伤通路相关蛋白的表达提取组织蛋白后,采用Western blot方法检测卵巢组织蛋白中ATM、P-ATM、CHEK1、P-CHEK1、P53和P-P53的含量。以β-actin为内参照,计算相对光密度值。光密度=(目的条带光强度×平均光密度)/ (同一样品β-actin条带光强度×平均光密度),相对光密度=实验组光密度/对照组光密度,即以0 mg·kg-1组的表达为1,计算其他组与0 mg·kg-1组相比增加或减少的倍数。

2结果
2.1大鼠卵巢组织蛋白中ATM和P-ATM水平与对照组比较,ATR处理组大鼠卵巢组织中ATM水平显著下降(P<0.05),以25mg·kg-1ATR组下降最为明显(P<0.01)。与对照组比较,经ATR处理后,各组大鼠卵巢组织中P-ATM水平显著上升(P<0.05)(见图1)。
2.2大鼠卵巢组织蛋白中CHEK1和P-CHEK1水平与对照组比较,5mg·kg-1ATR组大鼠卵巢组织中CHEK1水平未见明显差异,25mg·kg-1和125mg·kg-1ATR组大鼠卵巢组织中CHEK1水平降低(P<0.05),以125mg·kg-1ATR组中CHEK1水平最低;与对照组比较,25mg·kg-1和125mg·kg-1ATR组大鼠卵巢组织中P-CHEK1水平明显增高(P<0.05),且125mg·kg-1ATRP-CHEK1水平最高。见图2。

与对照组比较*P<0.05,**P<0.01
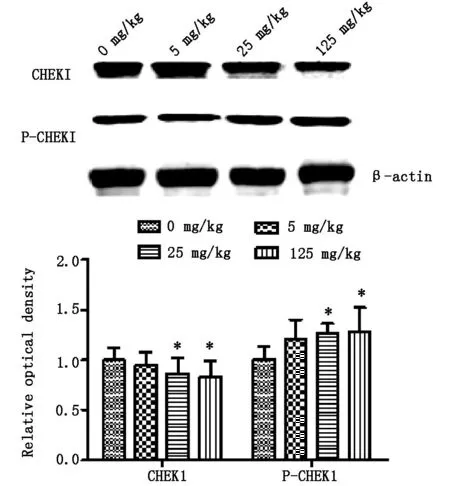
*与对照组比较P<0.05
2.3大鼠卵巢组织蛋白中P53和P-P53水平与对照组比较,经ATR处理的各组大鼠卵巢组织蛋白中P53水平明显降低(P<0.01或P<0.05),且随着ATR剂量增高,P53水平逐步降低;与对照组比较,5mg·kg-1和25mg·kg-1ATR组大鼠卵巢组织中P-P53水平增高(P<0.05),且25mg·kg-1ATR组升高最为明显。

与对照组比较*P<0.05,**P<0.01
3讨论
作为一种使用量大、在环境中残留期长的除草剂,ATR的生物毒性已引起越来越多的关注。研究[3,7,9]表明,ATR可导致动物生殖系统功能紊乱,进而导致动物的繁殖发生异常,但其具体机制尚不明确。我们在前期研究[10]中发现,ATR可引起卵巢组织中大型闭锁卵泡增加,并且卵巢组织中活性氧产生增多。由此我们猜测,活性氧的产生可能导致细胞内发生DNA损伤,进而引起DNA损伤应激,并激活细胞周期检查点,引起细胞周期阻滞,从而导致闭锁卵泡的发生。
细胞周期分为间期与分裂期两个阶段,间期又可分为DNA合成前期(G1期)、DNA合成期(S期)与DNA合成后期(G2期)。在细胞周期中,G1/S、G2/M期的调控点是细胞内外信号经过传递、整合汇集到细胞核,对细胞增殖进行调控的关键点[11]。正常情况下,当细胞受损时,可通过激活调控点,导致G1期和G2期延长,使细胞有充分的时间完成复制前和有丝分裂前的修复,以保证细胞的存活,当损伤超出细胞的修复能力时,则促使细胞凋亡[12]。
在细胞周期进程中,P53蛋白可作为转录因子或与其他转录因子结合,直接或间接影响细胞周期相关基因的转录,使细胞阻滞于G1或G2期[13]。P53可被细胞内多种有害因素所激活,形成磷酸化P53(P-P53),而DNA损伤是P53激活的主要刺激因素之一[14]。本研究结果表明,经ATR处理后,大鼠卵巢组织中P53含量明显下降,而P-P53含量显著增高,提示ATR可能通过磷酸化激活P53,导致细胞周期阻滞,并进而产生闭锁卵泡导致卵泡发育不良。
研究表明,CHEK1可诱导P53的磷酸化[15]。CHEK1是与DNA损伤应激密切相关的重要检查点蛋白,并可通过磷酸化CDC25影响CDK的激活,最终使细胞周期发生阻滞。本研究发现,经ATR处理的大鼠卵巢组织中,CHEK1含量随ATR剂量的增高而呈下降趋势,而P-CHEK1的表达则呈随剂量的变化明显增高。该结果提示,ATR可诱导CHEK1磷酸化激活,一方面通过CDC25途径使细胞周期发生阻滞,另一方面可激活P53,并通过P53途径使细胞周期发生阻滞。
P53的磷酸化以及CHEK1的磷酸化可通过ATM途径实现。ATM基因属于PI-3K激酶家族成员,其编码的蛋白具有调控DNA修复过程和调整细胞周期关卡的功能。本研究发现,经ATR处理的大鼠卵巢组织,ATM含量随ATR剂量的增高而呈下降趋势,而P-ATM含量则明显增高。近年来的研究[16-21]表明,ATR可引起氧化应激反应进而引起DNA损伤,而ATM是DNA损伤应答的关键调控者。因此我们推测,闭锁卵泡的产生可能与ATM磷酸化程度增高有关。
通过以上研究,我们推测ATR对大鼠生殖系统产生损伤的可能机制是,ATR诱导细胞内产生大量的ROS,ROS导致DNA损伤,激活ATM进行DNA修复,ATM引起CHEK1和P53磷酸化,同时CHEK1可对P53的磷酸化起到一定的诱导作用。而CHEK1和P53的磷酸化通过诱导细胞周期阻滞,导致闭锁卵泡的产生,卵巢闭锁卵泡比例增加通过影响卵泡的成熟及排卵,进而影响生殖功能。该机制尚有待于进一步的研究进行验证。
参考文献:
[1]万年升,顾继东,段舜山.阿特拉津生态毒性与生物降解的研究[J].环境科学学报,2006,4:552.
[2]KonstantinouIK,HelaDG,AlbanisTA.Thestatusofpesticidepollutioninsurfacewaters(riversandlakes)ofGreece.PartI.Reviewonoccurrenceandlevels[J].EnvironPollut,2006,141(3):555.
[3]GoodmanM,MandelJS,DesessoJM,etal.AtrazineandPregnancyOutcomes:ASystematicReviewofEpidemiologicEvidence[J].BirthDefectsResearchPartB:DevelopmentalandReproductiveToxicology,2014,101(3):215.
[4]SobolewskiM,ConradK,AllenJL,etal.Sex-specificenhancedbehavioraltoxicityinducedbymaternalexposuretoamixtureoflowdoseendocrine-disruptingchemicals[J].NeuroToxicology,2014,45:121.
[5]FraitesMJ,CooperRL,BuckalewA,etal.CharacterizationoftheHypothalamic-Pituitary-AdrenalAxisResponsetoAtrazineandMetabolitesintheFemaleRat[J].ToxicologicalSciences,2009,112(1):88.
[6]WhalenMM,LoganathanBG,YamashitaN,etal.Immunomodulationofhumannaturalkillercellcytotoxicfunctionbytriazineandcarbamatepesticides[J].Chemico-BiologicalInteractions,2003,145(3):311.
[7]AgopianAJ,CaiY,LangloisPH,etal.MaternalResidentialAtrazineExposureandRiskforChoanalAtresiaandStenosisinOffspring[J].TheJournalofPediatrics,2013,162(3):581.
[8]谭文溪,刘剑,上官梦原,等.除草剂阿特拉津对健康雌性小鼠血清性激素水平的影响及其意义[J].吉林大学学报(医学版),2013,6:1169.
[9]SimpkinsJW,SwenbergJA,WeissN,etal.Atrazineandbreastcancer:aframeworkassessmentofthetoxicologicalandepidemiologicalevidence[J].ToxicolSci,2011,123(2):441.
[10]ZhaoF,LiK,ZhaoL,etal.EffectofNrf2onratovariantissuesagainstatrazine-inducedanti-oxidativeresponse[J].IntJClinExpPathol,2014,7(6):2780.
[11]MckayJA,DouglasJJ,RossVG,etal.Analysisofkeycell-cyclecheckpointproteinsincolorectaltumours[J].JPathol,2002,196(4):386.
[12]柳友清,邢辉,韩晓兵,等.顺铂诱导宫颈癌SiHa细胞周期阻滞及凋亡的研究[J].中华肿瘤防治杂志,2006,4:248.
[13]赵丽晶,许多,程宏,等.20(s)-原人参二醇对体外培养Siha细胞caspase-3表达激活的影响[J].吉林大学学报(医学版),2011,1:26.
[14]LadelfaMF,PecheLY,ToledoMF,etal.Tumor-specificMAGEproteinsasregulatorsofp53function[J].CancerLett,2012,325(1):11.
[15]马晓宇.Chk1和p53在肿瘤细胞S期DNA损伤检查点中的复杂关系研究[D].中国科学技术大学,2012,114.
[16]AbarikwuSO,PantAB,FarombiEO.4-Hydroxynonenalinducesmitochondrial-mediatedapoptosisandoxidativestressinSH-SY5Yhumanneuronalcells[J].BasicClinPharmacolToxicol,2012,110(5):441.
[17]AbarikwuSO,AdesiyanAC,OyelojaTO,etal.Changesinspermcharacteristicsandinductionofoxidativestressinthetestisandepididymisofexperimentalratsbyaherbicide,atrazine[J].ArchEnvironContamToxicol,2010,58(3):874.
[18]AbarikwuSO,AdedaraIA,FarombiEO.Influenceofquercetinonhaematologicalindicesandbiomarkersofoxidativestressintheserumofratsexposedtoatrazine[J].AfrJMedMedSci,2010,39Suppl:81.
[19]ZhuL,DongX,XieH,etal.DNAdamageandeffectsonglutathione-S-transferaseactivityinducedbyatrazineexposureinzebrafish(Daniorerio) [J].EnvironToxicol,2011,26(5):480.
[20]WangJH,ZhuLS,MengY,etal.ThecombinedstresseffectsofatrazineandcadmiumontheearthwormEiseniafetida[J].EnvironToxicolChem,2012,31(9):2035.
[21]SantosTG,MartinezCB.AtrazinepromotesbiochemicalchangesandDNAdamageinaNeotropicalfishspecies[J].Chemosphere,2012,89(9):1118.
The molecular mechanism of follicular dysplasia caused by atrazineNIUTong,SUOQi,LIUJian,etal.(ClinicalCollageofJilinUniversity,Changchun130021,China)
Abstract:ObjectiveTo observe the expressions of ATM,P-ATM,CHEK1,P-CHEK1,P53 and P-P53 in ovarian tissues of rats treated by atrazine (ATR),and to evaluate the possible mechanisms of ATR on follicular maldevelopment.Methods32 female Wistar rats were randomly divided into 4 groups (8/group),treated by a daily gavage of 0,5,25 and 125mg·kg-1atrazine dissolved in corn oil for 28 consecutive days,and sacrificed under anesthesia in day 29.The ovaries were collected to isolate the total protein.Western blot were employed to detect the expressions of ATM,P-ATM,CHEK1,P-CHEK1,P53 and P-P53.ResultsThe expressions of ATM were significantly decreased(P<0.05 orP<0.01) in ATR groups,especially in 25 mg·kg-1ATR group(P<0.01),compared with the control group.While which of P-ATM were significantly increased in dose-dependent manner (P<0.05) in ATR groups.In 25 mg·kg-1and 125 mg·kg-1ATR groups,the expressions of CHEK1 were decreased (P<0.05) and which of P-CHEK1 were increased (P<0.05) compared with the control group,especially in 125 mg·kg-1ATR group.Compared with the control group,the expressions of P53 were decreased in dose-dependent manner (P<0.05) in ATR groups; the expressions of P-P53 were increased (P<0.05) in 25 mg·kg-1and 125 mg·kg-1ATR groups,especially in 25 mg·kg-1ATR group.ConclusionATR may active P53 and CHEK1 inspection points by trigger ATM signal pathway,so as to block the cell cycle,and cause atretic follicles.
Key words:atrazine;ovarian tissue protein;cell cycle;ATM signal pathway
(收稿日期:2015-09-16)
文献标识码:A
中图分类号:Q816
文章编号:1007-4287(2016)02-0194-04
*通讯作者
基金项目:吉林省财政厅科研基金资助课题(2012845)
