斑点叉尾鮰和蓝点马鲛鱼皮中胶原蛋白的提取与性质研究
2016-03-09袁春红王金梅包建强
黄 雯,袁春红,徐 萌,王金梅,包建强
(1.上海海洋大学食品学院,上海 201306;2.日本鹿儿岛大学,鹿儿岛 890-0056)
斑点叉尾鮰和蓝点马鲛鱼皮中
胶原蛋白的提取与性质研究
黄 雯1,袁春红2,徐 萌1,王金梅1,包建强1
(1.上海海洋大学食品学院,上海 201306;2.日本鹿儿岛大学,鹿儿岛 890-0056)
选取淡水鱼斑点叉尾鮰(Ictalurus punctaus,以下简称鮰鱼)和海水鱼蓝点马鲛(Scomberomorus niphonius,以下简称鲅鱼)鱼皮作为原料,进行胶原蛋白的提取研究。提取方法改良如下:在预处理阶段,鱼皮样品被尽可能切碎且调节溶液更换频率;在提取阶段,在盐析步骤前,添加三羟甲基氨基甲烷粉末将醋酸溶液的酸碱值调节至中性。结果表明,应用改良后的方法提取胶原蛋白,提取周期缩短为7 d。鮰鱼鱼皮胶原蛋白的变性温度是36.5℃,鲅鱼鱼皮胶原蛋白是30.5℃。水解电泳图谱显示,鲅鱼鱼皮胶原蛋白比鮰鱼鱼皮胶原蛋白更易被完全水解,鮰鱼鱼皮胶原蛋白比鲅鱼鱼皮胶原蛋白更稳定。
斑点叉尾鮰;蓝点马鲛;胶原蛋白;提取方法
胶原蛋白是一种生物性高分子物质,应用领域包括食品、制药、化妆品、生物医学原料、皮革影像业等[1]。胶原蛋白是一种功能性蛋白,一种丝状蛋白纤维,用以保持皮肤的弹性。人体中存在于皮肤、骨骼、肌腱等部位,用以粘合结缔组织。在鱼类的骨骼和结缔组织中也含有胶原蛋白[2],主要在真皮、骨、腱、鳞中含量较多。它的结构是由三条多肽α链组合而成的三股螺旋结构,分子量约30万道尔顿,主要组成氨基酸为丙氨酸、甘氨酸、羟脯氨酸,而且羟脯氨酸为其特征氨基酸[3]。截至2009年ZUCCHELLI等[4]发现XXIX型胶原,被人类报道过的胶原蛋白共有29种。胶原蛋白的结构类型多,大多数胶原蛋白在常温下不易溶于水,也不易被降解,但易受热变性。胶原蛋白I型和V型在水产动物中较为广泛存在。I型胶原蛋白主要由丙氨酸以及糖结合型羟赖氨酸组成。这种胶原蛋白主要分布在鱼类与软体动物的各个器官中,如鲍鱼腹足、乌贼类的头盖软骨和皮等[5]。V型胶原蛋白中含大量糖结合型羟赖氨酸,存在少量丙氨酸,其主要分布于蟹类、海蜇[6]、虾类的肌肉和外皮下膜中。
我国拥有十分丰富的水产资源,然而,在渔业加工过程中大量鱼皮、鱼鳞、鱼骨等被作为下脚料废弃,所产生的废弃物数量极为庞大。鱼皮中含有的蛋白质主要为纤维状胶原蛋白,以及少量球蛋白、弹性蛋白、白蛋白等[7]。从这些加工废弃物中提取胶原蛋白是一项很有前景的研究项目。斑点叉尾鮰(Ictalurus punctaus,以下简称鮰鱼)是我国最重要的水产养殖鱼类之一[9],自1984年从美国引入我国已推广到20多个省市,成为我国重要的水产养殖经济鱼类之一[10]。蓝点马鲛(Scomberomorus niphonius,以下简称鲅鱼),在日本产量巨大,且由于鲅鱼肉质不易保鲜,不适合制作成为日本最受欢迎的生鱼片,大量鲅鱼被浪费。本文选取淡水鱼鮰鱼和海水鱼鲅鱼作为原料,采用酸法和酶法提取胶原蛋白并对其进行性质研究,以期为渔业加工中废弃物的科学利用提供理论依据。
1 材料与方法
1.1 材料与仪器
鮰鱼于2014年7月购自上海市浦东新区临港新城古棕路菜市场,鮰鱼样品体长约42 cm,体质量约560 g。鲅鱼于2014年8月购自日本串木野养殖场高水株式会社,鲅鱼样品体长约35 cm,体质量约420 g。
本实验中的化学试剂:0.1 mol·L-1醋酸;0.5 mol·L-1醋酸;0.1mol·L-1NaOH;1 mol· L-1NaOH;6 mol·L-1NaOH;6 mol·L-1HCl;10%正丁醇,上述化学试剂均为分析纯。
KUBOTA 6200高速冷冻离心机购自日本久保田株式会社,J-820Q4圆二色谱仪购自JASCO日本分光株式会社,BF 200恒温水槽购自日本YAMATO科学株式会社。
1.2 实验方法
1.2.1 预处理
在4℃条件下,将新鲜鱼皮切下并除去鱼鳞,用手术刀切成5 mm×5 mm大小的碎片并称重5 g,浸入冰水,使用磁力搅拌器反复搅拌鱼皮至冰水变清澈。将洗净的鱼皮碎片放入100 mL 0.1 mol·L-1NaOH溶液(W/V:1/20)浸泡24 h去除杂蛋白,每4 h更换一次溶液。待第一次浸泡鱼皮溶胀后,用手术刀将鱼皮再次切碎,提高浸泡效果。用蒸馏水清洗鱼皮至溶液呈中性。用10%正己烷溶液(W/V:1/20)浸泡鱼皮24 h去除脂肪,每4 h更换一次溶液。蒸馏水清洗鱼皮,至溶液静置后无分层。
1.2.2 酸法抽提鱼皮胶原蛋白
鱼皮胶原蛋白的提取方法参考NAGAI等[11]的方法并做了一些优化。将预处理的鱼皮浸入0.5 mol·L-1醋酸溶液(W/V:1/20)24 h,期间磁力搅拌器持续搅拌;然后在15 000 g离心力下离心15 min,将上清液冷藏备用。下沉物再次浸于0.5 mol·L-1醋酸溶液(W/V:1/20)24 h,持续搅拌;再次离心之后,得上清液。将两次上清液缓慢加入Tris粉末并持续搅拌,至终浓度达到0.5 mol·L-1使醋酸溶液调至中性。缓慢加入NaCl粉末并搅拌,待溶液终浓度达到2.6 mol·L-1NaCl,在15 000 g离心力下离心30 min,沉淀物复溶于0.5 mol·L-1醋酸中。先在0.1 mol·L-1醋酸中透析24 h,每4 h更换一次透析液,再将胶原蛋白样品在蒸馏水中透析24 h,每4 h更换一次透析液。将得到的鱼皮酸溶性胶原蛋白(ASC)冻干备用。酸法提取鱼皮胶原蛋白的提取周期为6 d。
1.2.3 酶法抽提鱼皮胶原蛋白
将酸法抽提鱼皮胶原蛋白中第2次离心所得沉淀物放入0.5 mol·L-1醋酸溶液(W/V:1/10)浸泡24 h,期间加入胃蛋白酶20 U·g-1,并持续搅拌;在15 000 g下离心15 min,得到上清液。向上清液缓慢加入Tris粉末并缓慢搅拌,至终浓度达到0.5 mol·L-1使醋酸溶液调至中性。缓慢加入NaCl粉末并缓满搅拌,至终浓度达到2.6 mol·L-1。在15 000 g离心30 min,沉淀物复溶于0.5 mol·L-1醋酸中。先在0.1 mol·L-1醋酸中透析24 h,每4 h更换一次透析液。再将胶原蛋白样品在蒸馏水中透析24 h,每4 h更换一次透析液,将得到的鱼皮酶溶性胶原蛋白(PSC)冻干备用。酸法提取鱼皮胶原蛋白的周期为7 d。
1.2.4 鱼皮胶原蛋白的结构鉴定和分子质量计算
采用丙烯酰胺凝胶电泳(SDS-PAGE)分析胶原蛋白的结构,鉴定胶原蛋白的纯度并计算其相对分子质量。取0.1mL浓度为1mg·mL-1的鮰鱼鱼皮ASC、鮰鱼鱼皮PSC、鮰鱼鱼肉ASC、鮰鱼鱼肉PSC、鲅鱼鱼皮ASC、鲅鱼鱼皮PSC、鲅鱼鱼肉ASC、鲅鱼鱼肉PSC共8个样品溶液加入8 μL 1 mol·L-1Tris溶液调节pH,加入50μL混合染色液。进样前用热水浸泡试管3 min。样品槽中加入含量10μg的胶原蛋白样品。使用高分子量蛋白标准样来标记样品,计算分子量。分离胶的试剂为:40%Acrylamide,0.5 M Tris 1.5 M Glycine pH 8.9,18.3%glycerin(甘油)0.18% SDS 0.18 mM EDTA,10%APS(过硫酸铵),TEMED(胶凝促进剂),D.W.(双蒸水)。浓缩胶的试剂为:0.5 M Tris-HCl(pH 6.8)0.4%SDS,40%Acrylamide,10%APS(过硫酸铵),TEMED(胶凝促进剂),D.W.(双蒸水)。电泳缓冲液:125 mM Tris,375 mM Boric acid(硼酸),0.5% SDS(5倍浓度)。混合染色液:45%甲醇,9%醋酸,0.25%CBB考马斯亮蓝。脱色液:45%甲醇,9%醋酸[13]。
1.2.5 溶解度
1.2.5 .1 pH对鱼皮胶原蛋白溶解度的影响
将冻干的鱼皮胶原蛋白粉末溶解于0.1 mol ·L-1醋酸中得浓度为3mg·mL-1的胶原蛋白样品溶液。取10支带刻度的离心管,分别加入10 mL样液,用6 mol·L-1HCl、6 mol·L-1NaOH、1 mol·L-1NaOH将样品溶液pH调至1~10,然后用去离子水加至11 mL。溶液在4℃条件下搅拌10 min,然后以15 000 g冷冻离心30 min。各取1 mL稀释至10倍,取稀释后的样液0.1 mL,加入2 mL Bradford试剂,于室温放置30 min。用分光光度计测定的吸光值并代入标准曲线方程,得出不同pH条件下胶原蛋白溶液的浓度。
1.2.5 .2 NaCl浓度对鱼皮胶原蛋白溶解度的影响
取冻干的鱼皮胶原蛋白粉末溶解于0.1 mol ·L-1醋酸中得浓度为6mg·mL-1胶原蛋白样品溶液。取7支刻度离心管分别加入5 mL 6 mg· mL-1样品溶液和5 mL浓度依次为0%(w/w)、2%(w/w)、4%(w/w)、6%(w/w)、8%(w/w)、10%(w/w)、12%(w/w)的NaCl溶液。各样品终浓度依次为0%(w/w)、1%(w/w)、2%(w/w)、3%(w/w)、4%(w/w)、5%(w/w)、6%(w/w)。充分混合震荡,在15 000 g下冷冻离心30 min。各取1 mL稀释至10倍,将稀释后的样液取0.1 mL,加入2 mL Bradford试剂,于室温放置30 min。用分光光度计测定的吸光值代入标准曲线方程,得出不同NaCl浓度下胶原蛋白溶液浓度。
1.2.6 热稳定性
取一定量的胶原蛋白冻干粉末溶解于0.1 mol·L-1醋酸溶液中配成浓度为1 mg·mL-1的胶原蛋白样品溶液。在15 000 g下冷冻离心15 min,取上清液移入光径为1 mm的比色皿中,10℃下对样品在200~250 nm波长段进行扫描,扫描速率10 nm·min-1。将胶原蛋白样品溶液以1℃·min-1速度从10℃加热至45℃,再次进行扫描。然后将胶原蛋白溶液温度冷却至10℃,进行第3次扫描[14]。
将溶解的样品分别注入1 mm光径的比色皿中,将胶原蛋白样品溶液以1℃·min-1速度从10℃加热至45℃,扫描波长为220 nm。圆二色谱仪通过记录摩尔椭圆率[θ(λ)]的变化,检测随着温度变化胶原蛋白三螺旋结构解螺旋的情况,计算出变性温度。
1.2.7 水解实验
鱼皮胶原蛋白的内部结构通过胃蛋白酶进行水解进一步研究。将各6支试管注入0.1 mL 1 mg·mL-1未冻干的胶原蛋白样品溶液,分别放入30℃和35℃的水浴锅中水浴加热,胃蛋白酶浓度为1/40(w/w),水解时间6 h,分别取6个时间点:0 min、30 min、60 min、120 min、240 min、360 min。将样品加入8μL 1 mol·L-1Tris溶液以调节溶液pH和50μL混合染色液终止水解反应,通过SDS-PAGE观察胶原蛋白样品水解结果。
2 结果与分析
2.1 鱼皮胶原蛋白结构和分子质量
图1为8种胶原蛋白样品的电泳图谱,电泳图谱显示每一种胶原蛋白样品都由两条不一样的α链组成,即α1链和α2链,其中α1链的分子量比α2大且含量也更多。由图1可知,8种胶原蛋白样品均为I型胶原蛋白[15],β链则出现在所有类型的胶原蛋白中,它是α链的二聚体,在图谱最上端的γ链则是α链的三聚体。通过对照蛋白标准液标记,β链的相对分子质量约为198 KDa,α链约为117 KDa。所以,胶原蛋白的相对分子质量约为315 KDa。

图1 8种胶原蛋白样品的电泳图谱Fig.1 SDS-PAGE of fish skin collagen samples
2.2 溶解度
2.2.1 pH值对鱼皮胶原蛋白溶解度的影响
实验结果表明,在酸性溶液中鱼皮胶原蛋白更易溶解,如图2所示。当pH值在1~3之间,胶原蛋白的溶解度较高;随着pH逐渐上升,鱼皮胶原蛋白的溶解度明显下降。当pH达到7,溶解度最低。碱性溶液中,胶原蛋白的溶解度始终保持在最低水平。
2.2.2 NaCl浓度对鱼皮胶原蛋白溶解度的影响
NaCl浓度决定了溶液的离子强度,如图3所示,随着NaCl浓度不断升高(即离子强度增强),鱼皮胶原蛋白溶解度明显下降。当NaCl浓度在0~4%之间,下降趋势较平缓;当NaCl浓度达到5%,溶解度下降趋势明显。分析胶原蛋白溶解度随NaCl浓度升高而下降的原因,应是随着离子强度的增加,胶原蛋白分子肽链间疏水基团的相互作用增加了。

图2 pH对鱼皮胶原蛋白溶解度的影响Fig.2 Fish skin collagen concentrations of samples at different pH values

图3 NaCl浓度对鱼皮胶原蛋白溶解度的影响Fig.3 Fish skin collagen concentrations of samples at different NaCl concentrations
2.3 热稳定性
在10℃时对样品光谱扫描结果见图4,由图4可以看出,在220 nm处出现了胶原蛋白的特征峰,表明从鱼皮中提取的样品为拥有完整三螺旋结构的胶原蛋白样品。当样品加热至45℃后降至10℃再次扫描样品,此时不见正吸收峰,表明胶原蛋白样品变性,三螺旋结构在加热过程中解螺旋了。温度回复至10℃后,解螺旋后的胶原蛋白样品并没有重新恢复三螺旋结构,这说明胶原蛋白的受热变性是不可逆的。
在波长220 nm处,温度从10℃升至45℃,期间对胶原蛋白样品进行光谱扫描,将所得曲线微分处理得图5。由图5可知,鮰鱼ASC、PSC和鲅鱼ASC、PSC样品分别约在36.5℃和30.5℃时处于解螺旋最大速率,所以36.5℃为鮰鱼鱼皮胶原的变性温度,30.5℃为鲅鱼鱼皮胶原的变性温度,且性质改变无恢复性。
2.4 水解实验
在30℃、酶浓度1/40(w/w)的条件下,水解实验中6个时间点鮰鱼鱼皮样品所得的SDSPAGE如图6所示。在30℃时,鮰鱼鱼皮胶原蛋白基本无法被水解,只有极少量的ASC被水解,而PSC完全没有水解。分析原因可能由于鮰鱼鱼皮胶原蛋白的变性温度为36.5℃,所以在30℃条件下,胶原蛋白有良好的热稳定性,不易被水解。

图4 鱼皮胶原蛋白样品的圆二色谱仪扫描(10℃)Fig.4 CD spectrum of fish skin collagen samples(10℃)
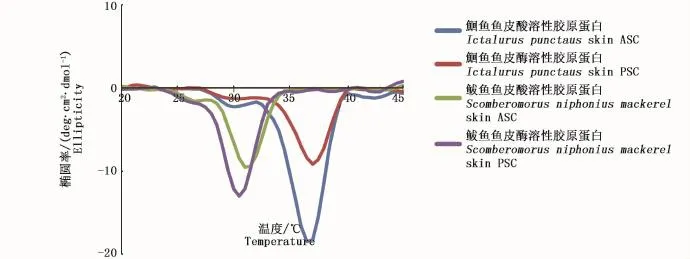
图5 鱼皮胶原蛋白样品的解螺旋Fig.5 Unfolding of fish skin collagen samples

图6 30℃条件下鮰鱼鱼皮ASC和PSC的水解电泳图谱Fig.6 Digestion SDS-PAGE of Ictalurus punctaus skin ASC and PSC at 30℃

图7 35℃条件下鮰鱼鱼皮ASC和PSC的水解电泳图谱Fig.7 Digestion SDS-PAGE of Ictalurus punctaus skin ASC and PSC at 35℃
在35℃、酶浓度1/40(w/w)的条件下,水解实验中6个时间点鮰鱼鱼皮样品所得的SDSPAGE如图7所示。在35℃下鮰鱼鱼皮胶原蛋白样品都能够被水解,ASC完全被水解,PSC只有部分被水解。由此得出,鮰鱼PSC比ASC有更好的稳定性。由鮰鱼鱼皮胶原蛋白的水解电泳图谱可以看出,胶原蛋白中的β链比α链更容易被水解,ASC中的β链在30 min时就基本上完全被水解,α链在120 min时才大量被水解。对比ASC和PSC的水解所得肽链片段基本一样,除PSC未水解完全部分,可知这两种胶原蛋白被水解时所断裂的肽链位置一致。
在30℃、酶浓度1/40(w/w)的条件下,水解实验中6个时间点鲅鱼鱼皮样品所得的SDSPAGE如图8所示。在30℃时,只有少量ASC和PSC被水解,ASC和PSC的水解程度基本一致。与鮰鱼鱼皮胶原蛋白的水解情况相比,鲅鱼鱼皮胶原蛋白在30℃时更易被水解,这可能是由于鲅鱼鱼皮胶原蛋白的变性温度为30.5℃,所以在30℃条件下,胶原蛋白可以被部分水解。

图8 30℃条件下鲅鱼鱼皮ASC和PSC的水解电泳图谱Fig.8 Digestion SDS-PAGE of Scomberomorus niphonius skin ASC and PSC at 30℃
在35℃、酶浓度1/40(w/w)的条件下,水解实验中6个时间点鲅鱼鱼皮样品所得的SDSPAGE如图9所示。在35℃下胶原蛋白样品都能够完全被水解。ASC和PSC的水解程度也基本一致。由鲅鱼鱼皮胶原蛋白水解电泳图谱可以看出,其胶原蛋白中的β链与α链的水解程度基本一致。对比ASC和PSC的水解所得肽链片段是相同的。
3 小结
本研究通过优化提取方法提高了酸溶性胶原蛋白和酶溶性胶原蛋白的提取效率,将整个提取周期缩短至7 d。通过聚丙烯酰胺凝胶电泳鉴定可知从鱼皮和鱼肉中提取的胶原蛋白样品为I型胶原蛋白,计算得出胶原蛋白的相对分子质量约为315 KDa。

图9 35℃条件下鲅鱼鱼皮ASC和PSC的水解电泳图谱Fig.9 Digestion SDS-PAGE of Scomberomorus niphonius skin ASC and PSC at 35℃
鮰鱼和鲅鱼鱼皮胶原蛋白在酸性环境下易溶,在中性和碱性条件下难溶。在离子强度低的溶液中易溶,离子强度高的溶液中难溶。鮰鱼鱼皮胶原蛋白较鲅鱼鱼皮胶原蛋白具有更高的热稳定性,且不易被水解,更适合投入应用产业。所以,鮰鱼鱼皮较鲅鱼鱼皮是一种更为优质的胶原蛋白源,具有更大的经济潜力。
[1]NAGAIT,SUZUKIN.Isolation of collagen from fish waste material-skin,bone and fin[J].Food Chemistry,2000(68):277-281.
[2]DUAN R,ZHANG J J,DU X Q,et al.Properties of collagen from skin,scale and bone of carp(Cyprinus carpio)[J].Food Chemistry,2009(112):702-706.
[3]连喜军,鲁晓翔,刘勤生,等.鱼类胶原蛋白研究进展[J].肉类研究,2007(1):46-49.
LIAN X J,LU X X,LIU Q S,et al.Research on process of fish collagen[J],Meat Research,2007(1):46-49.
[4]ZUCCHELLIM,TORKVIST L,BRESSO F,et al.No association between the eczema genes COL29A1 and IL31 and inflammatory bowel disease[J].Inflammatory Bowel Disease,2009,15(7):961-962.
[5]KIMURA S,MATSUURA F.The chain compositions of several invertebrate collagens[J].Journal of the Science of the Food and Agriculture,1974,75(6):1231-1240.
[6]NAGAI T,OGAWA T.Collagen of edible jellyfish exumbrella[J].Journal of the Science of the Food and Agriculture,1999,79(6):855-858.
[7]林 琳,郑 钰,吕 顺,等.有机酸提取草鱼皮胶原蛋白的工艺研究[J].安徽农业科学,2009,37(5):2246-2247.
LIN L,ZHENG Y,LV S,et al.Research on the process of extracting collagen from grass carp skin with organic acid[J],Journal of Anhui agricultural Sciences,2009,37(5):2246-2247.
[8]张慧君,罗仓学,张新申,等.胶原蛋白的应用[J].皮革科学与工程,2003,13(6):37-41.
ZHANG H J,LUO C X,ZHANG X S,et al.Application of collagen[J].Leather Science and Engineering,2003,13(6):37-41
[9]刘丽娜,付湘晋,许时婴.斑点叉尾鮰鱼皮明胶的风味成分及其脱腥的研究[J].食品与发酵工业,2007,33(12):94-98
LIU L N,FU X J,XU S Y.Research on deodorization and flavor components of channel catfish skin gelatin[J].Food and Fermentation Industries,2007,33(12):94-98
[10]夏宗祥.中国斑点叉尾鮰引进及其出口贸易浅析[J].对外经济贸易,2010(3):52-54
XIA Z X.China ictaluruspunctatus introduction and analysis of the export trade[J].Practice in Foreign Economic Relations and Trade,2010(3):52-54.
[11]NAGAIT,SUZUKIN.Isolation of collagen from fish waste material-skin,bone and fins[J].Food Chemistry,2000(68):277-281.
[12]KIMURA S,ZHU X P,Thermal stability and subunit composition of muscle and skin typeI collagens from skipjack[J].Nippon Suisan Gakkaishi,1991,57(4):755-760.
[13]DUAN R,ZHANG JJ,DU X Q,et al.Properties of collagen from skin,scale and bone of carp(Cprinuscarpio)[J].Food Chemstry,2009(112):702-706
[14]段 蕊,叶 超,邢芳芳,等.采用圆二色谱法研究冬夏鲢鱼鳞胶原蛋白的稳定性[J].生产与科研经验,2010,26(1):73-76.
DUAN R,YE C,XING F F,et al.Comparison on stability of scale collagens from silver carp(hypophthalmichthys molitrix)by circular dichroism[J].Food and Fermentation Industries,2010,26(1):73-76.
[15]KIMURA K,MIYAUCHIY,UCHIDA N.Scale and bone typeIcollagen of carp(Cyprinus carpio)[J].Comparative Biochemistry and Physiology,1991,99B(2):473-476.
Isolation and characterization of collagen from skin of Ietalurus punetaus and Scomberomorus niphonius
HUANG Wen1,YUAN Chun-hong2,XU Meng1,WANG Jin-mei1,BAO Jian-qiang1
(1.Shanghai Ocean University,Shanghai201306,China,2.Kagoshima University,Kagoshima890-0056,Japan)
This paper choseIetalurus punetaus(channel catfish)andScomberomorus niphonius(Japanese Spanish mackerel)fish skin as materials to study the isolation of collagen from skin and meat.In the pretreatment,the fish skin samples were cut into small pieces possibly and the frequency of solution change rate was adjusted;in the extraction step,before salting out of collagen the pH of solution was adjusted to neutral by adding Tris.As a reslut,the extraction yield of collagen reached 22.79%of wet weight by modified method and the extraction duration was 7 days.The denaturation temperature of channel catfish was 36.5℃while the mackerel was 30.5℃.When the digestion temperature was 35℃,it can be completely digested.And the result of SDS-PAGE of digestion showed the collagen from Japanese Spanish mackerel was more easily to be digested than the collagen from channel catfish.Therefore,the thermal stability of collagen from channel catfish skin was more stable than mackerel.
Ietalurus punetaus;Scomberomorus niphonius;collagen;extraction method
TS 254.9
A
1004-2490(2016)02-0198-08
2015-06-16
水产动物遗传育种中心上海市协同创新中心项目(ZF1206);上海市科委工程中心建设项目(11DZ2280300)
黄 雯(1989-),女,上海人,硕士研究生,食品科学与工程专业。E-mail:hw41618@163.com
包建强,教授。E-mail:baojq@shou.edu.cn
