盐度骤降对云纹石斑鱼肝脏代谢酶活力的影响
2016-03-09施兆鸿廖雅丽王孝杉高权新彭士明张晨捷
施兆鸿,廖雅丽,王孝杉,高权新,彭士明,张晨捷
(1.上海海洋大学水产与生命学院,上海 201306;2.中国水产科学研究院东海水产研究所,上海 200090)
盐度骤降对云纹石斑鱼肝脏代谢酶活力的影响
施兆鸿1,2,廖雅丽1,2,王孝杉2,高权新2,彭士明2,张晨捷2
(1.上海海洋大学水产与生命学院,上海 201306;2.中国水产科学研究院东海水产研究所,上海 200090)
为探讨云纹石斑鱼(Epinephelus moara)肝脏代谢酶活力对盐度骤降的响应,设置27(对照组)、21、15、9共4个盐度梯度对云纹石斑鱼进行盐度骤降胁迫实验。分别在0、1、2、3、7 d时取样,测定其肝脏中酸性磷酸酶(ACP)、碱性磷酸酶(AKP)、谷丙转氨酶(GPT)、谷草转氨酶(GOT)以及乳酸脱氢酶(LDH)活力。结果显示,ACP活力盐度21组先波动变化后恢复正常水平,盐度15组先下降后升高,随后第7天下降恢复正常水平;AKP活力盐度21组和盐度15组先呈下降趋势,第3天大幅度升高;GPT与LDH活力盐度21组和盐度15组基本呈现先下降再上升并波动的变化趋势;GOT活力变化趋势盐度21组先升后降,盐度15组先降后波动。研究表明:在盐度27骤降至21或15,均会使云纹石斑鱼产生应激反应,磷酸酶、转氨酶与乳酸脱氢酶活力初期均会受到抑制,随时间延长可以得到恢复;而当盐度从27骤降至9,3 d时实验鱼全部死亡。
云纹石斑鱼;骤降低盐胁迫;肝脏代谢酶
云纹石斑鱼(Epinephelus moara)俗称真油斑,属鲈形目(Perciformes),鮨科(Serranidae),石斑鱼属。具有肉味鲜美、生长快、环境适应性强、经济价值高等特点[1-2],是我国东南沿海地区重要养殖对象[3]。盐度作为水产养殖中重要的环境因子,直接影响水生生物的生长与存活。目前国内外关于云纹石斑鱼的研究主要有淋巴囊肿病、育苗技术、摄食生长、形态发育等[4-7],而盐度胁迫方面的研究报道主要集中在形态学方面,如盐度对其胚胎发育、仔鱼活力、早期幼鱼生长和存活的影响等[8-9]。
酸性磷酸酶(acid phosphatase,ACP)和碱性磷酸酶(akaline phosphatase,AKP)是衡量机体免疫机能和健康状况的重要指标[10]。水生生物机体部分新陈代谢由物质的磷酸化和去磷酸化进行调节,这些过程主要依靠不同磷酸酶催化完成[11]。转氨酶存在于血浆及多种身体组织中,但最常见与肝脏有关。转氨酶的种类很多,以谷丙转氨酶(alanine aminotransferase,GPT)和谷草转氨酶(aspartate transaminase,GOT)最为重要,是氨基酸代谢过程中两个重要的氨基转移酶,可以作为评价摄食水平、生长发育和肝功能测试的指标[12]。乳酸脱氢酶(lactate dehydrogenase,LDH)是糖酵解途径与柠檬酸循环之间的关键酶,能催化丙酮酸与乳酸之间的相互转化,并提供能量[13],其活力大小在一定程度上反映了无氧代谢能力的高低。VIJAYAVEL等[14]对锯缘青蟹(Scylla serrata)的研究认为,抑制乳酸脱氢酶活力能够导致呼吸下降,并影响机体氧化磷酸化作用,进而影响生物体能量供给和生理活动的进行。因此,ACP、AKP、GPT、GOT及LDH 5种酶在研究鱼类受盐度胁迫下组织功能及生理变化具有重要的意义,酶活性变化趋势可以间接的反映体内生理动态变化及组织损伤情况[15]。本实验首次研究了从盐度27骤降至9、15和21(7 d)对云纹石斑鱼肝脏中代谢酶(ACP、AKP、GPT、GOT、LDH)的影响,旨在明确其对盐度变化胁迫的响应,以期为养殖环境因子调控提供参考。
1 材料与方法
1 实验用鱼和条件
实验于2014年9月在上海水产研究所启东养殖基地进行。云纹石斑鱼幼鱼由黄海水产研究所提供,平均体长(10.43±1.08)cm,平均体质量(16.73±4.47)g。鱼运抵养殖基地后先在水温(27±1.0)℃、盐度27的环境中暂养14 d。暂养密度20 ind·m-3,每天8∶00和17∶00各饱食投喂由日本林兼株式会社生产的“鱼宝”牌6#(粒径大小:1.1~1.3 mm)配合饲料,不间断充气,每天换同盐同温水25%,同时吸去底部污物及残饵。实验用水为沉淀过滤处理后的天然海水。
1.2 实验设计
实验在直径1.0 m、深度0.8 m的圆形玻璃钢桶中进行。盐度梯度设为27、21、15、9,以暂养海水盐度27为对照组,低盐度海水(盐度21、15、9)用曝气后自来水兑天然海水配置,实验用水配制稳定48 h后使用。每个盐度梯度设3个平行,共12个桶。实验开始时,用手操网随机从暂养群体中捞取个体直接放入各盐度组(含对照组)水体中,每个平行20 ind。实验期间的投喂和管理与暂养期间相同,每天观察鱼的活动状况,及时捞出死鱼,统计死亡情况。从实验鱼放入各盐度组水体作为起始0 h并开始计时,在1、2、3、7 d各盐度梯度组中分别取样,每平行每次取3 ind。
1.3 取样和指标测定
取样前停喂饲料1次,用MS222(200 mg· L-1)将鱼麻醉后,将鱼置于冰盘上解剖,取出肝脏,用预冷生理盐水冲洗,并用吸水纸吸干,置于1.5 mL离心管中-20℃保存,在30 d内检测ACP、AKP、GPT、GOT及LDH活力。测定前,先将肝脏在匀浆介质(pH 7.4,0.01 mol·L-1Tris-HCl,0.000 1 mol·L-1EDTA-2Na,0.01 mol· L-1蔗糖,0.8%NaCl)中剪碎,用匀浆机15 000 r·min-1研磨制成匀浆。用低温离心机4℃下1 500 r·min-1离心5 min。根据需要,取上清液稀释后进行酶活力及总蛋白测定。
总蛋白采用考马斯亮兰法(南京建成试剂盒)进行测定。酶活力均采用南京建成试剂盒检测,按照说明书进行操作。其中,ACP活力和AKP活力测定采用磷酸苯二钠法,活力单位定义为每克组织蛋白在37℃与基质作用30 min和15 min,产生1 mg酚者为1个活力单位。GOT和GPT两种酶活力测定采用King氏法,活力单位定义为生成产物1 min内使NADH氧化成NAD+而引起吸光度每下降0.001为1个活力单位。LDH活力测定采用比色法测定,活力单位定义25℃条件下,每分钟催化1μmol的丙酮酸转化为乳酸的酶量为1个活力单位。
1.4 数据统计与分析
实验数据用SPSS 19.0软件进行统计与分析。运用单因素方差分析,先进行方差齐性检验,不满足方差齐性时,对数据进行自然对数或平方根转换,然后采用Duncan’s检验进行多重比较,P<0.05为有显著性差异,数据以平均值±标准差(Mean±SD)表示。用Excel 2007绘制图表。
2 结果与分析
2.1 不同盐度下云纹石斑鱼肝脏酸性磷酸酶(ACP)活性变化
随着盐度骤降的幅度增大和胁迫时间的延长,云纹石斑鱼肝脏ACP活力的变化见图1。盐度21组的ACP活力呈波动的变化趋势,在第1天和第3天出现两个峰值,且峰值显著高于其它时间的值(P<0.05);盐度15组ACP活力呈先下降后升高的趋势,第2天出现峰值且为各时间点中最高(P<0.05);盐度21和15组在第7天时都恢复到实验开始时水平,且均与盐度27组之间无显著性差异(P>0.05)。盐度9组ACP活力呈不断上升的趋势(P<0.05)。此外,盐度9组在实验第2天出现个别死亡,至实验第3天时全部死亡(死亡情况以下各部分不再重复描述)。同一时间的不同处理组,随着盐度的降低,第1、2、7天均呈波动变化趋势,第3天呈不断上升的变化趋势。
2.2 不同盐度下云纹石斑鱼肝脏碱性磷酸酶(AKP)活性变化
不同盐度下肝脏AKP活力的变化见图2。盐度21组与盐度15组AKP活力呈先下降后上升最后恢复的趋势,且均在第3天出现峰值;盐度21组第3天AKP活力值为不同时间点各组中最高(P<0.05);盐度9组AKP活力呈不断下降趋势(P<0.05)。对于同一时间的不同处理组:第1、3天AKP活力随盐度降低均呈波动变化趋势,第2、7天随盐度降低AKP酶活力下降且均未低于对照组。
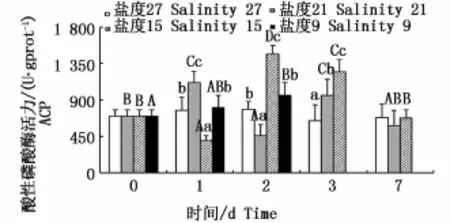
图1 不同盐度下云纹石斑鱼肝脏酸性磷酸酶(ACP)活性Fig.1 Activity of ACP in the liver of Epinephelus moara reared at different salinities
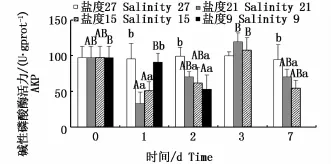
图2 不同盐度下云纹石斑鱼肝脏碱性磷酸酶(AKP)活性Fig.2 Activity of AKP in the liver of Epinephelus moara reared at different salinities
2.3 不同盐度下云纹石斑鱼肝脏谷丙转氨酶(GPT)活性
不同盐度下肝脏GPT活力的变化见图3。盐度21组GPT活力呈波动的变化趋势(P<0.05),且均未超过初始值;盐度15组与盐度9组GPT活力呈先下降后上升的趋势,盐度15组第3天出现峰值,且为不同时间点各组中最高(P<0.05);盐度9组第2天AKP活力值显著升高(P<0.05)。对于同一时间的不同处理组:随盐度降低各组GPT活力均呈波动变化趋势。
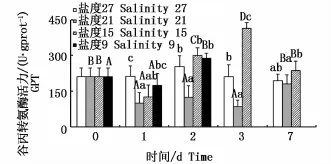
图3 不同盐度下云纹石斑鱼肝脏谷丙转氨酶(GPT)活性Fig.3 Activity of GPT in the liver of Epinephelus moara reared at different salinities
2.4 不同盐度下云纹石斑鱼肝脏谷草转氨酶(GOT)活性
不同盐度下肝脏GOT活力的变化见图4。盐度21组GOT活力呈先升高后降低的趋势,第1天出现峰值(P<0.05);盐度15组GOT活力呈先下降后上升再下降的趋势,第2天出现峰值,且为不同时间点各组中最高(P<0.05);盐度9组GOT活力呈不断上升的变化趋势(P<0.05)。对于同一时间的不同处理组,GOT活力随盐度降低均呈波动变化趋势。
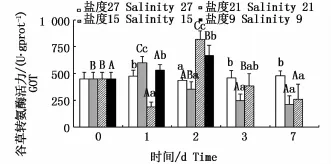
图4 不同盐度下云纹石斑鱼肝脏谷草转氨酶(GOT)活性Fig.4 Activity of GOT in the liver of Epinephelus moara reared at different salinities
2.5 不同盐度下云纹石斑鱼肝脏乳酸脱氢酶(LDH)活性
不同盐度下肝脏LDH活力的变化见图5。盐度21组与15组LDH活力均呈先降低后升高再恢复的变化趋势,且均在第3天出现峰值,盐度21组第3天为不同时间点各组中最高(P<0.05);盐度9组LDH活力呈先下降后上升的变化趋势(P<0.05),但均未超过对照组。同一时间各处理组LDH活力随盐度降低均呈波动变化趋势。
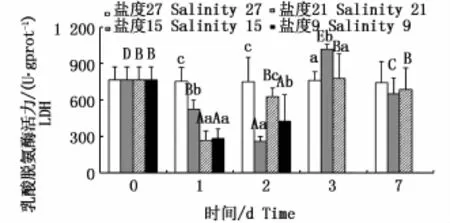
图5 不同盐度下云纹石斑鱼肝脏乳酸脱氢酶(LDH)活性Fig.5 Activity of LDH in the liver of Epinephelus moara reared at different salinities
3 讨论
3.1 不同盐度对云纹石斑鱼肝脏磷酸酶活力的影响
有研究显示,海洋生物在应对盐度变化的过程中,ACP与AKP活力会随着盐度的降低显著升高或者先降低再升高。文昌鱼(Branchiostoma lanceolatum)的培育盐度低于28.0~32.0范围时,磷酸酶活性显著升高[16];仿刺参(Apostichopus japonicus)在盐度胁迫下ACP和AKP活力先升高后降低[17];三疣梭子蟹(Portunus trituberculatus)在低盐14胁迫下,ACP和AKP活力先降后升再降[18];锯缘青蟹(Scylla serrata)在急性低盐胁迫时AKP活力显著被抑制,而高盐度的和小幅度低盐度的变化,会刺激机体使AKP活力增强[19]。本实验结果与上述研究基本一致,ACP活力盐度15组云纹石斑鱼第1天降低,第2天显著升高,盐度21组呈波动趋势,盐度9组呈升高趋势;AKP活力盐度21组与15组实验鱼均先降低后升高再恢复,盐度9组呈降低趋势。即在本实验初期盐度胁迫基本上在短时间内会先显著抑制磷酸酶活力,至实验第2天或第3天磷酸酶活力恢复并大幅升高,也有部分盐度胁迫会刺激鱼体,磷酸酶活力直接升高。整体升高的趋势说明盐度骤降引起云纹石斑鱼的应激反应,磷酸酶活力升高以增强鱼体免疫防御能力。对于不同盐度胁迫下,云纹石斑鱼机体内磷酸酶活力并不随盐度降低而成比例的变化,说明云纹石斑鱼在急性低盐胁迫下,不同的盐度范围有不同的免疫调节反应。
3.2 不同盐度对云纹石斑鱼肝脏转氨酶活力的影响
有研究表明,在盐度胁迫下生物需要足够的能量用于渗透调节,机体内大量营养物质被调动,多种氨基酸参与并被用于为渗透压调节提供能量[20],体内游离氨基酸如谷氨酸、丙氨酸、甘氨酸、脯氨酸和牛磺酸[21]含量会随盐度胁迫而升高。凡纳滨对虾(Litopenaeus vannamei)在低盐度胁迫下,其肝胰腺中蛋白质含量显著升高,以保障机体分解蛋白质时有足够的游离氨基酸来调节机体的渗透[22]。目前对于这种现象的解析主要有两种观点:GEOFFRIOR等[23]从能量学的角度认为机体在渗透胁迫下,体内游离氨基酸的动态变化与机体的能量消耗相关,高渗胁迫下,游离氨基酸的形成主要来自体内蛋白质的降解;而HOCHACHKA等[24]则认为机体为了获得足够的游离氨基酸用于渗透压调节,在一定程度上降低了从头合成途径的效率,从而使机体组织中的某些游离氨基酸积累量升高。转氨酶是组织中将一种氨基酸的氨基转运到另一种氨基酸上的一类氨基转移酶,参与氨基酸的分解和合成,其活性高低在一定程度可以反映氨基的转移能力[25]。本研究测定了不同盐度云纹石斑鱼肝脏中谷草转氨酶和谷丙转氨酶的活力,结果发现,盐度骤降胁迫下云纹石斑鱼肝脏中转氨酶活力呈先降低后升高的趋势。由此可见,初期盐度骤降对云纹石斑鱼肝脏中转氨酶活力产生一定的抑制作用,鱼体适应后,转氨酶活力恢复并显著升高,使氨基转运活力上升以抵抗环境胁迫。所以,根据转氨酶的功能,笔者推测云纹石斑鱼为了在低盐度下进行渗透调节,动用机体储存的蛋白质转化成游离氨基酸为渗透调节供能,这种解释与DEATON[26]的观点相符,且因转氨酶活力的升高推测鱼体内游离氨基酸的升高主要来自于蛋白质的降解,这与凡纳滨对虾在低盐度慢性胁迫下,其体内转氨酶活力会升高以加快机体氨基转运速度研究结果相似。
转氨酶主要存在于肝脏中,正常情况下,肝细胞内的转氨酶只有少量被释放到血液中,血清中的转氨酶活性较低。有研究通过测定血清中转氨酶含量,来判断环境变化对肝细胞的损伤程度。如大黄鱼(Pseudosciaena crocea)在盐度突降后血清中GPT和GOT显著上升[27];红耳龟(Trachemys scripta)在不同盐度胁迫下血液中GPT和GOT活性均显著升高[28]。肝脏中转氨酶活性也会因渗透胁迫而发生变化,如虎斑乌贼(Sepia plaraonis)幼体在盐度渐变情况下肝脏GOT活性和GPT呈先上升后下降的变化趋势[29];大马哈鱼(Oncorhynchus keta)在低盐度胁迫下,肝脏中GPT和GOT活性均降低[30]。
3.3 不同盐度对云纹石斑鱼肝脏乳酸脱氢酶活力的影响
脱氢酶类是生物体内氧化还原反应中重要的催化剂之一,在生物体内的氧化产能、解毒以及某些生理活动[31](如Cori循环)中起着很重要的作用。LDH是糖酵解途径与TCA循环之间的关键酶[32-34],其活力可作为衡量无氧代谢水平的指标之一[35]。本实验中,云纹石斑鱼肝脏中LDH先降低后升高,说明盐度骤降初期其机体内无氧代谢并不旺盛,甚至抑制了LDH的活力,直至第3天由LDH催化产生的NAD+保障了无氧条件下糖酵解作用的持续进行[34],从而为其抵御环境胁迫提供了能量。然而,盐度骤降为9时,云纹石斑鱼LDH活力逐渐下降并未恢复正常水平,说明盐度骤降至9时云纹石斑鱼无氧代谢会受到一定程度的阻碍,影响鱼类生长存活。此外,SOMERO等[36]认为LDH活力水平与生物高速游动的能力密切相关,并且随着规格的增大而增大。这可能是大规格生物游动对能量需求更大,使得LDH活力增大。由于鱼的种类繁多,实验所取的个体大小也各不相同,无法获得一个标准的范围值(如人类的LDH正常标准值为109~ 245、GPT和GOT标准值均为5~50),因此本实验只能说明受胁迫后各测试指标的变化趋势。
4 小结
本实验通过检测云纹石斑鱼在盐度骤降条件下肝脏中ACP、AKP、GPT、GOT及LDH活力随时间变化的情况,探讨了云纹石斑鱼肝脏代谢酶对盐度骤降的响应。研究结果表明云纹石斑鱼在盐度骤降胁迫下,部分盐度下磷酸酶、转氨酶与LDH酶活力初期会受到抑制,随后恢复,部分直接升高以抵御胁迫伤害。本研究使用的鱼规格较小,盐度骤降对鱼体生长影响大,因此在云纹石斑鱼幼鱼的养殖生产中应避免养殖水体盐度大幅度急剧降低。
[1]宋振鑫,陈 超,翟介明,等.云纹石斑鱼生物学特性及人工繁育技术研究进展[J].渔业信息与战略,2012,27(1):47-53.
SONG Z X,CHEN C,ZHAI JM,et al.Biological characteristics and progress of artificial breeding technique for Kelp Bass,Epinephelus moara[J].Fisheries Information&Strategy,2012,27(1):47-53.
[2]区又君.石斑鱼类的人工繁育技术[J].海洋与渔业,2009,12(3):14-15.
QU Y J.Artificial breeding technology ofEpinephalus[J].Ocean and Fishery,2009,12(3):14-15.
[3]王新安,马爱军,陈 超,等.七带石斑鱼(Epinephelus septemfasciatus)两个野生群体形态差异分析[J].海洋与湖沼,2008,39(6):655-660.
WANG X A,MA A J,CHEN C,et al.Orphological varlation in two wild populations of sevenband grouper(Epinephelus septemfasciatus)[J].Oceanologia Et Limnologia Sinica,2008,39(6):655-660.
[4]孙 鹏,尹 飞,王建建,等.操作胁迫对云纹石斑鱼肝脏抗氧化和鳃Na+-K+ATPase活力的影响[J].海洋渔业,2014,36(3):247-251.
SUN P,YIN F,WANG JJ,et al.Effects of handling stress on activities of antioxidant enzymes in liver and Na+-K+ATPase in gill ofEpinephelus moara[J].Marine Fisheries,2014,36(3):247-251.
[5]杨求华,黄种持,郑乐云,等.云纹石斑鱼(♀)×赤点石斑鱼(♂)杂交子代胚胎发育及生长[J].海洋渔业,2014,36(3):224-231.
YANG Q H,HUANG Z C,ZHENG L Y,et al.Embryonic development and growth of hybrid from the hybridization ofEqinephelus moara(♀)×E.akaara(♂)[J].Marine Fisheries,2014,36(3):224-231.
[6]陆丽君,陈 超,马爱军,等.云纹石斑鱼(Epinephelus moara)早期发育阶段的摄食与生长特性[J].海洋与湖沼,2011,42(6):822-829.
LU L J,CHEN C,MA A J,et al.Studies on the feeding behavior and morphological developments ofEpinephelus moarain early development stages[J].Oceanologia Et Limnologia Sinica,2011,42(6):822-829.
[7]宋振鑫,陈 超,翟介明,等.云纹石斑鱼胚胎发育及仔、稚、幼鱼形态观察[J].渔业科学进展,2012,33(3):26-34.
SONG Z X,CHEN C,ZHAI J M,et al.Embryonic development and morphological characteristics of larval,juvenile and young Kelp bass,Epinephelus moara[J].Progress in Fishery Sciences,2012,33(3):26-34.
[8]宋振鑫,陈 超,吴雷明,等.盐度与pH对云纹石斑鱼胚胎发育和仔鱼活力的影响[J].渔业科学进展,2013,34(6):52-58.
SONG Z X,CHEN C,WU L M,et al.Effects of salinity and pH on the embryonic development and larval activity of kelp bassEpinephelus moara[J].Progress in Fishery Sciences,2013,34(6):52-58.
[9]刘银华,钟幼平,曾庆民,等.温度和盐度对云纹石斑鱼早期幼鱼生长和存活的影响[J].集美大学学报(自然科学版),2014,19(4):241-246.
LIU Y H,ZHONG Y P,ZENG QM,et al.Effects of temperature and salinity on the growth and survivability of youngEpinephelus moara[J].Journal of Jimei University(Natural Science),2014,19(4):241-246.
[10]刘树青,江晓路,牟海津,等.免疫多糖对中国对虾血清溶菌酶、磷酸酶和过氧化物酶的作用[J].海洋与湖沼,1999,30(3):278-283.
LIU SQ,JIANG X L,MOU H J,et al.effects of immunopoiysaccharide on LSZ,ALP,ACP and POD activities of penaeus chinensis serum[J].Oceanologia Et Limnologia Sinica,1999,30(3):278-283.
[11]PIPE R K.Hydrolytic enzymes associated with the granular haemocytes of the marine mussel mytilus edulis[J].The Histochemical Journal,1990,11(22):596-603.
[12]SAMSONOVA M V,MINKOVA N O,LAPTEVA T I,et al.Aspartate and alanine aminotransferases in early development of the keta[J].Russian Journal of Developmental Biology,2003,34(1):14-18.
[13]梁 淼.刺参(Apostichopus japonicas)个体生长差异的实验研究[D].青岛:中国海洋大学,2010:1-164.
LIANG M.Experimental studies on individual variation in growth and causes in sea cucumber,Apostichopus japonicus[D].Qingdao:Ocean University of China,2010:1-164.
[14]VIJAYAVEL K,BALASUBRAMANLANM P.Changes in oxygen consumption and respiratory enzymes as stress indicators in an estuarine edible crabScylla serrataexposed to naphthalene[J].Chemosphere,2006,63(9):1523-1531.
[15]贾 冬,赵 敏.脓毒症大鼠血清乳酸、乳酸清除率及转氨酶水平与肝脏损伤关系的探讨[J].中国医科大学,2013,15(10):1353-1357.
JIA D,ZHAO M.The serum lactate clearance rate and transaminase levels in septic rats and its relationship with liver damage[J].Chinese Medical Sciences University,2013,15(10):1353-1357.
[16]白秀娟,卢伙胜,刘晓彬,等.盐度、pH胁迫对茂名海域文昌鱼磷酸酶活性的影响[J].海洋通报,2009,28(4):42-46.
BAIX J,LU H S,LIU X B,et al.Effect of salinity and pH on the ACP and ALP ofBranchiostoma belcheriin Maoming Sea Area[J].Marine Science Bulletin,2009,28(4):42-46.
[17]王 冲,田 燚,常亚青,等.盐度胁迫对刺参非特异性免疫酶的影响[J].中国农业科技导报,2013,15(3):163-168.
WANG C,TIAN Y,CHANG Y Q,et al.Effect of salinity stress on immune enzyme activity of sea cucumber(Apostichopus japonicus)[J].Journal of Agricultural Science and Technology,2013,15(3):163-168.
[18]郑萍萍.盐度胁迫对三疣梭子蟹血清非特异性免疫因子的影响[J].水产科学,2010,29(11):634-638.
ZHENG P P.Effect of salinity stress on serum nonspecific immune factors in swimming crab Portunus trituberculatus[J].Fisheries Science,2010,29(11):634-638.
[19]周素琴.环境胁迫对养殖锯缘青蟹主要免疫因子的影响[D].青岛:中国海洋大学,2006.
ZHOU S Q.Effects of environmental stress on the immune factors inScylla serrata[D].Qingdao:Ocean University of China,2006.
[20]CUZON G,LAWRENCEB A,GAXIOLACG,etal.Nutrition of Litopenaeus vannamei reared in tanks or in ponds[J].Aquaculture,2004,235(1-4):513-551.
[21]SOMERO G N,BOWLUS R D.3-Osmolytes and metabolic and products of molluscs:the design of compatible solute systems1[J].Mollusca,1983:77-100.
[22]李二超,陈立侨,曾 嶒,等.盐度对凡纳滨对虾体组织蛋白质积累、氨基酸组成和转氨酶活性的影响[J].水生生物学报,2009,33(3):532-538.
LI E C,CHEN L Q,ZENG C,et al.Protein accumulation,amino acid profile and amino transferase activities of the white shrimp,litopeneaus vannamei,at different salinities[J].Acta Hydrobiological Sinica,2009,33(3):532-538.
[23]GEOFFRION Y,GUDERLEY H,LAROCHELLE J.The effect of oxygen availability on the osmoregulatory contribution of free amino acids inAcanthamoeba castellanii[J].Canadin Journal of Zoology,1986,64(7):1430-1435.
[24]HOCHACHKA P W,SOMERO G N.Biochemical Adaptation[M].New Jersey:Princeton University Press.1984:27.
[25]PANA C H,CHIEN Y H,HUNTERC B.The resistance to ammonia stress ofPenaeus monodonFabricius juvenile fed diets supplemented with astaxanthin[J].Journal of Experimental Marine Biology&Ecology,2003,297(1):107-118.
[26]DEATON L E.Hyperosmotic volume regulation in the gills of the ribbed mussel,Geukensia demissa:rapid accumulation of betaine and alanine[J].Journal of ExperimentalMarine Biology and Ecology,2001,260(2):185-197.
[27]王 涛,苗 亮,李明云,等.突降盐度胁迫对大黄鱼(Pseudosciaena crocea)血清生理生化及鳃丝Na+/K+-ATP酶活性的影响[J].海洋与湖沼,2013,44(2):421-426.
WANG T,MIAO L,LIM Y,etal.Effects of abrupt salinity decrease on serum physiology,biochemistry and gill Na+/K+-ATP activity of the large yellow croaker pseudosciaena crocea[J].Oceanologia Et Limnologia Sinica,2013,44(2):421-426.
[28]舒超华,张 珂,洪美玲,等.盐度胁迫对红耳龟生长与血液生化指标的影响[J].四川动物,2012,36(6):912-916.
SHU C H,ZHANG K,HONG M L,et al.Effect of salinity stress on trachemys scripta elegans growth and blood biochemical ingredient[J].Sichuan Journal of Zoology,2012,36(6):912-916.
[29]乐可鑫,蒋霞敏,汪 元,等.盐度对虎斑乌贼幼体生长与酶活的影响[J].热带海洋学报,2015,34(6):64-72.
LE K X,JIANG X M,WANG Y,et al.Salinity effects on growth and enzyme activity of juvenileSepia pharaonis[J].Journal of Tropical Oceanography,2015,34(6):64-72.
[30]刘 伟,支兵杰,战培荣.盐度对大麻哈鱼幼鱼血液生化指标及肝组织的影响[J].应用生态学报,2010,21(9):2411-2417.
LIUW,ZHIB J,ZHAN PR.Effects of salinity on haematological biochemistrical indices and liver tissue in juvenileOncorhynchus keta[J].Chinese Journal of Applied Ecology,2010,21(9):2411-2417.
[31]王栋樑,曾强贵,石 瑜.生物化学[M].镇江:江苏大学出版社,2015.
WANG D L,ZENG Q G,SHI Y.Biological chemistry[M].Zhenjiang:Jiangsu University Press,2015.
[32]ABDELMOHSEN H A.Assessment of respiratory and ion transport potential ofPenaeus japonicasgills in response to environmental pollution[J].Mediterranean Marine Science,2009,10(1):5-18.
[33]VALARMATHI S,AZARIAH J.Effects of copper chloride on the enzyme activities of the crabSesarma quadratum(Fabricius)[J].Turkish Journal of Zoology,2003,27(3):253-256.
[34]王镜岩,朱圣庚,徐长法.生物化学(第三版)[M].北京:高等教育出版社,2005.
WANG J Y,ZHU S G,XU C F.Biological chemistry(3 edition)[M].Beijing:Higher Education Press,2005.
[35]BERGES J A,BALLANTYNE J S.Size scaling of whole-body maximal enzyme activities in aquatic crustaceans[J].Canadian Journal of Fisheries&Aquatic Sciences,1991,48(12):2385-2394.
[36]SOMERO G N,CHILDRESS J J.A violation of the metabolism-size scaling paradigm:activities of glycolytic enzymes in muscle increase in larger-size fish[J].Physiological Zoology,1980,53(3):322-337.
Impact of abrupt salinity decrease on metabolic enzymes in the liver of Epinehelus moara
SHI Zhao-hong1,2,LIAO Ya-li1,2,WANG Xiao-shan2,GAO Quan-xin2,PENG Shi-ming2,ZHANG Chen-jie2
(1.College of Fisheries and Life,Shanghai Ocean University,Shanghai201306,China;2.East China Sea Fisheries Research Institute,Chinese Academy of Fishery Sciences,Shanghai200090,China)
This experiment was conducted to investigate the response of metabolic enzymes in the liver ofEpinehelus moarato abrupt salinity decrease.Four salinity groups(27,21,15,9)were designed.The average body length ofEpinehelus moarawas(10.43±1.08)cm and the average body weight was(16.73± 4.47)g.The fish were reared temporarily in the water of(27±1.0)℃temperature and 27 salinity when reaching Shanghai Fisheries Research Institute of Qidong breeding base.The study was conducted in a circular glass cylinder barrelwith 1 m in diameter and 0.8 m in depth.The temporary rearing seawater at salinity 27 was the control group,and the seawater with lower salinities(salinity 21,salinity 15,salinity 9)used tap water after aerationmixed with natural seawater after purification treatment,and the experimentalwater could be used after stabling for 48 hours.Every salinity gradient had 3 parallels and 12 buckets.Fish livers in each group were sampled on day 0,1,2,3,and 7 tomeasure the activities of acid phosphatase(ACP),alkaline phosphatase(AKP),glutamic-pyruvic transaminase(GPT),glutamic-oxalacetic transaminase(GOT)and lactate dehydrogenase(LDH).Results showed that the activity of ACP in salinity 21 group first changed wavely,then recovered to the nomal level.ACP activity in salinity 15 group decreased first and then increased,finally decreased to the normal level on day 7;AKP activity in salinity 21 and 15 groups decreased on day 1 and 2,and then increased significantly on day 3;GPT and LDH activities in salinity 21 and 15 groups first decreased and then increased wavely;GOP activities in 21 salinity group increased first and then decreased,activities in salinity 15 group decreased first and then changed wavely.The results indicated that abrupt salinity decrease from 27 to 21 or 15 could cause stress response ofEpinehelus moara;the phosphatase,aminopherase and LDH activities were all inhibited first and recovered afterward;the abrupt salinity decrease from 27 to 9 caused the death of all fish on day 3.Research highlights:Epinehelus moaracan adapt themselves to a comparatively broad range of salinities and temperature.The impact of abrupt salinity decrease on the metabolic enzymes in the liver ofEpinehelus moarawas studied for the first time in this paper.Abrupt salinity decrease had a significant effect on metabolic enzymes in the liver ofEpinehelus moara,remaining steady salinity had an important ecophysiological significance on maintaining(or recovering)the normal metabolism and keeping the osmotic balance of organism during the culture period.
Epinehelus moara;abrupt salinity decrease;metabolic enzymes in liver
S 917
A
1004-2490(2016)02-0174-08
2015-07-15
中央级公益性科研院所基本科研业务费项目(东2015M04)
施兆鸿,研究员,主要研究方向为海水鱼类繁育与养殖。E-mail:shizh@eastfishery.ac.cn
