0#柴油水溶性成分对黑鲷肝脏、鳃、肌肉组织中抗氧化酶活性的影响
2016-03-09杨杰青许高鹏沈新强
董 冉,蒋 玫,李 磊,杨杰青,许高鹏,沈新强
(1.中国水产科学研究院东海水产研究所,上海 200090;2.上海海洋大学海洋科学学院,上海 201306)
0#柴油水溶性成分对黑鲷肝脏、鳃、
肌肉组织中抗氧化酶活性的影响
董 冉1,2,蒋 玫1,李 磊1,杨杰青1,2,许高鹏1,2,沈新强1
(1.中国水产科学研究院东海水产研究所,上海 200090;2.上海海洋大学海洋科学学院,上海 201306)
采用室内实验方法,研究了不同浓度(0 mg·L-1、0.015 mg·L-1、0.03 mg·L-1、0.06 mg·L-1)0#柴油水溶性成分(WSF)对黑鲷(Sparus macrocephalus)肝脏、鳃和肌肉谷胱甘肽-S-转移酶(GST)、超氧化物歧化酶(SOD)和过氧化氢酶(CAT)的影响。结果显示:(1)肝脏、鳃、肌肉和组织中GST活性与0#柴油具有明显的时间-效应和剂量-效应关系,肝脏组织中GST活性较肌肉和鳃组织中的更为灵敏;(2)各组织中SOD活性随时间和剂量的变化整体无明显规律;(3)肝脏组织中CAT活性先诱导后抑制,肌肉中始终被诱导,鳃中始终被抑制。CAT活性变化幅度不如GST明显。实验表明,黑鲷肝脏组织中GST更适合作为0#柴油污染响应的生物标志物,用作早期海洋石油污染的预警和监测的指标之一。
0#柴油;黑鲷;肝脏;鳃;肌肉;抗氧化酶
石油是一种复杂的混合物,由烷烃、芳烃、杂环芳烃等多种复杂分子结构组成,入海后发生一系列复杂变化,最终大多以水溶性成分(water soluble fraction,WSF)存在于海洋中,这正是产生毒性效应的主要部分。0#柴油是典型的石油污染物之一,其WSF中芳香烃含量高达90%以上。海洋石油污染对海洋生态平衡造成了严重影响,吕福荣等[1]发现石油污染使马粪海胆(Hemicentrotus pulcherrimus)胚胎发育延后,且延后程度与油品分散液浓度密切相关,肖雅元等[2]指出WSF会使翡翠贻贝(Perna viridis)的内脏团和外套膜组织受到不同程度的损伤,王振等[3]的研究表明原油水溶性成分会导致斜带髭鲷(Hapalogenysnitens)仔鱼畸形或死亡。
石油烃在生物体内生物转化的同时会伴随着大量活性氧自由基(reactive oxygen radical,ROR)的产生,从而引起机体的酶蛋白失活、免疫细胞的脂质过氧化、DNA损伤等氧化应激反应[4-5],进而影响生物体的免疫功能[6]。水生生物机体的抗氧化防御系统则可以通过一系列反应,减少活性氧在体内的蓄积,最大程度减少对细胞组织等造成的损伤。肝脏谷胱甘肽-S-转移酶(GST)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)均是抗氧化防御系统的重要组分,其活性的高低在一定程度上可以反映水生环境的早期污染[7-9]。
黑鲷(Sparus macrocephalus)是一种重要的浅海温水性底层鱼类,具有较高的养殖经济价值,广泛分布于我国东南沿海及日本、东南亚等地区。由于其具有适温适盐等特性,且食谱杂、抗病能力强、生长迅速,因此可作为理想的实验鱼类[10]。
目前,海洋环境污染监测中主要有关抗氧化酶活性的研究主要集中于虾类[11]、贝类[12]、鱼类[10,13-17]等水生生物,0#柴油水溶性成分对黑鲷体内酶活性变化方面也有研究[18],但关于0#柴油污染下黑鲷不同组织中多种抗氧化酶的分析比较研究较为罕见。本实验以0#柴油水溶性成分作为污染源,对黑鲷肝脏、鳃和肌肉3种组织中不同种类抗氧化酶活性表达进行对比研究,分析水体暴露处理后对黑鲷肝脏组织中GST、SOD和CAT活性的影响,并初步探讨0#柴油对黑鲷可能的致毒机制,旨在为石油污染的生物标志物选取方面提供新的参考资料和基础参数,并为溢油损害评估提供技术支持。
1 材料与方法
1.1 实验材料
实验用油为市售0#柴油。实验海水取自自然海区,盐度20~21,pH 8.20,经沉淀和砂滤后,充分曝气24 h以上备用。供试生物为江苏省海洋水产研究所提供的黑鲷,平均体质量(6.85± 1.54)g。实验前先将黑鲷驯养,期间每天定时投放饵料,自然死亡率低于1%,驯养15 d后,挑选健康、活泼、无损伤的个体进行实验。
将0#柴油与过滤海水按体积比1∶10(V∶V)配比[19],置于磁力搅拌机上连续搅拌24 h后静置3 h,吸取表层下水相,注入棕色玻璃瓶,4℃冰箱保存,作为0#柴油水溶性成分实验母液备用。按照海洋监测规范,使用紫外分光光度计法测定石油烃的含量[20]。
1.2 实验方法
实验包括富集和释放两个阶段,分别进行19 d(0~19 d)和3 d(20~22 d)。经过预实验确定半致死浓度后,将1.1中母液用过滤海水稀释成不同浓度[21],其梯度分别设为0 mg·L-1(天然海水)、0.015 mg·L-1、0.03mg·L-1、0.06mg· L-1,每组设3个平行,其中0 mg·L-1组为对照。每组投放50 ind黑鲷。
1.2.1 富集阶段
实验采用半静态法,整个实验过程中加入海水量为140 L,每24 h换水一次,换水量为100%,每天换水时需及时捞出死亡或行为异常的个体。每天定时定量喂食配合饲料(8∶00和18∶00投喂一次,投喂量为黑鲷个体质量的2%),并按设定的浓度梯度重新配置实验溶液。分别于实验的第3天、第7天、第15天、第19天各选取5 ind黑鲷,在冰水浴条件下用生理盐水清洗,取其肝脏、鳃和肌肉样品,匀浆,然后迅速转至液氮中冷冻保存,以备分析。
1.2.2 释放阶段
富集阶段结束后,排出每个容器中的实验溶液,在天然海水流水条件下(3.6 L·h-1)进行黑鲷体内富集石油烃的释放实验。喂食步骤与富集阶段相同。于第22天采集5 ind黑鲷,处理方法同富集阶段。
1.3 毒理学指标的测定
黑鲷的肝脏、肌肉和鳃组织中蛋白含量的测定采用考马斯亮蓝法,CAT、SOD和GST活性的测定均严格按照由南京建成生物公司提供的检测试剂盒所附带的说明书进行操作。GST活性定义为在37℃扣除非酶促反应,1 mg组织蛋白1 min内使反应体系中谷胱甘肽(GSH)浓度降低1 μmol·L-1为1个酶活力单位(U1),单位为U1· mg-1;SOD活性定义为1 mg组织蛋白在1 mL反应液中SOD抑制率达到50%时所对应的量为1个酶活性单位(U2),单位为U2·mg-1;CAT活性定义为1 mg组织蛋白在1 min内分解1μmol H2O2的量为1个酶活性单位(U3),单位为U3· mg-1。
1.4 统计分析
酶活性数据显示为3个平行组数据的平均值±标准差(Means±SD)。采用Excel2010软件进行绘图。用t检验法对试验组与对照组进行差异性分析,P<0.05被认为差异显著。
2 结果与分析
2.1 0#柴油水溶性成分对黑鲷肝脏、肌肉和鳃组织中GST活性的影响
由图1可知,在富集阶段,3种组织中各染毒浓度组GST活性在第3天均被诱导。肝脏组织中各染毒浓度组GST活性均在第7天达到峰值,显著高于对照组(P<0.05),随后肝脏中各染毒浓度组GST活性开始下降,第19天时高浓度组(0.06 mg·L-1)GST活性仍显著高于对照组水平(P<0.05)。鳃组织中各染毒浓度组GST活性在第3天时达到峰值,其中高浓度组GST活性为对照组的2.55倍,显著高于对照组(P<0.05),随后各染毒浓度组GST活性开始下降,第15天时基本达到稳定状态。肌肉组织中各染毒浓度组GST活性在第15天达到峰值,中浓度0.03 mg ·L-1组、高浓度组GST活性显著高于对照组(P<0.05),分别为对照组的2.15、3.23倍,第19天时只有高浓度组GST活性较对照组有显著性差异(P<0.05)。
进入释放阶段后,三种组织中各染毒浓度组GST活性逐渐下降。在第22天时,除肌肉组织高浓度组GST活性显著高于对照组(为其2.97倍,P<0.05)外,其余各试验组GST活性基本恢复至对照组水平(P>0.05)。
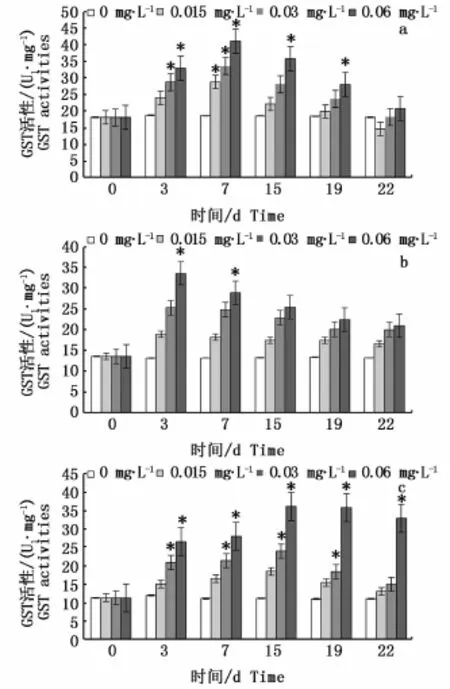
图1 0#柴油水溶性成分对黑鲷肝脏(a)、鳃(b)、肌肉(c)组织中GST活性的影响Fig.1 Effects of No.0 diesel oil exposure on GST activities in liver(a),muscle(b)and gill(c)of Sparus macrocephalus
2.2 0#柴油水溶性成分对黑鲷肝脏、肌肉和鳃组织中SOD活性的影响
如图2所示,在富集阶段,肝脏组织中各试验组SOD活性在第3天降至最低,高浓度组SOD活性为对照组的66%,差异显著(P<0.05),随后各试验组SOD活性升高,第15天达到峰值后又开始下降,至第19天时与对照组水平无显著差异(P>0.05)。鳃组织中的高浓度组SOD活性逐渐下降,在第15天降至最低,为对照组水平的62%,差异显著(P<0.05),第19天时升至对照组水平(P>0.05)。肌肉组织中的高浓度组SOD活性在第3天被显著诱导(P<0.05),在第7天升至峰值,显著高于对照组(P<0.05),为其1.86倍,随后下降,第19天时与对照组无显著差异(P>0.05)。
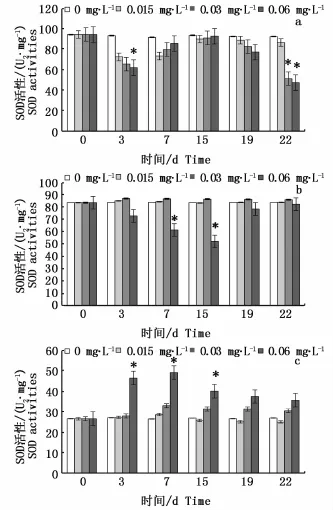
图2 0#柴油水溶性成分对黑鲷肝脏(a)、鳃(b)、肌肉(c)组织中SOD活性的影响Fig.2 Effects of No.0 diesel oil exposure on SOD activities in liver(a),muscle(b)and gill(c)of Sparus macrocephalus
在释放阶段,肝脏组织中各试验组SOD活性继续下降,第22天时,肝脏组织中的中、高浓度组SOD活性显著低于对照组(P<0.05),分别为对照组水平的56%、51%。鳃和肌肉组织中各试验组SOD活性在第22天与对照组水平无显著的统计学差异(P>0.05)。
2.3 0#柴油水溶性成分对黑鲷肝脏、肌肉和鳃组织中CAT活性的影响
在富集阶段,如图3所示,黑鲷肝脏和肌肉组织中各浓度组CAT活性整体先升高后降低。肝脏组织中各试验组CAT活性在第7天达到峰值,中、高浓度组CAT活性显著高于对照组(P<0.05),分别为对照组的2.94、5.38倍,至第19天肝脏组织中各试验组CAT活性恢复至对照组水平(P>0.05)。鳃组织中各试验组CAT活性持续下降,第19天时与对照组水平仍有显著差异(P<0.05)。肌肉组织中各试验组在第3天达到峰值,且中(0.03 mg·L-1)、高浓度组CAT活性显著高于对照组(P<0.05),分别为对照组的2.19、2.87倍,随后肌肉组织中各试验组CAT活性开始下降,其中高浓度组CAT活性在第19天仍显著高于对照组水平(P<0.05)。
进入释放阶段后,三种组织中各染毒浓度组CAT活性下降。第22天时,肌肉和肝脏各试验组CAT活性与对照组水平均无显著的统计学差异(P>0.05),鳃组织中各试验组CAT活性显著低于对照组水平(P<0.05)。
3 讨论
抗氧化系统由多个抗氧化酶系组成,是生物体内清除活性氧自由基、抵抗外源环境压力的重要防御系统。外源性污染物进入生物体内后,先经Ⅰ相反应在有关酶催化下生成一些活性基团或使活性基团暴露,活性基团经Ⅱ相反应在其它酶作用下与内源性化合物或基团(内源性辅因子)结合,生成亲水性更强、利于排出体外的二级代谢物[16]。
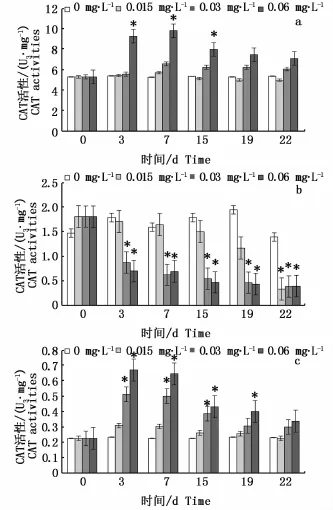
图3 0#柴油水溶性成分对黑鲷肝脏(a)、鳃(b)、肌肉(c)组织中CAT活性的影响Fig.3 Effects of No.0 diesel oil exposure on CAT activities in liver(a),muscle(b)and gill(c)of Sparus macrocephalus
有研究表明,在轻度污染下SOD活性往往升高,而在重度污染下SOD活性常常会降低,致使生物体内活性氧过量积累,进而对生物体造成伤害[22]。但本实验结果显示,黑鲷肝脏组织中各浓度组SOD活性呈下降-上升-下降趋势,在染毒初期被明显被抑制,且抑制程度与试验组浓度呈正相关,这说明细胞受到了一定程度的伤害[23],伤害程度随0#柴油水溶性成分浓度的增加而加深。随后SOD活性开始上升,表明黑鲷机体诱导产生大量的SOD,以清除过量的自由基,减少对机体造成的伤害。鲁双庆等[23]在黄鳝肝脏中也发现了同样的现象。在鳃组织中,中低浓度组SOD活性与对照组无明显差异,高浓度组(0.06 mg·L-1)SOD活性则被抑制,可见0.06 mg· L-1为其阈值浓度,当0#柴油污染的作用超过黑鲷机体的适应能力时就会出现中毒反应[24]。肌肉组织中高浓度组SOD活性诱导早于中低浓度组,这在夏斌等[24]的研究中也得到了验证。
黑鲷的肝脏和肌肉组织中CAT活性先升后降,说明受到污染后CAT能有效被诱导,将H2O2等被进一步代谢为水和分子氧,从而防止毒性更大的羟自由基等的产生,阻断其放大氧自由基的损伤,保护细胞免受其伤害,减少脂质过氧化损伤[25-27],但随着曝油时间的延长,黑鲷体内的活性氧蓄积,氧自由基使CAT和SOD酶蛋白结构和辅基的微环境与价态发生变化,使其受到损伤,放大了氧自由基的损伤效应,导致活性降低[28]。
从时间-效应来看,黑鲷各组织中GST活性先升后降。染毒初期表现出敏感性和诱导性,表明GST特定的亚基催化异生物质与GSH结合生成了易于排泄低毒的化合物[27],从而在石油烃的解毒过程起到了重要作用[29]。后期可能是解毒代谢过程中产生的中间代谢物使GST亚基组成发生变化,加上GSH被大量消耗,导致GST活性降低[12]。从剂量-效应来看,在本实验浓度范围内,黑鲷的肝脏和肌肉组织中CAT活性和黑鲷各组织中GST活性与0#柴油浓度呈正相关,该现象在其它污染物的毒性效应中也普遍存在[14-15]。释放结束后,除肌肉组织中高浓度组(0.06 mg· L-1)外,其余各浓度组均恢复至对照水平,说明在0.015~0.03 mg·L-1浓度范围内,受试黑鲷能够调节自身的适应机制,各组织并未受到不可逆损伤。此外,鳃的GST活性出现峰值的时间早于肝脏和肌肉,这印证了鳃是黑鲷吸收污染物的重要位点[30],对外界污染的应激反应最为优先,而肝脏是解毒代谢器官,受到污染的影响更为严重,需要更长的时间来缓和[31]。同时,各组织中三种酶活性大小依次为为:肌肉<鳃<肝脏,这可能是由各组织的功能进化差异造成的。
4 小结
(1)黑鲷各组织中GST活性整体先升后降,始终被诱导。肝脏中SOD活性呈抑制-诱导-抑制趋势,鳃中SOD活性先抑制后诱导,肌肉中SOD活性始终被诱导,各组织中SOD的活性表达整体随时间和剂量的变化曲线是多阶段的,无明显变化规律。肝脏和肌肉组织中CAT活性也呈现上升-下降趋势,但变化幅度不如GST明显;肝脏中CAT活性先诱导后抑制,肌肉中始终被诱导,而鳃组织中CAT活性始终被抑制。
(2)0#柴油污染对黑鲷肝脏组织中GST活性影响比肌肉和鳃组织中的更为灵敏,在0.015 mg ·L-1浓度下即可诱导GST的显著表达,各组织中GST活性大小依次为:肌肉<鳃<肝脏。SOD和CAT活性分别在0.06 mg·L-1、0.03mg·L-1浓度下才能被显著诱导,各组织中SOD和CAT活性大小呈现与GST活性相同的规律。
(3)从抗氧化酶角度来分析,所有检测的各组织的抗氧化生化指标中,只有GST对污染的反应同时具有明显的剂量-效应和时间-效应关系;从受试的黑鲷组织来看,肝脏组织中几种抗氧化酶的变化规律较为明显。因此,较其它指标而言,在本研究的受试浓度下,肝脏组织中的GST更适合作为监测石油污染的有效生物标志物。
[1]吕福荣.石油烃污染对马粪海胆的毒性效应及分子机制研究[D].大连:大连海事大学,2009.
LV R F.Study on toxic effect and molecular mechanism of petroleum hydrocarbon pollution to Hemicentrotus Pulcherrimus[D].Dalian:Dalian Maritime University,2009.
[2]肖雅元,李纯厚,徐姗楠,等.水溶性石油烃组分对翡翠贻贝的毒性效应研究[J].农业环境科学学报,2012,31(3):598-606.
XIAO Y Y,LIC H,XU S N,et al.Toxicological effects of water-soluble fraction in petroleum hydrocarbons on green mussel(Perna viridis)[J].Journal of Agro-Environment Science,2012,31(3):598-606.
[3]王 振,郑森林,刘文华,等.原油水溶性成分对斜带髭鲷受精卵及仔鱼的急性毒性效应[J].台湾海峡,2010,29(3):367-372.
WANG Z,ZHENG S L,LIU W H,et al.Acute toxic effects of the water accommodated fraction of crude oil onHapalogenysnitens zygotesand larvae[J].Journal of Oceanography in Taiwan Strait,2010,29(3):367-372.
[4]DI GIULIO R T,WASHBURN P C,WENNING R J,et al.Biochemical responses in aquatic animals:a review of determinants of oxidative stress[J].Environmental Toxicology and Chemistry,1989,8(12):1103-1123.
[5]LIVINGSTONE D R,ARCHIBALD S,CHIPMAN J K,et al.Antioxidant enzymes in liver of dabLimanda limandafrom the North Sea[J].Marine Ecology Progress Series,1992(91):97-104.
[6]王 凡,赵元凤,吕景才,等.铜污染对扇贝内脏团抗氧化酶活性的影响[J].水产科学,2008,27(12):622-624.WANG F,ZHAO Y F,LV J C,et al.Effect of Cu2+on the antioxidant enzyme of scallopchlamys farreri′sviscera[J].Fisheries Science.2008,27(12):622-624.
[7]BURGEOT T,BOCQUENE G,PORTE C,et al.Bioindicators of pollutant exposure in the northwestern Mediterranean Sea[J].Marine Ecology Progress Series,1996,131(1-3):125-141.
[8]JENA K B,VERLECAR X N,CHAINY G.Application of oxidative stress indices in natural populations of Perna viridis as biomarker of environmental pollution[J].Marine Pollution Bulletin,2009,58(1):107-113.
[9]STEIN JE,COLLIER T K,REICHERT W L,et al.Bioindicators of contaminant exposure and sublethal effects:studies with benthic fish in Puget Sound,Washington[J].Environmental Toxicology and Chemistry,1992,11(5):701-714.
[10]朱德芬.黑鲷人工养殖技术讲座—第一讲黑鲷生物学特性及增养殖概况[J].水产养殖,1996(1):30-32.
ZHU D F.Artificial Farming Technique ofSparus microcephalus—Biological characteristic ofSparus microcephalusand its artificial feeding[J].Journal of Aquaculture,1996(1):30-32.
[11]吴众望,潘鲁青,张红霞.重金属离子对凡纳滨对虾肝胰脏、鳃丝和血液SOD活力的影响[J].应用生态学报,2005,16(10):1962-1966.
WU ZW,PAN L Q,ZHANG H X.Effects of heavy metal ions on SOD activity of Litopenaeus vannamei hepatopancreas,gill and blood[J].Chinese Journal of Applied Ecology,2005,16(10):1962-1966.
[12]陈 荣,郑微云,郁 昂.0#柴油水溶性成分对僧帽牡蛎(Ostrea cucullata)谷胱甘肽硫转移酶活性的影响[J].厦门大学学报(自然科学版),2005,44(S1):219-221.
CHEN R,ZHENG W Y,YU A.Effect of Watersoluble fraction of No.0 oil on glutathione stransferase inostrea cucullata[J].Journal of Xiamen University(Natural Science),2005,44(S1):219-221.
[13]穆景利,王新红,林建清,等.苯并[a]芘对黑鲷肝脏GST活性的影响及其与肝脏代谢酶和胆汁代谢产物之间的变化关系[J].生态毒理学报,2009,4(4):516-523.
MU J L,WANG X H,LIN J Q,et al.Effects of benzo[a]pyrene exposure on hepatic GST activity in black porgy(Sparus macrocephalus)and variation relationships with hepatic metabolic enzymes and biliary metabolites[J].Asian Journal of Ecotoxicology,2009,4(4):516-523.
[14]陈家长,孟顺龙,胡庚东,等.低浓度阿特拉津对鲫鱼过氧化氢酶(CAT)活性的影响[J].农业环境科学学报,2008,27(3):1151-1156.
CHEN JZ,MENG S L,HU G D,et al.Effects of low concentration of atrazine on catalase activity in carassius auratus[J].Journal of Agro-Environment Science,2008,27(3):1151-1156.
[15]胡 蓉,唐正义.镉对鲫鱼肝胰脏CAT和SOD活性的影响[J].西南大学学报(自然科学版),2011,33(8):94-98.
HU R,TANG Z Y.Effect of cadmium on activities of catalase and superoxide dismutase from hepatopancreas of carassius auratus[J].Journal of Southwest University(Natural Science Edition),2011,33(8):94-98.
[16]陈家长,裘丽萍,瞿建宏,等.苯并(a)芘对罗非鱼肝脏CYP1A1和GST活性的影响[J].生态与农村环境学报,2014,30(2):268-272.
CHEN J Z,QIU L P,QU J H,et al.Effects of Benzo(a)pyrene on Activities of Hepatic CYP1A1 and GST in Tilapia[J].Journal of Ecology and Rural Environment,2014,30(2):268-272.
[17]穆景利.苯并(a)芘在黑鲷(Sparus macrocephalus)体内代谢转化机制的初步研究[D].厦门:厦门大学,2006.
MU J L.Preliminary study on metabolic mechanism of Benzo(a)pyrene in black porgy(Sparusmacrocephalus)[D].Xiamen:Xiamen University,2006.
[18]李 磊,蒋 玫,沈新强,等.0#柴油和原油水溶性成分对黑鲷肝脏7-乙氧基异吩噁唑酮-脱乙基酶活性及其mRNA表达的影响[J].应用与环境生物学报,2014,20(6):1027-1032.
LIL,JIANG M,SHEN X Q,et al.Effects of water accommodated fraction of No.0 fuel oil and Pinghu crude oilon the EROD activities and CYP1 A1 mRNA expression in liver ofSparus macrocephlus[J].Chinese Journal of Applied and Environmental Biology,2014,20(6):1027-1032.
[19]贾晓平,林 钦.南海原油和燃料油对仔虾和仔鱼的急性毒性试验[J].热带海洋,1998,17(1):93-98.
JIA X P,LIN Q.Toxicity of Nanhai crude oil and fuel oils to larval shrimps and larval fishes[J].1998,17(1):93-98.
[20]国家海洋局.海洋监测规范[S].北京,1991.
State Oceanic Administration people′s Republic of China.The specification for marine monitoring[S].Beijing,1991.
[21]李 磊,蒋 玫,沈新强,等.0#柴油和原油水溶性成分在黑鲷(Sparus macrocephlus)体内的富集动力学[J].应用与环境生物学报,2014,20(2):286-290.
LIL,JIANG M,SHEN X Q,et al.Accumulation kinetics of water accommodated fraction in No.0 oil and Pinghu crude oil inSparus macrocephlus[J].Chinese Journal of Applied and Environmental Biology,2014,20(2):286-290.
[22]STEBBING A.Hormesis-the stimulation of growth by low levels of inhibitors[J].Science of the Total Environment,1982,22(3):213-234.
[23]鲁双庆,刘少军,刘红玉,等.Cu2+对黄鳝肝脏保护酶SOD、CAT、GSHPX活性的影响[J].中国水产科学,2002,9(2):138-141.
LU SQ,LIU SJ,LIU H Y,et al.Effects of Cu2+on activities of protecting enzymes SOD,CAT and GSHPX in liver tissue ofMonopterus albus[J].Journal of Fishery Sciences of China,2002,9(2):138-141.
[24]夏 斌,陈碧鹃,李传慧,等.胜利原油对半滑舌鳎肝脏超氧化物歧化酶和过氧化氢酶活性的影响[J].渔业科学进展,2011(1):53-59.
XIA B,CHEN B J,LIC H,et al.Effect of Shengli crude oil on the activities of superoxide dismutase and catalase in the liver of Tongue sole Cynoglossussemilaevis[J].Progress in Fishery Sciences,2011,32(1):53-59.
[25]PANNUNZIO TM,STOREY K B.Antioxidant defenses and lipid peroxidation during anoxia stress and aerobic recovery in the marine gastropod Littorina littorea[J].Journal of Experimental Marine Biology and Ecology,1998,221(2):277-292.
[26]LEMAIRE P,MATTHEWS A,FÖRLIN L,et al.Stimulation of oxyradical production of hepatic microsomes of flounder(Platichthys flesus)and perch(Perca fluviatilis)by model and pollutant xenobiotics[J].Archives of Environmental Contamination and Toxicology,1994,26(2):191-200.
[27]JORDAN R A,SCHENKMAN J B.Relationship between malondialdehyde production and arachidonate consumption during NADPH-supported microsomal lipid peroxidation[J].Biochemical Pharmacology,1982,31(7):1393-1400.
[28]姜招峰,杨翰仪.氧自由基对CAT、SOD和GPX的氧化修饰研究[J].北京联合大学学报(自然科学版),2003,17(3):12-17.
JIANG Z F,YANG H Y.Effects of oxygen free radicals on functions and structuresof CAT,SOD and GPX invitro[J].Journal of Beijing Union University(Natural Sciences),2003,17(3):12-17.
[29]罗朝晖,李彦宏,赵 红.0号柴油水溶性成分影响褐菖鲉肝脏、脾脏和肾脏抗氧化能力的比较[J].福建师范大学学报(自然科学版),2012,28(6):113-117.
LUO C H,LI Y H,ZHAO H.Comparison on antioxidant capacity of liver,spleenand kidney ofSebastiscus marmoratusAffected by No.0 diesel oil water-soluble fraction[J].Journal of Fujian Normal University(Natural Science Edition),2012,28(6):113-117.
[30]陈玛丽,瞿璟琰,刘青坡,等.四溴双酚-A和五溴酚对红鲫肝脏组织和超微结构的影响[J].安全与环境学报,2008,8(4):8-11.
CHEN M L,QU JY,LIU Q P,etal.A comparative study between the two biotic ligand models(BLMs)on predicting the acute Zn toxicity toDaphniamagna[J].Journal of Safety and Environment,2008,8(4):8-11.
[31]李 磊,蒋 玫,沈新强,等.苯并[a]芘暴露对三疣梭子蟹鳃、肝胰腺组织毒理学指标的影响1[J].动物学杂志,2015,50(2):252-261.
LIL,JIANG M,SHEN X Q,et al.Effects of benzo[a]pyrene exposure on the toxicology parameter in gill and liver of Portunus trituberculatus[J].Chinese Journal of Zoology,2015,50(2):252-261.
Effects of water-soluble fraction in No.0 diesel oil exposure on the antioxidase activities in liver,gill and muscle of Sparus microcephalus
DONG Ran1,2,JIANG Mei1,LI Lei1,YANG Jie-qing1,2,XU Gao-peng1,2,SHEN Xin-qiang1
(1.East China Sea Fisheries Research Institute,Chinese Academy of Fishery Sciences,Shanghai200090,China;2.Colloge of Marine Sciences,Shanghai Ocean University,Shanghai 201206,China)
No.0 diesel is a typical pollutant in marine environment,it will trigger a chain reaction if exposed in the sea.Most of these compositions exist as water-soluble fraction(WSF),which is toxic to sea-life and thus breaks the balance of marine ecosystem.Under indoor simulation conditions,the activities of glutathione s-transferase(GST),superoxide dismutase(SOD)and catalase(CAT)in the liver,gill and muscle ofSparus microcephaluswere studied,with a 19-day No.0 diesel oil water-soluble fraction(WSF)exposure period and 3-day elimination period.The experimental larvae were provided by fish farms from Jiangsu Fisheries Research Institute.Experimental water was natural seawater,with the pH at8.20 and salinity at20-21.Four groups at concentrations of 0,0.015,0.03,0.06 mg·L-1of No.0 diesel WSF solution were set in all three organs.Results indicated that:(1)within the experimental dose range,the time-response trend of inductions of liver,gill and muscle GST ofSparus macrocephaluswas bell-shaped.The activities of GST in the liver,gill and muscle versus time increased first and then decreased under the prolonged exposure of No.0 diesel oil water-soluble fraction(WSF).Overall,GST activities in the liver,gill and muscle were induced during the exposure period.There was an obvious dose-time response relationship between No.0 diesel oil water-soluble fraction(WSF)and GST activities in the liver,gill and muscle ofSparus microcephalus.GST activities in liver were the most sensitive to No.0 diesel oil water-soluble fraction(WSF),as which could be induced significantly under No.0 diesel oil water-soluble fraction(WSF)exposure at the concentration of0.015 mg· L-1.(2)On the whole,SOD activities in the liver,gill and muscle of Sparus microcephalus didn’t show a direct correlation with the concentration of No.0 diesel oil water-soluble fraction(WSF),neither with time.(3)CAT activities in three organs were distinct.The time-response trend of inductions of liver and muscle CAT was bell-shaped,which was similar to that of GST,but varied less than that of GST.CAT activities in liver were induced at first and then inhibited,while that in muscle was induced all the time,in contrast,the CAT activities in gill kept inhibited all through the experiment.When the elimination period came to an end,except for the three groups in gill,the CAT activities in all other groups showed no difference from control groups.In summary,the simulation results showed that GST activities in liver of Sparus macrocephalus were recommended for environmental No.0 diesel oil pollution monitoring.
No.0 diesel oil;Sparus macrocephalus;liver;gill;muscle;antioxidase
S 973.2
A
1004-2490(2016)02-0190-08
2015-06-30
农业部应对溢油关键技术专项(2012-2014);中国水产科学研究院基本科研业务费(2014A02XK01);
中央级公益性科研院所基本科研业务费专项(2014T06)
董 冉(1990-),女,硕士研究生,主要研究方向为水环境毒理学。E-mail:197668825@qq.com
沈新强,研究员。E-mail:xinqiang_shen@hotmail.com
