咖啡因与低剂量阿司匹林协同抑制结肠癌细胞生长的机制
2016-03-06刘寒旸宋军周艳刘坤汤黎明
刘寒旸 宋军 周艳 刘坤 汤黎明
作者单位:213000 常州 南京医科大学附属常州第二人民医院普外科研究室
基础研究
咖啡因与低剂量阿司匹林协同抑制结肠癌细胞生长的机制
刘寒旸 宋军 周艳 刘坤 汤黎明
作者单位:213000 常州 南京医科大学附属常州第二人民医院普外科研究室
目的探讨咖啡因联合低剂量阿司匹林对结肠癌细胞生长增殖的抑制作用及其可能的机制。方法按照不同处理方式将人结肠癌细胞株Caco-2、SW-480、HT-29和HCT-116各分为4组:空白对照组、咖啡因单药组、低剂量阿司匹林组和咖啡因+低剂量阿司匹林组(联合用药组)。采用CCK-8法和流式细胞术检测细胞增殖和细胞凋亡情况,实时荧光定量PCR检测凋亡相关关键因子p53、PTEN、EGFR和TNF-α mRNA的表达,免疫印迹法(western blot)检测凋亡相关蛋白p53、Cyt-C和caspase-9/-3剪切形式的蛋白表达情况,同时进行阿司匹林和咖啡因撤药实验。结果联合用药组较咖啡因单药组和低剂量阿司匹林组显著抑制细胞增殖,加速细胞早期凋亡。联合用药组各细胞株p53 mRNA表达量显著上调(P<0.05)。与空白对照组相比,咖啡因单药组、低剂量阿司匹林组和联合用药组目标蛋白p53、Cyt-C、caspase-9/-3剪切形式的表达量均上调,其中联合用药组差异最显著,具有统计学意义(P<0.05)。各组加入p53抑制剂后细胞活力水平均有不同程度提升,其中低剂量阿司匹林组和联合用药组的细胞活力水平提升最明显,差异有统计学意义(P<0.01)。阿司匹林撤药后,咖啡因维持可使结肠癌细胞活力持续抑制、p53持续相对高表达。结论咖啡因和低剂量阿司匹林联合可通过上调p53表达和激活caspase-9/-3凋亡通路抑制结肠癌细胞增殖和激活细胞凋亡,咖啡因能维持阿司匹林撤药后一定时效的抑癌效果。
结肠肿瘤;阿司匹林;咖啡因;细胞增殖;协同作用
结肠癌发病率呈上升趋势,全球每年大约有100万新发病例,近60万人死亡[1-2]。越来越多的研究证实前列腺素生成异常在大多数上皮来源的恶性肿瘤(包括结肠癌、乳腺癌和前列腺癌等)的发生、发展中扮演重要作用[3]。阿司匹林通过作用于环氧化物酶(cyclooxygenase,COX)抑制前列腺素(prostaglandins,PGs)合成。研究表明长期规范服用阿司匹林可降低结肠癌发病率和死亡率[4-5]。研究倾向于认为阿司匹林的抗癌作用依赖摄入的剂量和时间,长期服用(≥10年)一定剂量(≥每周两片325 mg片剂)能显著降低结肠癌过表达COX-2[6]。另有研究表明,前列腺素E2(PGE2)与其受体亚型(EP2、EP4)结合后,可增强癌细胞的增殖和侵袭能力,产生这种作用与其调控下游β-catenin、PTEN/PI3K/AKT/mTOR、RAS/RAF/MAPK和NF-κB等肿瘤相关信号通路有关。阿司匹林的介入可能抑制以上被PGE2激活的信号通路,从而发挥抑制肿瘤发生、发展的作用[7]。同样,近年来大量流行病学调查发现,长期摄入咖啡因或含咖啡因的食品能降低癌症发生的风险。一些研究把咖啡因与癌症相关通路蛋白,如VEGF、PTEN、PI3K/AKT和mTOR联系在一起,在乳腺癌、结肠癌以及食管癌等上皮来源的肿瘤研究中发现,咖啡因通过调控PI3K/AKT/mTOR通路,激活凋亡相关Caspase家族,从而促进癌细胞凋亡进程[8-10]。但咖啡因协同其他药物的抗癌作用研究较少。本研究就联用咖啡因和低剂量阿司匹林在抑制结肠癌细胞生长增殖的协同作用进行研究和探讨。
1 材料与方法
1.1 主要试剂
阿司匹林和咖啡因购自Sigma-Aldrich公司,胎牛血清(FBS)和无血清培养基(DMEM)购于美国Gibco公司,CCK-8试剂购于日本Dojindo公司,p53抑制剂(Pifithrin-α)和BCA蛋白定量试剂盒购自碧云天生物技术有限公司,RNA提取试剂盒和实时荧光定量PCR试剂盒(SYBRPremixExTaq)购自TaKaRa公司,cleavedcaspase-3、cleaved-caspase-9、Cyt-c、p53和β-Tublin抗体购于Cell Signaling Technology公司。
1.2 细胞培养
结肠癌细胞株Caco-2、SW-480、HT-29和HCT-116均购于美国ATCC公司。在含10%灭活胎牛血清、青霉素(1×105U/L)和链霉素(100 mg/L)的DMEM培养基,37℃、5%CO2的培养箱内培养;常规每3~4 d传代1次,所有实验均采用对数生长期细胞。
1.3 CCK-8法检测细胞增殖
将结肠癌细胞株Caco-2、SW-480、HT-29和HCT-116分别按照阿司匹林浓度梯度0.01 mmol/L、0.1 mmol/L、0.5 mmol/L、1 mmol/L、2 mmol/L、4 mmol/L、6 mmol/L、8 mmol/L和10 mmol/L分为9组,并设立空白对照组(以等量血清培养基培养)。当阿司匹林浓度为0.5 mmol/L时,各细胞株增殖率为80%左右(增殖率=A实验/A对照×100%),因此本实验选取0.5 mmol/L阿司匹林为低剂量浓度。
将细胞接种于96孔细胞培养皿中,接种浓度为5×103个/孔,培养24 h后,按照不同处理因素将各株细胞分为5组:咖啡因单药组(1 mmol/L咖啡因)、低剂量阿司匹林组(0.5 mmol/L阿司匹林)、联合用药组(1mmol/L咖啡因+0.5mmol/L阿司匹林),以10mg/L 5-FU为阳性对照组,同时设置空白对照组(以等量血清培养基培养)。继续培养24 h后加入20 μL/100 μL CCK-8试剂并于37℃培养箱孵育2 h,用酶标仪检测490 nm波长处的吸光度(A),并计算细胞增殖率。然后各组加入10 mmol/L p53抑制剂Pifithrin-α,再次检测细胞增殖情况。
同时选取对实验药物较敏感的结肠癌细胞株进行阿司匹林撤药实验,按照以下处理因素分为4组:咖啡因单药撤药组、咖啡因维持的低剂量阿司匹林撤药组、咖啡因和阿司匹林两药撤药组,设置空白对照组(以等量血清培养基培养),按照上述方式检测其细胞增殖情况。
1.4 细胞克隆形成实验
结肠癌细胞株Caco-2、SW-480、HT-29和HCT-116分别按照不同处理因素(咖啡因和阿司匹林浓度同上)分为4组:咖啡因单药组、低剂量阿司匹林组、联合用药组,同时设立空白对照组(以等量血清培养基培养)。处理24 h后,将各株细胞分别用0.25%胰蛋白酶消化并吹打成单个细胞,进行细胞计数。每组细胞以每培养皿200个细胞的梯度密度分别接种于含10 mL 37℃预温培养液的培养皿,置于37℃、5%CO2及饱和湿度的细胞培养箱中培养2周。用PBS浸洗2次,加4%多聚甲醛固定细胞5mL固定15min,适量基姆萨(GIMSA)应用染色液染10~30 min。对集落数进行统计并计算各组细胞克隆形成率。
1.5 流式细胞术检测细胞凋亡
将结肠癌细胞株Caco-2、SW-480、HT-29和HCT-116分为联合用药组(1 mmol/L咖啡因+0.5 mmol/L阿司匹林)和空白对照组(以等量血清培养基培养)。处理24 h后,用胰酶(无EDTA)消化,4℃预冷的PBS洗涤细胞1次,Binding Buffer洗涤1次;Binding Buffer和annexin V混合液重悬细胞,室温避光孵育15min,BindingBuffer洗涤1次;Binding Buffer和PI的混合液重悬细胞,25℃避光孵育15 min,每次洗涤或染剂孵育前均经过1 000 r/min离心5 min。采用流式细胞仪进行细胞凋亡检测,FlowJo软件进行分析,以annexin V+/PI-象限的细胞为早期凋亡细胞,记录并计算比例。
1.6 实时荧光定量PCR检测
实时荧光定量PCR检测结肠癌细胞株Caco-2、SW-480、HT-29和 HCT-116中p53、PTEN、EGFR和TNF-α mRNA的表达。将4株细胞株按照不同处理因素(咖啡因和阿司匹林浓度同上)分为4组:咖啡因单药组、低剂量阿司匹林组、联合用药组,同时设置空白对照组(以等量血清培养基培养)。Trizol试剂提取组织总RNA,1 μg RNA样本逆转录合成cDNA,-80℃低温保存。分别加入2 μL Hotstar DNA Taq酶、0.5 μL上下游引物(10 μmol/L)、2 μL cDNA模板、15 μL双蒸水于200μL的Eppendoff管中混匀。设置反应参数:95℃5 min,按94℃20 s、60℃20 s、72℃40 s依次进行35个循环,最后72℃延伸5 min。不同样本目的基因表达的相对差异量用2-ΔΔCt法计算,引物序列见表1。
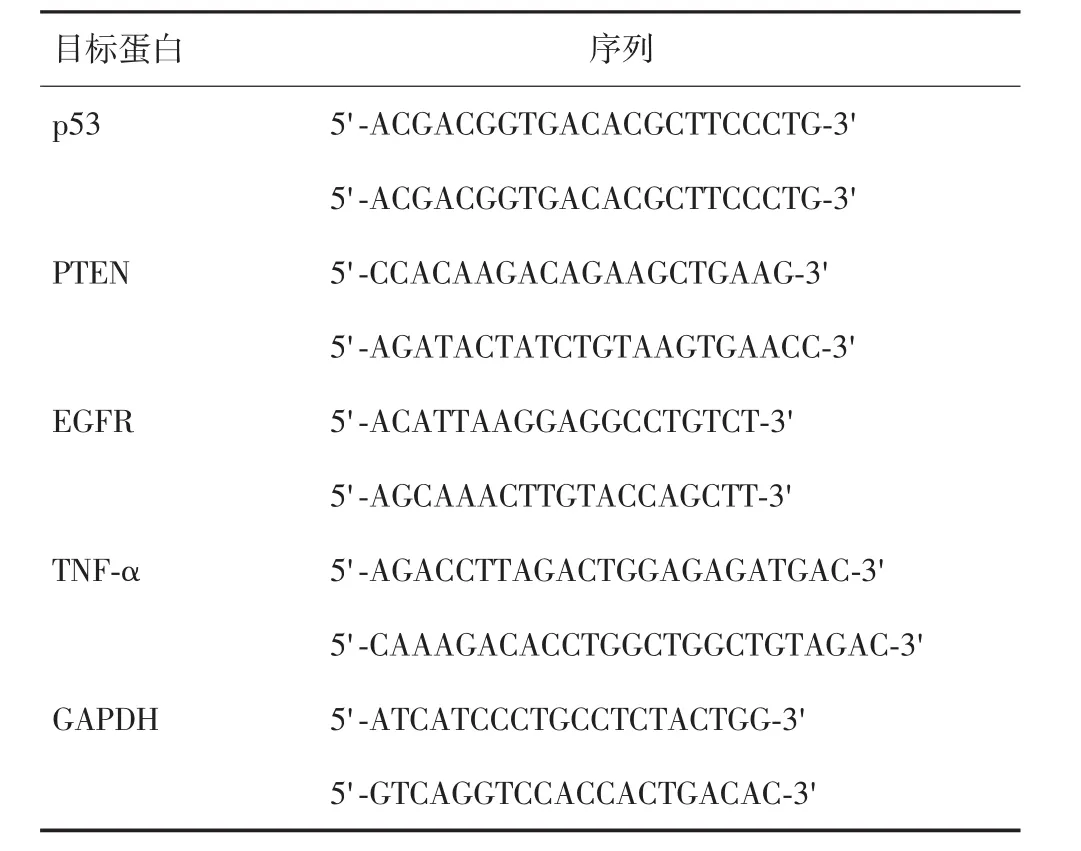
表1 引物序列
1.7 蛋白提取和western blot检测
结肠癌细胞株HT-29按照不同处理因素(咖啡因和阿司匹林浓度同上)分为咖啡因单药组、低剂量阿司匹林组、联合用药组,药物处理24 h后,同时撤去药物,更换为普通血清培养基,分别在撤药后0 h、12 h、24 h、36 h和48 h再次收获细胞,再设置空白对照组(以等量血清培养基培养)。收获的细胞加入western及IP细胞裂解液提取总蛋白,用BCA蛋白浓度检测法检测并调节蛋白浓度。用SDS-PAGE电泳,转膜,封闭缓冲液(含5%脱脂奶粉TTBS)封闭,按照适当浓度(p53:1∶200、Cyt-C:1∶1 000、cleaved-caspase-9:1∶1 000、cleaved-caspase-3:1∶1 000、β-Tublin:1∶2 000)孵育一抗4℃过夜,TBST多次漂洗后孵育二抗(1∶2 000),暗室曝光。
1.8 统计学处理
采用SPSS 13.0统计软件对数据进行分析,两组比较采用独立样本t检验,组间比较采用方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 咖啡因协同低剂量阿司匹林的抑癌作用
药物处理24 h后,CCK-8法检测细胞增殖情况,结果显示,结肠癌细胞株Caco-2、SW-480、HT-29和HCT-116中咖啡因单药组和低剂量阿司匹林组的细胞增殖率降至(80±5)%,联合用药组降至(60±8)%,阳性对照组降至(50±4)%,相对于两个单药处理组,联合用药组显著降低了细胞增殖率(P<0.05),见图1。克隆形成实验结果显示,处理24 h后,相对于空白对照组,咖啡因单药组、低剂量阿司匹林组和联合用药组细胞克隆形成率均下降,其中HT-29细胞株表现最明显,其联合用药组细胞克隆形成率(27%)明显低于咖啡因单药组(93%)和低剂量阿司匹林组(66%),差异有统计学意义(P<0.05),见图2。流式细胞术检测结果显示,联合用药组有效增加了结肠癌细胞早期细胞凋亡水平,其中HT-29细胞的早期细胞凋亡率两药联用处理后从0.5%增至10.2%,变化幅度最明显,差异有统计学意义(P<0.05),见图3。综合细胞增殖、细胞克隆形成以及流式细胞术检测结果,认为两药联用有效抑制结肠癌细胞生长,咖啡因可能增强了低剂量阿司匹林的抑癌效果,同时发现HT-29细胞株可能对药物最敏感。
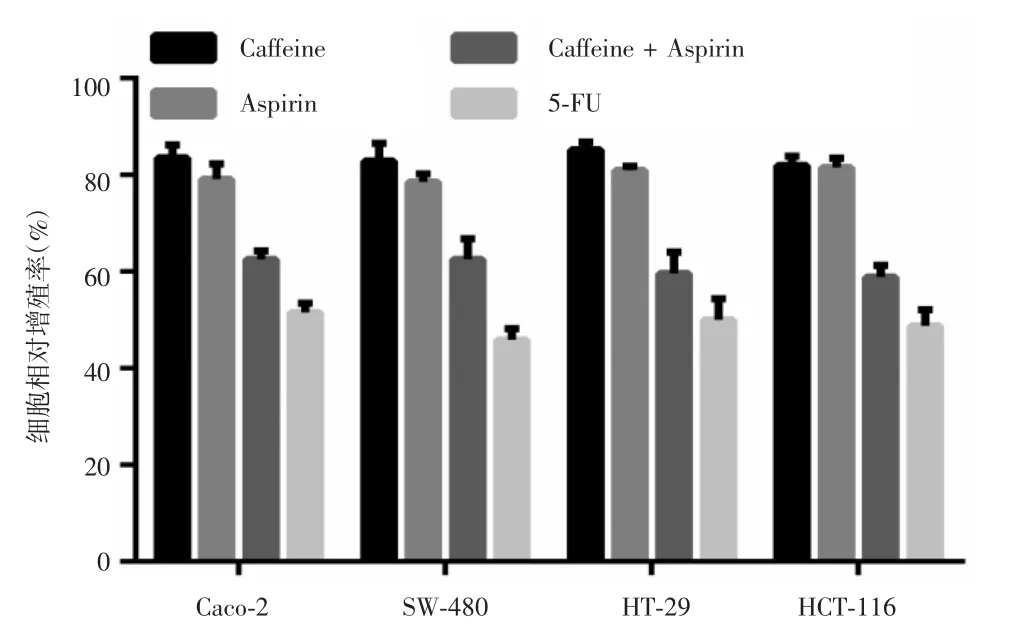
图1 CCK-8法检测细胞增殖
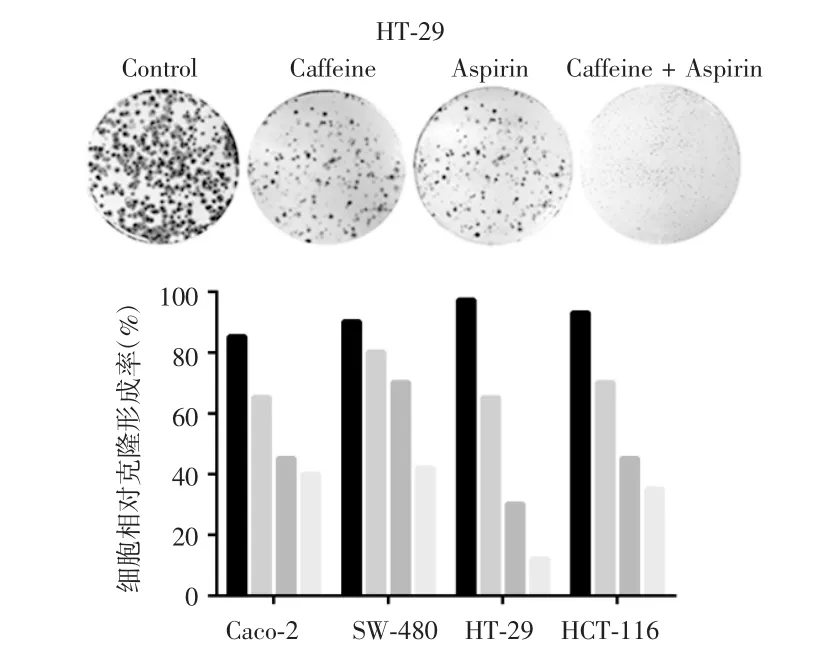
图2 细胞克隆形成实验
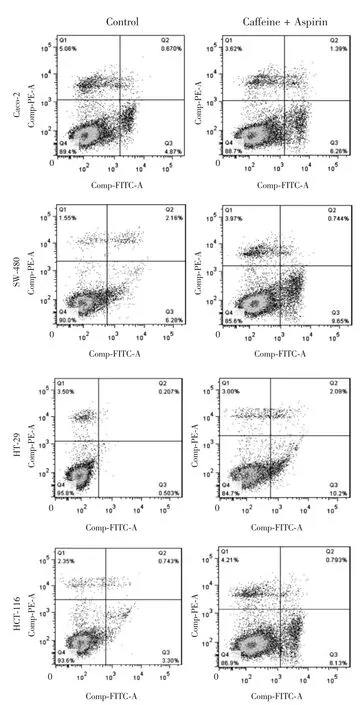
图3 流式细胞术检测细胞凋亡
2.2 阿司匹林与p53表达和caspase/-9/-3凋亡通路的关系
实时荧光定量PCR检测结肠癌细胞株Caco-2、SW-480、HT-29和HCT-116中p53、PTEN、EGFR和TNF-α mRNA的表达,结果显示联合用药组p53 mRNA表达量显著上调(P<0.05),在Caco-2、SW-480和HT-29细胞株中,TNF-α mRNA表达量出现上调(P<0.05),见图4。根据上述结果,选取对实验药物较为敏感的结肠癌细胞株HT-29,进一步研究药物引起结肠癌细胞株凋亡的机制,检测其凋亡相关蛋白p53、Cyt-C和caspase-9/-3剪切形式的蛋白表达量。结果显示,与空白对照组相比,咖啡因单药组、低剂量阿司匹林组和联合用药组目标蛋白p53、Cyt-C、caspase-9/-3剪切形式的表达量均出现上调,其中,联合用药组差异最显著,具有统计学意义(P<0.05),见图5。各组加入p53抑制剂后细胞活力水平均有不同程度提升,其中低剂量阿司匹林组和联合用药组的细胞活力水平提升最明显,差异有统计学意义(P<0.01),见图6。以上结果可能提示,阿司匹林可能通过上调p53的表达抑制HT-29结肠癌细胞株细胞的活力和激活caspase-9/-3凋亡通路。
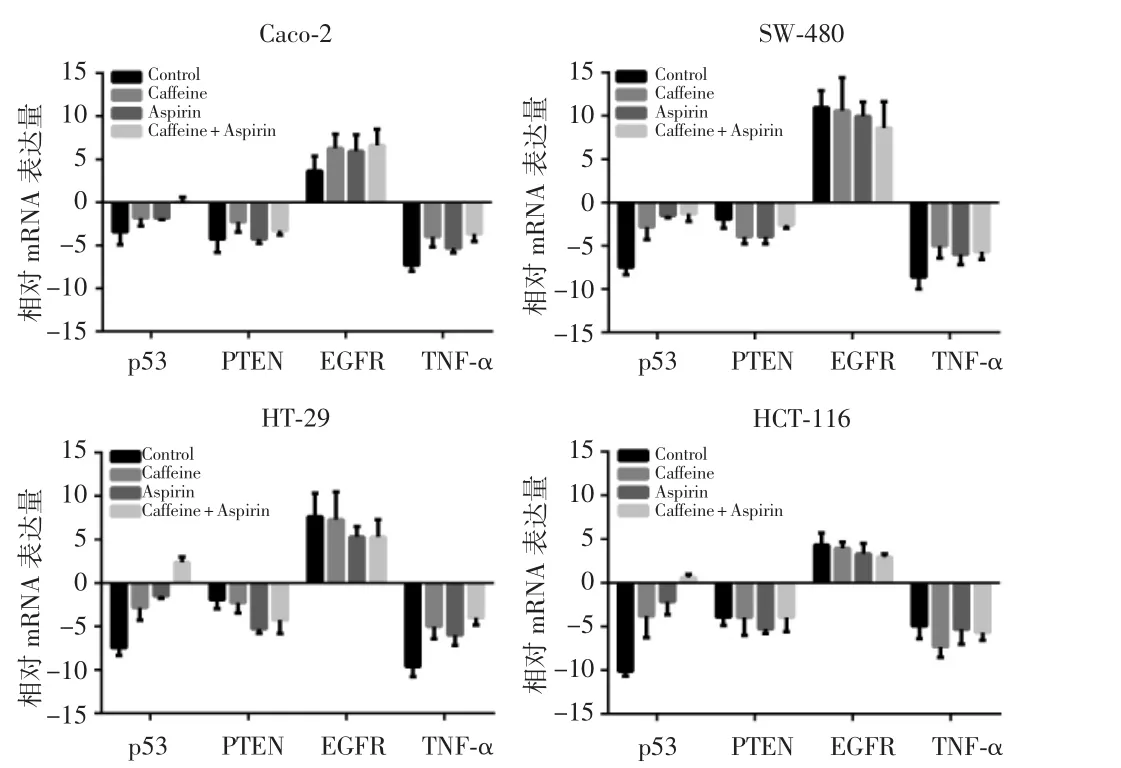
图4 实时荧光定量PCR检测p53、PTEN、EGFR和TNF-α mRNA的表达
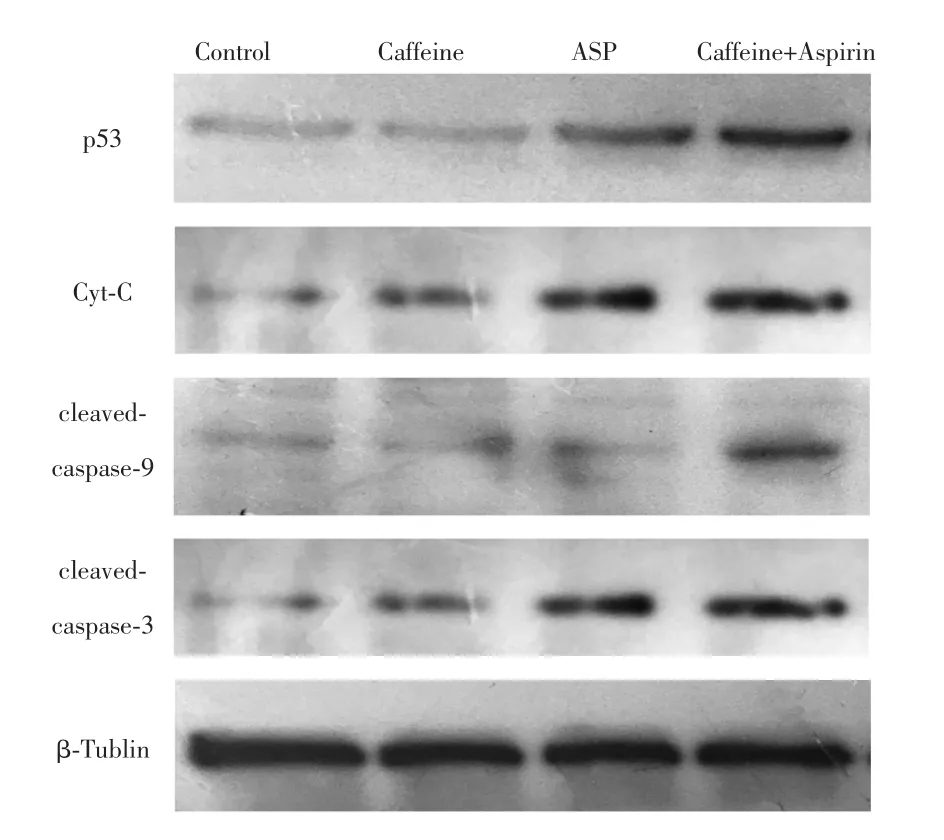
图5 免疫印迹法检测凋亡相关蛋白表达
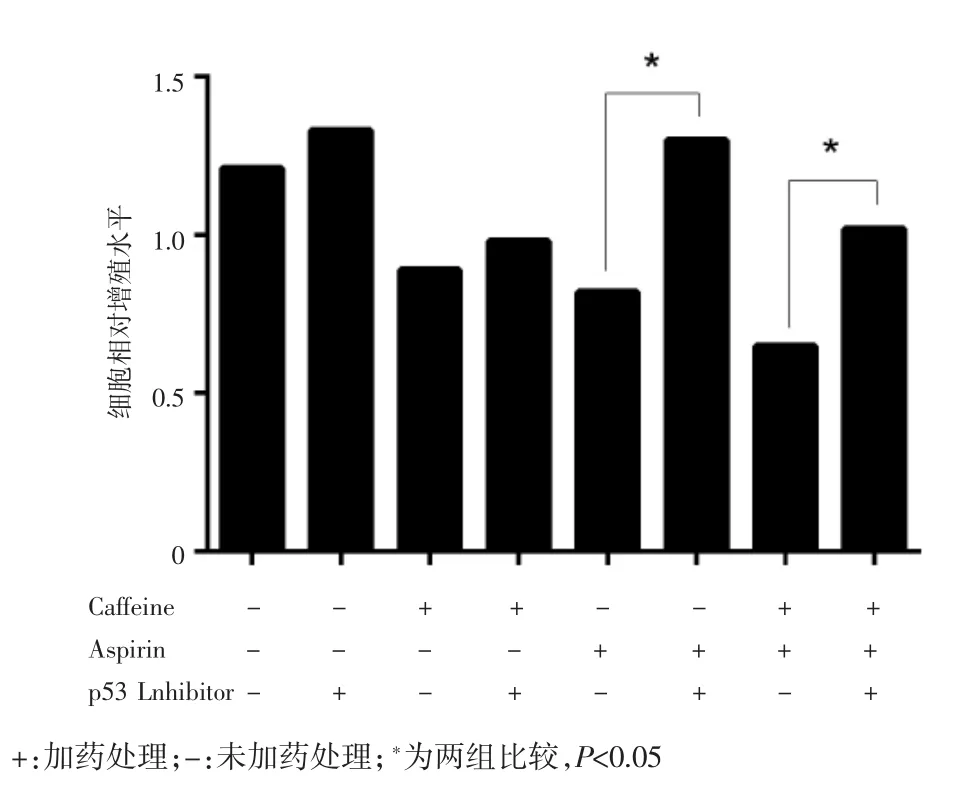
图6 各组加入p53抑制剂后CCK-8法检测细胞活力
2.3 咖啡因与低剂量阿司匹林撤药对结肠癌细胞的影响
为了进一步探索低剂量阿司匹林联合咖啡因在抵抗结肠癌作用的可行性,本研究选取对实验药物较为敏感的结肠癌细胞株HT-29进行阿司匹林撤药实验。经CCK-8法检测细胞活力,结果显示,与空白对照组相比,咖啡因单药撤药组、咖啡因维持的低剂量阿司匹林撤药组和两药撤药组细胞活力水平升高趋势相对缓慢,其中咖啡因维持的低剂量阿司匹林撤药组细胞数量增长趋势最缓慢,咖啡因单药撤药组次之,而两药撤药组升高最明显,见图7。
实时荧光定量PCR检测各撤药组p53 mRNA表达量,结果显示,24 h内咖啡因维持的低剂量阿司匹林撤药组p53 mRNA仍呈相对高表达水平,两药撤药组在12 h内p53 mRNA表达水平显著下降,咖啡因单药撤药组的p53 mRNA则始终保持低表达水平,差异无统计学意义(P<0.05),见图8。western blot检测咖啡因维持的低剂量阿司匹林撤药组p53蛋白的表达,结果显示24 h内p53蛋白的表达下降,但仍处在较高水平,24 h后显著下降(P<0.05),见图9。以上结果提示,单独咖啡因处理不能显著提升p53 mRNA的表达,阿司匹林撤药后一段时间内仍可抑制细胞活力和激活p53。
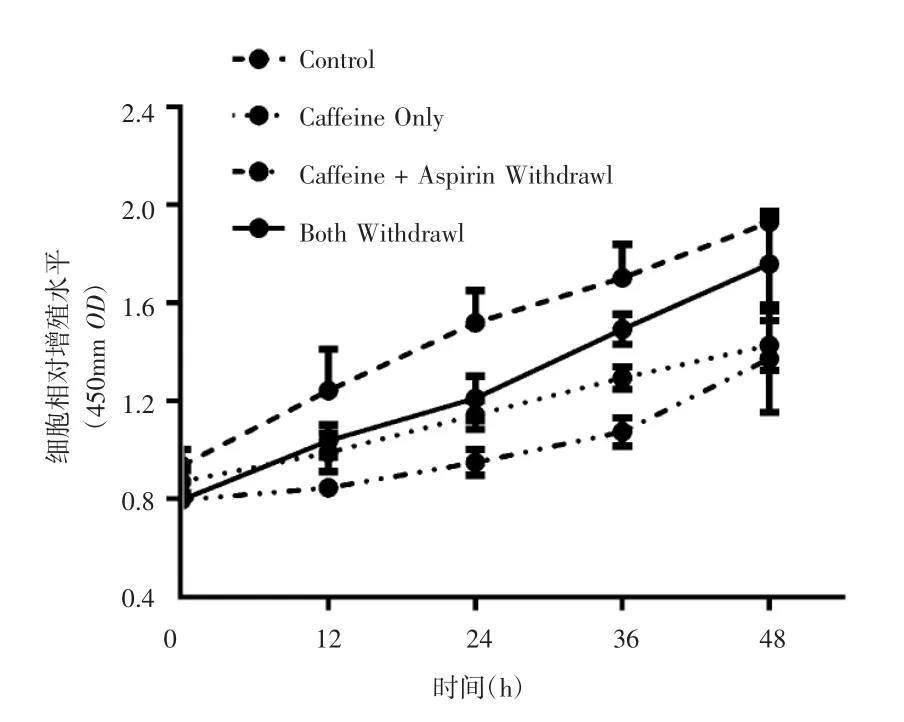
图7 各组撤药后CCK-8法检测细胞活力
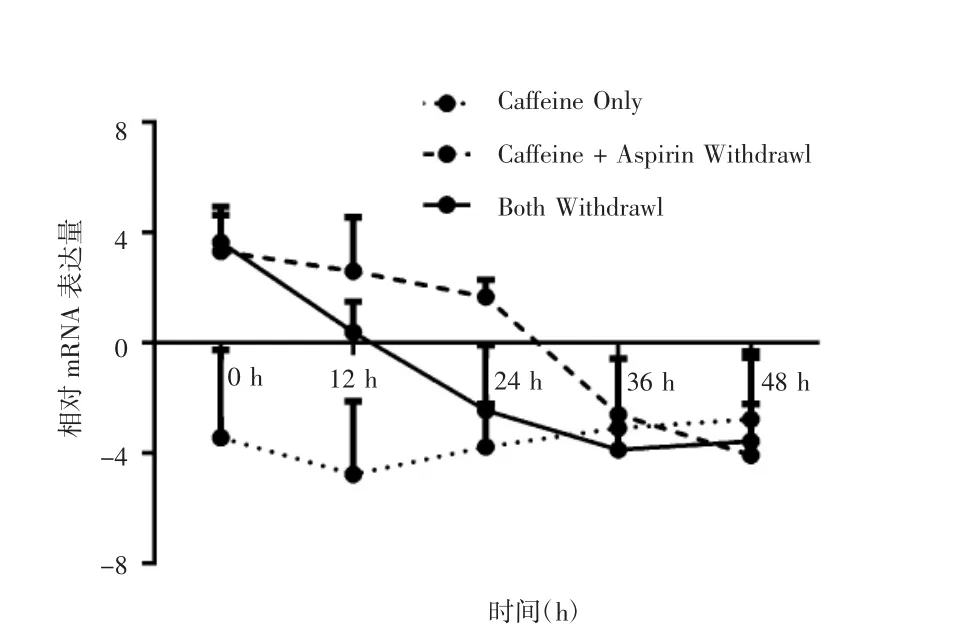
图8 各组撤药后实时荧光定量PCR检测p53 mRNA表达
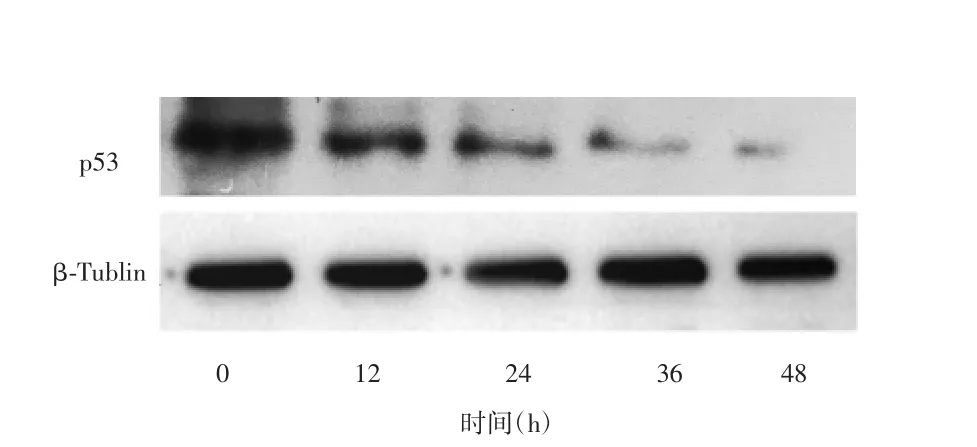
图9 咖啡因维持下阿司匹林单药撤药后western blot检测p53蛋白表达
3 讨论
阿司匹林潜在的抗癌作用受到广泛关注,研究显示长期规律服用和短期每日服用阿司匹林均能一定程度降低肿瘤的发病风险[11-13]。口服阿司匹林吸收迅速,半衰期在6~15 min,口服500~600 mg后,血药浓度可迅速达到40~60 μg/mL。然而,阿司匹林也存在明显的副作用,即使低剂量使用(75 mg/d),胃肠道损伤和溃疡等并发症风险依旧上升,其对胃黏膜的副作用不容忽视[8]。进一步降低阿司匹林常规摄入剂量可能是降低其副作用的途径。然而,降低摄入剂量同时亦降低了阿司匹林的抗癌效果,联用其他药物以提升阿司匹林的抗癌效果成为新的思路。咖啡因作为食品和药品已被广泛应用,对咖啡因抑癌作用的研究亦有一定基础[14-15]。阿司匹林联合咖啡因已在一些神经疾病研究中取得良好效果,并具有联用增效的能力[16]。基于二者联用的可行性和低剂量阿司匹林抗癌的前景,本研究通过咖啡因协同低剂量阿司匹林,探索联用咖啡因后低剂量阿司匹林抑制结肠癌细胞生长的效果及可能的作用机制。
本研究结果显示,咖啡因与低剂量阿司匹林联用后对结肠癌细胞增殖有抑制作用,并促进了细胞早期凋亡,提示咖啡因可能增强了低剂量阿司匹林的抑癌效果。细胞增殖实验和细胞克隆形成实验结果显示,HT-29细胞株对两药作用相对敏感。为了探索两药作用的关键因子,本研究进一步选取4个常见的抑癌因子p53、PTEN、EGFR和TNF-α,通过实时荧光定量PCR检测其在HT-29细胞株的表达,结果发现,两药联合处理后HT-29细胞株p53 mRNA水平出现上调。为了进一步验证,进行了western blot检测并加入p53抑制剂,结果显示阿司匹林通过上调p53的表达激活结肠癌细胞株的凋亡进程,而咖啡因虽能一定程度激活caspase-9/-3凋亡通路,但p53表达未显示差异。相对低剂量阿司匹林单药处理,联用咖啡因后p53表达上调,同时caspase-9/-3通路亦被激活。此外,有报道咖啡因撤药后可持续抑制乳腺癌[8]。因此,本研究设计了撤药实验,结果显示,低剂量阿司匹林撤药后咖啡因对结肠癌细胞株存在一定时间的持续性抑制,western blot检测p53蛋白表达,发现撤去药物后p53的表达下降延迟,而这一现象发生的原因目前尚不清楚。综上认为咖啡因虽不能显著上调p53表达,但可能有延缓p53蛋白降解的作用。但单纯依靠分子通路难以发挥此作用,猜测可能在基因调控层面发挥作用。因此,相关非编码RNA的作用特性值得进一步探索。
结合本研究结果,认为联用咖啡因可能增强了低剂量阿司匹林抑制结肠癌细胞生长的效果,同时咖啡因在低剂量阿司匹林撤药后维持了一定时效的抑癌效果,这为长期摄入阿司匹林预防结肠癌提供一定依据。同时,对两药联用潜在的撤药持续效果的验证可能提供了一种新的服药方案,即可降低阿司匹林摄入频率,亦可维持一定时效的抗癌效果。然而,本研究结果亦存在一定局限性,期待将这一用药方案引入动物实验,以验证体外细胞实验的结果。
[1] Jemal A,CenterMM,DeSantisC,et al.Global patterns of cancer incidence and mortality rates and trends[J].Cancer Epidemiol Biomarkers Prev,2010,19(8):1893-1907.
[2] Nan H,Hutter CM,Lin Y,et al.Association of aspirin and NSAID use with risk of colorectal cancer according to genetic variants[J]. JAMA,2015,313(11):1133-1142.
[3] Misra S,Sharma K.COX-2 signaling and cancer:new players in old arena[J].Curr Drug Targets,2014,15(3):347-359.
[4] Coghill AE,Newcomb PA,Campbell PT,et al.Prediagnostic nonsteroidal anti-inflammatory drug use and survival after diagnosis of colorectal cancer[J].Gut,2011,60(4):491-498.
[5] Rothwell PM,Wilson M,Elwin CE,et al.Long-term effect of aspirin on colorectal cancer incidence and mortality:20-year follow-up of five randomised trials[J].Lancet,2010,376(9754):1741-1750.
[6] Chan AT,Ogino S,Fuchs CS.Aspirin and the risk of colorectal cancer in relation to the expression of COX-2[J].N Engl J Med,2007,356(21):2131-2142.
[7] Nakanishi M,Rosenberg DW.Multifaceted roles of PGE2 in inflammation and cancer[J].Semin Immunopathol,2013,35(2):123-137.
[8] Al-AnsariMM,AboussekhraA.Caffeinemediatessustainedinactivation of breast cancer-associated myofibroblasts via up-regulation of tumor suppressor genes[J].PLoS One,2014,9(3):e90907.
[9] Miwa S,Sugimoto N,Shirai T,et al.Caffeine activates tumor suppressor PTEN in sarcoma cells[J].Intl J Oncol,2011,39(2):465-472.
[10]Miwa S,Sugimoto N,Yamamoto N,et al.Caffeine induces apoptosis of osteosarcoma cells by inhibiting AKT/mTOR/S6K,NF-kap paB and MAPK pathways[J].Anticancer Res,2012,32(9):3643-3649.
[11]Algra AM,Rothwell PM.Effects of regular aspirin on long-term cancer incidence and metastasis:a systematic comparison of evidence from observational studies versus randomised trials[J].Lancet Oncol,2012,13(5):518-527.
[12]Rothwell PM,Price JF,Fowkes FG,et al.Short-term effects of daily aspirin on cancer inci dence,mortality,and non-vascular death:analysis of the time course of risks and benefits in 51 randomised controlled trials[J].Lancet,2012,379(9826):1602-1612.
[13]Rothwell PM,Wilson M,Elwin CE,et al.Long-term effect of aspirin on colorectal cancer incidence and mortality:20-year follow-up of fiverandomisedtrials[J].Lancet,2010,376(9754):1741-1750.
[14]Cheng YC,Ding YM,Hueng DY,et al.Caffeine suppresses the progression of human glioblastoma via cathepsin B and MAPK signaling pathway[J].J Nutr Biochem,2016,33:63-72.
[15]Edling CE,Selvaggi F,Ghonaim R,et al.Caffeine and the analog CGS 15943 inhibit cancer cell growth by targeting the phosphoinositide 3-kinase/Akt pathway[J].Cancer Biol Ther,2014,15(5):524-432.
[16]Hudson GM,Green JM,Bishop PA,et al.Effects of caffeine and aspirin on light resistance training performance,perceived exertion,and pain perception[J].J Strength Cond Res,2008,22(6):1950-1957.
[2016-09-30收稿][2016-11-22修回][编辑 罗惠予]
Synergistic effects of aspirin and caffeine for preventing colorectal cancer
Liu Hanyang,Song Jun,Zhou Yan,Liu Kun,Tang Liming(Department of Gastrointestinal Surgery,Nanjing Medical University Affiliated Changzhou No.2 People's Hospital,213000 Changzhou,P.R.China)
Tang Liming.E-mail:halfmoon@foxmail.com
ObjectiveThis study aimed to investigate the synergistic effects of low-dose aspirin and caffeine for preventing colorectal cancer.MethodsThe colorectal cell lines Caco-2,SW-480,HT-29,and HCT-116 were exposed to low-dose aspirin alone,caffeine alone or both agents,then cell viability was measured using the cell counting kit-8 and extent of apoptosis was measured using flow cytometry.Expression of relevant factors(p53,PTEN,EGFR,TNF-α)was measured using real-time PCR.Drug-withdrawal experiments were conducted.ResultsTreating cell lines with both caffeine and aspirin inhibited cell proliferation and accelerated early apoptosis significantly more than treating cells with either agent alone.Western blotting showed that treating with aspirin alone caffeine alone and with the combination of aspirin and caffeine up-regulated p53,Cyt-C and caspase-9/-3 expression,and the difference of treatment with the combination of aspirin and caffeine was the most significant(P<0.05).The level of cell vitality were improved,when the p53-specific inhibitor pifithrin-α were added.In drug-withdrawal experiments,caffeine treatment prolonged p53 up-regulation and inhibition of proliferation.ConclusionAspirin and caffeine synergistically inhibit proliferation and promote apoptosis of colorectal cancer cells.In addition,maintaining caffeine can prolong growth inhibition after aspirin withdrawal.
Colonic Neoplasm;Aspirin;Caffeine;Cell pvolifevation;Synergy
R735.3+5
A
1674-5671(2016)06-07
10.3969/j.issn.1674-5671.2016.06.01
汤黎明。E-mail:halfmoon@foxmail.com
