稳定过表达XAF1基因鼻咽癌放射抗拒CNE-2R细胞株的构建
2016-03-06武江波苏芳李龄朱小东陈龙曲颂莫柒艳林欢
武江波苏芳李龄朱小东陈龙曲颂莫柒艳林欢
作者单位:530021 南宁1广西医科大学附属肿瘤医院放疗科;2广西医科大学研究生院
基础研究
稳定过表达XAF1基因鼻咽癌放射抗拒CNE-2R细胞株的构建
武江波1,2苏芳1李龄1朱小东1陈龙1曲颂1莫柒艳1,2林欢1,2
作者单位:530021 南宁1广西医科大学附属肿瘤医院放疗科;2广西医科大学研究生院
目的构建稳定过表达X连锁凋亡抑制蛋白相关因子1(X-linked inhibitor of apoptosis associated factor 1,XAF1)基因的鼻咽癌放射抗拒CNE-2R细胞株。方法分别将携带XAF1基因感染复数(multiplicity of infection,MOI)为50的慢病毒稀释液、MOI为100的慢病毒原液和MOI为100的慢病毒原液加入终浓度为5 μg/mL的聚凝胺(polybrene)转染人鼻咽癌放射抗拒CNE-2R细胞株。通过倒置荧光显微镜观察细胞内荧光数量及强度评判转染效率,通过实时荧光定量逆转录聚合酶链反应(real-time quantitative reversetranscription polymerase chain reaction,qRT-PCR)和蛋白免疫印记法(western blot)检测XAF1基因mRNA和蛋白的表达。结果慢病毒稀释液转染,约60%的细胞可观察到微弱荧光;慢病毒原液转染,约70%的细胞观察到较弱荧光;慢病毒原液加入5 μg/mL polybrene的转染效率较高,约90%的细胞观察到较强荧光。嘌呤霉素筛选上述转染效率最高的慢病毒原液加5 μg/mL polybrene组细胞,其成功将携带XAF1基因的慢病毒转入鼻咽癌放射抗拒CNE-2R细胞株。qRT-PCR和western blot进一步证实细胞株稳定过表达XAF1基因。结论
鼻咽肿瘤;X连锁凋亡抑制蛋白相关因子1;慢病毒载体;鼻咽癌放射抗拒细胞;基因转染;荧光效率
X连锁凋亡抑制蛋白相关因子1(X-linked inhibitor of apoptosis associated factor 1,XAF1)是一种运用酵母双杂交法发现的新的X连锁凋亡抑制蛋白(X-linked inhibitor of apoptosis protein,XIAP)的拮抗蛋白。XAF1基因定位于染色体17p13.2位点,通过拮抗XIAP的抗凋亡作用而发挥抗肿瘤作用[1]。研究发现,XAF1重新表达可增强肿瘤细胞对顺铂的敏感性[2],但目前XAF1在人鼻咽癌放射抗拒CNE-2R细胞株中的作用鲜见报道。慢病毒载体是来源于人类免疫缺陷病毒-1的一类改良病毒载体,具有良好的生物安全性,可将外源性基因有效地整合到宿主染色体,从而达到持久表达目的序列的效果[3]。本实验采用慢病毒转染,构建过表达XAF1基因的鼻咽癌放射抗拒CNE-2R细胞株,以期进一步观察XAF1基因对鼻咽癌放射抗拒细胞CNE-2R放射敏感性的影响。
1 材料与方法
1.1 材料
人鼻咽癌放射抗拒CNE-2R细胞株为本实验室所有;293T人胚肾细胞购自中国科学院细胞库;慢病毒包装质粒pGag/Pol、pRev、pVSV-G和慢病毒过表达质粒XAF1-LV5(EF-1aF/GFP&Puro)均由上海吉玛公司提供。细胞培养基RPMI Medium 1640、DMEM、胎牛血清(fetal bovine serum,FBS)、胰酶Trypsin-EDTA Solution购自GIBCO公司,嘌呤霉素、polybrene购自Sigma公司。Trizol购自Invitrogen公司,高效率荧光定量PCR Master Mix和cDNA合成试剂盒购自TOYOBO公司,XAF1一抗、β-actin一抗购自CST公司,二抗购自碧云天公司。
1.2 方法
1.2.1 重组慢病毒包装、收集和浓缩 293T细胞在10 cm培养皿中培养至80%~90%融合时,接种于15 cm培养皿。倾去培养液,用1 mL D-Hank's solution洗涤细胞2次。加入胰酶消化,重悬为单细胞悬液,并接种于15 cm培养皿,加入18 mL含10%FBS的DMEM培养液,混匀后置于37℃、5%CO2培养箱培养过夜。5 mL离心管加入1.5 mL无血清DMEM、慢病毒过表达质粒XAF1-LV5(EF-1aF/GFP&Puro)和包装质粒(pGag/Pol、pRev、pVSV-G),混匀。取另一支无菌5 mL离心管,加入1.5mL无血清DMEM和300 μL RNAi-Mate转染试剂,混匀,室温放置5 min后将两管混合,放置20min。除去15 cm培养皿中的培养液,加入8 mL无血清的DMEM培养液。将转染混合物逐滴加入15 cm培养皿中,轻轻前后摇晃培养皿混匀复合物,在37℃、5%CO2培养箱中温育4 h。弃去转染液,加入18 mL含10%FBS的DMEM培养液,37℃、5%CO2培养箱中继续培养72 h。将培养皿中的细胞上清液吸至50 mL离心管中,4℃,4 000 r/min,低速离心4 min。将上清液吸入50 mL注射器内,0.45 μm过滤器过滤。滤液超速离心,4℃,20 000 r/min,2 h。将浓缩液收集分装,-80℃冰箱保存。
1.2.2 携带XAF1基因慢病毒感染鼻咽癌放射抗拒细胞株CNE-2R 取对数期生长良好的细胞,接种于6孔板中(1×105个/孔),选取感染复数(multiplicity of infection,MOI)为50的慢病毒稀释液(MOI 50)和MOI为100的慢病毒原液(MOI 100)分别加入对应孔中,其中慢病原液(MOI 100)一半孔中加入5 μg/mL polybrene,最后用无血清的1640培养基将体积补充至1 mL,轻轻摇匀,放入培养箱培养。12 h后观察细胞状态,更换新鲜培养基。感染96 h后在倒置荧光显微镜下观察感染效率。
1.2.3 筛选稳定转染细胞株 以上述转染效率最高者进行嘌呤霉素筛选稳定转染细胞株。转染XAF1基因2 d后更换含嘌呤霉素的RPMI 1640完全培养液培养,并设浓度梯度,每日观察各浓度梯度细胞生长和死亡情况,3 d更换培养液1次,2周形成抗性细胞株。选择细胞处于最佳状态时的嘌呤霉素浓度培养转染细胞1个月。
1.2.4 qRT-PCR检测XAF1基因mRNA的表达 收集对数期生长的细胞,以构建XAF1稳定表达的XAF1-CNE-2R细胞株为实验组,空载慢病毒构建的NC-CNE-2R细胞株为空白对照组,CNE-2R细胞株为阴性对照组。并用Trizol提取细胞RNA,取1 μg加入到10 μL反应体系中进行逆转录反应。将上述产物9 μL加入到20 μL的反应体系中,用Stratagene Mx3000P定量PCR仪扩增目的基因XAF1,正向引物序列:5'-CGCCCTGTTGAGTGTAAGTT-3',反向引物序列:5'-CCTGTTCACTGCGACAGACA-3'。并以β-actin为内参,正向引物序列:5'-ACCGAGCGCGGCTACAGC-3',反向引物序列:5'-CTCATTGCCAATGGTGAT-3'。用2-ΔΔCt法进行基因的相对定量分析。
1.2.5 western blot实验检测XAF1基因蛋白的表达
收集实验组、空白对照组和阴性对照组对数期生长的细胞,RIPA裂解液抽提细胞总蛋白,BCA法行蛋白定量。每组细胞取20 μg蛋白质,加适量上样缓冲液,用12%SDS-PAGE电泳、转膜、5%脱脂牛奶封闭后,分别加入特异性XAF1抗体(1∶1 000)和β-actin抗体(1∶1 000),4℃孵育过夜,荧光二抗(1∶1 000)摇床室温孵育1 h,ECL显影,凝胶成像系统拍照和分析。
2 结果
2.1 慢病毒感染效果
慢病毒感染鼻咽癌放射抗拒CNE-2R细胞96 h后,在倒置显微镜下可见慢病毒稀释液(MOI 50)感染,约60%的细胞内观察到微弱的绿色荧光(图1);慢病毒原液(MOI 100)感染,约70%的细胞内观察到较弱的绿色荧光(图2);慢病毒液(MOI 100)中加入5 μg/mL polybrene感染,约90%细胞可观察到较强荧光,且细胞生长状态良好(图3)。
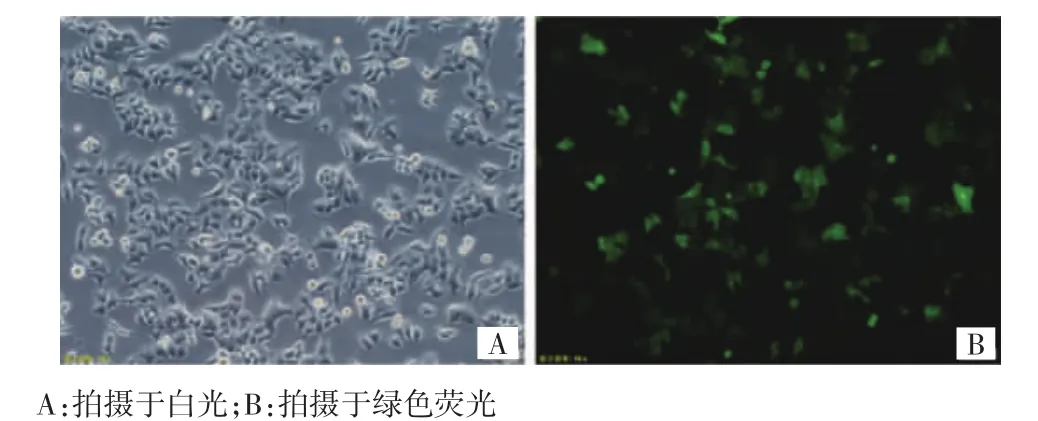
图1 慢病毒稀释液感染鼻咽癌放射抗拒CNE-2R细胞(×200)

图2 慢病毒原液感染鼻咽癌放射抗拒CNE-2R细胞(×200)
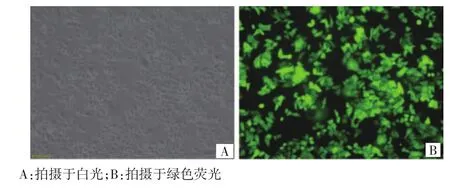
图3 慢病毒原液加5 μg/mL polybrene感染鼻咽癌放射抗拒CNE-2R细胞(×200)
2.2 嘌呤霉素筛选稳定转染细胞株
慢病毒液(MOI 100)加入5 μg/mL polybrene的感染效率最高,选其进行嘌呤霉素筛选。嘌呤霉素浓度为1 μg/mL时细胞处于最佳状态。持续用含1 μg/mL嘌呤霉素的RPMI 1640完全培养基培养1个月,最终成功将携带XAF1基因的慢病毒转入人鼻咽癌放射抗拒CNE-2R细胞株。
2.3 qRT-PCR和western blot验证结果
qRT-PCR法检测上述成功转染携带XAF1基因的人鼻咽癌放射抗拒CNE-2R细胞株中XAF1基因mRNA的表达,结果显示,实验组XAF1基因mRNA高表达,空白对照组及阴性对照组XAF1基因mRNA低表达(图4)。western blot法检测三组中XAF1蛋白的表达水平,结果显示实验组XAF1蛋白高表达,空白对照组及阴性对照组XAF1蛋白不表达。综上说明,成功构建稳定过表达XAF1基因的鼻咽癌放射抗拒CNE-2R细胞株(图5)。

图4 qRT-PCR检测鼻咽癌放射抗拒CNE-2R细胞中XAF1基因mRNA的表达
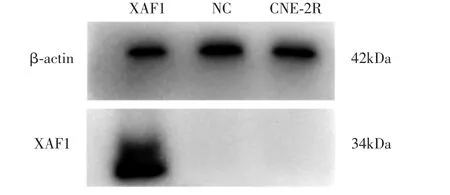
图5 western blot检测鼻咽癌放射抗拒CNE-2R细胞中XAF1蛋白的表达
3 讨论
鼻咽癌是中国南方常见的恶性肿瘤[4],放疗是主要的治疗方法,而放射抗拒是治疗失败的主要原因[5]。本课题组前期发现XAF1基因在鼻咽癌放射敏感性CNE-2细胞中低表达,在放射抗拒性CNE-2R细胞中高表达,提示XAF1基因可能与鼻咽癌的放射敏感性相关[6-7]。
作为重要的肿瘤抑制因子,XAF1可与XIAP结合,并抑制XIAP与半胱天冬酶结合,从而发挥肿瘤抑制作用。Fong等[1]检测美国国立癌症研究所(national cancer institute,NCI)60多种肿瘤细胞中XAF1 mRNA的表达水平,结果显示,XAF1 mRNA在大多数细胞株中低表达或不表达,呈转录抑制状态。进一步研究表明,XAF1不仅在多种肿瘤组织中的表达明显低于正常组织,且与肿瘤临床分期和病理分级有关[8-11]。Tu等[12]研究发现,XAF1可显著增强肿瘤坏死因子相关凋亡诱导配体(tumor necrosis factor-related apoptosis inducing ligand,TRAIL)诱导肿瘤细胞凋亡的作用,并诱导细胞周期G2/M期静止。Leaman等[13]研究发现,XAF1可增强依赖IFN-β的细胞对TRAIL诱导凋亡的敏感性。Kim等[14]研究发现XAF1/XIAP通过DDB1-CUL4A E3结构域与Chk1结合,进而下调Chk1,增加肺癌细胞的放射敏感性。同时,IFN-γ可进一步促进XAF1分子灭活Chk1,消除G2/M期阻滞,增强放射敏感性[15]。本实验构建稳定转染XAF1基因的鼻咽癌放射抗拒CNE-2R细胞株,为继续探讨XAF1基因对鼻咽癌放射抗拒CNE-2R细胞株放疗敏感性的影响提供基础。
载体是供插入目的基因并将其导入宿主细胞内表达或复制的运载工具。目前载体分为病毒载体和非病毒载体。病毒载体转染效率较高,可在体内稳定表达,具有高效的转染率[16-17]。慢病毒属逆转录病毒,其载体以慢病毒基因组为基础,除去其复制所需的基因,还可携带基因片段,容量大、无毒性且不易诱发宿主免疫反应,不仅能感染分裂细胞,而且能转染终末未分化细胞和非分裂细胞,整合靶细胞基因组的目的基因能够长期、稳定表达。基于以上优点,本实验采用慢病毒载体转染鼻咽癌放射抗拒CNE-2R细胞。polybrene是一种多聚阳离子聚合物,可中和细胞表面和病毒颗粒上唾液酸的电荷,消除排斥作用,促进细胞与病毒颗粒的吸附作用[18]。本实验分别采用慢病毒稀释液、慢病毒原液、慢病毒原液加入5 μg/mL polybrene 3种方式转染鼻咽癌放射抗拒CNE-2R细胞株,结果发现,慢病毒原液加5 μg/mL polybrene的转染效果较好,借助慢病毒载体所携带的嘌呤霉素抗性基因筛选稳定细胞株,结果成功将XAF1基因转入人鼻咽癌CNE-2R细胞株,说明慢病毒加入polybrene是较为有效的转染方法。本研究进一步以qRT-PCR和western blot检测上述嘌呤霉素筛选的鼻咽癌放射抗拒CNE-2R细胞株中XAF1基因的表达,结果稳定过表达XAF1基因,说明成功构建了稳定过表达XAF1基因的鼻咽癌CNE-2R细胞株,这为进一步研究XAF1对鼻咽癌放射抗拒CNE-2R细胞放射敏感性的影响奠定了基础。
[1] Fong WG,Liston P,Rajcan-Separovic E,et al.Expression and genetic analysis of XIAP-associated factor 1(XAF1)in cancer cell lines[J]. Genomics,2000,70(1):113-122.
[2] Zhao WJ,Deng BY,Wang XM,et al.XIAP associated factor 1(XAF1)represses expression of X-linked inhibitor of apoptosis protein(XIAP)and regulates invasion,cell cycle,apoptosis,and cisplatin sensitivity of ovarian carcinoma cells[J].Asian Pac J Cancer Prev,2015,16(6):2453-2458.
[3] 孟凡荣,陈琛,万海粟,等.慢病毒载体及其研究进展[J].中国肺癌杂志,2014,17(12):870-876.
[4] Tang LL,Chen WQ,Xue WQ,et al.Global trends in incidence and mortality of nasopharyngeal carcinoma[J].Cancer Lett,2016,374(1):22-30.
[5] 马嘉林,郭亚,曲颂,等.沉默CDKN1A基因对鼻咽癌放射抗拒性CNE-2R细胞放射敏感性的影响[J].中国癌症防治杂志,2014,6(2):121-126.
[6] 朱小东,郭亚,曲颂,等.应用蛋白质的相互作用网络图筛选鼻咽癌放射抗拒相关基因[J].中华放射医学与防护杂志,2012,32(1);20-24.
[7] Guo Y,Zhu XD,Qu S,et al.Identification of genes involved in radioresistance of nasopharyngeal,carcinoma by integrating gene ontology and protein-protein interaction networks[J].Int J Oncol,2011,40(1):85-92.
[8] Wang YX,Mao HL,Hao QZ,et al.Association of expression of XIAP-associated factor 1(XAF1)with clinicopathologic factors,overall survival,microvessel density and cisplatin-resistance in ovarian cancer[J].Regul Pept,2012,178(1-3):36-42.
[9] Zhu LM,Shi DM,Dai Q,et al.Tumor suppressor XAF1 induces apoptosis,inhibitsangiogenesisand inhibitstumorgrowth in hepatocellular carcinoma[J].Oncotarget,2014,5(14):5403-5415.
[10]Yang WT,Chen DL,Zhang FQ,et al.Experimental study on inhibition effects of the XAF1 gene against lung cancer cell proliferation[J]. Asian Pac J Cancer Prev,2014,15(18):7825-7829.
[11]Wang Y,Mao H,Hao Q,et al.Association of expression of XIAP-associated factor 1(XAF1)with clinicopathologic factors,overall survival,microvessel density and cisplatin-resistance in ovarian cancer[J].Regul Pept,2012,178(1-3):36-42.
[12]Tu SP,Sun YW,Cui JT,et al.Tumor suppressor XIAP-Associated factor 1(XAF1)cooperates with tumor necrosis factor-related apoptosis-inducing ligand to suppress colon cancer growth and trigger tumor regression[J].Cancer,2010,118(5):1252-1263.
[13]Leaman DW,Chawlasarkar M,Vyas K,et al.Identification of X-linked inhibitor of apoptosis-associated factor-1 as an interferonstimulated gene that augments TRAIL Apo2L-induced apoptosis[J]. J Biol Chem,2002,277(32):28504-28511.
[14]Kim KS,Heo JI,Choi KJ,et al.Enhancement of cellular radiation sensitivitythrough degradation ofChk1 bytheXIAP-XAF1 complex[J].Cancer Biol Ther,2014,15(12):1622-1634.
[15]Kim KS,Choi KJ,Bae S.Interferon-gamma enhances radiation-induced cell death via downregulation of Chk1[J].Cancer Biol Ther,2012,13(11):1018-1025.
[16]毛颖佳,郑源强,石艳春.慢病毒载体及其应用的研究进展[J].中国生物制品学杂志,2009,22(2):196-200.
[17]褚波,黄雪峰,唐云明.慢病毒载体及其应用进展[J].生物医学工程学杂志,2008,25(1):224-226.
[18]黄会杰,葛岩,罗国兰,等.难转染悬浮细胞OCI-LY8慢病毒过表达稳定细胞株的构建[J].广东医学,2014,35(9):1323-1326.
[2016-10-04收稿][2016-11-29修回][编辑 罗惠予]
Optimizing construction of a nasopharyngeal cancer CNE-2R cell stably expressing XAF1
Wu Jiangbo1,2,Su Fang1,Li Ling1,Zhu Xiaodong1,Chen Long1,Qu Song1,Mo Qiyan1,2,Lin Huan1,2(Department of Radiology,Affiliated Tumor Hospital of Guangxi Medical University;2Graduate School of Guangxi Medical University,Nanning 530021,P.R.China)
Li Ling.E-mail:lilingmoon99@163.com
ObjectiveTo examine methods for constructing a nasopharyngeal cancer cell line(CNE-2R)stably expressing(X-linked inhibitor of apoptosis associated factor 1)XAF1.Method CNE-2R cells were infected with lentivirus encoding XAF1 as well as a green fluorescent protein reporter.Cells were infected at multiplicities of infection(MOI)of 50 or 100 without polybrene,or at an MOI of 100 in the presence of polybrene(5 μg/mL).Expression of XAF1 mRNA and protein was verified using quantitative RT-PCR and Western blotting.ResultsFaint fluorescence was detected in 60%of CNE-2R cells after transfection with lentivirus at an MOI of 50.A slightly higher percentage(70%)of CNE-2R cells showed weak fluorescence after transfection with lentivirus at an MOI of 100. When cells were infected at an MOI of 100 in the presence of polybrene,90%of CNE-2R cells showed strong fluorescence.Stably transfected cell lines were selected using puromycin.ConclusionThe efficiency with which XAF1-expressing lentivirus can infect CNE-2R cells is closely related to the state of the cells,MOI,and polybrene concentration.Addition of appropriate concentrations of polybrene to lentivirus can increase efficiency of infection.Stably transfected cell lines can be selected with puromycin.
Nasopharyngeal neoplasms;X-linked inhibitor of apoptosis associated factor 1;Lentiviral vector;Radioresistant human nasopharyngeal carcinoma cell line;Gene transfection;Fluorescence efficiency
R739.63
A
1674-5671(2016)06-05
10.3969/j.issn.1674-5671.2016.06.03
区域性高发肿瘤早期防治研究广西重点实验室研究资助项目(GK2015-ZZ07);广西医科大学青年科学基金资助项目(GX-MUYSF201317)
李龄。E-mail:lilingmoon99@163.com
【共同第一作者】苏芳。
慢病毒加polybrene转染可成功构建稳定过表达XAF1基因的鼻咽癌放射抗拒CNE-2R细胞株。
