新发脑胶质瘤患者细胞免疫功能与肿瘤WHO分级的关系
2016-03-06邓腾莫立根陈海南曾先捷
邓腾莫立根陈海南曾先捷
作者单位:530021 南宁 广西医科大学附属肿瘤医院1骨软组织神经外科,2头颈外科
临床研究
新发脑胶质瘤患者细胞免疫功能与肿瘤WHO分级的关系
邓腾1莫立根1陈海南1曾先捷2
作者单位:530021 南宁 广西医科大学附属肿瘤医院1骨软组织神经外科,2头颈外科
目的探讨新发脑胶质瘤患者外周血细胞免疫功能与肿瘤WHO分级的关系,为脑胶质瘤的综合治疗提供依据。方法应用流式细胞技术检测92例新发脑胶质瘤患者术前外周血细胞免疫功能,用Spearman等级相关分析细胞免疫功能与术后病理分级的相关关系。结果脑胶质瘤WHO分级不同组间CD3+、CD4+、CD8+、CD4+/CD8+、CD16+CD56+及CD19+的差异无统计学意义(P>0.05),各项指标与肿瘤WHO分级无等级相关关系。结论新发脑胶质瘤患者外周血细胞免疫功能与肿瘤WHO分级无等级相关关系,尚不能用于术前区分低级别与高级别胶质瘤。
脑胶质瘤;细胞免疫;WHO肿瘤分级
脑胶质瘤是中枢神经系统最常见的原发性肿瘤,目前根据WHO神经系统肿瘤分级将脑胶质瘤划分为低级别脑胶质瘤(I~Ⅱ级)和高级别脑胶质瘤(Ⅲ~Ⅳ级)[1]。对于脑胶质瘤发生和发展的具体机制目前仍不明确。有研究表明[2],脑胶质瘤恶性程度越高,细胞免疫功能越低,提示免疫功能异常是脑胶质瘤进展的原因之一。然而,目前国内外相关研究较少,免疫功能异常是否与脑胶质瘤发展密切相关仍需进一步研究[3]。本研究通过检测新发脑胶质瘤患者外周血细胞免疫功能,探讨细胞免疫功能与脑胶质瘤WHO分级的关系。
1 材料和方法
1.1 临床资料
回顾性分析2010年8月至2016年7月广西医科大学附属肿瘤医院神经外科手术治疗的新发脑胶质瘤患者92例。其中男性60例,女性32例,年龄11~78岁,平均年龄44.9岁。按WHO分级标准低级别脑胶质瘤36例,其中I级2例(病理类型为毛细胞型星形细胞瘤),Ⅱ级34例(病理类型为弥漫性星形细胞瘤,室管膜瘤,少突胶质细胞瘤);高级别脑胶质瘤56例,其中Ⅲ级32例(病理类型为间变型星形细胞瘤,间变型少突胶质细胞瘤,间变型室管膜瘤),Ⅳ级24例(病理类型为胶质母细胞瘤),见表1。纳入标准:(1)术后病理明确为脑胶质瘤病变;(2)无长期营养不良、无结核、无恶性肿瘤手术、未行放化疗、无器官移植,无重大创伤及烧伤病史;(3)手术前进行细胞免疫功能检测;(4)采血前均未使用抗癫痫药物及激素。入院后第二天清晨采集2 mL肝素抗凝外周血液,采血前未使用静脉输液及口服药物。

表1 92例脑胶质瘤患者的临床资料
1.2 仪器和试剂
流式细胞仪(BD influx)、免疫荧光抗体试剂盒均购自Becton Dickinson公司。
1.3 方法
采用流式细胞术检测患者外周血液中的总T淋巴细胞(CD3+)、辅助性淋巴细胞(CD4+)、抑制性淋巴细胞(CD8+)、Th/Ts(CD4+/CD8+)、自然杀伤细胞(CD16+CD56+)及B淋巴细胞(CD19+)等指标。按操作程序上机检测。
1.4 统计学分析
采用SPSS 17.0统计软件对数据进行处理,结果以均数±标准差(s)表示,脑胶质瘤WHO分级不同组间细胞免疫功能的比较采用方差分析;用Spearman等级相关分析细胞免疫功能与脑胶质瘤WHO分级的相关关系。以P<0.05为差异有统计学意义。
2 结果
不同脑胶质瘤WHO分级组间CD3+、CD4+、CD8+、CD4+/CD8+、CD16+CD56+及CD19+的差异无统计学意义(P>0.05),见表2。脑胶质瘤患者细胞免疫功能与肿瘤WHO分级的关系经Spearman等级相关检验,结果显示CD3+、CD4+、CD8+、CD4+/CD8+、CD16+CD56+及CD19+与肿瘤WHO分级无等级相关关系,见表3。
表2 不同WHO分级脑胶质瘤患者细胞免疫功能检测结果(s)
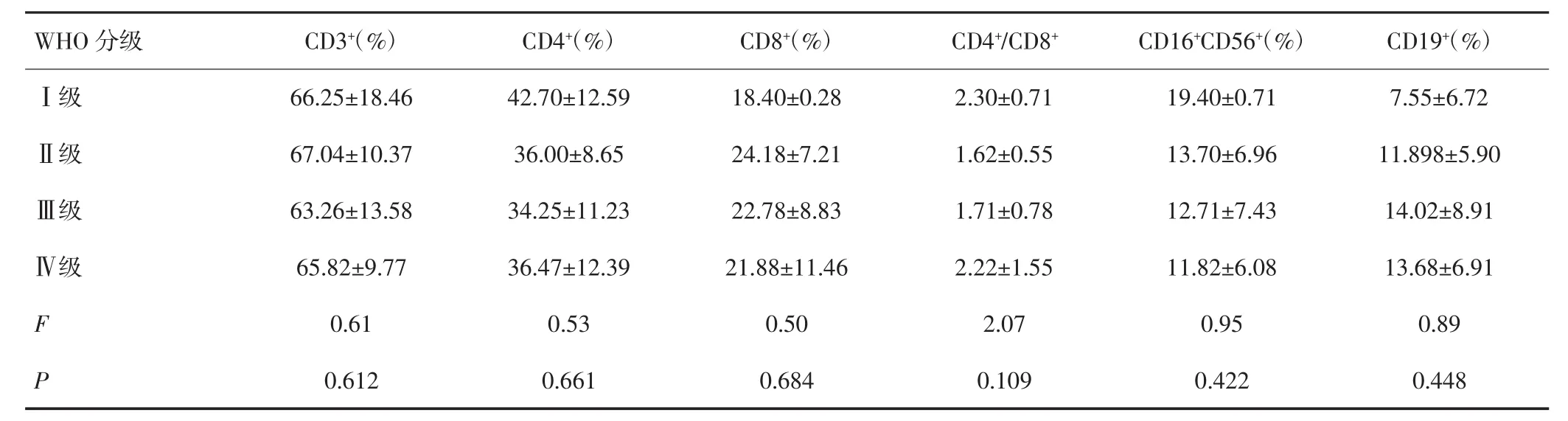
表2 不同WHO分级脑胶质瘤患者细胞免疫功能检测结果(s)
不同WHO分级组间比较:P<0.05
WHO分级 CD3+(%) CD4+(%) CD8+(%) CD4+/CD8+CD16+CD56+(%) CD19+(%)Ⅰ级 66.25±18.46 42.70±12.59 18.40±0.28 2.30±0.71 19.40±0.71 7.55±6.72Ⅱ级 67.04±10.37 36.00±8.65 24.18±7.21 1.62±0.55 13.70±6.96 11.898±5.90Ⅲ级 63.26±13.58 34.25±11.23 22.78±8.83 1.71±0.78 12.71±7.43 14.02±8.91Ⅳ级 65.82±9.77 36.47±12.39 21.88±11.46 2.22±1.55 11.82±6.08 13.68±6.91 F 0.61 0.53 0.50 2.07 0.95 0.89 P 0.612 0.661 0.684 0.109 0.422 0.448
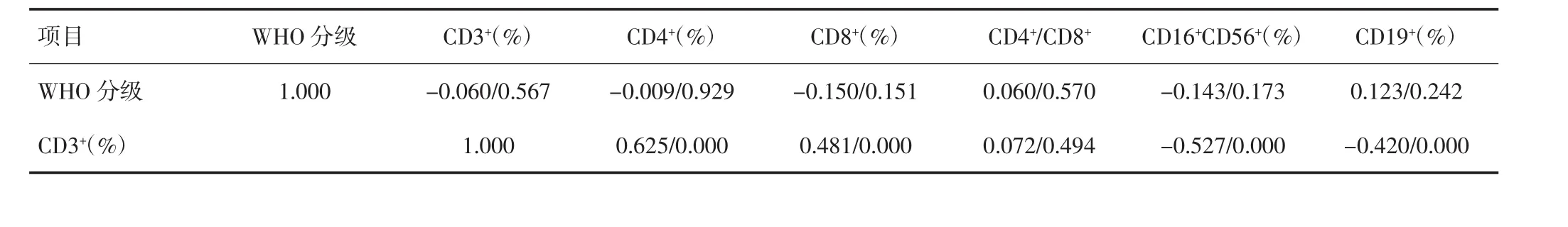
表3 细胞免疫功能与肿瘤WHO分级的Spearman等级相关分析结果
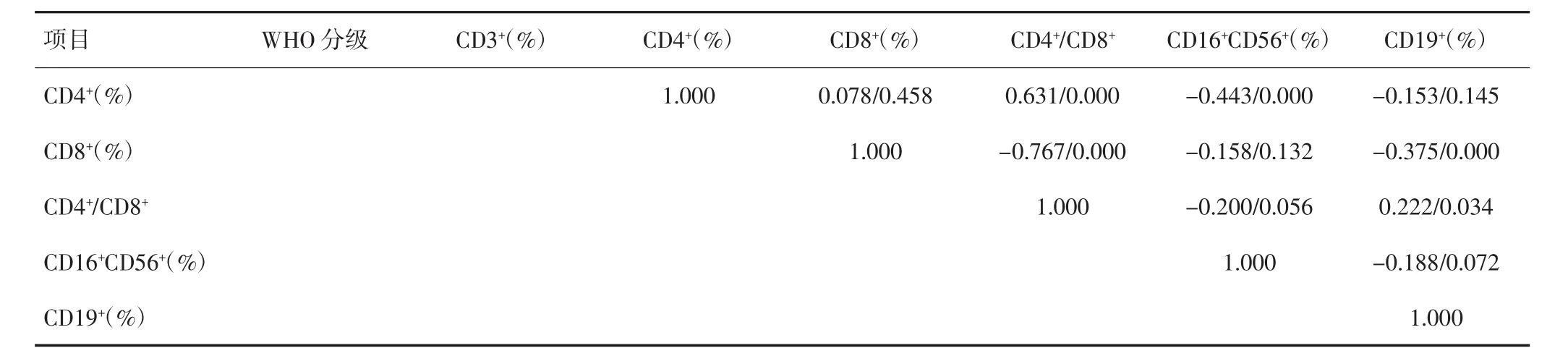
(续表)
3 讨论
脑胶质瘤是中枢神经系统最常见的原发性肿瘤,预后较差。尽管采用了手术切除、放疗及化疗等综合治疗,但高级别脑胶质瘤患者的中位生存期仍少于15个月[4-5]。有研究[6-9]发现脑胶质瘤患者免疫功能明显减低,提示免疫治疗可能是改善其预后的手段之一。Gousias等[2]研究显示,WHO分级升高与外周血CD3+、CD4+、CD8+及CD4+/CD8+下降明显相关,提示外周血细胞免疫功能监测可反映患者病情严重程度,高级别脑胶质瘤患者免疫功能损害更加严重。然而,本组研究却发现新发脑胶质瘤患者肿瘤WHO分级不同组间CD3+、CD4+、CD8+、CD4+/CD8+、CD16+CD56+及CD19+的差异无统计学意义,相关分析提示新发脑胶质瘤患者外周血细胞免疫功能与肿瘤分级无等级相关关系。出现与上述研究结果不一致的原因可能有:(1)两个研究中的研究对象来源于不同种族,不排除不同种族的患者其免疫功能状态存在差异的可能;(2)外周血细胞免疫功能容易受到各种因素的影响,如营养不良、感染、使用免疫抑制剂、放疗、手术、创伤、烧伤和脾切除等。
本研究结果提示脑胶质瘤患者外周血细胞免疫功能与WHO等级无关,其中可能的原因有如下几点:(1)本研究纳入的研究对象为新发脑胶质瘤患者,大部分患者发病时间较短,可能肿瘤生长尚未形成对血脑屏障的严重破坏,肿瘤抗原未能进入淋巴循环诱导免疫应答,这可能是其主要原因。(2)外周血免疫功能尚不能真实反映肿瘤微环境中的机体免疫功能状态。Nimmerjahn等[10]研究发现在脑胶质瘤发展的初期,小胶质细胞可获取脑胶质瘤相关抗原。虽然活化的小胶质细胞在感染性疾病或损伤时具有较强的免疫功能,但在脑胶质瘤的微环境中却难以启动抗肿瘤免疫应答。Heimberger等[11]研究发现高级别脑胶质瘤微环境中存在大量免疫抑制性调节性T细胞,脑胶质瘤中调节性T细胞浸润程度与肿瘤来源、病理分级密切相关,调节性T细胞是引起肿瘤免疫逃逸的重要原因。因此研究肿瘤微环境中各种免疫细胞功能状况,可能能够如实反映患者抗肿瘤免疫功能情[12-13]。(3)纳入研究的样本例数较少。本研究显示的一些免疫功能指标,比如CD16+CD56+,其随着WHO肿瘤分级升高而出现降低趋势,如果纳入更多研究对象,则可能会得到有意义的结果。(4)本研究纳入的研究例数,特别是某些级别的患者例数较少,可能存在偏倚。新发脑胶质瘤患者进行术前免疫功能检测尚不能帮助区别低级别及高级别脑胶质瘤,但这仍需要今后纳入更大样本的研究加以证实。
[1] 杨学军,江涛.解读《世界卫生组织中枢神经系统肿瘤分类(2016年)》[J].中国神经精神疾病杂志2016,42(6):321-329.
[2] Gousias K,Markou M,Arzoglou V,et al.Frequent abnormalities of the immune system in gliomas and correlation with the WHO grading system of malignancy[J].J Neuroimmunol,2010,226(1-2):136-142.
[3] Ge J,Zhao L,Li G,et al.Cytotoxic CD4+T cells are correlated with better prognosis in Han Chinese grade II and grade III glioma subjects and are suppressed by PD-1 signaling[J].Int J Neurosci,2016,12:1-10.
[4] Stupp R,Mason WP,van den Bent MJ,et al.Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma[J].N Engl J Med,2005,352(10):987-996.
[5] Wheeler LA,Manzanera AG,Bell SD,et al.Phase II multicenter study of gene-mediated cytotoxic immunotherapy as adjuvant to surgical resection for newly diagnosed malignant glioma[J].Neuro Oncol,2016,18(8):1137-1145.
[6] 林彤,浦佩玉,胡应礼,等.胶质瘤患者细胞免疫功能的检测及其与临床指标的关系[J].中华神经外科杂志,1992,8(4):256-259.
[7] 徐春华,刘越,肖利民,等.不同级别脑胶质瘤患者手术前后外周血T淋巴细胞免疫细胞水平变化及意义[J].重庆医学,2016,45(2):180-182.
[8] Grossman SA,Ye X,Lesser G,et al.Immunosuppression in patients with high-grade gliomas treated with radiation and temozolomide[J]. Clin Cancer Res,2011,17(16):5473-5480.
[9] Prins RM,Soto H,Konkankit V,et al.Gene expression profile correlates with T-cell infiltration and relative survival in glioblastoma patients vaccinated with dendritic cell immunotherapy[J]. Clin Cancer Res,2011,17(6):1603-1615.
[10]Nimmerjahn A,Kirchhoff F,Helmchen F.Resting microglial cells are highly dynamic surveillants of brain parenchyma in vivo[J]. Science,2005,308(5726):1314-1318.
[11]Heimberger AB,Abou-Ghazal M,Reina-Ortiz C,et al.Incidence and prognostic impact of FoxP3+regulatory T cells in human gliomas[J]. Clin Cancer Res,2008,14(16):5166-5172.
[12]Hu Q,Kang T,Feng J,et al.Tumor microenvironment and angiogenic blood vessels dual-targeting for enhanced anti-glioma therapy[J]. ACS Appl Mater Interfaces,2016,8(36):23568-23579.
[13]Zhang X,Rao A,Sette P,et al.IDH mutant gliomas escape natural killer cell immune surveillance by downregulation of NKG2D ligand expression[J].Neuro Oncol,2016,18(10):1402-1412.
[2016-08-26收稿][2016-11-21修回][编辑 江德吉]
Correlation between cellular immunity and WHO classification of newly diagnosed glioma
Deng Teng1,Mo Ligen1,Chen Hainan1,Zeng Xianjie2(1Department of neurosurgery,2Department of Head and Neck Surgery,Affiliated Tumor Hospital of Guangxi Medical University,Nanning 530021,P.R.China)
Zeng Xianjie.E-mail:zengxianjie@gxmu.edu.cn
ObjectiveTo investigate the cellular immunity status of glioma patients and their correlation with the WHO classification of gliomas.MethodsThe clinical data of 92 patients with newly diagnosed patients analyzed retrospectively.Preoperative cellular immunity was measured by flow cytometry and WHO classification of gliomas were confirmed by postoperative pathology.The correlation between cellular immunity and WHO classification of glioma was analyzed by Spearman's rank correlation coefficient.ResultsNo statistically significant differences were observed concerning CD3+,CD4+,CD8+,CD4+/CD8+,CD16+CD56+or CD19+(P<0.05).No significant correlation between cellular immunity and WHO classification of gliomas were observed by Spearman's rank correlation coefficient(P<0.05).Conclusions There is no significant correlation between patient's cellular immunity and WHO classification of gliomas.Preoperative cellular immunity test can not differentiate low grade glioma from high grade glioma.
Glioma;Cellular immunity;WHO classification
R739.41
A
1674-5671(2016)06-04
10.3969/j.issn.1674-5671.2016.06.07
广西自然科学基金面上项目(2015GXNSFAA139160)
曾先捷。E-mail:zengxianjie@gxmu.edu.cn
