福建连江海带循环制冷育苗水体的浮游植物群落结构分析
2016-03-04钟晨辉郭书悦黄瑞芳林向阳宋武林陈德富
钟晨辉,杨 芳,林 琪,郭书悦,黄瑞芳,林向阳,宋武林,陈德富
(1.福建省水产研究所,福建省海洋生物增养殖与高值化利用重点实验室,福建厦门 361013;2.福建省海洋经济运行监测与评估中心,福建福州 350003;3.福建省连江县官坞海产开发有限公司,福建连江 350511)
福建连江海带循环制冷育苗水体的浮游植物群落结构分析
钟晨辉1,杨 芳1,林 琪1,郭书悦1,黄瑞芳1,林向阳1,宋武林2,陈德富3
(1.福建省水产研究所,福建省海洋生物增养殖与高值化利用重点实验室,福建厦门 361013;2.福建省海洋经济运行监测与评估中心,福建福州 350003;3.福建省连江县官坞海产开发有限公司,福建连江 350511)
为准确掌握海带(Saccharina japonica)循环制冷育苗过程水体的浮游植物群落结构变化特征,本研究于2014年9月下旬~11月中旬调查了福建省连江县官坞海产开发有限公司海带育苗车间循环水9个批次的浮游植物群落结构,对浮游植物种类组成、优势种和生态特征指数进行统计分析。结果显示,共鉴定浮游植物43种,隶属于5门31属,以硅藻门出现的种类数最多,达22属32种,占总种数的74.42%,其它为蓝藻门、甲藻门、裸藻门和绿藻门。在整个育苗期间,第一优势种始终为奇异棍形藻(Bacillaria paradoxa),第二优势种为佛氏海毛藻(Thalassiothrix frauenfeldii)和新月细柱藻(Cylindrotheca closterium)交替,优势种组成较简单,变化不明显,单一种优势地位显著。海带幼苗生长期1~8 d阶段的水体浮游植物种类较多,多样性指数、均匀度和丰富度分别达到3.191~3.225、0.765~0.806和1.324~1.500,然而在生长期15~57 d阶段的水体浮游植物种类数降低,多样性指数为1.172~1.818,均匀度为0.370~0.570,丰富度为0.485~0.841,生态特征指标变化幅度较小,多样性水平相对较低,群落结构不匀称,较适合海带幼苗的生长。
海带;浮游植物;循环制冷水体;种类组成;优势种
海带(Saccharina japonica)是一种世界性的大型经济藻类,也是目前我国养殖规模最大和总产量最高的海藻栽培品种,主要养殖在辽宁、山东和福建的沿海地区,总年产量(干品)达80× 104t以上,居世界第一位[1]。海带原产于北太平洋与大西洋沿海地区,引种到我国仅有80多年的历史,但我国海带人工育苗及养殖技术均处于世界领先。自上世纪60年代“海带夏苗培育技术”和“海带南移养殖技术”等难题被攻克后,福建省逐步成为我国南方主要的海带育苗与养殖集群地[2]。据2012年的《中国渔业统计年鉴》数据显示:福建省海带年总育苗量达到207.3×108株,占全国育苗总量的69.5%;海带养殖产量(干品)达到53.2×104t,占全国总产量的54.4%[1]。海洋浮游植物普遍存在于海洋生物繁育水体中,具有广适性、广温性、繁殖力强的特点[3]。福建省海带人工育苗采用夏季自然光人工育苗方法,整个育苗车间的循环制冷海水源于自然海区,存在着杂藻(水云属、浒苔属和硅藻门等海洋浮游植物)污染情况[4]。杂藻与海带配子体或幼孢子体呈生长竞争关系,杂藻大量增长将会阻碍海带幼孢子体的生长,严重时造成育苗器上幼苗附着量稀少,不能用于养殖应用。按现有的海带育苗技术工艺,海带孢子体幼苗被杂藻包围后,一般情况下难以通过调节光照强度和温度,控制营养盐添加量等处理方法得以清除[5]。为了逐步建立优势性杂藻控制或防治技术,需要准确掌握海带人工育苗水体的浮游植物种类组成及主要优势种。因此,本试验在海带室内自然光育苗期间连续监测了循环制冷水体中浮游植物群落的多样性指数、均匀度、丰富度及优势度等指标,初步探讨了浮游植物种类组成和优势种变化趋势,以期为将来开展杂藻防控技术研究提供基础资料。
1 材料与方法
1.1 海带循环水育苗车间采样点设置
浮游植物的采集地在福建省连江县官坞海产开发有限公司的海带育苗车间内,采集时间为整个海带育苗时期(2014年9月下旬~11月中旬),海带育苗车间采用海水循环制冷系统(图1-A所示)。采集点位于育苗车间的S1、S2、S3、S4、S5和S6位置(图1-B所示)。

图1 海水循环制冷系统模式(A)及海带育苗车间水样采样点图(B)Fig.1 Diagram of the circulating cold seawater system(A)and sam pling locations in the breeding room of Saccharina japonica(B)
1.2 样品采集、处理和分析
从种海带释放游孢子附着维尼龙育苗器后开始采集水样,随后每隔7 d采集一次水样直至海带孢子体幼苗出库。由于海带循环制冷育苗系统的育苗池池内水流交换通畅,同时工人每2 d采用高压水枪冲刷育苗器表面附着的浮游植物,在同一时间采集育苗水体的浮游植物相对分布均匀。浮游植物样品的采集依据GB17378.7-2007《海洋监测规范》的生态调查方法。具体方法:正午时分等量采集海带育苗车间的S1、S2、S3、S4、S5和S6站位的表层水体,用5%Lugos溶液固定样品,带回实验室静置24 h以上浓缩至适量体积,制成混合样品。采用移液器移取定量藻液置于浮游植物计数框内,盖上盖玻片后移到Leica DM4500B生物显微镜下进行种类分析和计数。种类鉴定方法参照《中国海洋浮游生物图谱》[6]和《中国海域常见浮游硅藻图谱》[7]并进行数据统计分析。
1.3 数据分析
生态特征指数计算包括多样性指数(H′)、均匀度(J)、丰富度(d)、优势度(D2)和物种优势度(Y),具体计算公式如下:
多样性指数(Shannon-Wiener,1963):H′=-∑si=1Pilog2Pi
均匀度(Pielou,1966):J=H′/log2S
丰富度(Margalef,1958):d=(S-1)/log2N
优势度(Manauhton):D2=(N1+N2)/NT
物种优势度:Y=(ni/N)×fi
其中,ni为某样品第i个物种的个体数,N为样品的总个体数,S为样品中物种总数;Pi为第i种的个体数(ni)与总个体数(N)之比值;N1为样品中第一优势种的个数,N2为样品中第二优势种的个数,NT为所有样品的总个体数,fi为出现频率,当物种优势度(Y)>0.02时,该种即为优势种。
2 结果与分析
2.1 种类组成
如表1和表2所示,经鉴定,福建连江的海带循环制冷育苗水体的浮游植物共5门31属43种(包括变种和变型等),分属于蓝藻门、甲藻门、硅藻门、裸藻门和绿藻门,以广温种和暖水种为主。其中,以硅藻门出现的种类数最多,共22属32种,占总种数的74.42%;其次是绿藻门共5属7种,占总种数的16.28%;甲藻门种类数共2属2种,占总种数的4.65%;蓝藻门和裸藻门最少,均为1属1种,各占总种数的2.33%。不同时期的海带育苗水体中的浮游植物种类数在9~23种之间,其中第1天出现种类数最多为23种,其次是第8天出现的种类数为18种,第29天、36天和43天出现的种类数最少,均为9种。

表1 不同采集时间内海带循环制冷育苗水体的浮游植物种类数Tab.1 Species numbers of phytoplankton collected from circulated cold seawater in different sam p ling time of Saccharina japonica

表2 不同采集时间内海带循环制冷育苗水体的浮游植物种类组成Tab.2 Species com position of phytop lankton collected from circulated cold seawater in different sam pling time of Saccharina japonica

续表2
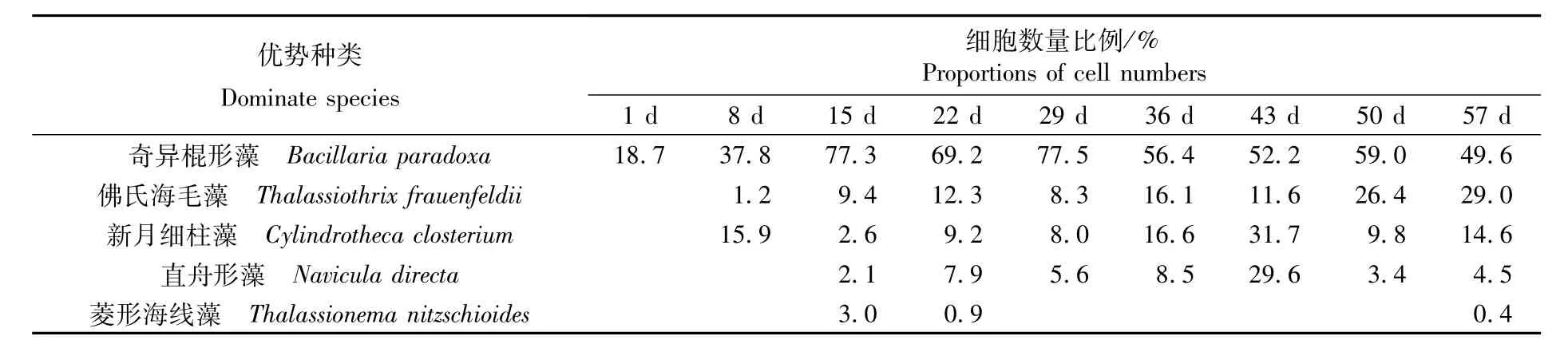
表3 不同采集时间的海带循环制冷育苗水体浮游植物优势种的数量比例Tab.3 Proportions of cell numbers of dom inate phytoplankton collected from circulated cold seawater in different sam pling time of Saccharina japonica
2.2 优势种及其变化
以物种优势度Y>0.02计算,整个海带育苗水体浮游植物的优势种包括奇异棍形藻(Bacillaria paradoxa)、佛氏海毛藻(Thalassiothrix frauenfeldii)、新月细柱藻(Cylindrotheca closterium)、直舟形藻(Navicula directa)和菱形海线藻(Thalassionema nitzschioides)。硅藻门的优势地位较明显。如表3所示,从各种类数量占浮游植物总数量的比例来看,整个海带育苗期间水体内的第一优势种均为奇异棍形藻(属广布性的赤潮生物),细胞数量占总细胞数量的比例在29.9%~77.5%之间。在育苗期的8 d、36 d和43 d水体内的第二优势种为新月细柱藻,育苗期的22 d、29 d、50 d、57 d水体内的第二优势种为佛氏海毛藻。所有样本的第二优势种数量占总细胞数量的比例在8.3%~31.7%之间。整个海带育苗水体的浮游植物优势种变化较简单,第一优势种一直是奇异棍形藻,在29 d时的育苗水体和维尼龙附苗器上发现存在大量的奇异棍形藻(图2-A,B),而第二优势种则由佛氏海毛藻和新月细柱藻两者相互更替。
2.3 生态特征指数的变化

图2 海带循环制冷育苗水体中的奇异棍形藻Fig.2 Bacillaria paradoxa in circulated cold seawater of Saccharina japonica
从表4可以看出,本次调查浮游植物细胞数量(N)范围为0.26×104~0.91×105cell·L-1,不同取样时间的浮游植物的生态特征指数差异较大,22 d时育苗水体的细胞总数量上升一个数量级,细胞总数量呈现初期数量较低,随后逐步增加后略有降低并再次稍微增加的变化过程。整个海带循环制冷育苗水体中浮游植物的丰富度(d)在0.485~1.500之间,丰富度呈现逐步下降的态势;群落多样性指数(H′)分布范围为1.172~3.225;均匀度(J)分布范围为0.370~0.806;优势度(D2)分布范围为0.486~0.867。15 d时的育苗水体多样性指数、均匀度和丰富度都逐步降低,而优势度小幅度升高,在15~57 d阶段趋于稳定,变化幅度极小,优势种的优势地位明显,群落结构比较不均匀。
3 讨论
3.1 浮游植物种类分析
海带室内自然光育苗系统是一个简单的海水循环制冷育苗系统,育苗期间水体温度通常控制在9~11℃[8]。本试验发现1 d的水样中存在淡水型藻类,即银灰平裂藻(Merismopedia glauca),该种藻类极大程度上是由靠近海带育苗场的山涧溪流渗入启用前的蓄水池,与后来的新鲜海水混合在一起进入循环制冷育苗车间。1 d的水样中浮游植物种类最多,达23种,可能与来自开放性海域海水中的浮游植物种类较丰富且缺乏竞争性生物有关。海带育苗车间的浮游植物主要以硅藻门为主,而甲藻门、蓝藻门等表征富营养化浮游藻类比例极低,仅在抽检的1 d和8 d水样中有发现。15~43 d育苗水体的浮游植物种类数逐渐减少,这可能是海区环境与冷却循环水环境差异较大,环境突变导致浮游植物种类数和细胞数量降低。然而,50 d和57 d时抽检水体中浮游植物的种类增加,可能是部分环境适应性强的藻类增加所引起的。另外,相关研究表明大型海藻可以通过感化作用来抑制微型浮游植物的生长与增殖[9-10]。在实际观察时也发现大量的奇异棍形藻附着在海带幼苗表面(图2-A),推测优势种富集在海带幼苗表面竞争到更多空间,一定程度上缓解了海带幼苗对优势种生长的化感抑制作用,利于其它类型浮游植物增殖与生长。
3.2 浮游植物数量与优势种变化分析
浮游植物数量变化主要取决于水体中营养盐含量的分布[11]。海带循环制冷育苗系统的水体交换较频繁,营养盐分布均衡,因此在逐步添加营养盐时浮游植物的数量在同一时期育苗水体中的分布相对较均匀。此外,福建连江海域沿岸主要以海水养殖业为主,无大型工业基地和生活区,短时间内浮游植物的分布相对均匀,引入海带育苗系统的冷却海水中的浮游植物数量也相对稳定。15 d前的育苗水体中几乎不添加任何营养盐,而29 d后通常会向水体添加适量的营养盐,既促进海带幼孢子体的生长可能也促进了浮游植物增殖,尤其体现在育苗后期的浮游植物细胞数量明显增多。在优势种方面,第一优势种一直是奇异棍形藻,第二优势种是佛氏海毛藻和新月细柱藻,3者都属于广温种[3],可以在较低的水温环境下生长,但是历史记录表明福建沿海夏季海水中以弱伪菱形藻(Pseudo-Nitzschiadelicatissima)、中肋骨条藻(Skeletonema costatum)和旋链角毛藻(Chaetoceros curvisetus)等适应富营养化理化特征种类为主要优势种[12-13],自然海水进入循环制冷系统后,浮游植物优势种是如何发生演替的,与各营养盐浓度的相关性如何,还需进一步研究。此外,越来越多的研究发现大型藻类可以分泌化感物质来抑制浮游植物生长,海带在生长过程中也能通过化学防御来阻碍中肋骨条藻等赤潮藻类的生长[9],因此不同生长期的海带幼苗对优势种的化感抑制作用机制也有待研究。

表4 不同采集时间海带育苗水体的浮游植物生态群落特征参数Tab.4 Ecological characteristic indices of phytoplankton collected from circulated cold seawater in different sam pling time of Saccharina japonica
3.3 浮游植物多样性分析
浮游植物的多样性指数与水体生态环境因子的稳定性相关[14]。海带室内人工育苗系统的光照、温度和营养盐供给较稳定,那么造成浮游植物多样性变化的因素可能与海带幼苗的生长发育有关。通常情况下,富营养化水体中的浮游植物种类数相对较少,优势种的比例增加,多样性指数和均匀度都会降低[15]。本次调查发现浮游植物的多样性指数呈现递减并趋于稳定的态势。在抽检1 d和8 d的海水样品中的浮游植物种类较多,多样性指数也较高,这可能是海带幼苗处在生长发育前期,个体较小,无生长竞争优势,较利于浮游植物的增殖。在育苗15 d时,抽检水样中的浮游植物多样性指数降低,丰富度也逐渐降低,推测海带幼苗逐步趋于快速生长,对浮游植物生长的化感抑制作用增强,易于竞争水体中的营养盐,占据生长优势地位。在15~57 d的育苗阶段,冷却循环水育苗车间的浮游植物多样性指数(H′)整体介于1.172~1.818之间,多样性水平不高,群落结构不匀称,变化幅度较小,这说明在海带幼苗生长发育过程的生态系统处于相对稳定状态,较利于海带幼苗的生长。
[1] 农业部渔业局.中国渔业统计年鉴[M].北京:中国农业出版社,2012:1-85.
Fisheries Bureau of Agriculture Ministry.China Fishery Statistical Yearbook[M].Beijing:China Agriculture Press,2012:1-85.
[2] 金振辉,刘 岩,张 静,等.中国海带养殖现状与发展趋势[J].海洋湖沼通报,2009(1):141-150.
JIN Z H,LIU Y,ZHANG J,et al.Breeding actuality and developing direction ofLaminariain China[J].Transactions of Oceanology and Limnology,2009(1):141-150.
[3] 林更铭,杨清良.台湾海峡小型浮游植物的多样性和分布特征[J].生物多样性,2007,15(1):31-45.
LIN G M,YANG Q L.Species diversity and the distribution of micro-phytoplankton in the Taiwan Strait[J].Biodiversity Science,2007,15(1):31-45.
[4] 单体锋,刘 峰,刘启顺,等.海带幼苗低温度夏技术的回顾与展望[J].中国农业科技导报,2011,13(2):129-134.
SHAN T F,LIU F,LIU Q S,et al.Review and prospect of“Summer Sporing”technique ofSaccharina japonicain China[J].Journal of Agricultural Science and Technology,2011,13(2):129-134.
[5] 李 涛,王飞久,孙修涛,等.GeO2对海带幼孢子体培育过程中硅藻污染的抑制效应[J].渔业科学进展,2012,33(3):83-87.
LIT,WANG F J,SUN X T,et al.Suppressive effect of germanium dioxide on diatom contamination during cultivation ofSaccharina japonicayoung sporophytes[J].Progress in Fishery Sciences,2012,33(3):83-87.
[6] 束蕴芳,韩茂森.中国海洋浮游生物图谱[M].北京:海洋出版社,1992:1-21.
SU Y F,HAN M S.Atlas of Marine Plankton in China[M].Beijing:China Ocean Press,1992:1-21.
[7] 杨世民,董树刚.中国海域常见浮游硅藻图谱[M].青岛:中国海洋大学出版社,2006:1-267.
YANG S M,DONG S G.A common planktonic diatom map in Chinese waters[M].Qingdao:China Ocean University Press,2006:1-267.
[8] 曾呈奎,王素娟,刘思俭,等.海藻栽培学[M].上海:上海科学技术出版社,1985:55-121.
ZENG C K,WANG S J,LIU S J,et al.Cultivation of Seaweed[M].Shanghai:Shanghai Science and Technology Press,1985:55-121.
[9] 安 蓁.大型海藻及纳米材料对赤潮中肋骨条藻的抑制作用研究[D].青岛:中国海洋大学,2008.
AN Z.The research of inhibitory effect on red tideSkeletonema costatumby macroalgae and nanomaterials[D].Qingdao:Ocean University of China,2008.
[10] 李 斌.海洋大型藻类对微藻类的化感作用[D].大连:大连海事大学,2015.
LI B.The allelopathy on microalgaes caused by marine macroalgaes[D].Dalian:Dalian Maritime University,2015.
[11] BU-OLAYAN A H,AI-HASSAN R,THOMASB V,et al.Impact of tracemetals and nutrients levels on phytoplankton from the Kuwait coast[J].Environment International,2001,26(4):199-203.
[12] 王 雨,林 茂,林更铭.福建沿岸不同海区夏季浮游植物的组成与分布[J].台湾海峡,2009,28(4):496-503.
WANG Y,LIN M,LIN G M.Study on the composition and distribution of phytoplankton on different waters of coastal Fujian in summer[J].Journal of Oceanography in Taiwan Strait.2009,28(4):496-503.
[13] 罗民波,陆健健,王云龙,等.东海浮游植物数量分布与优势种[J].生态学报,2007,27(12):5076-5085.
LUO M B,LU J J,WANG Y L,et al.Horizontal distribution and dominant species of phytoplankton in the East China Sea[J].Acta Ecologica Sinica,2007,27(12):5076-5085.
[14] ELTON C S.The Ecology of Invasions by Animals and Plants[M].London:Methuen and Co Ltd,1958.
[15] 韦昌用,王大鹏,张益峰,等.新村湾珍珠贝养殖区浮游植物现状调查分析[J].南方农业学报,2014,45(7):1286-1290.
WEI C Y,WANG D P,ZHANG Y F,et al.Investigation and analysis of phytoplankton in pearl oyster culture area of Xincun bay[J].Journal of Southern Agriculture,2014,45(7):1286-1290.
Analysis of phytoplankton community structure in circulated cold seawater from the breeding room of Saccharina japonica in Lianjiang,Fujian Province
ZHONG Chen-hui1,YANG Fang1,LIN Qi1,GUO Shu-yue1,HUANG Rui-fang1,LIN Xiang-yang1,SONGWu-lin2,CHEN De-fu3
(1.Fujian Fisheries Research Institute,Fujian Key Laboratory of Cultivation and High-value Utilization of Marine Organisms,Xiamen 361013,Fujian,China;2.Fujian Marine Economic Operation Monitoring and Assessment Center,Fuzhou 350003,Fujian,China;3.Fujian Guanwu Marine Products and Development co.,LTD,Lianjiang350511,Fujian,China)
Characterization of phytoplankton community structure in circulated cold seawater from the whole breeding stages ofSaccharina japonicawas studied.We collected nine samples from circulated cold seawater in the breeding room of S.japonica in Guanwu Marine Products and Development Co.,LTD,from late September to middle November of 2014.The species composition,dominate species,and ecological characteristic of phytoplankton were analyzed.The results showed that a total of 43 species belonging to 5 phyla and 31 genera were indetified.The richest Bacillariophyta consisting of 32 species belonged to 22 genera,accounting for 74.42%,whereas the rest were Pyrrophyta,Chlorophyta,Cyanophyta and Euglenophyta.Furthermore,the first dominate species was alwaysBacillaria paradoxa,eitherThalassiothrixfrauenfeldii or Cylindrotheca closterium was the second dominate species,suggesting that simple composition and unconspicuous temporal changes of dominate specieswere involved in the circulated cold seawater.From 1d to 8d in the growth stages of S.japonica,the diversity indices,evenness indices and richness indices of the phytoplankton were 3.191-3.225,0.765-0.806 and 1.324-1.500,respectively.However,from 15 d to 57 d in the growth stages,the diversity indiceswere 1.172-1.818,the evenness indiceswere 0.370-0.570,and the richness indiceswere 0.485-0.841.Therefore,the circulated cold seawater was suitable to propagate young blades of S.japonica as a consequence of phytoplankton with small variations in ecological and diversity indices,and unstable community structure.
Saccharina japonica;phytoplankton;circulated cold seawater;species composition;dominate species
S 932.7
A
1004-2490(2016)03-0283-08
2015-11-04
福建省自然科学基金(2014J01095);福建省海洋高新产业发展专项(闽海洋高新2014-19);福建省属公益类科研院所基本科研专项(闽海渔科2013R001-1);福建省种业创新与产业化工程(2014S1477-10);福建省海洋与渔业结构调整专项
钟晨辉(1984-),男,助理研究员,博士研究生,主要从事藻类生理生态与遗传育种研究。E-mail:zhongchenhui@126.com
