微纳米抗菌材料与器械研究现状
2016-03-04徐思峻陈思宇
张 峰,徐思峻,陈思宇,3,陆 强
(1.沙洲职业工学院,江苏 张家港,215600) (2.张家港耐尔纳米科技有限公司,江苏 张家港 215600)(3.苏州大学纺织与服装工程学院,江苏 苏州, 215021)(4.苏州爱得科技发展有限分司,江苏 张家港,215600)

微纳米抗菌材料与器械研究现状
张峰1,2,徐思峻2,陈思宇2,3,陆强4
(1.沙洲职业工学院,江苏 张家港,215600) (2.张家港耐尔纳米科技有限公司,江苏 张家港 215600)(3.苏州大学纺织与服装工程学院,江苏 苏州, 215021)(4.苏州爱得科技发展有限分司,江苏 张家港,215600)
摘要:随着微纳米技术的发展,微纳米抗菌材料及其在医疗器械中的应用已成为近年来的研究热点。按抗菌有效成份及其作用机理的不同,对微纳米抗菌材料进行了分类;介绍了不同类别微纳米抗菌材料的制备方法和抗菌机理;根据微纳米抗菌材料在医疗器械中的应用现状,重点介绍了银基微纳米材料在抗菌医用导管、抗菌敷料、植入材料、牙科材料和外科器械等方面的应用;分析了目前微纳米抗菌材料与器械研究、应用、检测和市场推广中存在的问题,尤其关注了近几年国内外关于含银医疗器械生物安全性的争议;展望了未来微纳米抗菌材料与器械的研究发展方向。
关键词:微纳米抗菌材料;分类原则;制备方法;抗菌机理;医疗器械
1前言
近年来,一些由新型病毒引起的传染病频繁爆发,如埃博拉病毒、禽流感病毒、中东呼吸综合征(MERS)冠状病毒等;此外,抗生素的滥用,导致细菌变异催生了各种超级病菌,如耐甲氧西林金黄色葡萄球菌、绿脓杆菌等。因此,如何制备低耐药性、高抗菌性和光谱抗菌性的新型抗菌材料越来越受到重视[1-2]。
抗菌剂是指能够在一定时间内杀死或抑制微生物活性的各种制剂,主要分为有机抗菌剂、无机抗菌剂和复合抗菌剂[3]。有机抗菌剂包括天然的和合成的两种[4],如酰基苯胺类、咪唑类、季铵盐类等,具有杀菌力强、加工方便、种类多等特点。但有机抗菌剂往往耐热性较差、容易分解、不耐洗涤、抗菌持久性差;此外,部分抗菌剂还容易在溶剂存在的环境下析出,产生耐药性、化学稳定性差和分解产物高毒性等缺陷,如三氯生在光照下容易分解为类似于二噁英的物质,对人体具有潜在的毒性[5]。相比较而言,无机抗菌剂则具有缓释长效性、高耐热性、低耐药性、广谱性、较高的安全性和易加工性等优点,但价格较高、存在抗菌迟效性,不能像有机抗菌剂那样迅速杀灭细菌[6-7]。
为了降低抗菌剂的用量,提高抗菌剂的抗菌效率,伴随着微纳米技术的发展,微纳米抗菌材料应运而生。该材料是将抗菌剂制成微米级或纳米级抗菌剂,再与抗菌载体通过一定的方法和技术制备而成的具有抗菌功能的材料[8]。追踪国内外微纳米抗菌材料的研究与应用,无机微纳米抗菌材料是研究重点。微纳米技术的应用,使无机微纳米抗菌材料具有更为广泛、卓越的抗菌杀菌性能,并且通过缓释作用,提高了抗菌长效性。同时得益于其特殊的抗菌机理,无机微纳米抗菌材料对单细胞生物(细菌、真菌等)杀伤力较强而对多细胞生物毒性较小,因而成为替代有机抗菌剂的理想选择,已开始在建材、陶瓷洁具、塑料、纺织品、医疗器械等领域得到广泛应用[9]。
2微纳米抗菌材料分类
微纳米抗菌材料按维度可分为零维微纳米抗菌微粒、一维微纳米抗菌线、二维微纳米抗菌膜和三维微纳米抗菌结构材料[10];按抗菌有效成份及其作用机理的差异分为微纳米金属抗菌材料、微纳米金属氧化物抗菌材料、微纳米碳基抗菌材料和复合微纳米抗菌材料等。
2.1微纳米金属抗菌材料
微纳米金属抗菌材料,即以金属或金属离子为抗菌有效成份,通过微纳米技术制备得到微纳米金属粉体或微纳米金属分散溶液,如纳米金、纳米银、纳米铜粉体或纳米金、纳米银、纳米铜分散液等;亦可将具有抗菌功能的金属或金属离子负载到沸石、膨润土、蒙脱石、二氧化硅、羟基磷灰石和磷酸盐等多孔、表面积大、吸附性能好、无毒且化学性质稳定的各种矿物载体上制备微纳米抗菌材料。虽然大多数重金属及其氧化物具有很好的抗菌性能,但是Hg,Cd,Pb和Cr等金属的毒性较大;Cu,Zn虽然成本较低,但抗菌性能比Ag低得多;Au虽然也具有较高的抗菌效率,但成本高昂。微纳米金属抗菌材料目前研究最多的是银基微纳米抗菌材料,该材料往往具有抗菌性能优异[11],制备方法相对简单等优点。
银基微纳米抗菌材料包括微纳米银粉体或分散液和载体微纳米含银抗菌材料等。其制备方法有物理法和化学法两种。物理法包括激光烧蚀法、真空冷凝法、机械球磨法;化学法包括化学还原法、光还原法、电化学还原法、超声波还原法和微乳液法等,其中化学还原法设备工艺简单、重现性好、产率高,是国内外研究的重点。截止目前,能真正实现粒径均匀、稳定性好且能规模化生产的微米银、纳米银还很少,很多文献报道中研究的纳米银制备方法大多难以实现产业化。国内现阶段较为成熟的产业化制备方法有:①孔黄宽等[12]以线性二氧化硅作为无机固态骨架,用金属银盐还原法制备了分散、均匀的粒径<100 nm的纳米银颗粒,通过纳滤膜或阴阳离子树脂脱除杂离子,从而获得稳定的中性纳米银水溶液;②张峰等[13]以烷基化环糊精水溶液和硝酸银为原料,一步法制备了新型强吸附型纳米银溶液,稳定性能优异,纳米银的粒径在5~10 nm左右,如图1所示。载体微纳米含银抗菌材料主要通过离子交换和物理吸附等作用将单质银或银离子沉淀到无机材料的表面或介孔材料中,制成无机抗菌剂使其具有杀菌作用。③吴继贤等[14]以立方型磷酸锆为载体,将银离子以稳定的形态均匀地分布到磷酸锆的结构中,制备了具有强抗菌作用的超微细粉末,粒径<1.4 μm。磷酸锆载银是目前主流载银抗菌技术,其空隙率远小于沸石载体,在银离子释放速度上控制好、释放均匀、抗菌性能好、且耐变色性能好。④ Jiang等[15]采用气溶胶法制备了一种以二氧化硅为载体的复合纳米银超细微粉,如图2所示,粒径<1 um,具有较好的稳定性。

图1 纳米银TEM照片[13]Fig.1 TEM micrograph of nano silver[13]

图2 纳米银-硅复合材料TEM照片[15]Fig.2 TEM micrograph of nano silver-silica composite[15]
微纳米金属抗菌材料的抗菌机理主要有接触灭菌机理和活性氧抗菌机理两种。接触灭菌机理,即微纳米金属抗菌材料在实际应用过程中,金属离子从抗菌材料中释放出来,与微生物接触造成微生物共有成份被破坏或产生功能障碍,如Ag+穿透细胞壁进入胞内并与-SH、-NH反应,能够使蛋白质变性,破坏细胞合成酶的活性,或破坏微生物的电子传输系统、呼吸系统、物质传送系统等,最终导致细胞丧失分裂能力而死亡。活性氧抗菌机理,即微纳米金属抗菌材料表面的金属离子,如Ag+在可见光作用下,能激活空气或水中的氧,产生羟基自由基(·OH)及活性氧离子(O2-),对微生物发生作用从而达到抗菌作用[16]。
2.2微纳米金属氧化物抗菌材料
据报道,目前已发现Ag2O、ZnO、Fe2O3、TiO2、SnO2、CuO、Cu2O、CeO2、CdS和WO3等微纳米金属氧化物材料具有抗菌性能[17-20],其中研究较多的有ZnO、TiO2和CuO/Cu2O,这3种金属氧化物具有类似的结构与性能,相比较而言,纳米TiO2具有价廉无毒、催化活性高、氧化能力强、稳定性好、易制备成透明薄膜等特点,是最具代表性的光催化型抗菌剂材料。
该材料的制备方法通常有气相法和液相法两种。气相法即使用金属卤化物或金属有机物在加热条件下挥发,经气相反应使生成物沉淀下来,得到微纳米金属氧化物。通过气相法制备的微纳米金属氧化物往往纯度高、粒度细、分散性好,但设备和工艺要求高。国内外较多采用气相氢氧焰高温水解法(Aerosil法)制备微纳米级TiO2,即将H2、O2和TiCl4同时喷入燃烧炉,高温燃烧得到微纳米级TiO2。与气相法相比,液相法合成温度低、设备和操作简单,是实验室和工业生产中较为广泛使用的方法,包括溶胶-凝胶法、水热反应法、溶剂热法、化学沉淀法、胶束/反胶束法、氧化法等[21-22]。典型的溶胶-凝胶法制备纳米TiO2,即将钛醇盐的酒精溶液缓慢滴加到硝酸/乙醇/水的混合溶液中,受控水解生成淡黄色透明凝胶,最后热处理(煅烧,水热处理等)即可得到相应的纳米颗粒[23]。如Nikam等[24]采用溶剂热法制备纳米CuO/Cu2O,即将醋酸铜与苄醇混合,然后转移到微波反应器中微波反应10 min后提纯、烘干即可得到纳米Cu2O颗粒,或混合溶液预先加入NaOH则反应产物为纳米CuO。
微纳米金属氧化物主要的抗菌机理是光催化作用,即在可见光或紫外光照射下,通过光催化作用产生很强化学活性的羟基自由基(·OH)及活性氧离子(O2-),并与微生物内的有机物发生作用,从而实现抗菌效果。如纳米ZnO在紫外光照射下,价带电子跃迁产生正电荷电子空穴对,电子空穴对转移到表面与表面吸附的O2、OH-作用产生羟基自由基(·OH)及活性氧离子(O2-),这些自由基能够破坏细胞膜上或内部的重要蛋白质,将其氧化并分解为H2O和CO2,并最终对环境中的微生物实施抑制和杀灭作用。
2.3微纳米碳基抗菌材料
微纳米碳基抗菌材料包括碳纳米管、石墨烯和氧化石墨烯等。碳纳米管为一维碳纳米材料,可以看做由单层或多层石墨烯卷曲而成,具有锯齿型、扶手椅型和螺旋型3种结构。石墨烯是一种二维碳纳米材料,是一种由碳原子以 sp2杂化轨道组成的六角形蜂巢晶格结构的平面薄膜,厚度为一个碳原子厚度,如图3所示[25]。
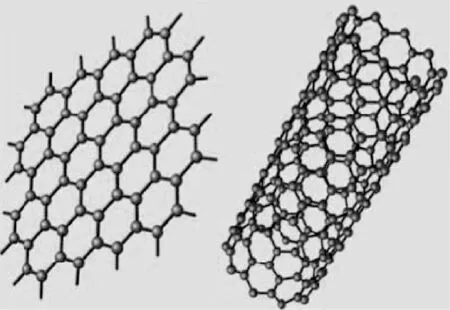
图3 石墨烯和碳纳米管结构示意图[25]Fig.3 Structural schematic diagram of graphene and carbon nanotubes[25]
碳纳米管的制备方法以物理方法为主,主要包括电弧法、化学气相沉淀法(CVD)、脉冲激光蒸发法等。石墨烯的制备方法分为物理法和化学法,物理法包括机械剥离法、外延生长法、化学气相沉淀法等,其中化学气相沉淀法的产物质量好、成产效率高且成本较低,是目前产业化生产方法中最具潜力的方法;化学法则主要以氧化石墨烯还原法为主,该方法操作简单、制备成本低,可以大规模制备石墨烯[26]。
碳纳米管抗菌活性的作用机理尚不完全清晰,目前的研究结果认为,主要是细胞膜损伤(物理穿刺作用)和碳纳米管诱导的氧化应激反应[27]。细胞膜损伤,即当细菌与碳纳米管接触时,其细胞形态发生畸变、细胞膜完整性受损、胞内物质流出,使细菌细胞失去功能;氧化应激反应是通过破坏细菌细胞壁内强氧化剂和抗氧剂的平衡而杀死细菌。石墨烯和氧化石墨烯的抗菌能力强于碳纳米管,氧化石墨烯的抗菌机理和碳纳米管相似,即氧化石墨烯能够破坏细菌的细胞膜,从而导致胞内物质外流并杀死细菌;而石墨烯不但可以通过对细菌细胞膜的插入进行切割,还可以通过对细胞膜上磷脂分子的大规模直接抽取,来破坏细胞膜从而杀死细菌[28-29]。这是全新的抗菌机制,为微纳米碳基抗菌材料在医疗卫生领域的应用提供了理论支持。
2.4复合微纳米抗菌材料
复合微纳米抗菌材料是通过将不同类型的抗菌剂经物理混合或化学反应制备而成,发挥各类抗菌剂协同作用和优势互补,克服单一微纳米抗菌材料的局限性,有效提高抗菌材料的抗菌性能和适用范围。复合微纳米抗菌材料种类复杂,目前研究较为活跃的主要有金属复合微纳米抗菌材料、金属与金属氧化物复合微纳米抗菌材料和金属与碳基材料复合微纳米抗菌材料等。
金属复合微纳米抗菌材料日本早在1993年就有关于含金属离子的酚醛复合抗菌材料的报道。该抗菌材料的主要成分含有Ag或Cu,Ni,Sn等金属离子的酚醛环状缩合体[30]。Jia等[31]以纳米SiO2为载体,制备了负载Ag/Zn纳米SiO2无机抗菌剂,通过Ag,Zn离子复配,发挥二者的抗菌协同作用,大大提高了抗菌剂的抗菌性能,并可降低Ag系无机抗菌剂的变色性。
金属与金属氧化物复合微纳米抗菌材料Anchun等[32]将Ag离子与TiO2复合制备了Ag/TiO2复合抗菌材料,该材料既具有纳米TiO2的光催化抗菌作用,又具有Ag离子的抗菌作用,克服了纳米TiO2避光处无抗菌能力的不足;Wang等[33]采用锌盐掺杂法制备了Zn/TiO2复合抗菌材料,提高了TiO2在可见光条件下的光催化抗菌作用;另外还可通过稀土金属Ce,Sm和In等掺杂[34-35],降低TiO2带隙能,提高TiO2在可见光条件下的光催化抗菌作用。
金属与碳基材料复合微纳米抗菌材料何光裕等[36]以聚乙二醇为还原剂通过水热反应,还原氧化石墨烯同时在石墨烯表面原位生长银纳米粒子,制备纳米银-石墨烯复合材料,该纳米银-石墨烯复合材料在100 mg/L时可以完全抑制大肠杆菌的生长,是一种效果显著的新型抑菌材料;Bao等[37]利用合成的纳米银/氧化石墨烯复合材料研究了在水质净化方面的效果,结果表明,纳米银/氧化石墨烯复合材料能有效杀灭水中的细菌并可过滤水中杂质,达到水净化的目的;连崑等在国内实现了铜/碳-核/壳结构纳米复合材料 (n-Cu/C)的规模化生产,含铜-氧化亚铜平衡成份的纳米铜23%,当尼龙D70纱中复合材料的添加量为7‰时,布样对大肠杆菌和金黄色葡萄球菌的抗菌率在99.9%以上。
3微纳米抗菌材料在医疗器械中的应用
随着微纳米抗菌材料技术的不断成熟,微纳米抗菌材料在抗菌涂料、抗菌纤维、抗菌塑料、抗菌陶瓷、抗菌玻璃、抗菌金属制品、化妆品和医疗器械等方面得到了广泛应用。其中,微纳米抗菌材料在医疗器械中的应用是目前的研究热点。在抗菌医疗器械应用中,主要采用微纳米金属抗菌材料和金属复合微纳米抗菌材料,其中银基微纳米抗菌材料因其优异的抗菌性能获得了最为广泛的应用,主要涉及抗菌医用导管、抗菌敷料、植入材料、牙科材料、外科器械等。
(1)应用于导尿管、气管插管、中心静脉导管等医用导管,可显著降低导尿管伴随尿路感染、肺部感染和ICU插管感染等院内感染[38]。Samuel等[39]在聚亚胺树脂和硅树脂中添加纳米银颗粒制备的导管具有优异的广谱抗菌效果,可降低导管相关感染;Plowman等[40]制备的纳米Ag-SiO2导尿管可显著减少导尿管相关性尿路感染的发生率;臧奎等[41]研究纳米银/聚乳酸复合材料(AgNPs/PLLA)对ICU导管术感染耐药菌的杀灭效果,结果显示AgNPs/PLLA能够显著降低细菌的生存率,降低ICU插管感染;蒋旭宏等[42]以医用聚乙烯气管插管导管为基材、纳米载银TiO2为抗菌剂制备Ag-TiO2抗菌涂层气管插管导管;陆运涛等[43]将6.0%纳米银含量的磷酸锆载银抗菌剂应用于抗菌静脉导管,以提高静脉导管的抗菌性能。
(2)应用于伤口敷料,可用于各类伤口护理,尤其是一些慢性伤口、困难伤口的护理,如褥疮、糖尿病患者伤口、动静脉溃疡伤口、烧烫伤和因感染而导致延迟愈合的急性伤口等。其典型产品形式包括:英国Smith &Nephew公司、瑞典Molnlycke Health Care AB公司和英国Advanced Medical Solutions Ltd.公司开发的含银藻酸盐敷料;丹麦Coloplast A/S公司和瑞典Lnlycke Health Care AB公司开发的含银泡沫敷料;美国ConvaTec Inc公司开发的羧甲基纤维素钠敷料和丹麦康乐保公司开发的由羧甲基纤维素钠水胶体颗粒悬浮在凡士林聚酯纤维网中构成的银离子抗菌敷料;台湾Lin等[44]以聚丙烯腈基活性炭纤维(ACF)为原料,通过浸渍醋酸银溶液或硝酸银溶液,再经高温分解获得银颗粒呈纳米级均匀分布的含银活性炭纤维敷料,如图4所示,并制成了“科云”

图4 Ag-25/ACF(a)和Ag-50/ACF(b)的SEM照片[44]Fig.4 SEM micrographs of the Ag-25/ACF (a) and Ag-50/ACF (b)[44]
含银胶布;张峰等[45-46]以自制纳米银溶液开发的含银网状纱布、含银藻酸盐敷料和含银活性炭纤维敷料并实现了产业化,相关检测表明,抗菌性能和临床应用效果令人满意;Madhumathi等[47]研究的纳米银/壳聚糖结合制作的敷料,用于处理烧烫伤伤口,可以抵抗金葡、大肠等多种细菌,且表现出良好的止血效果。相关研究表明[48-49],局部使用含纳米银的敷料不仅能加速伤口愈合,还能改善疤痕愈合的外观,甚至降低疼痛感、缩短疗程和降低费用。
(3)应用于医用植入材料。据报道,美国每年有约30 000~50 000例疝修补手术会发生植入网片感染,为此Cohen 等[50]采用物理气相沉积法制备了一种纳米银涂层聚丙烯网片,可应用于纳米银疝修补术和骨盆重建手术。检测结果表明,该网片具有优异的抗菌性能,可大大降低术后植入网片的感染。Saravanan等[51]制备了壳聚糖/纳米羟基磷灰石/纳米银复合支架材料;Marsich等[52]采用冷冻干燥法制备了海藻酸钠/纳米羟基磷灰石/纳米银复合支架材料。纳米银的引入旨在赋予复合支架材料一定的抗菌性能,以保持支架微结构的性能及其功效,确保支架上细胞的生长。
(4)应用于牙科材料。如在牙槽骨手术植入材料和相关修复材料中引入微纳米含银抗菌材料[53],可降低术后细菌污染率,防止种植体周围感染等。曹江南等[54]采用离子溅射技术在基托树脂表面制备纳米银涂层,对义齿基托进行表面改性,得到了均匀致密的纳米银颗粒涂层,改性后的基托树脂材料有较好的生物相容性与抗菌性能。
(5)应用于外科器械中。茂启二郎等[55]研制的载有纳米级银粒的抗菌不锈钢夹子、抗菌不锈钢刀具、抗菌把手等医疗器械,经检测这些器械具有优异的抗菌性能。余森等[56]配制了一种含有纳米银溶液的微弧氧化电解液,并将钛及钛合金医疗器械作为阳极,在此电解液中进行微弧氧化处理,得到了含有抗菌复合涂层的钛及钛合金医疗器械。银基微纳米抗菌材料还可以用于避孕器械,如含有Cu,Ag和Zn的纳米复合材料,可用作新型宫内节育器(IUD)的基本材料[57],不仅可通过控制金属离子的释放速率、高转化率、降低材料表面沉积物来提高IUD的避孕效果,而且还能降低副反应的发生,增加续用率。
除银基微纳米抗菌材料外,微纳米碳基抗菌材料也有望应用于医疗器械。如利用细菌在石墨烯上不能生长的特性,制造石墨烯防菌纱布。但由于其抗菌方式以细胞膜损伤(物理穿刺作用)为主,如何提高与细菌的接触面积是增强其抗菌效率的关键,也是其抗菌的瓶颈所在。据C&EN网站2014年6月10日报道,曲小刚等使用石墨烯量子点催化分解双氧水,使其产生强而有力的杀菌羟基自由基。在类似于创可贴的绷带上,含有石墨烯量子点和少量的过氧化氢,即可显著减少小鼠创伤处细菌的数量,有望应用于伤口敷料。
4存在的问题
随着微纳米技术的发展,大量微纳米抗菌材料已实现规模化生产,相关抗菌医疗器械也已实现了临床应用,但微纳米抗菌材料与器械的研究与应用领域仍存在诸多问题:
概念与命名不规范以银基微纳米抗菌材料及银基抗菌医疗器械为例,往往存在纳米银、纳米银颗粒、纳米银涂层、纳米银化合物、纳米银复合材料、银离子、络合银等概念。由于国内企业及监管部门缺乏专业知识,使用时往往较为随意[58];甚至国内曾经因为纳米银医疗器械的注册报批存在争议,为了规避纳米银,出现了一批本该命名为纳米银产品的,现均命名为银离子抗菌材料及银离子抗菌医疗器械;有些医疗器械上银颗粒明显呈纳米级分布,但在工艺描述时,只简单描述为浸泡硝酸银溶液,与实际生产工艺大相径庭。这些不科学与不严谨的命名方式,不利于毒理学专家和监管部门的审评人员迅速了解产品状态,扰乱了抗菌医疗器械的终端市场。
材料表征与稳定性检测存在问题国内外文献提出一种新型微纳米抗菌材料制备方法时,往往仅采用透射电镜(TEM)、扫描电镜(SEM)或动态光散射纳米粒度仪(DLS)等进行表征,但其实这是远远不够的。以制备纳米银溶液为例,往往没有检测溶液中的银离子有没有完全转化为纳米银颗粒、没有分析溶液中处于纳米级分布的银颗粒的比例、没有检测纳米银溶液的稳定性、更没有考虑纳米银溶液在实际应用中的稳定性与相容性问题,等等。这些问题导致了虽然国内外已报道的纳米银技术层出不穷,但能够实际应用的比例很低,甚至有些不成熟的技术在没有解决上述问题的前提下就盲目应用于实际生产,影响了产品的应用性能,影响了微纳米抗菌产品的市场声誉。
材料研发与应用之间存在脱节现象即国内外微纳米抗菌材料的研究人员较多是化学或材料学相关专业人员,缺乏对后续应用加工工艺的了解;而微纳米抗菌材料加工工艺的操作人员却往往是非专业人员,缺乏对微纳米抗菌材料特性的了解,两者之间存在脱节现象。例如,在实际生产加工中,往往购买的微纳米抗菌材料是微米、纳米级的,但在加工过程中因操作人员不了解产品性能,操作不当导致抗菌材料团聚;另由于微纳米材料本身的不稳定性,无法适应极端加工环境,导致材料在加工过程中性质发生根本性改变,无法保证产品最终的抗菌特性。
材料实际添加量存在争议国内外文献在研究一种微纳米抗菌材料时,往往会检测其最低抑菌浓度(MIC),但是以此来简单推断相关抗菌产品的实际添加量是不合理的。因为抗菌产品抗菌性能的实现不仅与抗菌剂的添加量有关系,还与微纳米抗菌材料与产品的结合方式、释放形式、抗菌产品的使用环境等有关系。如在加工含银抗菌敷料时,银基微纳米抗菌材料直接吸附于纤维表面与银基微纳米抗菌材料在纤维纺丝时共混添加相比,实现同等抗菌性能时其添加量相差甚大;海藻酸钙纤维、棉纤维与甲壳素纤维因其表面活性基团的不同,银基微纳米抗菌材料的添加量也不尽相同;此外,部分银基微纳米抗菌材料能与纤维材料的牢固结合,提高了抗菌敷料的生物安全性能和缓释性能,但考虑其抗菌效果,在一定程度上也应适当提高银基微纳米抗菌材料的添加量。
生物安全性问题的困扰近几年,国内外关于含银医疗器械生物安全性的争议不断[59]。汤京龙等[60]直接采用微米银、纳米银细胞培养液培养L929细胞,发现在50~500 ug/mL剂量范围内,纳米银颗粒引起的细胞毒性显著高于微米银颗粒,而且纳米银颗粒能够通过细胞吞噬进入细胞内部,而微米银颗粒不能进入细胞内部。Kim 等[61]将30,125,500 mg/kg的纳米银粒子直接注射到老鼠体内,结果被注射125 mg/kg以上纳米银粒子的老鼠肝脏出现了毒性反应。于永生等[62]以梯度浓度2.5~80.0 ug/mL的纳米银直接染毒CHL细胞,揭示了纳米银对CHL细胞有显著的细胞毒性和遗传毒性,线粒体功能受损和细胞凋亡在纳米银的细胞毒性和遗传毒性中起到重要作用。类似研究引起了国内外对纳米银潜在毒性的重视,在一定程度上影响了含银抗菌医疗器械的注册与临床应用。但是关于含银医疗器械应用临床中毒的报道还是鲜见的[63],即使有些报道的纳米银中毒现象也是较为极端的。如Mirsattari等[64]报道了一名71岁的老人在连续口服纳米银悬浮溶液4个月后,出现了持续性肌阵孪性癫痫、昏迷,并于5.5个月后死亡。Chung等[65]报道了3名连续2年服用纳米银胶体溶液后出现反常的血清银浓度,脸部、脖子和手等处皮肤变色的案例。事实上2014年美国Barillo等[66]已发现这些银中毒的负面案例均是因不当使用造成的,很多都是采用了口服纳米银溶液的方式。Barillo等回顾了公元前335年以来Ag在医疗抗菌领域被广泛应用的历史,认为不可忽视Ag具有其他现代抗菌材料所没有的几千年应用实践。Ong等[67]还发现虽然纳米银壳聚糖敷料出现了严重的体外细胞毒性,但实际应用于伤口护理时,却发现其能够促进表皮成纤细胞的增殖和角化细胞的成熟,促进伤口的愈合,这表明实验室研究方法并不能够完全模拟或预测实际应用中的抗菌产品的效果。Poon等[68]发现体外细胞毒性检测与伤口表面实际状况存在差异,伤口表面的氯化物和蛋白质会影响银离子的生理活性。孙晓霞等[69]进行了不同振荡条件下制备的某种含银敷料的体外细胞毒性试验,如图5所示,在静态浸提条件下检测得到的体外细胞毒性为1级,而振荡显著提高体外细胞毒性。但众所周知,含银敷料在实际应用时主要为静止状态,因此如果用现有标准来衡量含银敷料的安全性或过度考虑体外细胞毒性是不合适的。Walker等[70]认为在正确使用含银伤口敷料时,局部或全身银中毒的风险是较低或可忽略的。Marx等[71]认为应正确权衡Ag的益处与危害,如果考虑伤口表面氯离子和其他伤口渗透液的影响,应适当考虑提高伤口敷料的纳米银含量,以提高释放量和延长有效释放时间。

图5 不同振荡速度下含银敷料浸提液对细胞存活率的影响[69]Fig.5 The effect of silver adhesive extracted by different shaking speed on cell viability[69]
5结语
随着微纳米技术的发展,微纳米抗菌材料的研究取得了很大的成就,在此基础上,不少抗菌医疗器械也应运而生并广泛应用于医疗领域。但国内微纳米抗菌材料与医疗器械行业的现状确实不容乐观,市场优劣难辨、不当使用等问题影响了行业的正常发展。该材料的研究及应用往往存在技术难度高、抗菌机理尚不清晰、检测标准不统一等问题;另外,细菌用肉眼无法观察到,消费者难以用感观辨别抗菌产品的效果,再加上抗菌产品的不恰当使用,抗菌效果未能达到预期,造成了国内外微纳米抗菌产品的信任危机。
目前,微纳米抗菌材料及其医疗器械产品的技术稳定性、推广难度、政策不确定性等因素已使众多相关企业处于困境。未来应:①加强绿色环保、技术稳定、成本低廉、抗菌性能优异和毒性低的微纳米抗菌材料的研究;②注重理论研究与产品应用相结合,特别是不可忽视微纳米抗菌材料延伸产品添加工艺的研究;③加强微纳米抗菌产品的抗菌机理和毒理研究,确保抗菌产品的应用安全性;④对于抗菌医疗器械,尤其应注重模拟临床实际,权衡利弊;⑤进一步研究微纳米抗菌材料及其延伸产品的检测方法与检测标准,规范行业发展;⑥加强科普宣传,提升消费群体抗菌意识,促进抗菌产品科学使用。
参考文献References
[1]Zhang Changhui(张昌辉),Xie Yu(谢 瑜),Xu Xuan(徐 旋).ChemicalIndustryandEngineeringProgress(化工进展)[J],2007,26(9):1 237-1 242.
[2]Ma Wei(马 威),Tuo Tingting(拓婷婷),Zhang Shufen(张淑芬).FineChemicals(精细化工)[J],2012,29(6):521.
[3]Sun Hong(孙 洪),Xia Ying(夏 英),Chen Li(陈 莉),etal.ChinaPlasticsIndustry(塑料工业)[J],2006,34(9):1-4.
[4]Zhang Kui Hua(张葵花),Lin Songbai(林松柏),Tan Shaozao(谭绍早).Paint&CoatingsIndustry(涂料工业)[J],2005,35(5):45-49.
[5]Dann A B,Hontela A.JournalofAppliedToxicology[J],2011,31(4):285-311.
[6]Mao Yong(毛 勇),Deng Yuming(邓玉明).Nanotechnology(纳米技术)[J], 2011,24(9):58-62.
[7]Li Yiling(李一凌).ScienceandTechnologyInnovationHerald(科技创新导报)[J], 2009,5(3):1-1.
[8]Kong Binbin(孔彬彬),Hao Lujiang(郝鲁江),Yu Tongli(于同立).ChinaBrewing(中国酿造)[J], 2008,185(8):1-3.
[9]Jia Dongshu(贾冬舒),Yang Feihua(杨飞华),Tong Zhongliang(童忠良).BuildingDecorationMaterialsWorld(建筑装饰材料世界)[J], 2003,(4):56-61.
[10]Shen Haijun(沈海军),Shi Youjing(史友进).ShanghaiBuildingMaterials(上海建材)[J], 2006,(2):13-15.
[11]Yuan G,Cranston R.TextileResearchJournal[J], 2008,78(1):60-72.
[12]Kong Huangkuan(孔黄宽),Jiang Yan(江 艳),Xiang Yuhua(项玉华),etal. China,201010530646[P], 2010-11-03.
[13]Zhang Feng(张 峰),Wu Nana(武娜娜),Xu Sijun(徐思峻),etal.ChinaTextileLeader(纺织导报)[J], 2012,(5): 92.
[14]Wu Jixian(吴继贤),Zhou Lu(周 路),Wu Yongxing(吴永鑫),etal. China,201210273501[P],2012-08-01.
[15]Jiang X M,Jeffrey B C,Lin Y,etal. US,8246933 B2 [P],2012-08-21.
[16]Inoue Y,Hoshino M,Takahashi H,etal.JournalofColloidandInterfaceScience[J], 2002,92(1):37-42.
[17]Azam A,Ahmed A S,Khan M S,etal.InternationalJournalofNanomedicine[J], 2012,7:6 003-6 009.
[18]Dizaj S M,Lotfipour F,Barzegar-Jalali M,etal.MaterialsScience&EngineeringC-MaterialsforBiologicalApplications[J], 2014,44:278-284.
[19]Yang H,Wang Y,Xue X.ColloidsandSurfacesB-Biointerfaces[J], 2014,122:701-708.
[20]Ahamed M,Alhadlaq H A,Khan M A M,etal.JournalofNanomaterials[J], 2014,(2014):1-4.
[21]Chen H,Nanayakkara C E,Grassian V H.ChemicalReviews[J], 2012,112(11):5 919-5 948.
[22]Liu K,Cao M,Fujishima A,etal.ChemicalReviews[J], 2014,114(19):10 044-10 094.
[23]Macwan D P,Dave P,Chaturvedi S.JournalofMaterialsScience[J], 2011,46:3 669-3 686.
[24]Nikam A V,Arulkashmir A,Krishnamoorthy K,etal.CrystalGrowth&Design[J], 2014,14(9):4 329-4 334.
[25]Castro N A H,Guinea F,Peres N M R,etal.ReviewofModernPhysics[J], 2009,81(1):109-162.
[26]Georgakilas V,Otyepka M,Bourlinos A B,etal.ChemicalReviews[J], 2012,112(11): 6 156-6 214.
[27]Li Airong(李爱荣),Zhu Han(朱 菡),Xu Zengrui(徐增瑞),etal.MaterialsReview(材料导报)[J], 2013,27(9):54.
[28]Hu W,Peng C,Luo W,etal.ACSNano[J], 2010,4(7): 4 317-4 323.
[29]Tu Y,Lv M,Xiu P,etal.NatureNanotechnology[J], 2013,8(8):594-601.
[30]Kasuga N C,Sckino K,lshikawa M,etal.JournalofInorganicBiochemistry[J], 2003,96(2):298-310.
[31]Jia H S,Hou W S,Wei L Q,etal.DentalMaterials[J], 2008,24(2):244-249.
[32]Mo A C,Liao J,Xu W,etal.AppliedSurfaceScience[J], 2008,255(2):435-438.
[33]Wang Y,Xue X,Yang H. Vacuum[J], 2014,101:193-199.
[34]Wang Y Z,Xue X X,Yang H.etal.AppliedSurfaceScience,[J], 2014,292:608-614.
[35]Jiang W,Zhan G L,Liu J.JournalofRareEarths[J], 2014, 32(8):727-732.
[36]He Guangyu(何光裕),Ma Kai(马 凯),Hou Jinghui(侯景会),etal.FineChemicals(精细化工)[J], 2012,29(9): 840-843.
[37]Bao Q,Zhang D,Qi P.JournalofColloidandInterfaceScience[J],2011,360(2):463-470.
[38]Frasca D,Dahyot-Fizelier C,Mimoz O.CriticalCare[J],2010,14(2):212-219.
[39]Samuel U,Guggenbichler J P.InternationalJournalofAntimicrobialAgents[J],2004,23(1):S75-S78.
[40]Plowman R,Graves N,EsquiVel J,etal.JournalofHospitalInfection[J],2001,48(1):33-42.
[41]Zang Kui(臧 奎),Shang Futai(尚褔泰),Guo Shiguang(郭世光).JiangsuMedicalJournal(江苏医药)[J],2011,37(20):2 374-2 376.
[42]Jiang Xuhong(蒋旭宏),Wang Yuan(王 原),Hua Junyi(华军益),etal.ChinaCriticalCareMedicine(中华危重病急救医学)[J],2014,26(5):343-346.
[43]Lu Yuntao(陆运涛),Zhu Yingang(朱迎钢),Qu Jieming(瞿介明),etal.ChineseJournalofClinicalPharmacy(中国临床药学杂志)[J],2010,19(1):18-22.
[44]Lin Y H,Lin J H,Wang S-H,etal.JournalofAppliedBiomaterials[J],2012,100B(8):2 288-2 296.
[45]Zhang Feng(张 峰),Yao Liyong(姚利荣). China,201310767513.7 [P], 2013-07-31.
[46]Zhang Feng(张 峰),Xu Dianchen(许丹晨),Chu Jiamian(褚加冕),etal. China,201110366674.x[P], 2013-05-01.
[47]Madhumathi K,Sudheesh K P T,Abhilash S,etal.JournalofMaterialsScience-MaterialsinMedicine[J],2010,21(2): 807.
[48]Tian J,Wong K K Y,Ho C M,etal.ChemMedChem[J],2007,2(1):129-137.
[49]Leaper D J.InternationalWoundJournal[J], 2006,3(4):282.
[50]Cohen M S,Stern J M,Vanni A J,etal.SurgicalInfections[J],2007,8(3):397-403.
[51]Saravanan S,Nethala S,Pattnaik S,etal.InternationalJournalofBiologicalMacromolecules[J],2011,49(2):188-193.
[52]Marsich E,Bellomo F,Turco G,etal.JournalofMaterialsScience:MaterialsinMedicine[J],2013,24(7):1 799-1 807.
[53]Stefano S,Edoardo S,Giulia B,etal.JournalofNanomaterials[J],2012,2012:1 687-4 110 .
[54]Cao Jiangnan(曹江南),Liu Xiaoqiu(刘晓秋),Yao Huizheng(姚慧珍),etal.ChineseJournalofStomatology(中华口腔医学杂志)[J],2014,49(4):229-233.
[55]Shigeru K,Inoue Y,Awano Y. Japan,10237643-A[P], 1998.
[56]Yu Seng(余 森),Yu Zhengtao(于振涛),Han Jianye(韩建业),etal. China,201210194294.7[P], 2012-09-09.
[57]Wang Hong(王 洪).ActaMedicinaeUniversitatisScientiaeetTechnologiaeHuazhong(华中科技大学学报(医学版))[J],2014,43(3):364-367.
[58]Chen Kuan(陈 宽).HebeiMedicalJournal(河北医药)[J],2015,37(10):1 552-1 554.
[59]Zhang Yuanyuan(张媛媛),Sun Jiao(孙 皎).ChineseJournalofMedicalInstrumentation(中国医疗器械杂志)[J],2007,31(1):36-41.
[60]Tang Jinlong(汤京龙),Wang Shuoli(王硕丽),Wang Chunren(王春仁),etal.BeijingBiomedicalEngineering(北京生物医学工程)[J],2013,32(5):485-489.
[61]Kim Y S,Song M Y,Park J D,etal.ParticleandFibreToxicology[J],2010,7(1):19-29.
[62]Yu Yongshen(于永生),Shi Chang(施 畅),Xu Liming(徐丽明),etal.Carcinogenesis,TeratogenesisMutagenesis(癌变·畸变·突变)[J],2014,26(6):428-433.
[63]Wang Z,Xia T,Liu S J.Nanoscale[J], 2015,7(17):7 470.
[64]Mirsattari S M,Hammond R R,Sharpe M D,etal.Neurology[J],2004,62(8):1 408-1 410.
[65]Chung I S,Lee M Y,Shin D H,etal.InternationalJournalofDermatology[J],2010,49(10):1 175-1 177.
[66]Barillo D J,Marx D E.Burns[J],2014,40:S3-S8.
[67]Ong S Y,Wu J,Moochhala S M,etal.Biomaterials[J],2008,29(32):4 323-4 332.
[68]Poon V K M,Burd A.Burns[J],2004,30(2):140-147.
[69]Sun Xiaoxia(孙晓霞),Wang Luanluan(王鸾鸾),Hou Li(侯 丽).JournalofBiomedicalEngineeringResearch(生物医学工程研究)[J],2014,33(3):189-192.
[70]Walker M,Parsons D.InternationalWoundJournal[J],2014,11(5):496-504.
[71]Marx D E,Barillo D J.Burns[J],2014,40:S9-S18.
(编辑王方)

专栏特约编辑顾 宁

特约撰稿人郭志睿

特约撰稿人王强斌

特约撰稿人徐 明

特约撰稿人许海燕
顾宁 :男,1964年生,东南大学教授、博导,教育部长江学者特聘教授,国家杰出青年基金获得者。现任江苏省生物材料与器件重点实验室主任,苏州纳米科技协同创新中心纳米药物与医用材料专业中心主任,同时兼任国家纳米科技协调指导委员会专家组成员、国家重大科学仪器设备研制专项技术专家组委员、国家自然科学基金委员会信息学部咨询专家组成员、中国生物医学工程学会常务理事及纳米医学与工程分会主任委员等。已发表论文200余篇,发明专利授权近60项。获国家自然科学奖二等奖、教育部首届青年教师奖、省部级科技进步奖等数项鼓励。主要从事医药纳米材料,特别是分子功能薄膜,磁性纳米材料的宏量制备、表征与标准、及其在生物医(药)学领域中应用的研究。
郭志睿 :男,1975年生,副研究员,硕导。2010年江苏省人民医院心内科博士后出站,作为高层次人才引进到南京医科大学第二附属医院工作。2013年入选江苏省“六大人才高峰”高层次人才选拔培养对象。
主要从事基于贵金属纳米颗粒的局域等离激元共振(LSPR)特性进行生物检测的研究工作, 目前的研究兴趣为新型纳米功能材料的可控制备以及在生物医学领域的应用。作为主要完成人之一,参与了博士后工作单位自主研发的心肌肌钙蛋白Ⅰ快速检测试剂盒(胶体金法)项目。现该项目已成功研发并转化。主持国家自然科学基金项目(青年和面上项目)、江苏省科技支撑计划-社会发展项目、南京市科技计划项目等6项课题;已发表SCI论文36篇;获国家发明专利和实用新型专利5项 。主要研究方向:贵金属纳米材料的可控、宏量制备;基于纳米技术的生物标志物的高敏检测;基于胶体金的高敏侧向层析技术的研发;基于纳米颗粒的光热治疗研究。
王强斌:男,1973年生,研究员,博导。2010年中科院“百人计划”,2014年国家杰出青年基金获得者,获2014年中国科学院“百人计划”结题优秀、2014年中国科学院特聘研究员、2015年日本化学会“Distinguished Lectureship Award”等荣誉。现任中科院纳米-生物界面重点实验室主任,NanoResearch编委。已发表论文70余篇,申请专利20余项,国际专利2项,国际会议特邀报告20余次;承担了国家自然科学基金、973重大研究计划、中科院科技战略先导专项等项目。
主要从事无机半导体近红外量子点可控合成、光学性质调控及其在活体成像中的应用研究,取得了系列进展:①提出和发展了一种新型的近红外荧光Ag2S量子点及其合成技术,利用能带裁剪理论对其光学性质进行了精确调控,并在此基础上合成了一系列窄带隙的半导体金属硫化物;②构筑了量子点表面生物功能化平台,分别通过化学分子(聚乙二醇)和生物分子(蛋白质和DNA)修饰获得了高生物相容性和靶向性的荧光量子点;③发展了基于近红外荧光Ag2S量子点的活体影像技术,实现了对活体组织原位、实时、高灵敏度和高信噪比的影像研究。
徐明:男,1983年生,博士,副研究员。2011年于厦门大学获博士学位,2011~2013年赴法国国家科学研究中心(CNRS)进行博士后研究,2014年进入中国科学院生态环境研究中心环境化学与生态毒理学国家重点实验室工作。2015年晋升副研究员。主要从事纳米材料与典型环境污染物(如重金属)的毒理学研究,重点关注其暴露引发的生物效应和分子作用机制,揭示纳米材料和环境污染物的环境与健康风险。主持和参与多项国家自然科学基金和“973”课题;发表SCI论文10余篇,他引200多次。
许海燕:女,1962年生,北京协和医学院基础学院/中国医学科学院基础医学研究所生物医学工程学系系主任,教授,博导。主要学术兼职包括中国微米纳米技术学会纳米科学技术分会常务理事,全国纳米技术标准化委员会委员及“健康、安全和环境”标准化技术工作组委员兼秘书长等。主持和完成包括国家重大科学研究计划“纳米研究”计划项目的课题、国家自然科学基金项目和北京市自然科学基金项目等多项科研任务。主编或共同主编出版专著《纳米生物医学技术》、《纳米生物医药载体》、《生物医学纳米材料对细胞作用》;在Biomaterials、Theranostics、Nanotoxicology等期刊发表论文数十篇;申请发明专利6项,已获得授权4项。主要研究方向:①纳米材料对肿瘤微环境的作用及抗肿瘤免疫治疗新方法研究,②基于生物材料的纳米结构和环境响应性引导组织再生与修复。

特约撰稿人张 峰
张峰:男,1971年生,博士,教授。曾主持和参与江苏省科技支撑计划项目、江苏省高校重大基础研究项目等多项省级以上科技计划项目5项;主要从事纤维的功能化改性、纳米材料的开发及应用、绿色染整技术和清洁生产技术等领域的研究与教学工作,在含银抗菌敷料的技术研发与产业化推广方面取得重要进展。研究成果在Cellulose、FibersandPolymers等期刊发表论文25篇,其中SCI收录7篇,EI收录1篇;参与国家行业标准《含银抗菌溶液》(HG/T 4317-2012)的制定;拥有含银抗菌溶液、载银活性炭纤维、载银海藻酸钙纤维等8项中国专利、1项美国发明专利;曾获张家港市创业型领军人才、张家港“十大杰出青年”和江苏省“青蓝工程中青年骨干教师”培养对象等荣誉称号。
Research Status of Micro-Nano Antibacterial Materials and Devices
ZHANG Feng1,2,XU Sijun2,CHEN Siyu2,3,LU Qiang4
(1. Department of Textile Engineering,Shazhou Institute of Technology, Zhangjiagang 215600,China)(2. Zhangjiagang Nellnano Technology Co., Ltd., Zhangjiagang 215600,China)(3.College of Textile and Clothing Engineering, Suzhou University, Suzhou 215021,China)(4.Suzhou And Science & Technology Development Co., Ltd., Zhangjiagang 215600,China)
Abstract:With the development of micro-nano technology, micro-nano antibacterial materials and their application in medical devices have attracted extensive research in recent years. In this review, micro-nano antibacterial materials were classified according to the effective ingredient and their antibacterial mechanism. And, preparation method and antibacterial mechanism of different types of micro-nano antibacterial materials were introduced. Besides, based on the recent application status of micro-nano antibacterial materials in medical devices, micro-nano silver materials in the antibacterial medical devices were mainly introduced, such as antibacterial catheters, wound dressings, implant materials, dental materials and surgical instruments. In addition, problems on current research, application, testing and market promotion of the micro-nano antibacterial materials as well as the related medical devices were analyzed, in which the medical biological safety of silver around the word in recent years was especially focused. Finally, the research aspects of a micro-nano antibacterial materials and devices were predicted.
Key words:micro-nano antibacterial materials;principles of classification;preparation method;antibacterial mechanism;medical devices
中图分类号:R318.08;TB383.1;TQ1
文献标识码:A
文章编号:1674-3962(2016)01-0040-08
DOI:10.7502/j.issn.1674-3962.2016.01.06
基金项目:江苏省科技厅科技支撑计划项目(BE2013649)
收稿日期:2015-09-06
第一作者:张峰,男,1971年生,博士,教授,Email:
8769811@qq.com
