近红外Ag2S量子点的研究进展
2016-03-04张叶俊王强斌
张叶俊,王强斌
(中国科学院苏州纳米技术与纳米仿生研究所,江苏 苏州 215123)

近红外Ag2S量子点的研究进展
张叶俊,王强斌
(中国科学院苏州纳米技术与纳米仿生研究所,江苏 苏州 215123)
摘要:量子点作为一种发光纳米晶,在过去20年里一直是研究的热点,持续研究的动力在于量子点独特的光学性质,如荧光强度高、稳定性好、发射范围宽、具有尺寸效应等。最近几年,近红外二区量子点因具有较高的组织穿透深度和较低的自发荧光受到了人们的广泛关注,并且作为荧光探针在小动物活体体外和体内成像方面已得到应用。作为一种新型的近红外二区量子点,Ag2S因其低毒、稳定性好、成本低、生物相容性好等优良性质,过去5年在国内外掀起了研究的热潮。从Ag2S量子点的发展史、制备方法、异质结构、生物应用、毒理学研究等方面对国内外研究成果进行了总结,并着重概述了其制备方法。进一步,讨论了其存在的问题以及对今后的研究进行了展望。
关键词:Ag2S;量子点;近红外二区;成像
1前言
在过去20年里,量子点(Quantum Dots, QDs)作为半导体纳米晶的典型代表,由于其独特的电子光学特性,如荧光强度高、颜色连续可调、半峰宽窄、激发谱宽等,成为研究的热点。QDs的内核尺寸约为1~10 nm,当尺寸小于其玻尔半径时,QDs的连续能级开始分离,能级值最终由它的尺寸决定。随着QDs尺寸逐渐变小,能隙增加,发射峰发生蓝移,其尺寸可以通过反应温度、时间、前驱体、配体进行精确控制[1-2],但在1998年之前,人们也仅仅在研究其物理化学性质,并没有真正意义上的应用研究。
1998年,Alivisatos[3]和Nie[4]两个课题组首次解决了可见荧光QDs的特异性生物标记问题,这是QDs作为荧光探针进入生物应用时代的重要标志。随后,科研人员花费了巨大的努力来优化QDs的制备方法、提高量子效率、改善生物相容性,以及交联靶向分子以满足生物应用需求[5-6]。当然,这些努力都是为了能够让QDs早日实现在临床上应用。但随着研究的深入,人们发现可见荧光QDs组织穿透深度浅、散射强,这些劣势都严重影响了可见荧光QDs在生物医学方面的进一步应用[7-8]。
相比可见光,近红外(Near Infrared, NIR)荧光具有更高的组织穿透深度和更低散射的特点[7]。近红外荧光常被分为NIR-Ⅰ区(700~950 nm)和NIR-Ⅱ区(1.0~1.4 μm)两个窗口,其中NIR-Ⅱ区荧光具有更高的信噪比[9-12],所以人们把目光都聚焦到具有NIR-Ⅱ优异荧光学性质的窄禁带半导体纳米晶。目前已经报道的NIR-Ⅱ QDs包括PbS[13-16]、PbSe[17-20]、CdHgTe[21-22]、Ag2S[23]、Ag2Se[24-26]等,其中,大部分都含有有毒重金属成分如Cd,Pb和Hg,这些都限制了它们的进一步应用[27-35]。相比较而言,银基QDs是一种低毒甚至无毒的理想NIR QDs材料,其中Ag2S QDs发展较为迅速,在体外和体内成像两方面都已经得到了广泛的应用[36-37]。α-Ag2S是一种直接带隙半导体材料,禁带宽度为0.9~1.1 eV,玻尔半径为2.2 nm,它在NIR-Ⅱ区表现出了非常优异的荧光性质[38]。除此之外,Ag2S具有超低的溶解度(Ksp= 6.3×10-50, 而传统量子点CdS和CdSe则分别为Ksp(CdS)=8.0 × 10-27和Ksp(CdSe)=6.31×10-36),与传统Cd基QDs相比,在生物体内仅仅释放非常痕量的Ag+,赋予Ag2S NIR QDs良好的生物相容性[39]。
2Ag2S QDs的发展
Pileni等[40]在1998年第一次报道了Ag2S纳米颗粒。他们用不同长度烷基链硫醇制备了尺寸均匀且都小于10 nm的疏水性Ag2S纳米颗粒。在该方法中,当烷基链在8~12时,制备出来的Ag2S纳米颗粒可以组装成微米级的三维超晶格结构。次年,Mehra等[41]制备出了半胱氨酸和谷胱甘肽修饰的亲水性Ag2S半导体胶体纳米粒子,平均尺寸约9 nm,但均一性较差。在2003年和2004年,Zhao[42]和Qian[43]等相继用十二硫醇作为表面配体分子和溶剂制备出了尺寸均匀的Ag2S纳米颗粒。Ag2S QDs的第一次报道出现在2004年,Ikushima等[44]将自己课题组制备得到的Ag2S纳米颗粒首次以Ag2S QDs命名。但是在这些报道中,均没有提及Ag2S纳米晶的荧光性能,直到2010年,Wang等[23]第一次报道了具有荧光发射的近红外Ag2S QDs。他们用二乙基二硫代氨基甲酸银Ag(DDTC)作为单源前驱体,在十八胺(ODA)和油酸(OA)为配体分子的溶剂中制备得到了单分散性的Ag2S QDs。随后,众多课题组都致力于研究制备高质量具有近红外荧光的Ag2S QDs,并推进它们在生物领域的应用。
目前,已有许多关于Ag2S QDs制备方法的报道[45-60],特别是在过去5年,科研人员花了很大的努力专注于研究Ag2S QDs的形貌、尺寸、分散性、稳定性、光谱、功能化等的控制。在本文中,我们将对具有NIR-II荧光的Ag2S QDs进行概述和总结。
3Ag2S QDs的合成方法
3.1有机相合成
高温有机相合成是一种制备高质量无机半导体纳米晶的重要方法,因为较高的温度可以提高纳米晶的成核速率和结晶度,高沸点表面配体分子则控制着Ag2S晶核缓慢生长为Ag2S QDs,并且较高的温度和配体分子都有效地减少了表面缺陷,提高了荧光量子产率。
2010年,Wang课题组以Ag(DDTC)为单源前驱体,十八胺和油酸作为表面配体分子,在十八烯溶液中,首次合成了新型具有近红外荧光的单分散Ag2S QDs,其合成机理如图1a所示。首先,Ag(DDTC)前驱体在一定温度下热分解产生大量表面配体分子包覆的Ag2S晶核,产生的晶核进一步生长熟化,最终得到配体分子包覆的Ag2S QDs。图1b和1c分别为该方法制备的Ag2S QDs的TEM照片和XRD图谱,从图上可观察到:Ag2S纳米晶的粒径大小为10.2±0.4 nm,具有良好的单分散性,其晶体结构为单斜相,图1b插图中的高分辨透射电子显微镜照片(HRTEM)表明产物呈单晶结构。合成得到的Ag2S QDs在近红外光区域有明显的特征吸收(图1d),并且在1 058 nm处具有优异的近红外荧光发射 (图1e)。
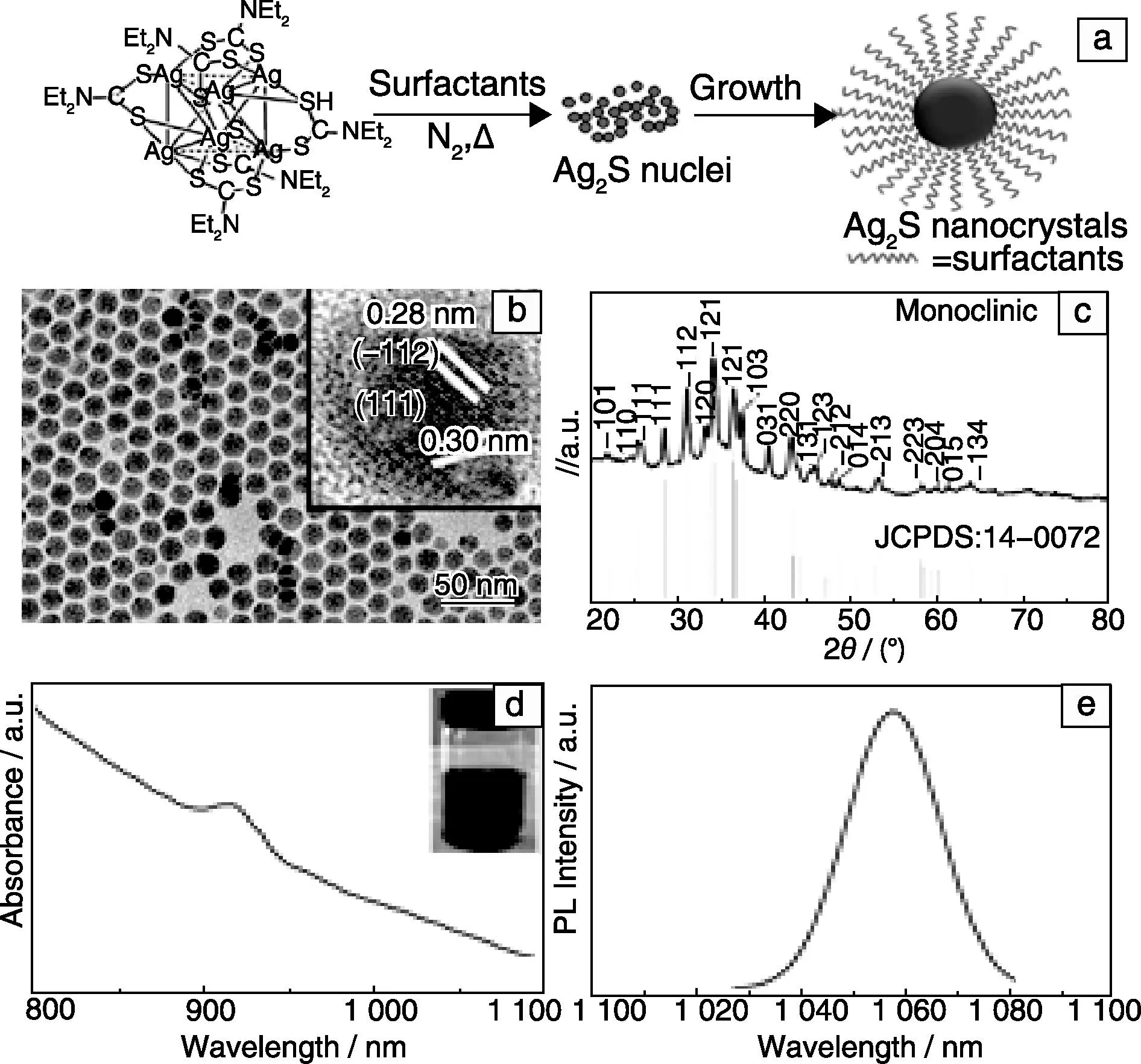
图1 单源前驱体法制备Ag2S QDs的合成机理示意图(a), Ag2S QDs的TEM照片(b)、XRD图谱(c)、吸收光谱(d)和荧光发射光谱(e)[23]Fig.1 The facile formation process of synthesizing of Ag2S NIR QDs from a single source precursor of Ag(DDTC) (a), TEM and HRTEM images(b) and XRD pattern(c) of the as-prepared Ag2S QDs, NIR absorption spectrum (d) of as-obtained Ag2S QDs, NIR PL emission spectrum (e) of Ag2S QDs at room temperature under λex= 785 nm[23]
用同样的方法,Wang等又合成出了十二硫醇(DT)作为配体分子包覆的Ag2S QDs,粒径从2.4 nm到7 nm均匀可调(图2a~g)[38],晶体结构均为单斜相。他们还详细研究了不同粒径Ag2S QDs的发射光谱和激发光谱,结果表明随着QDs尺寸从2.4 nm逐渐增大到4.4 nm时,相应的近红外荧光从975 nm红移到1 175 nm,当尺寸继续增大到7 nm时,荧光光谱不再发生变化(图2h)。激发光谱数据显示Ag2S QDs的最佳激发波长在400~500 nm之间,其与粒径的关系与发射光谱类似,当粒径增大到4.4 nm时,激发光谱不再发生红移(图2i)。他们进一步计算了Ag2S QDs的玻尔半径,约为2.2 nm,这一数据得到了他们实验结果的佐证。为了改善有机相Ag2S QDs的生物相容性,他们通过硫辛酸(DHLA)与QDs表面配体交换,得到了水溶性良好的DHLA修饰的Ag2S QDs;为了进一步提高Ag2S QDs在生物体内的生物相容性,他们在DHLA修饰的Ag2S QDs表面交联了六支链氨基PEG (6-PEG),这为后续的体外与体内成像打下了坚实的基础。

图2 不同尺寸的Ag2S QDs的TEM照片和尺寸分布图(a~g),不同粒径Ag2S QDs的近红外荧光光谱图(h)和对应的激发光谱图(i)[38]Fig.2 Typical TEM images and size distributions (a~g), photoluminescence emission spectra (h) and photoluminescence excitation spectra (i) of as-prepared Ag2S QDs with different size[38]
2011年,Li等[61]采用油酸银(AgOA)作为银源,硫粉作硫源,十二硫醇为表面配体分子,在120 ℃反应1 h,制得二维Ag2S纳米颗粒超晶格结构。在此基础上将配体分子换成油酸和十二胺(DM),他们发现制得的Ag2S QDs具有较好的单分散性(图3a),直径约10 nm,单斜相。且在658 nm和785 nm激发光下,该QDs在1 225 nm均有着较强的荧光发射(图3b)。
2012年,Pang等[62]用两步法制备得到了具有690~1227 nm荧光发射的Ag2S QDs (图4)。首先,他们在醋酸银、十四酸(MA)、油胺(OM)和十八烯的混合溶液中,高温注入硫源——六甲基二硅硫烷,制得Ag2S纳米小颗粒。然后,在上述制得的Ag2S纳米小颗粒溶液中加入Ag+和油胺的螯合物以及溶有S粉的甲苯溶液,进一步制得较大颗粒的Ag2S QDs。同年,Robinson等[63]发展了一种在有机相溶液里制备单分散金属硫化物的通用方法,他们以(NH4)2S和AgCl作为前驱体,油胺和三辛基膦(TOP)作配体分子和溶剂,制得发射波长为940 nm的小粒径Ag2S QDs。
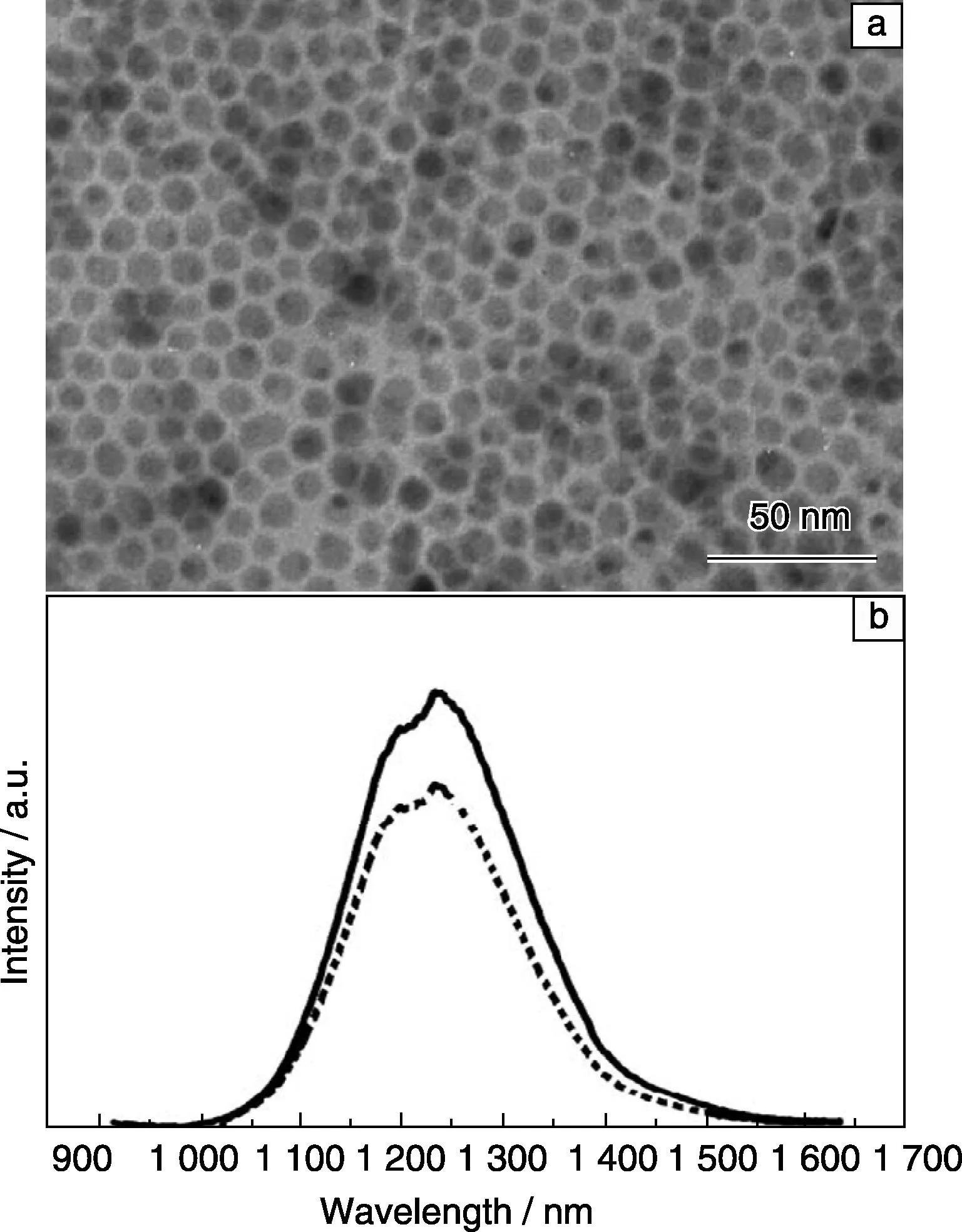
图3 制备得到的Ag2S QDs的TEM照片(a),室温下近红外荧光光谱图(b)(其中实线为658 nm光激发,虚线为785 nm光激发)[61]Fig.3 TEM image(a) and NIR photoluminescence spectra (b) at room temperature of nearly monodisperse Ag2S QDs (solid line: λex=658 nm, dotted line: λex=785 nm)[61]
在这些有机相合成方法中,我们不难发现合成过程中大量使用了油酸、油胺、十八胺、十二胺、十二硫醇、三辛基膦等对环境有害的有机溶剂。从环保和生物相容性角度出发,我们应当尽量减少这些高沸点有机试剂的使用。另外,这些油溶性Ag2S QDs在生物医学应用过程中往往需要水溶化处理,因此,近年来水相合成Ag2S QDs制备技术研究吸引越来越多的关注。
3.2水相合成
水相合成Ag2S QDs主要使用的配体分子包括3-巯基丙酸(3-MPA)[64-67]、2-巯基丙酸(2-MPA)[68]、谷胱甘肽(GSH)[69-71]、2,3-二巯基丁二酸(DMSA)[72]等[73-76]。
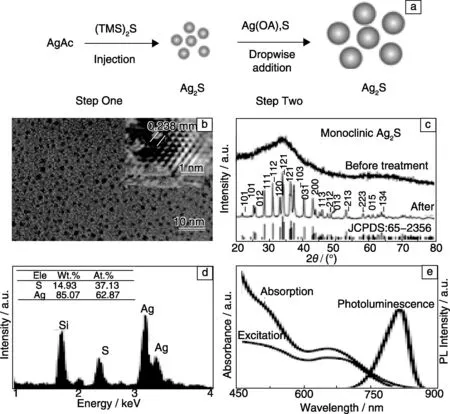
图4 两步法制备Ag2S QDs的合成示意图(a); Ag2S 纳米晶的TEM照片(b),插图为HRTEM照片;在180 ℃惰性气体中反应1 h前后的XRD图谱(c);EDS元素分析图谱(d); 获得的Ag2S QDs的吸收、激发和发射光谱(e)[62]Fig.4 The facile formation process of synthesizing of Ag2S NIR QDs with a two-step procedure(a), TEM image and HRTEM image (b) of Ag2S nanocrystals synthesized in step one, XRD patterns of the 1.5 nm Ag2S nanocrystals before and after thermal treatment at 180 ℃ under Ar flow for 1 h (c), EDS spectrum (d), absorption spectrum, excitation spectrum, and photoluminescence spectrum of Ag2S nanocrystals synthesized in step one (e)[62]
Tian等[65]用AgNO3作银源,3-MPA作硫源和配体分子,在乙二醇溶剂中145 ℃反应不同的时间,合成得到粒径从1.5 nm到6.3 nm的亲水性Ag2S QDs(图5a),对应的荧光光谱从510 nm到1 221 nm可调,XRD图谱表明合成得到的Ag2S QDs为单斜相。Acar等[68]则使用2-MPA作配体分子,Na2S用作硫源,同样使用AgNO3为银源,在去离子水中制得光谱从780 nm到950 nm可调的单斜相Ag2S QDs(图5b)。

图5 3-MPA(a)和2-MPA(b)修饰的Ag2S NIR QDs的制备过程示意图[65, 68]Fig.5 The facile formation process of preparation of 3-MPA(a) and 2-MPA(b) coated Ag2S NIR QDs[65, 68]
还原性GSH也是水相量子点合成中比较常用的一种配体分子,它的C链更长,官能团更多,使得GSH修饰的QDs在生理盐水中比MPA修饰的更稳定,生物相容性更好。Lin等[69]通过S-N2H4·H2O作硫源,与Ag+在GSH的保护下室温就制得624 nm到724 nm光谱可调的水相Ag2S QDs(图6)。当然,GSH还可以用作硫源,比如Wan等[70]把还原型GSH同时用作硫源和配体分子,一步法制备得到了Ag2S QDs。
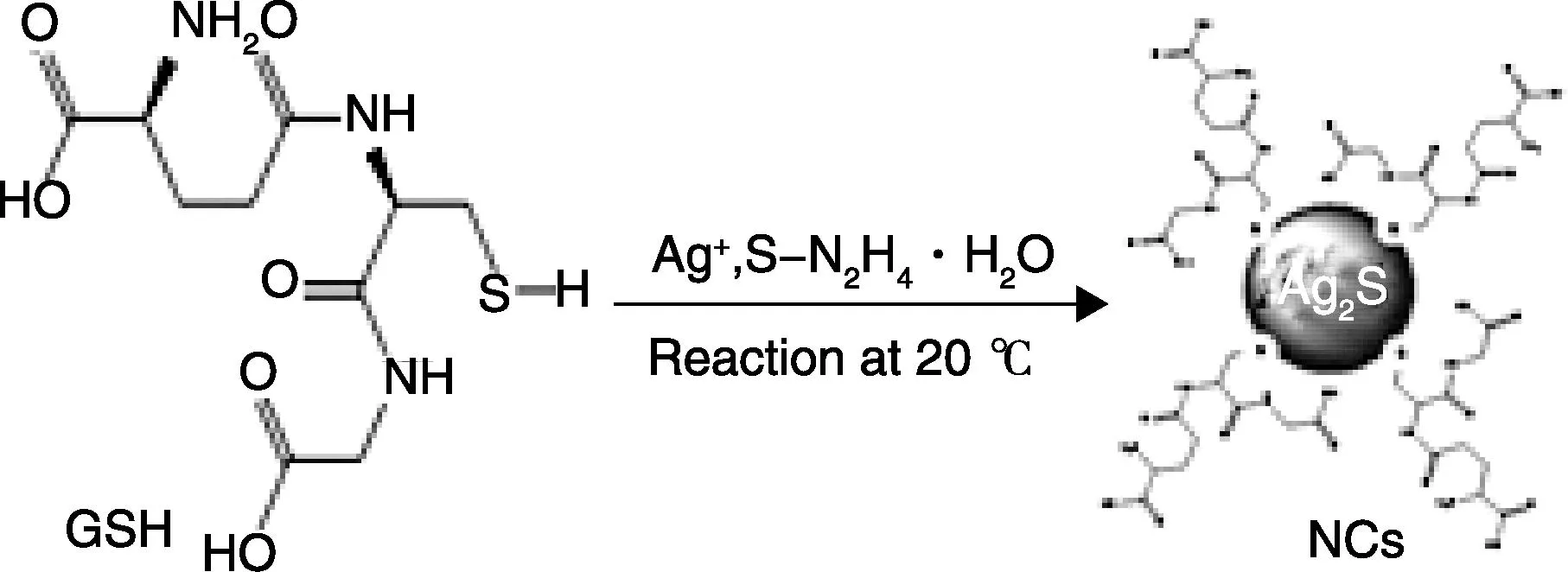
图6 GSH修饰的Ag2S NIR QDs的合成示意图[69]Fig.6 The facile formation process of preparation of GSH coated Ag2S NIR QDs[69]
Hocaoglu等[72]合成了DMSA修饰的尺寸可调的近红外Ag2S QDs。在该反应中,DMSA在50~90 ℃(pH =7~10)条件下,可以缓慢地释放S元素。也就是说该反应中DMSA可用作硫源,同时又是表面修饰剂。从以上几种小分子表面修饰制备Ag2S QDs的方法中,我们可以总结出以下几个规律:①这些修饰剂均含有巯基,且巯基均与Ag2S QDs表面发生作用;②这些巯基除了用作配体分子之外,还可以用作硫源;③在反应形成Ag2S 晶核之前,巯基均会先与Ag+螯合,形成新的反应前驱体;④除了巯基以外,这些修饰剂还含有亲水性的-COOH或者-NH2功能基团,使得QDs在水溶液中具有更好的分散性,也为后续靶向分子或抗体分子的偶联提供了功能基团。
牛血清蛋白(BSA)是水相合成Ag2S QDs的方法中使用最多的一种生物大分子,它与上述小分子配体有着共同的特征:含有巯基,以及官能团-COOH和-NH2。在合成过程中,BSA中的巯基首先与Ag+反应,形成螯合物BSA-Ag+,然后再加入硫源制得Ag2S QDs。Yan[77]等使用Na2S作为硫源,在37 ℃反应12 h,制备得到了小粒径的Ag2S QDs(图7)。他们通过调控Ag和S的摩尔比,实现了荧光光谱的调控,如Ag∶S从6∶1减小到4∶1,再到2∶1时,相应的荧光峰从660 nm红移到750 nm,再到840 nm。Yu等[78]也使用Na2S作为硫源,在室温下通过注射法加入到BSA-Ag+溶液中,制备得到1 050~ 1 294 nm发射光谱可调的Ag2S QDs,他们也是通过调节Ag和S的摩尔比(3∶1, 1∶2, 1∶3, 1∶5, 1∶10),制备得到平均尺寸1.6, 3.3, 3.7, 5.0和6.8 nm的Ag2S QDs,对应的禁带宽度分别为1.23, 1.16, 1.12, 1.02 和 0.94 eV。类似的方法还有许多,人们热衷于选用BSA作为表面配体分子,主要是因为分子较大,使得制备的QDs生物相容性更好、毒性更低、在生物体内更加稳定。
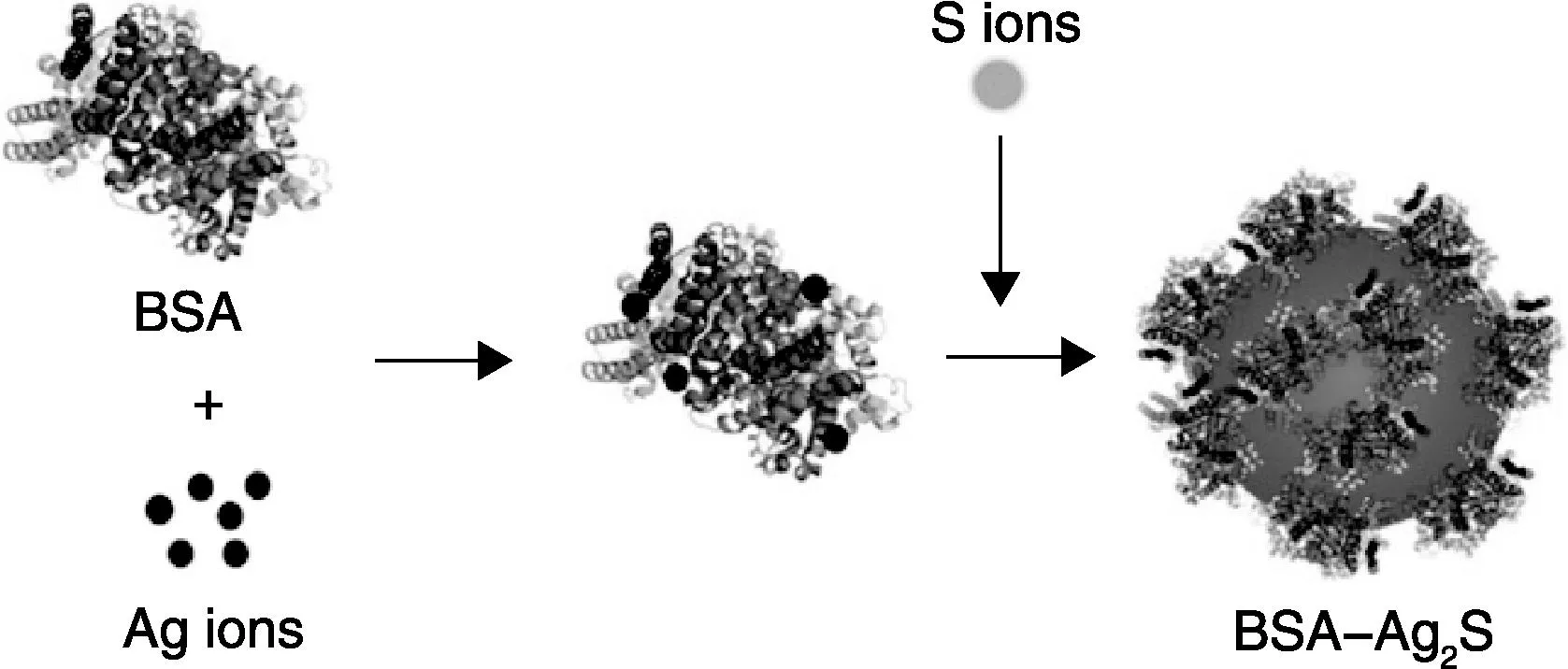
图7 BSA修饰的Ag2S NIR QDs的合成机理示意图[77]Fig.7 Proposed formation mechanism of BSA coated Ag2S NIR QDs[77]
水相合成Ag2S QDs与有机相合成方法相比,条件更温和,操作也更简单,但制备得到的QDs尺寸的均一性较差,发射光谱半峰宽更大。
3.3离子交换法
阳离子交换制备目标QDs是一种快速且比较有效的方法。通常选用CdS或者CdSe作为QDs基元,然后通过Ag+在有机相或者水相中取代纳米晶中的Cd2+形成Ag2S或者Ag2Se QDs。Alivisatos在这方面开展了一系列创新性工作[79-81],他们除用CdSe QDs通过Ag+交换制备得到Ag2Se QDs之外,还将CdS通过离子交换获得CdS-Ag2S超结构(图8),不过在他们的研究中没有测量所获得的Ag2Se或者Ag2S的荧光性质。Gui等[82]在水溶液中通过Ag+与GSH修饰的CdS QDs反应得到了GSH-Ag2S (图9),该QDs呈现出905~1090 nm的荧光发射。该反应在室温下进行,且对环境的要求较低,所以相对来说比较简单。Ag+可以实现如此简单、快速且行之有效的离子交换反应,主要有以下两点原因:①Ag+具有很高的迁移率;②Ag2S的溶度积常数(Ksp(Ag2S)=6.3×10-50)远远小于CdS(Ksp(CdS)=8.0×10-27)。但是离子交换的方法也有不足之处,在反应过程中,QDs表面容易产生表面缺陷,直接导致QDs荧光量子效率降低。
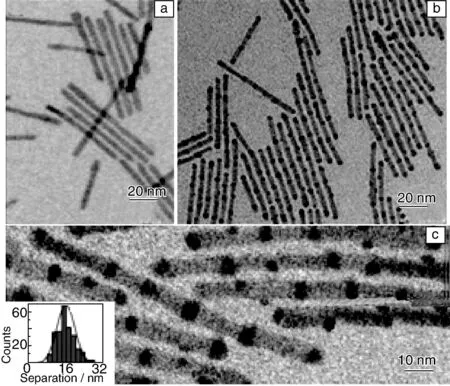
图8 初始4.8 nm×64 nm 的CdS纳米棒(a),离子交换后CdS-Ag2S超结构(b~c)。(c)中的插图为两个Ag2S之间的距离统计柱状图[79]Fig.8 The original 4.8 nm×64 nm CdS nanorods(a), transformed CdS-Ag2S superlattices (b~c), inset in (c) is histogram of Ag2S segment spacing (center-to-center)[79]
表1对不同方法制备的Ag2S QDs的荧光性质进行了总结。
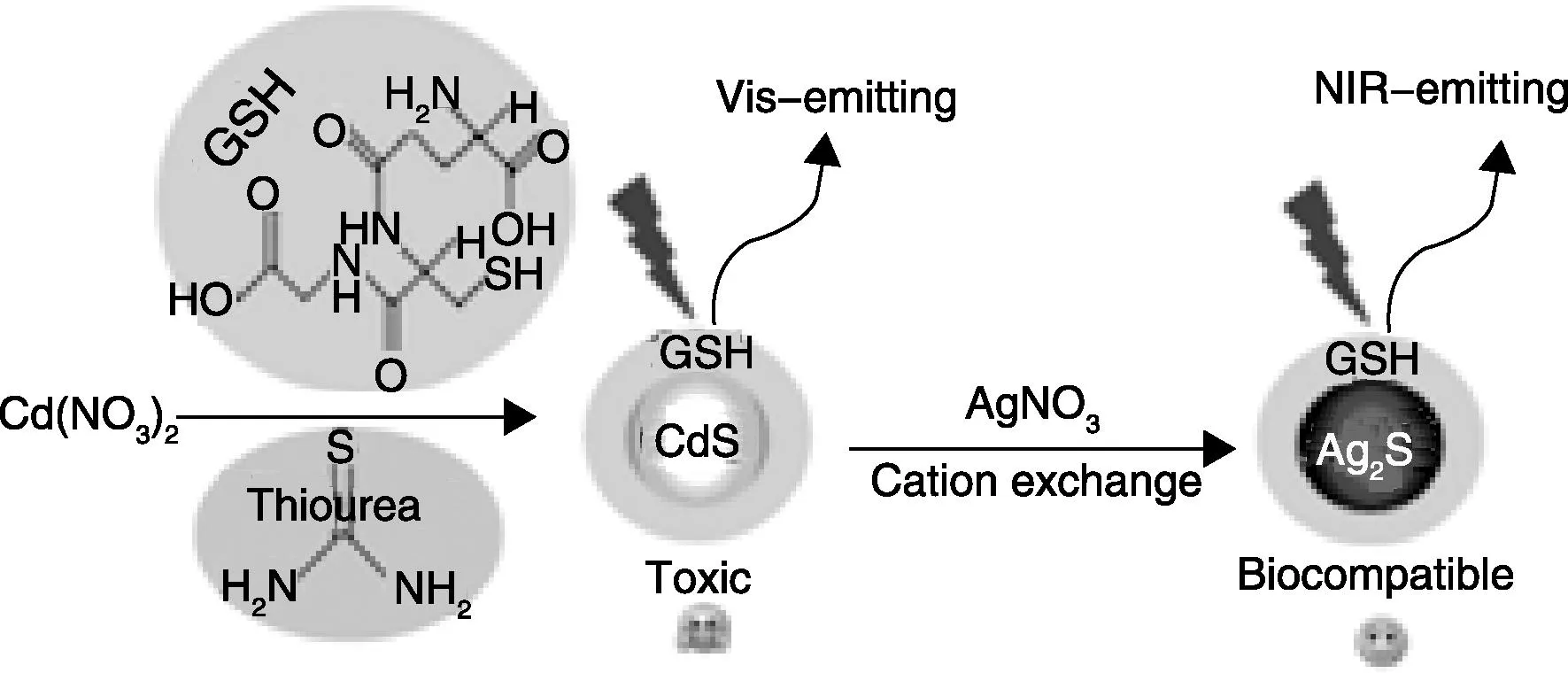
图9 水相中通过Ag+交换合成GSH修饰的Ag2S近红外量子点的示意图[82]Fig.9 Schematic illustration of the aqueous synthesis of GSH-Ag2S NIR QDs with Ag+ions exchange[82]
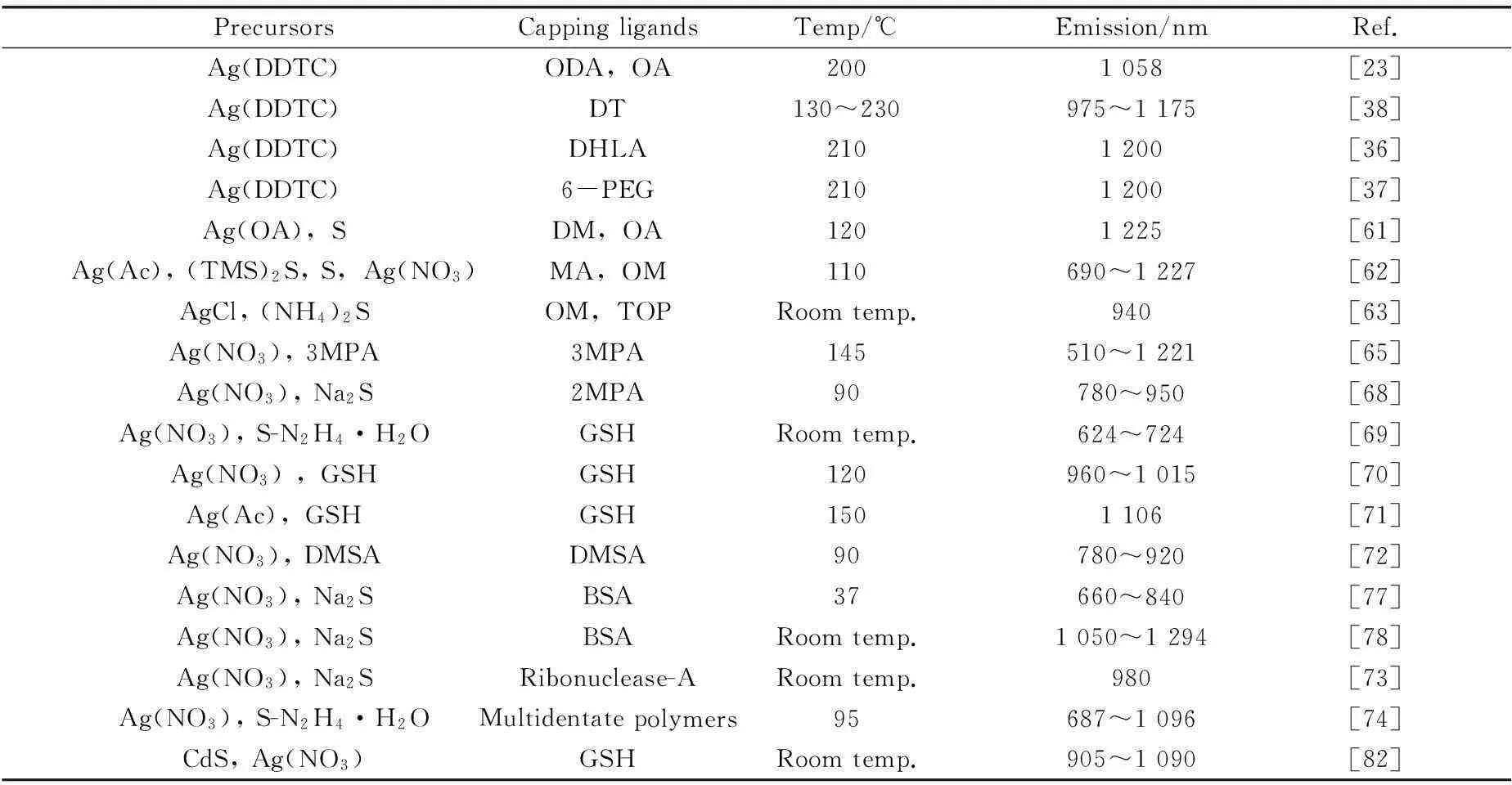
PrecursorsCappingligandsTemp/℃Emission/nmRef.Ag(DDTC)ODA,OA2001058[23]Ag(DDTC)DT130~230975~1175[38]Ag(DDTC)DHLA2101200[36]Ag(DDTC)6-PEG2101200[37]Ag(OA),SDM,OA1201225[61]Ag(Ac),(TMS)2S,S,Ag(NO3)MA,OM110690~1227[62]AgCl,(Nh1)2SOM,TOPRoomtemp.940[63]Ag(NO3),3MPA3MPA145510~1221[65]Ag(NO3),Na2S2MPA90780~950[68]Ag(NO3),S-N2h1·pOGSHRoomtemp.624~724[69]Ag(NO3),GSHGSH120960~1015[70]Ag(Ac),GSHGSH1501106[71]Ag(NO3),DMSADMSA90780~920[72]Ag(NO3),Na2SBSA37660~840[77]Ag(NO3),Na2SBSARoomtemp.1050~1294[78]Ag(NO3),Na2SRibonuclease-ARoomtemp.980[73]Ag(NO3),S-N2h1·pOMultidentatepolymers95687~1096[74]CdS,Ag(NO3)GSHRoomtemp.905~1090[82]
4Ag2S QDs异质纳米结构
近些年,在纳米尺度下结合两种或两种以上组分的纳米异质结构(Heteronanostructures, HNSs)受到了越来越多的关注。通过设计和构建多组分的HNSs,可同时展现不同组分材料各自的优异性质,或者不同组分材料通过协同作用而获得的全新性能,从而大大拓宽了材料的应用范围[83]。以Ag2S QDs为种子合成众多纳米异质结构近年来也备受关注,如Ag2S-ZnS[84]和Ag2S-CdS[85, 86]等,其制备方法主要有一锅法和注射法两类。
Wang等[84]首次采用共热分解Ag(DDTC)和二乙基二硫代氨基甲酸锌(Zn(DDTC)2)的合成策略成功制备了具有紫外/蓝-近红外双荧光特性的火柴状Ag2S-ZnS HNSs(图10),其中紫外/蓝色荧光来自ZnS纳米线,近红外荧光来自Ag2S QDs。通过调节反应前驱体的摩尔比可实现HNSs的尺寸调控,随着尺寸的增加,Ag2S-ZnS HNSs的双荧光特性表现出明显的量子尺寸效应。这种采用单源前驱体Ag(DDTC)和Zn(DDTC)2一锅煮的方法合成HNSs,比传统的种子生长法或催化辅助生长方法更加简单、可控,且具有普适性。利用该方法他们也成功构建了Ag2S-CdS HNSs[87](图11)。进一步的,他们通过能带工程在Ag2S-ZnS HNSs中引入Mn过渡金属离子掺杂,实现了对双色荧光发射特性的Ag2S-ZnS HNSs的光学性质的调控,成功得到了具有三色荧光特性的Mn掺杂的Ag2S-ZnS HNSs,其中蓝色荧光来自ZnS纳米线,橙色荧光来自Mn离子的6A1-4T1跃迁,近红外荧光来自Ag2S QDs[88]。进一步研究发现,通过调节Mn2+掺杂温度和掺杂浓度可以调控HNSs生长和掺杂的动力学和热力学过程,实现对Ag2S-ZnS HNSs尺寸和光学性质的精确调控(图12)。这种同时具有可见荧光和近红外荧光并且不同荧光可调的HNSs有望在生物活体体内/体外同时成像以及纳米光电器件等领域获得应用。

图10 当Ag(DDTC)∶Zn(DDTC)2=1∶2时,制备得到的Ag2S-ZnS异质纳米结构的TEM照片(a),XRD图谱(b),紫外/蓝光以及近红外荧光光谱(c~d)[84]Fig.10 TEM image (a), XRD pattern (b), and UV/blue and NIR photoluminescence spectra (c~d) of Ag2S-ZnS HNSs with Ag(DDTC)∶Zn(DDTC)2=1∶2[84]
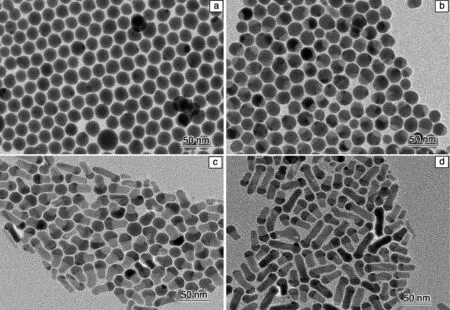
图11 Ag2S QDs的TEM照片(a),Ag2S与CdS比例为1∶0.4,1∶1和1∶2时的Ag2S-CdS HNSs TEM照片(b~d)[87]Fig.11 TEM images of Ag2S (a) and Ag2S-CdS HNSs prepared with different Ag2S /CdS molar ratios:(b) 1∶0.4, (c) 1∶1, and (d) 1∶2[87]
Xu等[89]以Ag2S QDs作为种子和催化剂,通过注射Cd(S2CNnBu2)2(Cd(dbdc)2)和Zn(S2CNnBu2)2(Zn(dbdc)2)的方法制备得到了Ag2S-CdS和Ag2S-ZnS HNSs (图13),在获得该两种结构的基础上,继续按顺序注射Zn(dbdc)2和Cd(dbdc)2,他们进一步获得了Ag2S-CdS-ZnS、Ag2S-ZnS-CdS-ZnS HNSs。除此之外,他们还以Ag2S纳米晶作为主基元,通过在不同的温度注射In(S2CNnBu2)3(In(dbdc)3)前驱体,成功制得Ag2S-AgInS2、AgInS2-Ag2S-AgInS2HNSs。不过对于Ag2S纳米晶在该体系中的荧光性质,他们并没有报道。
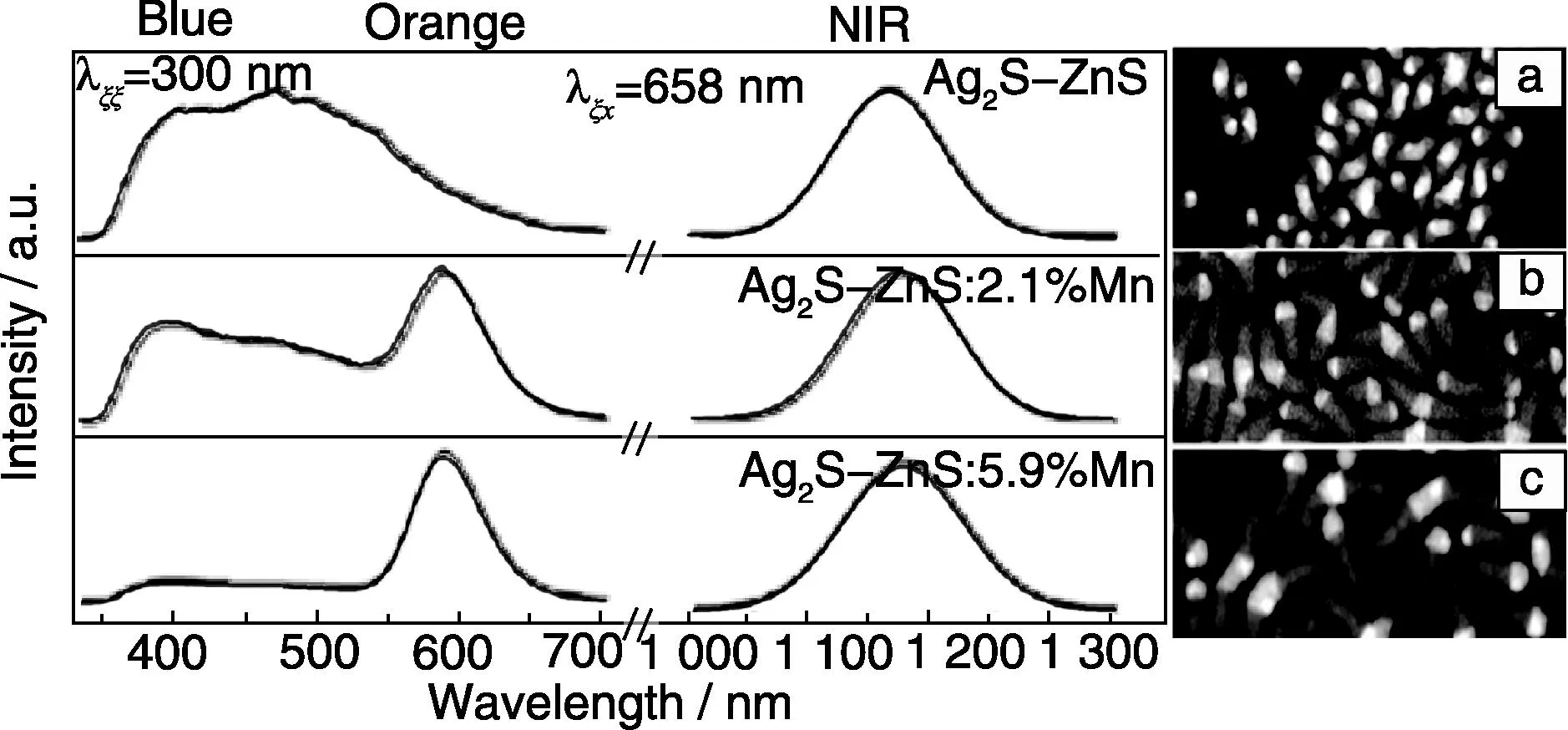
图12 Ag2S-ZnS HNSs (a),掺杂2.1% Mn离子(b)和5.9% Mn离子(c)的Ag2S-ZnS HNSs的扫描TEM照片,以及对应的荧光光谱[88]Fig.12 Scanning TEM(STEM) images of Ag2S-ZnS HNSs (a), doping of 2.1% Mn (b), doping of 5.9% Mn (c), and corresponding photoluminescence spectrum[88]
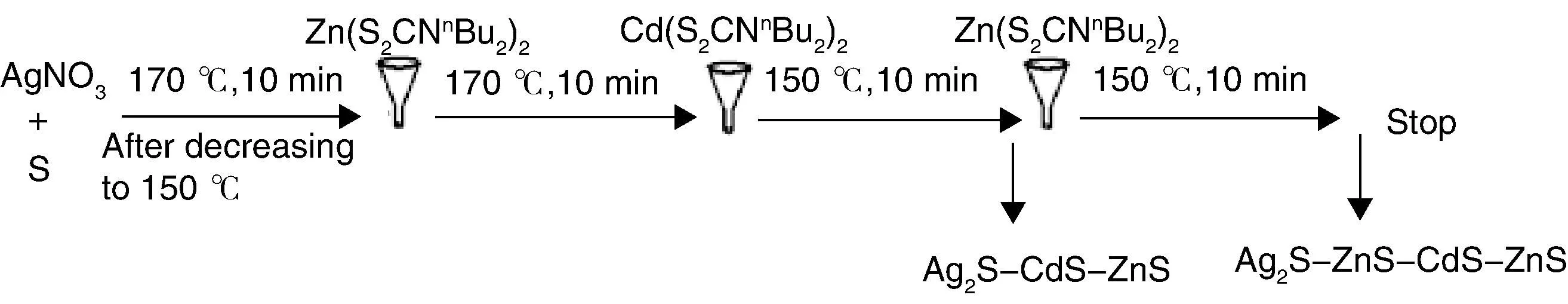
图13 Ag2S-CdS-ZnS和Ag2S-ZnS-CdS-ZnS HNSs的合成机理示意图[89]Fig.13 Synthetic route for preparing of Ag2S-CdS-ZnS and Ag2S-ZnS-CdS-ZnS HNSs[89]
除了Ag2S QDs与金属硫化物的HNSs外[90-92],还有很多Ag2S与贵金属异质结构的报道[93-94],特别是Ag2S-Ag HNSs[95-98],这些主要以纳米结构的研究为目标,并没有关于Ag2S荧光性质的相关报道。
5生物应用
由于Ag2S QDs优异的NIR-Ⅱ区荧光性质,在活体成像中具有高组织穿透深度、高信噪比等优点,所以许多研究小组都在积极开展其在近红外窗口的生物成像研究。Wang等开展了一系列从细胞到动物活体水平的Ag2S QDs 近红外影像研究。他们首先在体外进行成像研究,在QDs表面分别修饰Erbitux 和RGD分子,可分别实现对MDA-MB-468和U87 MG细胞的特异性标记[36]。进一步,在活体水平上,通过将Ag2S QDs 经尾静脉注入小鼠体内,因肿瘤组织对大分子的高通透性和滞留效应(EPR 效应),表现出对Ag2S NIR QDs 具有很高的摄取[37]。实验结果表明,Ag2S NIR QDs 通过尾静脉注入小鼠体内后可以成功实现对小鼠体内肿瘤的非特异性靶向标记,显示了Ag2S NIR QDs 在肿瘤早期诊断以及手术的可视化指导方面具有潜在应用前景。
除此之外,科研人员还开展了Ag2S NIR QDs用于淋巴管成像[99]、肿瘤治疗实时成像[100]、干细胞在体内的迁移和分布成像以及干细胞肝损伤示踪等应用研究[101-102]。
6毒理学与稳定性研究
Ag2S QDs虽然具有优异的NIR-Ⅱ区荧光,且在生物成像领域已展现出很好的应用潜力,但它们的生物相容性决定了它们在生物医学研究领域的发展前景。通常QDs进入生物体以后,易被体内微环境腐蚀、降解或氧化光解,如在胃液等低pH值条件下,QDs稳定性降低,会释放金属离子,这些离子在生物体内降解时会释放出毒素,从而对细胞或组织产生损伤。
Wang等从细胞增殖、细胞凋亡与坏死、活性氧和DNA损伤实验等方面系统地评价了Ag2S QDs的细胞毒性[36]。在该项研究中,选取6.25,12.5,25,50和100 μg/mL五个浓度的Ag2S QDs与小鼠的L929细胞作用。实验结果表明,当浓度增加至100 μg/mL(8倍于成像时的浓度),细胞的各项指标均无异常。他们还用同步辐射X光近边吸收结构谱对Ag2S QDs在细胞中的稳定性进行了测试[101](图14),数据表明该QDs在细胞中30 d仍不会释放Ag+,表明Ag2S QDs高度的化学稳定性。在此基础上,研究人员进一步对Ag2S QDs的活体毒性进行了系统研究[103]。实验以Balb/C小鼠为研究对象,通过尾静脉注射一定剂量的Ag2S QDs,然后观察不同时间在脏器的分布情况,同时研究QDs对小鼠体重、血常规指标、血液生化指标以及重要脏器病理学变化的影响。研究结果显示,Ag2S QDs进入小鼠体内后主要富集在肝和脾等网状内皮系统,随着时间的推移能够通过胆汁途径通过粪便代谢掉;浓度高达30 mg/kg(30倍于成像剂量)的Ag2S QDs不会引起小鼠的急性和慢性毒性反应。
Wang等的一系列研究证明,Ag2S QDs 是一种稳定、低毒的NIR-II 活体成像荧光探针,这些研究结果与Ag2S具有较低的溶度积常数相一致。
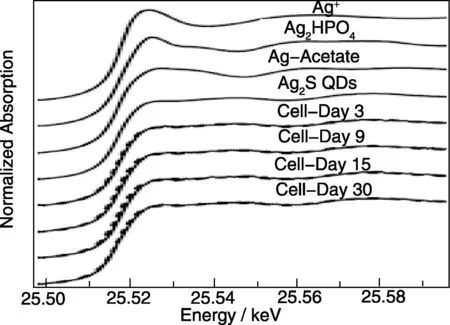
图14 Ag2S QDs 标记人骨髓间充质干细胞在3,9,15和30 d 后的Ag的X光近边吸收结构谱,以及Ag(ac)、Ag2HPO4和 Ag+的Ag的X光近边吸收结构谱[101]Fig.14 Ag X-ray absorption near-edge structure (XANES) spectra of the Ag2S QDs-labeled hMSCs after 3, 9, 15, and 30 days incubation and the spectra of reference compounds of Ag2S QDs, Ag(ac), Ag2HPO4, and Ag+[101]
7结语
新型Ag2S QDs以其优异的近红外荧光性质和生物相容性引起了人们极大的研究兴趣。近年来从制备到应用都取得了重大进展,可实现荧光强度高、发光谱精确可调、发光性能稳定的高质量Ag2S QDs的可控制备,在细胞成像、活体肿瘤靶向成像、血管与淋巴成像、干细胞修复组织损伤示踪、手术的可视化指导、新药筛选与评估等领域表现出了巨大的应用前景。然而由于Ag2S QDs颗粒比较小,具有较大的比表面积,导致了表面原子的配位不足、不饱和键和悬键增多,都严重影响了Ag2S QDs的荧光量子效率。但是目前并没有找到一种晶格比较匹配的半导体纳米晶能够有效地实现Ag2S QDs的核壳结构,以提高其荧光量子产率以及增强荧光稳定性,这也成为未来Ag2S QDs制备方法上的一个挑战。另外,目前Ag2S QDs的研究大多聚焦在制备方法以及生物应用研究,其在激光器、光电探测器、太阳能电池、催化等领域的潜在应用没有引起人们足够的关注。我们期望通过众多研究者的共同努力,这种新型近红外荧光探针能够获得更加广泛的研究和应用。
参考文献References
[1]Alivisatos A P.Science[J], 1996, 271(5251): 933-937.
[2]Yin Y, Alivisatos A P.Nature[J], 2005, 437(7059): 664-670.
[3]Bruchez M, Moronne M, Gin P,etal.Science[J], 1998, 281(5385): 2 013-2 016.
[4]Chan W C W, Nie S M.Science[J], 1998, 281(5385): 2 016-2 018.
[5]Medintz I L, Uyeda H T, Goldman E R,etal.NatureMaterials[J], 2005, 4(6): 435-446.
[6]Wang Q, Xu Y, Zhao X,etal.JournaloftheAmericanChemicalSociety[J], 2007, 129(20): 6 380-6 381.
[7]Ma Q A, Su X G.Analyst[J], 2010, 135(8): 1 867-1 877.
[8]Aswathy R G, Yoshida Y, Maekawa T,etal.AnalyticalandBioanalyticalChemistry[J], 2010, 397(4): 1 417-1 435.
[9]Welsher K, Liu Z, Sherlock S P,etal.NatureNanotechnology[J], 2009, 4(11): 773-780.
[10]Welsher K, Sherlock S P, Dai H J.ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica[J], 2011, 108(22): 8 943-8 948.
[11]Liu Z, Tabakman S, Welsher K,etal.NanoResearch[J], 2009, 2(2): 85-120.
[12]Smith A M, Mancini M C, Nie S M.NatureNanotechnology[J], 2009, 4(11): 710-711.
[13]Bakueva L, Gorelikov I, Musikhin S,etal.AdvancedMaterials[J], 2004, 16(11): 926-929.
[14]Hines M A, Scholes G D.AdvancedMaterials[J], 2003, 15(21): 1 844-1 849.
[15]Giansante C, Infante I, Fabiano E,etal.JournaloftheAmericanChemicalSociety[J], 2015, 137(5): 1 875-1 886.
[16]Yanover D, Vaxenburg R, Tilchin J,etal.JournalofPhysicalChemistryC[J], 2014, 118(30): 17 001-17 009.
[17]Wehrenberg B L, Wang C J, Guyot-Sionnest P.JournalofPhysicalChemistryB[J], 2002, 106(41): 10 634-10 640.
[18]Yanover D, Capek R K, Rubin-Brusilovski A,etal.ChemistryofMaterials[J], 2012, 24(22): 4 417-4 423.
[19]Woo J Y, Ko J H, Song J H,etal.JournaloftheAmericanChemicalSociety[J], 2014, 136(25): 8 883-8 886.
[20]Kortschot R J, Van Rijssel J, Van Dijk-Moes R J A,etal.JournalofPhysicalChemistryC[J], 2014, 118(13): 7 185-7 194.
[21]Harrison M T, Kershaw S V, Burt M G,etal.MaterialsScienceandEngineeringB-SolidStateMaterialsforAdvancedTechnology[J], 2000: 69 355-69 360.
[22]Rogach A L, Harrison M T, Kershaw S V,etal.PhysicaStatusSolidiB-BasicResearch[J], 2001, 224(1): 153-158.
[23]Du Y P, Xu B, Fu T,etal.JournaloftheAmericanChemicalSociety[J], 2010, 132(5): 1 470-1 471.
[24]Dong B H, Li C Y, Chen G C,etal.ChemistryofMaterials[J], 2013, 25(12): 2 503-2 509.
[25]Zhu C N, Jiang P, Zhang Z L,etal.ACSAppliedMaterials&Interfaces[J], 2013, 5(4): 1 186-1 189.
[26]Gu Y P, Cui R, Zhang Z L,etal.JournaloftheAmericanChemicalSociety[J], 2012, 134(1): 79-82.
[27]Zrazhevskiy P, Sena M, Gao X H.ChemicalSocietyReviews[J], 2010, 39(11): 4 326-4 354.
[28]De La Zerda A, Zavaleta C, Keren S,etal.NatureNanotechnology[J], 2008, 3(9): 557-562.
[29]Welsher K, Liu Z, Daranciang D,etal.NanoLetters[J], 2008, 8(2): 586-590.
[30]Chen Z, Tabakman S M, Goodwin A P,etal.NatureBiotechnology[J], 2008, 26(11): 1 285-1 292.
[31]Kam N W S, O′Connell M, Wisdom J A,etal.ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica[J], 2005, 102(33): 11 600-11 605.
[32]Hong G S, Tabakman S M, Welsher K,etal.AngewandteChemie-InternationalEdition[J], 2011, 50(20): 4 644-4 648.
[33]Robinson J T, Welsher K, Tabakman S M,etal.NanoResearch[J], 2010, 3(11): 779-793.
[34]Hong G S, Tabakman S M, Welsher K,etal.JournaloftheAmericanChemicalSociety[J], 2010, 132(45): 15 920-15 923.
[35]De la Zerda A, Liu Z A, Bodapati S,etal.NanoLetters[J], 2010, 10(6): 2 168-2 172.
[36]Zhang Y, Hong G S, Zhang Y J,etal.ACSNano[J], 2012, 6(5): 3 695-3 702.
[37]Hong G S, Robinson J T, Zhang Y J,etal.AngewandteChemie-InternationalEdition[J], 2012, 51(39): 9 818-9 821.
[38]Zhang Y J, Liu Y S, Li C Y,etal.JournalofPhysicalChemistryC[J], 2014, 118(9): 4 918-4 923.
[39]Gui R J, Jin H, Wang Z H,etal.CoordinationChemistryReviews[J], 2015, 296:91-124.
[40]Motte L, Pileni M P.JournalofPhysicalChemistryB[J], 1998, 102(21): 4 104-4 109.
[41]Brelle M C, Zhang J Z, Nguyen L,etal.JournalofPhysicalChemistryA[J], 1999, 103(49): 10 194-10 201.
[42]Gao F, Lu Q, Zhao D.NanoLetters[J], 2003, 3(1): 85-88.
[43]Liu Z P, Liang J B, Xu D,etal.ChemicalCommunications[J], 2004(23): 2 724-2 725.
[44]Liu J C, Raveendran P, Shervani Z,etal.ChemicalCommunications[J], 2004(22): 2 582-2 583.
[45]Xiang J, Cao H, Wu Q,etal.JournalofPhysicalChemistryC[J], 2008, 112(10): 3 580-3 584.
[46]Suresh A K, Doktycz M J, Wang W,etal.ActaBiomaterialia[J], 2011, 7(12): 4 253-4 258.
[47]Schaaff T G, Rodinone A J.JournalofPhysicalChemistryB[J], 2003, 107(38): 10 416-10 422.
[48]Liu S H, Qian X F, Yin J,etal.JournalofSolidStateChemistry[J], 2002, 168(1): 259-262.
[49]Lou W, Wang X, Chen M,etal.Nanotechnology[J], 2008, 19(22): 225 607.
[50]Huxter V M, Mirkovic T, Nair P S,etal.AdvancedMaterials[J], 2008, 20(12): 2 439-2 443.
[51]Sahu A, Qi L, Kang M S,etal.JournaloftheAmericanChemicalSociety[J], 2011, 133(17): 6 509-6 512.
[52]Liu H, Hu W, Ye F,etal.RSCAdvances[J], 2013, 3(2): 616-622.
[53]Wang D S, Xie T, Peng Q,etal.JournaloftheAmericanChemicalSociety[J], 2008, 130(12): 4 016-4 022.
[54]Hou X, Zhang X, Yang W,etal.MaterialsResearchBulletin[J], 2012, 47(9): 2 579-2 583.
[55]Wang D, Hao C, Zheng W,etal.AdvancedMaterials[J], 2008, 20(13): 2 628-2 632.
[56]Chen J, Kong Y, Ji J,etal.Nanoscale[J], 2012, 4(15): 4 455-4 458.
[57]Maji S K, Sreejith S, Mandal A K,etal.AnalyticalMethods[J], 2014, 6(7): 2 059.
[58]Lin S, Feng Y, Wen X,etal.JournalofPhysicalChemistryC[J], 2015, 119(1): 867-872.
[59]Jagadeesh E, Khan B, Chandran P,etal.ColloidsandSurfacesB:Biointerfaces[J], 2015: 125 284- 125 290.
[60]Shen S, Zhang Y, Peng L,etal.CrystEngComm[J], 2011, 13(14): 4 572-4 579.
[61]Li P, Peng Q, Li Y.Chemistry-AEuropeanJournal[J], 2011, 17(3): 941-946.
[62]Jiang P, Tian Z Q, Zhu C N,etal.ChemistryofMaterials[J], 2012, 24(1): 3-5.
[63]Zhang H, Hyun B R, Wise F W,etal.NanoLetters[J], 2012, 12(11): 5 856-5 860.
[64]Tan L, Liu S, Yang Q,etal.Langmuir[J], 2015, 31(13): 3 958-3 964.
[65]Jiang P, Zhu C N, Zhang Z L,etal.Biomaterials[J], 2012, 33(20): 5 130-5 135.
[66]Tang R, Xue J P, Xu B G,etal.ACSNano[J], 2015, 9(1): 220-230.
[67]Sun J, Yu W, Usman A,etal.JournalofPhysicalChemistryLetters[J], 2014, 5(4): 659-665.
[68]Hocaoglu I, Cizmeciyan M N, Erdem R,etal.JournalofMaterialsChemistry[J], 2012, 22(29): 14 674.
[69]Wang C, Wang Y, Xu L,etal.Small[J], 2012, 8(20): 3 137-3 142.
[70]Tan L J, Wan A J, Li H L.ACSAppliedMaterials&Interfaces[J], 2013, 5(21): 11 163-11 171.
[71]Tan L, Wan A, Li H.Langmuir[J], 2013, 29(48): 15 032-15 042.
[72]Hocaoglu I, Demir F, Birer O,etal.Nanoscale[J], 2014, 6(20): 11 921-11 931.
[73]Chen J, zhang T, Feng L,etal.MaterialsLetters[J], 2013, 96:224-227.
[74]Gui R, Wan A, Liu X,etal.Nanoscale[J], 2014, 6(10): 5 467-5 473.
[75]Han L, Lv Y, Asiri A M,etal.JournalofMaterialsChemistry[J], 2012, 22(15): 7 274.
[76]Mukherjee N, Jana S, Gopal Khan G,etal.JournalofAppliedPhysics[J], 2012, 112(12): 124 324.
[77]Wang Y, Yan X P.ChemicalCommunications[J], 2013, 49(32): 3 324-3 326.
[78]Yang H Y, Zhao Y W, Zhang Z Y,etal.Nanotechnology[J], 2013, 24(5): 055 706.
[79]Son D H, Hughes S M, Yin Y D,etal.CationScience[J], 2004, 306(5698): 1 009-1 012.
[80]Robinson R D, Sadtler B, Demchenko D O,etal.Science[J], 2007, 317(5836): 355-358.
[81]Sadtler B, Demchenko D O, Zheng H,etal.JournaloftheAmericanChemicalSociety[J], 2009, 131(14): 5 285-5 293.
[82]Gui R, Sun J, Liu D,etal.DaltonTransactions[J], 2014, 43(44): 16 690-16 697.
[83]Chen Y, Dong L, Zhao M,etal.ChemicalCommunications[J], 2014, 50(78): 11 514-11 516.
[84]Shen S, Zhang Y, Peng L,etal.AngewandteChemie-InternationalEdition[J], 2011, 50(31): 7 115-7 118.
[85]Wang J, Feng H, Chen K,etal.DaltonTransactions[J], 2014, 43(10): 3 990-3 998.
[86]O′Sullivan C, Gunning R D, Sanyal A,etal.JournaloftheAmericanChemicalSociety[J], 2009, 131(34): 12 250-12 257.
[87]Zhang Y, Shen S, Wang Q.CrystEngComm[J], 2014, 16(40): 9 501-9 505.
[88]Shen S, Zhang Y, Liu Y,etal.ChemistryofMaterials[J], 2012, 24(12): 2 407-2 413.
[89]Zhu G X, Xu Z.JournaloftheAmericanChemicalSociety[J], 2011, 133(1): 148-157.
[90]Zou C, Li M, Zhang L,etal.CrystEngComm[J], 2011, 13(10): 3 515-3 520.
[91]Peng P, Sadtler B, Alivisatos A P,etal.JournalofPhysicalChemistryC[J], 2010, 114(13): 5 879-5 885.
[92]Shen S, Wang Q.ChemistryofMaterials[J], 2013, 25(8): 1 166-1 178.
[93]Yang J, Ying J Y.JournaloftheAmericanChemicalSociety[J], 2010, 132(7): 2 114-2 115.
[94]Zhu G, Bao C, Liu Y,etal.Nanoscale[J], 2014, 6(19): 11 147-11 156.
[95]Ma X, Zhao Y, Jiang X,etal.ChemPhysChem[J], 2012, 13(10): 2 531-2 535.
[96]Pang M L, Hu J Y, Zeng H C.JournaloftheAmericanChemicalSociety[J], 2010, 132(31): 10 771-10 785.
[97]Jiang F, Tian Q, Tang M,etal.CrystEngComm[J], 2011, 13(24): 7 189.
[98]Zeng J, Tao J, Su D,etal.NanoLetters[J], 2011, 11(7): 3 010-3 015.
[99]Li C, Zhang Y, Wang M,etal.Biomaterials[J], 2014, 35(1): 393-400.
[100]Hu F, Li C, Zhang Y,etal.NanoResearch[J], 2015, 8(5): 1 637-1 647.
[101]Chen G, Tian F, Zhang Y,etal.AdvancedFunctionalMaterials[J], 2014, 24(17): 2 481-2 488.
[102]Chen G, Tian F, Li C,etal.Biomaterials[J], 2015:53 265-53 273.
[103]Zhang Y, Zhang Y, Hong G,etal.Biomaterials[J], 2013, 34(14): 3 639-3 646.
(编辑惠琼)
Recent Advances of Ag2S Near-Infrared Quantum Dots
ZHANG Yejun, WANG Qiangbin
(Suzhou Institute of Nano-Tech and Nano-Bionics, Chinese Academy of Sciences, Suzhou 215123, China)
Abstract:As light-emitting nanocrystals, quantum dots (QDs) have been a major focus of research during the past two decades. The impetus can be attributed to their unique optical properties, such as high fluorescence intensity, high photostability, multiple fluorescence colors, and size-tunable light emission. In recent years, the second near-infrared window QDs have emerged as a fluorescent probe for in vitro and in vivo imaging for maximal penetration depth and minimized autofluorescence. As a new type of second near-infrared window QDs, Ag2S has attracted increasing attention for ultralow toxicity, high stability, low cost, and good biocompatibility in the past five years. This review summarizes the history, synthetic method, heterostructure, biological applications, and toxicology research of Ag2S QDs from domestic and international research results, and emphatically outlines its synthetic method. Furthermore, the existing problems of Ag2S QDs are discussed, and the prospects of the related research are presented.
Key words:Ag2S; quantum dots; second near-infrared window; imaging
中图分类号:O657.3
文献标识码:A
文章编号:1674-3962(2016)01-0017-11
DOI:10.7502/j.issn.1674-3962.2016.01.03
通讯作者:王强斌,男,1973年生,研究员,博士生导师,
基金项目:国家自然科学基金(21303249, 21425103, 81401464和21501192),江苏省自然科学基金(BK20130347 和 BK20130366)
收稿日期:2015-06-30
第一作者:张叶俊,男,1985年生,助理研究员
Email:qbwang 2008@ sinano.ac.cn
