纳米银生物过程及影响的研究进展
2016-03-04刘思金
徐 明,王 哲,刘思金
(中国科学院生态环境研究中心,环境化学与生态毒理学国家重点实验室,北京 100085)

纳米银生物过程及影响的研究进展
徐明,王哲,刘思金
(中国科学院生态环境研究中心,环境化学与生态毒理学国家重点实验室,北京 100085)
摘要:纳米银是目前全球产量和使用量最大的人工纳米材料之一。由于其优良的抗菌等特性,纳米银应用范围广泛,与人们的生产、生活密切相关。随着纳米银在工业品、医疗品和生活用品中日益广泛的应用,其伴随的环境与健康风险也日益受到人们的关注,并成为重要的研究热点。近年来,关于纳米银的生物过程、生物效应及其相关分子作用机制的研究都取得重要进展,为全面地阐明纳米银的环境和生物安全性提供了重要的理论依据。为了更深入地理解纳米银暴露的环境健康危害,系统地总结了纳米银进入生物体的途径以及在生物体内的组织分布;纳米银与生物分子的相互作用;纳米银进入细胞的途径以及引发致死效应的毒性机制等方面的研究现状和进展。此外,还阐述了纳米银的环境健康风险及其在低剂量暴露条件下引发生物体非致死效应的作用机制,并对未来可能的研究前景进行了展望。
关键词:纳米银;生物过程;致死效应;非致死效应;环境健康风险
1前言
随着纳米科技的发展,越来越多的人工纳米材料被应用到人类的生活和生产过程中。不同于常规材料,纳米材料由于其独特的尺寸和表面性能,因而在光、电、热、磁等性质上具有独特的微观效应,可以根据不同的用途进行设计和改造。其中,纳米银(Silver Nanoparticles, AgNPs)是最为重要的人工纳米材料之一,由于其优良的抗菌等特性,已经成功地推广和应用到多个领域内(如医疗、建筑、水处理等)。目前,由于其广阔的应用前景,纳米银仍然是重要的研究热点,而且越来越多的人力和物力投入到纳米银产品的研发。然而,目前关于纳米银的生物安全性和潜在生物毒性的研究远远落后于对纳米银性能及应用方面的研究。为了更深入地理解纳米银暴露的环境健康危害,作者课题组系统地总结了近年来有关纳米银的生物过程、生物效应及其分子作用机制的研究,并指出纳米银安全性研究中存在的问题。
2纳米银的基本性质
AgNPs是最重要的金属类人工纳米材料之一。纳米银颗粒是直径在1~100 nm、含有20~15 000个银原子的银原子簇[1-2]。目前,市场上的人工纳米产品中,纳米银产品占据非常大的比例,其生产和开发规模也日益扩大。近年来,纳米银合成方法已经被广泛和深入地探索(如化学还原法、光学还原法、电化学法等),各种具有不同形貌(如纳米球、纳米线、纳米片、纳米立方体等)和表面性质(正电荷、负电荷、极性和非极性等)的纳米银材料被不断开发出来[1]。这些纳米银材料具有不同的光、电和催化性质,如球形纳米银颗粒的表面等离子体子共振性质(Surface Plasmon Resonance, SPR)就与其尺寸紧密相关。此外,作为新一代的抗菌剂,纳米银具有广谱抗菌特性,能有效抑制和杀死细菌、真菌、霉菌等微生物,这些特点也使得纳米银具有非常大的应用潜力。
3纳米银的功能和应用
相对于块状银,纳米银颗粒由于其比表面积高、催化活性高、表面活性强等优点而受到广泛的关注,并成功应用到光学、医疗和食品等领域[1,3]。作为发展最快的人工纳米产品之一,纳米银产品主要生产于美国、亚洲和欧洲地区[2]。据报道,在中国大陆生产的含有人工纳米材料的医疗器械产品中,接近60%的产品含有纳米银抗菌成分[4]。由于其广谱的抗菌活性,纳米银已被作为抗菌剂添加至多种商品中,包括:①抗菌织物(如抗菌纱布),作为外科手术纱布,可以治疗烧伤、烫伤等;②医疗器械(如手术刀),可增强器械的抗菌能力;③建材涂料,可有效杀灭建材表面细菌并抑制其生长;④导尿管、妇科栓剂、食品包装、净水处理、生活日用品等方面[5]。未来,随着纳米银产品的开发和市场需求的增加,纳米银产品的种类和数量都会日益扩大,相应的人体暴露风险也不断增加。
4纳米银进入生物体的主要途径和组织分布
随着纳米银的广泛使用,人体暴露的风险也不断增加,特别是经常接触含有纳米银医用品(如纳米银的喷剂、绷带、医疗器械等)的病人和医生,或长期使用含有纳米银工业品和生活品(如含纳米银的涂料、食品包装等)的人群,长期的接触可能会对人体健康产生潜在的威胁。根据暴露途径的不同,纳米银颗粒可通过呼吸道、消化道、皮肤及直接包埋等途径进入人体的循环系统,然后被特定的脏器(如肝脏和脾脏)吸收和积累,并最终通过代谢系统排出体外。根据已有的研究报道,纳米银进入生物体的能力与其颗粒大小及表面性质紧密相关,并最终影响其在生物体内的分布[6]。目前,已知纳米银主要分布和累积于生物体的肝脏、脾脏、肺、肾、脑等重要的器官(如图1)。
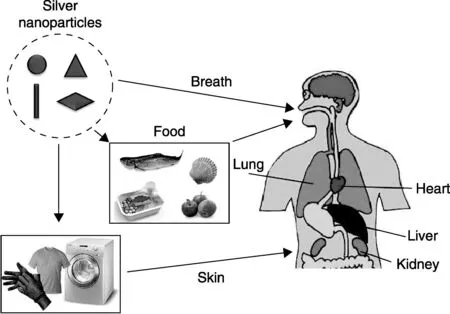
图1 纳米银的人体暴露途径和组织分布示意图Fig.1 The exposure routes and organ distribution of AgNPs
不同于金属离子,金属纳米颗粒在生物体内的代谢和排泄要困难的多,比如通过呼吸系统进入人体的纳米颗粒的半衰期可长达700天之久[7]。本研究组前期的研究也发现,通过腹腔注射和尾静脉注射的方式对实验动物BALB/c小鼠进行纳米银暴露,实验结果表明纳米银主要累积于小鼠的肝脏和脾脏,而且其在小鼠肝脏中停留的时间可超过4个月之久[8]。这意味着纳米银颗粒一旦进入生物体,就很难被清除。虽然目前还没有纳米银直接致病的报道,但大量基于动物和体外细胞的科学研究都证明了纳米银的生物毒性[1,6,9],如小鼠和大鼠分别暴露纳米银1天和28天后,其肝脏会吸收超过20%的纳米银[10-11],且高剂量的纳米银暴露(> 20 mg/kg)会导致其肝功能的损伤。因而,纳米银的长期暴露所引发的潜在健康风险依然不能被忽视。
5纳米银与生物分子的相互作用
在进入生物体后,纳米银颗粒会与多种生物分子(如蛋白、DNA和RNA等)发生直接或间接的相互作用,这种相互作用的强弱取决于纳米银颗粒的理化性质(如尺寸、形状、电荷、极性等)。此外,同原始的纳米银颗粒比较,与生物分子发生相互作用后的纳米银颗粒的理化性质和状态也会发生变化,并最终决定其在生物体内的行为。
5.1纳米银与蛋白的相互作用
当纳米银颗粒进入生物介质后(如血液),由于颗粒表面带有电荷或有机分子,生物介质中的蛋白就会吸附在其颗粒的表面,并形成一层“蛋白冠界面(Protein Corona)”(如图2),该层界面的形成是一个动态的过程[12]。伴随着纳米银颗粒所处环境的改变,由于蛋白亲和能力的不同,蛋白分子会在纳米银颗粒表面不断地被吸附和解离。这些被吸附的蛋白分子的生物功能也决定了纳米银颗粒与生物体发生相互作用的过程,如被细胞识别和吞噬的过程、引起机体的免疫反应、触发机体的应激反应等。Walkey等通过鉴定和比较不同纳米银表面蛋白冠界面的“指纹图谱(Fingerprint)”研究并预测了不同纳米银颗粒与细胞的相互作用,结果表明透明质酸连接蛋白(Hyaluronan-Binding Proteins)可能是介导纳米颗粒与细胞间相互作用的一类重要蛋白分子[13]。同时,多项研究也证明血清和胞内蛋白,如白蛋白(Albumin)[14]、肌动蛋白(Actin)[15]、泛素蛋白(Ubiquitin)[16]等都会与纳米银的表面发生直接的相互作用,并改变纳米银的生物学特性(Biological Identity)和行为。

图2 纳米银颗粒与蛋白直接相互作用的示意图Fig.2 Schematic diagram of the direct interaction between AgNPs and protein molecules
此外,由于纳米银颗粒会被氧化而释放出银离子(Ag+),其释放出的Ag+也会同蛋白等生物分子发生相互作用,如与蛋白分子中的目标基团(如巯基、羟基和磷酸基等)结合,形成“Ag-生物分子”复合物,进而破坏生物分子的生物功能和代谢过程。本研究组前期的研究发现,在细胞内,纳米银颗粒具有“特洛伊木马(Trojan Horse)”效应[17],进入细胞后能够进一步释放银离子,并产生细胞毒性。Xiu等通过实验证明,在无氧环境中,因为纳米银不会被氧化而释放Ag+,其对大肠杆菌几乎没有毒性,所以推测纳米银释放的银离子才是纳米银毒性的主要原因[18]。Loza等研究和比较了纳米银在不同生物介质中的银离子释放情况,同样发现处于还原或无氧条件下的纳米银更加稳定,释放出比较少的银离子而具有更低的细胞毒性[19]。
5.2纳米银与DNA的相互作用
纳米银暴露对生物体遗传物质(如DNA)的损伤也是其产生生物毒性并带来潜在健康风险的主要途径之一。根据报道,Hackenberg等发现纳米银颗粒可以进入人间充质干细胞的细胞核,并造成细胞DNA的损伤,产生遗传毒性[20]。Ahamed等研究和比较了具有不同表面化学性质的纳米银对小鼠胚胎干细胞和成纤维细胞的DNA损伤,发现损伤的程度与纳米银颗粒的表面性质有紧密的关系[21]。此外,动物实验也进一步的证实了纳米银的遗传毒性和对遗传物质的损伤[22-23]。Kowuru 等发现小鼠经口途径暴露PVP修饰的纳米银后,会造成发育过程中小鼠胚胎的DNA缺失、骨髓不可逆的染色体损伤、外周血和骨髓DNA双链的断裂和氧化损伤[23]。
研究证明,纳米银和银离子都会引起细胞的氧化应激,并造成胞内活性氧(ROS)水平的上升[24],而增加的ROS会破坏DNA分子。Hussain等报道纳米银暴露24h会导致大鼠肝细胞(BRL 3A)的氧化应激,细胞内的谷胱甘肽(GSH)水平明显降低,而ROS的水平明显上升[25]。Kim等发现纳米银暴露的人肝癌细胞(HepG2)中,由纳米银引起的DNA损伤可以被抗氧化物(N-乙酰半胱氨酸)阻止[26]。因而,细胞在暴露纳米银后,胞内ROS的含量增加,可能会破坏胞内的氧化还原平衡并导致细胞的凋亡。
然而,纳米银和DNA分子发生相互作用,并造成DNA损伤的具体分子机制还没有完全清楚。特别是,DNA损伤到底由纳米银颗粒本身,其释放的Ag+,还是二者共同作用造成的?除了对DNA双链的直接破坏,纳米颗粒暴露是否还可能对DNA的修饰(如DNA甲基化)产生影响,从而进一步影响生物正常的遗传和发育?除了DNA分子,纳米银是否还会和其它遗传物质(如RNA分子)发生相互作用,并破坏其结构和功能?这些问题都有待于进一步研究。
6纳米银进入细胞的途径与机制
纳米颗粒能否进入细胞以及在细胞内的分布是其发挥生物效应和毒性作用的基础[27]。研究表明,纳米银主要通过主动的内吞(Endocytosis)途径进入细胞,并且该过程与细胞类型密切相关。对于非吞噬性的真核细胞(如上皮细胞和神经细胞),纳米银可以通过包括:①网格蛋白(Clathrin)依赖的内吞作用;②小窝蛋白(Caveolin)依赖的内吞作用;③网格蛋白和小窝蛋白非依赖的内吞作用;④大胞饮作用(Pinocytosis)在内的多种途径转运入细胞内[28 - 30]。对于吞噬性的真核细胞(如巨噬细胞和单核细胞),吞噬作用(Phagorytosis)则是纳米银跨膜转运的主要机制[31-32]。这些不同的内化途径已通过特异性的抑制剂、显性失活突变体和基因敲除等多种手段证实。此外,纳米银的细胞摄取过程可以同时涉及多种内吞作用。例如,氯丙嗪(Chlorpromazine,一种网格蛋白抑制剂)和渥曼青霉素(Wortmannin,一种胞饮作用抑制剂)预处理人间叶干细胞后,纳米银的细胞摄入量明显减少,这表明网格蛋白依赖的内吞作用和大胞饮作用同时存在于纳米银的胞内转运过程[30]。再如,通过使用多聚肌苷酸(Polyinosinic Acid,清道夫受体结合抑制剂)、氯丙嗪、制霉菌素(Nystatin,一种小窝蛋白抑制剂)和细胞松弛素(Cytochalasin,一种肌动蛋白抑制剂)等多种抑制剂,证实纳米银颗粒会与细胞表面的清道夫受体发生相互作用,然后经过网格蛋白和肌动蛋白依赖的内吞作用被吞噬入小鼠巨噬细胞J774A.1的胞内[31]。进入细胞后,纳米银颗粒主要存在于内吞体中,后者可进一步与溶酶体融合。同时,内吞体和溶酶体中的纳米银颗粒可逃逸到细胞质中,并进入其它亚细胞器(如线粒体和细胞核)。
纳米颗粒的几何结构(如尺寸、形状和比表面积)、表面配体和配体密度都是影响其与膜蛋白发生相互作用,并进入细胞的关键因素[33]。这种相互作用除了依赖于纳米颗粒自身的理化性质,还取决于纳米颗粒表面所形成的生物界面(如蛋白冠界面)。纳米颗粒表面吸附的蛋白分子的结构和功能可以进一步影响纳米颗粒与膜受体、膜蛋白之间的相互作用[34-36]。研究表明,小尺寸纳米银(10 nm)比大尺寸纳米银(20 nm和40 nm)更易被细胞摄入[37]。相对于椭圆形和盘形的纳米银,球形纳米银更容易进入细胞[38-39]。此外,表面修饰也是影响纳米银颗粒进入细胞的重要因素,例如,支气管上皮细胞对无表面修饰的纳米银的摄入量达到10 pg Ag/cell,而对PVP和柠檬酸修饰的纳米银的摄入量则少于4 pg Ag/cell[40]。值得注意的是,纳米银在生物体内的物理转化(如团聚)和化学转化(如溶解)也会显著改变其细胞摄入和组织分布等相互作用过程[40-42]。
7纳米银的生物毒性机制
纳米银进入生物体和细胞后会引起一系列的生物效应。这些生物效应的强弱又与纳米银自身理化性质、暴露剂量和暴露时间紧密相关。纳米银不合适的形貌和表面修饰、过高的纳米银暴露剂量或过长的暴露时间都会诱发明显的生物毒性,如导致细胞形态异常,细胞生长速率下降,生理器官的病变和衰竭等[43-46]。例如, Carlson等发现,在相同的暴露剂量下(15 μg/mL),15 nm的纳米银能够使细胞活力降低85%以上,而55 nm的纳米银仅使细胞活力降低了约15%[47];Ahamed等发现,表面具有多糖修饰的纳米银所引发的 DNA 损伤和细胞凋亡要强于表面无修饰的纳米银[48]。
7.1氧化自由基(ROS)的生成
大量体外细胞实验的研究结果表明,ROS的产生和氧化应激是纳米银诱发生物毒性效应的主要机制[49]。由于纳米银颗粒具有“Trojan Horse” 效应[17],在进入细胞和生物体后,可以在胞内或体内释放Ag+,并导致ROS水平的上升和多种氧化应激反应,最终造成对细胞和组织的损伤。ROS的产生可能由纳米银的“颗粒效应”和“Ag+离子效应”共同作用而引起,其可能的机制:①纳米银颗粒进入线粒体,并诱发线粒体的机械性损伤,阻断电子在呼吸链上的传递,最终破坏线粒体的功能,导致细胞内的ROS增加[28];②Ag可以取代蛋白分子中的Fe2+离子,后者则可通过Fenton反应产生ROS[50-52];③Ag可以破坏胞内的氧化还原平衡,如与抗氧化剂谷胱甘肽(Glutathione)结合,降低胞内还原分子的水平,导致过量的ROS无法被清除[43-44],过多的ROS可以导致炎症反应和细胞死亡[53-54]。纳米银诱发产生高水平的ROS可以通过以下几种途径导致细胞死亡:①引发脂质过氧化,提高膜通透性;②激活线粒体相关的凋亡通路;③干扰细胞自噬过程;④氧化损伤DNA,阻滞细胞周期。
7.2触发凋亡、坏死和自噬过程
研究表明,纳米银暴露可以引发不同类型的细胞死亡过程(凋亡、坏死和自噬)[55-56]。纳米银诱发产生的ROS可以激活JNK(Jun-N Terminal Kinase)和p53蛋白,伴随前凋亡体Bax向线粒体的转运以及线粒体中细胞色素C(激活Caspase的活化剂)的释放,从而引发线粒体依赖的细胞凋亡[57]。随着暴露剂量的增加和暴露时间的延长,纳米银可进一步引发细胞坏死。除了线粒体,高水平的ROS还可以通过内质网(Endoplasmic Reticulum, ER)应激加速细胞凋亡[58]。自噬(Autophagy)是细胞的一种生存机制,可以清除衰老的蛋白分子和损伤的细胞器,同时,它也是细胞对氧化应激的一种生理反应[59-60]。最近的研究发现,纳米银处理细胞后诱发的高水平ROS可以干扰自噬体与溶酶体的融合,最终引发细胞凋亡或者自噬性细胞死亡[56]。此外,ROS和氧化应激还可引发DNA 损伤。ROS被认为是导致DNA自发性损伤的主要来源,例如,高反应活性的羟基自由基(OH·)可以导致DNA发生突变,形成 8-羟基腺嘌呤和 8-羟基鸟嘌呤结构,降低重复序列的稳定性,进而引起DNA发生单链和双链的断裂、链内和链间的交联[28,61]。DNA损伤将会引起细胞周期停滞,为DNA修饰提供时间。如果DNA损伤无法完全修复,细胞将会进入程序性死亡即凋亡过程。Eom和Choi等发现T细胞在暴露纳米银后,其诱发的ROS和氧化应激,会进一步活化p38丝裂原活化的蛋白激酶(MAPK),导致DNA链断裂,细胞周期停滞于G2/M期,细胞活力显著下降[62]。
8纳米银的环境健康风险与机制
在实际环境中,Ag在地表水体(主要是河流和湖泊)中的含量为0.2~2 μg/L,在土壤中的含量为200~300 μg/kg,在空气中的含量则低于1 × 10-6μg/L[63]。目前,虽然还没有关于实际环境中纳米银相关研究的报道,但是随着人类生产和生活过程中纳米银的释放,其带来的环境和健康风险也不能被忽视[64]。除了纳米银自身可能带来的风险,进入实际环境的纳米银还可以进一步发生,例如团聚、离子释放、与有毒污染物相互作用、结合天然有机物等环境转化过程,这些转化可能会改变纳米银的生物有效性,带来其它的潜在风险[65]。
8.1纳米银的非致死效应
在洗涤过程中,医疗用品(如纱布)和日用品(如袜子)中所含的纳米银,可能会脱落并释放到城市污水中,随着排放进入水环境或底部污泥,进而进入土壤[66-67]。由于纳米银具有抑菌特性[68-69],分散在环境中的纳米银可能会破坏水体和土壤中微生物群落(如细菌)的生态平衡。已有研究报道,纳米银会抑制污水处理系统中细菌(如硝化细菌)的生长,并干扰土壤中微生物群落的正常功能[67,70]。另一方面,纳米银的释放可能会进一步提高水体和土壤中细菌对Ag的耐受性[70-71]。Xiu等发现大肠杆菌(E.coli)暴露于不同尺寸和表面修饰的纳米银6 h后,相对于无纳米银处理的对照组,低剂量纳米银(2~7 μg/mL)暴露组的存活率增加了6%~21%,这说明非致死剂量的纳米银可以提高细菌的存活率和耐受性[72]。除了细菌,据报道,非致死剂量的纳米银暴露可以干扰鱼类胚胎的发育过程。Lee等发现,纳米银颗粒可以进入斑马鱼胚胎,并沉积于大脑、心脏、腮部和尾部,导致胚胎发育畸形和形态异常[41]。该项研究中所使用的纳米银暴露剂量(4~71 ng/L)与污染水体中的Ag含量类似[64],这也说明水体中如果发生纳米银污染,确实可能会对水生生物带来威胁。
纳米银进入动物体内所引发的健康危害已有报道。急性和高剂量暴露可以导致实验动物死亡[73-74],而慢性和低剂量纳米银暴露则会引起局部炎症反应并造成组织器官损伤。Wang等通过口咽滴入的方式对小鼠暴露低剂量的纳米银溶液后,观察到肺部炎症和轻度纤维化[75]。这项研究所使用的暴露剂量(0.1,0.5,1.0 mg/kg)是根据纳米银在其生产车间空气中的实际含量推算出来的,具有环境相关性[75-76]。本研究组的研究结果发现,对 BALB/C 小鼠暴露低剂量的纳米银(22 μg/kg和108 μg/kg)后,可以在胎儿体内,尤其是在胎肝中检测到银,且累积于胎儿体内的纳米银会导致胚胎发育迟缓。同时,纳米银暴露后,母体小鼠并没有发生饮食和运动异常、器官损伤及血液指标的变化[8]。
虽然纳米银在医疗卫生用品中已有应用,但目前鲜有关于纳米银中毒的报道。据研究报道,临床上纳米银的慢性中毒通常表现为皮肤变色,即银质沉着(Argyria),它既可以是局部性的,也可以是全身的[49]。此外,纳米银生产和应用过程中的长期低剂量的职业暴露也不能被忽视。在过去的研究中,低剂量纳米银的生物效应研究的比较少,但是低剂量暴露可以更客观地反映环境中可能的纳米银暴露的特征。因此,在未来的研究中,还需要更多地关注低剂量纳米银暴露的潜在环境与健康危害。
8.2纳米银非致死效应的分子机制
纳米银高剂量和低剂量暴露不仅引发的毒性效应不同,而且相应的分子机制也不完全相同。虽然二者引发的毒性作用均与纳米银的理化性质、生物体和细胞内的分布以及Ag+的毒性密切相关,但是,高剂量的纳米银暴露主要诱发ROS产生和氧化应激,导致细胞形态异常和细胞死亡;低剂量的纳米银暴露可以干扰细胞内生物分子的功能及其介导的信号转导,引发细胞功能障碍,参与更广泛的生物学过程,并且细胞中没有检测到大量的ROS,细胞活力没有显著下降[77]。因而,低剂量纳米银暴露条件下,其触发的生物效应和潜在机制也值得深入的研究和探索。
8.2.1影响细胞的能量平衡和代谢
线粒体是哺乳动物细胞产生能量并维持能量平衡的重要细胞器[78]。高剂量的纳米银干扰细胞内的氧化还原平衡,诱导产生ROS,进而提高线粒体膜的通透性,使呼吸链的氧化磷酸化接偶联,中断ATP的合成,导致DNA 损伤和细胞凋亡[79-80]。而低剂量的纳米银则可以抑制线粒体呼吸链复合体的活性,改变能量代谢相关基因的表达水平和蛋白水平,进而破坏细胞内的能量平衡[81-82]。本研究组的研究发现,低剂量的纳米银可以抑制过氧化物酶体增殖物激活受体γ辅助活化因子1α(PGC-1α,控制能量代谢的关键调节因子)以及丙酮酸脱氢酶(PDH,起始氧化磷酸化的关键酶)的浓度,引发细胞能量稳态从氧化磷酸化为主的有氧代谢转换到糖酵解为主的无氧代谢,导致能量代谢的重新编程(Energy Metabolism Reprogramming)[81]。
8.2.2促进细胞增殖相关基因的表达
虽然高剂量和低剂量的纳米银均可以改变细胞的基因表达谱,但前者常常提高与应激反应有关的基因的表达水平,降低与细胞周期相关的基因的表达水平;后者则更易于促进与细胞增殖有关的基因的表达[83-84]。Kawata等发现,当暴露剂量(1 μg/mL)对肝细胞的生存能力没有影响时,纳米银导致细胞内236个基因的表达水平上升,其中122个基因参与细胞增殖和细胞周期进程,包括M期,基于微管的细胞活动,DNA合成和胞内转运[84]。需要指出的是,在该实验条件下,细胞内没有明显检测到ROS的产生以及应激相关基因的表达。
8.2.3抑制细胞内RNA的转录
纳米颗粒不仅可以通过ROS引发DNA点突变和DNA链断裂,也可以通过损害细胞转录机器而干扰遗传信息的完整性[85]。本研究组的研究结果显示, 当细胞存活率为100%时,红细胞前体细胞在暴露低剂量纳米银(1~8 μg/mL)48 h后,细胞内mRNA,18S rRNA 和 28S rRNA 的转录水平均下降。通过体外结合实验和免疫共沉淀实验,证实纳米银可以原位结合RNA 聚合酶,抑制聚合酶介导的RNA转录效应,从而降低细胞内整体基因的表达水平,扰乱遗传信息传递的稳定性[17]。进一步的动物实验证明了纳米银可以抑制红细胞前体细胞内RNA的转录水平。E14.5天的胎肝中90%的细胞属于红系前体细胞,是研究红细胞生成的理想模型[86]。在BALB/c小鼠暴露22 μg/kg纳米银4周后,进行组内交配,并于E14.5天时取出胚胎,对胎肝细胞进行基因芯片分析,发现纳米银暴露后有301个基因的表达水平发生了改变,其中有264个基因的表达水平被抑制[17]。这些被抑制的基因大部分与造血和红细胞生成密切相关。纳米银对造血相关基因表达水平的抑制作用导致红细胞生成发生障碍,引发贫血和胚胎发育迟缓。
9结语
纳米银是目前全球产量和使用量最大的人工纳米材料之一。由于其优良的抑菌特性,纳米银应用范围很广,与人们的生活与医疗等密切相关。这种背景下,纳米银可经皮肤、呼吸系统、消化系统或破损处进入人体,对机体造成潜在的损伤。尽管目前没有关于纳米银直接造成人体健康危害的报道,但其潜在的健康风险已日益受到关注。
到目前为止,虽然已开展了一些研究并取得了一定的成果,仍存在诸多的问题,尚待深入探索:①用于定性定量检测以及原位表征生物介质中纳米银(纳米形态和变化后的赋存形态等)的技术手段还不完善;②纳米银与生物分子的相互作用(特别是蛋白分子)机制仍不清楚,同时对于这种相互作用如何影响其生物效应等需要深入探索;③纳米银在生物系统中的组织分布、传递及累积微观过程等尚不明确;④大多数研究仅考察原始态纳米银的生物效应,而对于机体的实际暴露形态(即在环境介质和生物介质中发生变化后的赋存状态)对其生物效应的影响尚不了解;⑤多数研究采用急性暴露方式,纳米材料的使用剂量较大,无法客观地反映实际日常生活或者医疗背景下纳米材料低剂量暴露的安全性特征,需要更多的研究关注低剂量暴露的潜在健康危害。围绕纳米银在生命体内的生物过程及影响,上述这些问题亟待展开深入研究。
参考文献References
[1]Chernousova S, Epple M.AngewChemIntEdEngl[J], 2013 (52):1 636-1 653.
[2]Wijnhoven S W P, Peijnenburg W J G M, Herberts C A,etal.Nanotoxicology[J], 2009 (2):109-138.
[3]Rai M, Yadav A, Gade A.BiotechnolAdv[J], 2009 (27):76-83.
[4]Shi X L, Wang Q B, Hu K,etal.InterfaceFocus[J], 2012 (2):387-392.
[5]Liu H, Wang H, Xi Z. J.EnvironHealth[J], 2009 (26):736-739.
[6]Reidy B, Haase A, Luch A,etal.Materials[J], 2013 (6):2 295-2 350.
[7]El-Ansary A, Al-Daihan S.JToxicol[J], 2009 (754810). DOI: 10.1155/2009/754810.
[8]Wang Z, Qu G, Su L,etal.CurrPharmDes[J], 2013 (19):6 691-6 697.
[9]Qu C, Liu W, Rong H,etal.JEnvironHealth[J], 2010 (27):842-845.
[10]Chrastina A, Schnitzer J E.IntJNanomedicine[J], 2010 (5):653-659.
[11]Van Der Zande M, Vandebriel R J, Van Doren E,etal.ACSNano[J], 2012 (6):7 427-7 442.
[12]Lynch I, Dawson K A.Nanotoday[J], 2008 (3):40-47.
[13]Walkey C D, Olsen J B, Song F,etal.ACSNano[J], 2014 (8):2 439-2 455.
[14]Ali M S, Al-Lohedan H A, Atta A M,etal.JMolLiq[J], 2015 (204):248-254.
[15]Wen Y, Geitner N K, Chen R,etal.RSCAdv[J], 2013 (3):22 002-22 007.
[16]Brahmkhatri V P, Chandra K, Dubey A,etal.Nanoscale[J], 2015 (7):12 921-12 931.
[17]Wang Z, Liu S, Ma J,etal.ACSNano[J], 2013 (7): 4 171-4 186.
[18]Xiu Z M, Zhang Q B, Puppala H L,etal.NanoLett[J], 2012 (12):4 271-4 275.
[19]Loza K, Sengstock D C, Ruiz-Gonzalez L,etal.JMaterChemB[J], 2014 (2):1 634-1 643.
[20]Hackenberg S, Scherzed A, Kessler M,etal.ToxicolLett[J], 2011 (201):27-33.
[21]Ahamed M, Karns M, Goodson M,etal.ToxicolApplPharmacol[J], 2008 (233):404-410.
[22]Gurabi M A A, Ali D, Alkahtani S,etal.OncoTargetsTher[J], 2015 (8):295-302.
[23]Kowuru P, Mancilla P E, Shirode A B,etal.Nanotoxicology[J], 2015 (9):162-171.
[24]Guo D, Zhao Y, Zhang Y,etal.JBiomedNanotechnol[J], 2014 (10):669-678.
[25]Hussain S M, Hess K L, Gearhart J M,etal.ToxicolInVitro[J], 2005 (19):975-983.
[26]Kim S, Choi J E, Choi J,etal.ToxicolInVitro[J], 2009 (23):1 076-1 084.
[27]Xia T, Kovochich M, Liong M,etal.ACSNano[J], 2008 (2):85-96.
[28]AshaRani P V, Low Kah Mun G, Hande M P,etal.ACSNano[J], 2009 (3):279-290.
[29]Asharani P V, Hande M P, Valiyaveettil S.BMCCellBiol[J], 2009 (10):65.
[30]Greulich C, Diendorf J, Simon T,etal.ActaBiomater[J], 2011 (7):347-354.
[31]Wang H, Wu L, Reinhard B M,etal.ACSNano[J], 2012 (6):7 122-7 132.
[32]Singh R P, Ramarao P.ToxicolLett[J], 2012 (213):249-259.
[33]Albanese A, Tang P S, Chan W C.AnnuRevBiomedEng[J], 2012 (14):1-16.
[34]Nel A E, Madler L, Velegol D,etal.NatureMaterials[J], 2009 (8):543-557.
[35]Saptarshi S R, Duschl A, Lopata A L,etal.JNanobiotechnology[J], 2013 (11):26.
[36]Brown D M, Dickson C, Duncan P,etal.Nanotechnology[J], 2010 (21):215 104.
[37]Liu W, Wu Y, Wang C,etal.Nanotoxicology[J], 2010 (4):319-330.
[38]Champion J A, Mitragotri S.ProcNatlAcadSciUSA. [J], 2006 (103):4 930-4 934.
[39]George S, Lin S J, Jo Z X,etal.ACSNano[J], 2012 (6):3 745-3 759.
[40]Gliga A R, Skoglund S, Wallinder I O,etal.PartFibreToxicol[J], 2014 (11):11.
[41]Lee K J, Nallathamby P D, Browning L M,etal.ACSNano[J], 2007 (1):133-143.
[42]Pratsinis A, Hervella P, Leroux J C,etal.Small[J], 2013 (9):2 576-2 584.
[43]Carlson C, Hussain S M, Schrand A M,etal.JPhysChemB[J], 2008 (112):13 608-13 619.
[44]Hussain S M, Hess K L, Gearhart J M,etal.ToxicolinVitro[J], 2005 (19):975-983.
[45]Braydich-Stolle L, Hussain S, Schlager J J,etal.ToxicolSci[J], 2005 (88):412-419.
[46]Zhu L, Guo D, Gu N.ChineseSciBull[J], 2014 (59):2 145-2 152.
[47]Carlson C, Hussain S M, Schrand A M,etal.JPhysChemB[J], 2008 (112):13 608-13 619.
[48]Ahamed M, Karns M, Goodson M,etal.ToxicolApplPharmacol[J], 2008 (233):404-410.
[49]Johnston H J, Hutchison G, Christensen F M,etal.CritRevToxicol[J], 2010 (40):328-346.
[50]He W, Zhou Y T, Wamer W G,etal.Biomaterials[J], 2012 (33):7 547-7 555.
[51]He D, Miller C J, Waite T D.JournalofCatalysis[J], 2014 (317):198-205.
[52]Gordon O, Vig Slenters T, Brunetto P S,etal.AntimicrobAgentsChemother[J], 2010 (54):4 208-4 218.
[53]Yang E J, Kim S, Kim J S,etal.Biomaterials[J], 2012 (33):6 858-6 867.
[54]Shi J, Sun X, Lin Y,etal.Biomaterials[J], 2014 (35):6 657-6 666.
[55]Volker C, Oetken M, Oehlmann J.RevEnvironContamToxicol[J], 2013 (223):81-106.
[56]Lee Y H, Cheng F Y, Chiu H W,etal.Biomaterials[J], 2014 (35): 4 706-4 715.
[57]Hsin Y H, Chena C F, Huang S,etal.ToxicologyLetters[J], 2008 (179):130-139.
[58]Zhang R, Piao M J, Kim K C.InternationalJournalofBiochemistry&CellBiology[J], 2012 (44):224-232.
[59]Ryter S W, Choi A M.CurrPharmDes[J], 2013 (19):2 747-2 756.
[60]Kiffin R, Christian C, Knecht E,etal.MolBiolCell[J], 2004 (15):4 829-4 840.
[61]Cadet J, Delatour T, Douki T,etal.MutatRes[J],1999 (424):9-21.
[62]Eom H J, Choi J.EnvironSciTechnol[J], 2010 (44):8 337-8 342.
[63]Statement ATSDR.ToxicologicalProfileforSilver. CAS#:7440-22-4 US. Public Health Service,1990.
[64]Luoma S N.ProjectonEmergingNanotechnologies,Woodrow Wilson International Center for Scholars,2008,1-66.
[65]Massarsky A, Trudeau V L, Moon T W .EnvironToxicolPharmacol[J], 2014 (38):861-873.
[66]Gottschalk F, Sonderer T, Scholz R W,etal.EnvironSciTechnol[J], 2009 (43):9 216-9 222.
[67]Colman B P, Arnaout C L, Anciaux S,etal.PLoSOne[J], 2013 (8):e57189.
[68]Morones J R, Elechiguerra J L, Camacho A,etal.Nanotechnology[J], 2005 (16):2 346-2 353.
[69]Li W R, Xie X B, Shi Q S,etal.ApplMicrobiolBiotechnol[J], 2010 (85):1 115-1 122.
[70]Faunce T, Watal A.Nanomedicine[J], 2010 (5):617-632.
[71]Seltenrich N.EnvironHealthPerspect[J], 2013 (121):A220-A225.
[72]Xiu Z M, Zhang Q B, Puppala H L,etal.NanoLett[J]., 2012 (12):4 271-4 275.
[73]Wijnhoven S W P, Peijnenburg W J G M, Herberts C A,etal.Nanotoxicology[J], 2009 (3):109-U178.
[74]Schmaehl D, Steinhoff D.ZKrebsforsch[J], 1960 (63):586-591.
[75]Wang X, Ji Z X, Chang C H,etal.Small[J]. 2014 (10):385-398.
[76]Lee J H, Ahn K, Kim S M,etal.JNanopartRes[J], 2012 (14):1 134.
[77]Wang Z, Xia T, Liu S.Nanoscale[J], 2015 (7):7 470-7 481.
[78]Friedman J R, Nunnari J.Nature[J], 2014 (505):335-343.
[79]Teodoro J S, Simoes A M, Duarte F V,etal.ToxicolinVitro[J], 2011 (25):664-670.
[80]Kim S, Choi J E, Choi J,etal.ToxicolinVitro[J], 2009 (23):1 076-1 084.
[81]Chen Y, Wang Z, Xu M,etal.ACSNano[J], 2014 (8):5 813-5 825.
[82]Costa C S, Ronconi J V, Daufenbach J F,etal.MolCellBiochem[J], 2010 (342):51-56.
[83]Foldbjerg R, Irving E S, Hayashi Y,etal.ToxicolSci[J],2012 (130):145-157.
[84]Kawata K, Osawa M, Okabe S.EnvironSciTechnol[J], 2009 (43):6 046-6 051.
[85]Singh N, Manshian B, Jenkins G J,etal.Biomaterials[J]. 2009 (30):3 891-3 914.
[86]Liu S, Bhattacharya S, Han A,etal.BrJHaematol[J], 2008 (143):129-137.
(编辑盖少飞)
大连化学物理研究所金催化剂研究取得新进展
近日,中国科学院大连化学物理研究所航天催化与新材料研究室在金催化剂研究方面取得新进展,首次发现了在高温氧化条件下的金与非金属氧化物之间的金属载体强相互作用(SMSI)效应,研究成果以通讯形式发表在JournaloftheAmericanChemicalSociety上。
20世纪70年代末80年代初,研究人员发现二氧化钛等可还原性载体负载的Pt族金属在高温(500 ℃)还原后会失去对小分子(CO,H2)的吸附性能,并将该现象命名为金属载体强相互作用(SMSI)。SMSI能够改变金属纳米粒子的形貌和电子性质,因此可以改变反应活性与选择性,对催化剂的催化性能具有重要影响。同时,SMSI通常伴随着载体对金属颗粒的包埋从而在很大程度上能够有效地稳定金属粒子,这有助于制备稳定型金属催化剂。
20世纪80年代末以来,由于其独特的催化性能,负载型金催化剂的研究受到了广泛而持续的关注。然而负载型金催化剂与载体是否能形成强相互作用,长期以来一直没有定论。近期台湾国立大学教授牟中原研究组首次发现氧化锌纳米棒负载Au纳米粒子可以在氧化条件下形成SMSI。大连化物所张涛和王军虎研究团队在多年羟基磷灰石(HAP)负载金属催化剂的研究基础上,首次发现Au与HAP能够形成典型的SMSI效应。该SMSI效应与经典的SMSI效应相比除发生条件相反(前者发生在氧化环境,后者发生在还原环境)外,其余特征均一致。Au/HAP之间的SMSI不仅能够有效提升金纳米粒子的高温抗烧结性能,并且能够提高催化剂在液相反应中的选择性和重复使用性能。进一步研究发现该SMSI体系可以扩展到金与其它磷酸盐体系,比如Au/LaPO4体系。该研究发现为设计和制备兼具高稳定性和选择性可调节的负载型金催化剂提供了新的研究思路和制备方法。
上述研究工作得到国家自然科学基金委的资助。
From http://www.cas.cn/syky/201601/t20160120_4521308.shtml
Research Progress on the Biological Process and Effect ofSilver Nanoparticles
XU Ming,WANG Zhe,LIU Sijin
(State Key Laboratory of Environmental Chemistry and Ecotoxicology, Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100085, China)
Abstract:With the increasing development of nanomaterials, silver nanoparticles (AgNPs) have become one of the most widely produced and used artificial nanomaterials in global markets. Due to their excellent antimicrobial activity, AgNPs have been applied in a wide spectrum of fields, including industry, medicine and consumer products. Therefore, it is necessary to comprehensively understand the potential risks of AgNPs to environment and human health. Thus far, studies focusing on the safety of AgNPs have described the biological process of AgNPs in bodies, AgNPs-mediated effects and according molecular mechanisms. In this review, we systematically recapitulated recent findings on biological effects of AgNPs, including:① general routes of AgNPs exposure to human bodies, as well as subsequent tissue distribution;② interactions with biological molecules of AgNPs in the body; ③cellular uptake and mechanisms responsible for AgNPs-induced lethal effects. Moreover, we emphasized findings on environmental and health risks of AgNPs and corresponding mechanisms by which AgNPs exerted sublehtal effects under low concentrations. Additionally, we have a further outlook on the future studying in this field of AgNPs’ adverse effects.
Key words:silver nanoparticles;biological process;lethal effects;sublethal effects;environment and health risks
中图分类号:R318.08
文献标识码:A
文章编号:1674-3962(2016)01-0028-08
DOI:10.7502/j.issn.1674-3962.2016.01.04
通讯作者:刘思金 ,男,1975年生,研究员,博士生导师,
基金项目:科技部973计划项目(2014CB932000); 中国科学院战略性先导科技专项(XDB14000000); 国家自然科学基金资助项目(21425731,21377159,21177151,21407169,21407172)
收稿日期:2015-08-01
第一作者:徐明,男,1983年生,副研究员
Email:sjliu@rcees.ac.cn
