三氧化二砷联合阿糖胞苷在MDS患者中的疗效探讨
2016-03-03刘卉
刘 卉
(西安医学院第一附属医院,西安 710000)
三氧化二砷联合阿糖胞苷在MDS患者中的疗效探讨
刘 卉
(西安医学院第一附属医院,西安 710000)
目的:探析三氧化二砷(As2O3)+阿糖胞苷(Ara-c)联合治疗在骨髓增生异常综合征(MDS)患者中的临床疗效及价值。方法:分析2014年5月~2016年4月在我院接受治疗的82例MDS患者的临床资料。随机将入选者分成观察组(As2O3+ Ara-c,40例)和对照组(HA方案,42例)两组。比较两组患者的基线资料、治疗效果、不良反应发生率以及治疗前后血管内皮生长因子(VEGF)水平的变化。结果:两组患者的基线资料无显著差异。观察组患者的总有效率(90.0%)明显高于对照组(71.4%)。治疗前两组患者的VEGF水平无显著差异,治疗后观察组患者的VEGF水平明显低于对照组;治疗后同组患者的VEGF水平较治疗前显著降低。两组患者的不良反应无显著差异。结论:As2O3+ Ara-c联合治疗可以有效提升MDS患者的三系血细胞,降低骨髓原始细胞的数量,同时不良反应发生率低,耐受性较高,值得临床推广和应用。
三氧化二砷;阿糖胞苷;骨髓增生异常综合征;血管内皮生长因子
临床上,骨髓增生异常综合征(MDS)的特征性生理病理改变主要是无效造血和克隆性造血干细胞及祖细胞的发育异常,其是获得性造血干细胞的一组恶性克隆性疾病。据报道,MDS的发病率呈逐年上升趋势,其中20%~40%可以进一步发展成急性白血病[1,2]。迄今为止,尚未寻找出有效的方法治愈MDS患者。本文旨在通过对MDS患者实施三氧化二砷(As2O3)+阿糖胞苷(Ara-c)的治疗方法,探析此种联合治疗的临床疗效及价值。
1 资料与方法
1.1 研究对象分析2014年5月~2016年4月在我院接受治疗的82例MDS患者的临床资料。入选标准:年龄18~77岁;入选者均符合第二届全国难治性白血病研讨会中“难治性白血病”的相关诊断标准,且接受2或3个治疗周期后未能达到缓解标准的患者;血清中钙离子检测值超过4.0mmol/L,镁离子浓度超过1.8mmol/L;血肌酐(SCr)浓度不超过1.5mmol/L,SGTP、SGOP及胆红素为正常值;用药治疗1月内未曾接受细胞生长因子及细胞毒药物治疗;心电图的检查结果显示,QT间期低于460ms。随机将入选者分成观察组(As2O3+ Ara-c,40例)和对照组(HA方案,42例)两组。观察组患者的免疫分型均是髓系表达或髓单系表达,其中染色体异常者13例(包括-7、+8等复杂异常情况);骨髓增生明显活跃11例,活跃者22例,低下者7例。对照组患者髓系表达或髓单系表达41例,另外1例为红系表达;骨髓增生明显活跃者8例,活跃者24例,低下者10例。
1.2 研究方法观察组:每12h皮下注射一次10~20mg/m2Ara-c,持续治疗2w,第3、4w休息,治疗1个疗程需要1个月的时间;第1、2w各连续使用As2O35d,10mg/d,停用2d;第3、4w休息,治疗1个疗程同样需要1个月的时间。
对照组:传统的小剂量高三尖杉脂碱(Har)和Ara-c(HA方案),静脉滴注2~3mgHar和100~150mg Ara-c,持续7d;外周血白细胞(WBC)低于4×109/L时,每天给予300 μg的G-CSF,直至WBC超过4×109/L时停用。
两组均接受一样的支持治疗,即血小板(PLT)低于30×109/L、血红蛋白(Hb)低于70g/L时,输注新鲜血液或血小板悬液;出现感染的患者则给予抗霉菌、抗细菌及抗病毒药物治疗;治疗期间需注意对患者肝肾功能的保护。治疗均需3个疗程。
疗效判定:临床出血症状及贫血症状消失;PLT达(80~100)×109/L、Hb达100g/L,WBC达4×109/L,且外周血分类中均无幼稚细胞;早幼稚细胞+原始细胞不超过5%,且可持续时间至少为6个月者为基本缓解(CR);临床出血、贫血症状消失;血象中PLT、Hb、WBC三系细胞一定程度上有所恢复,且外周血分类中早幼稚细胞+原始细胞不超过5%,骨髓象中早幼稚细胞+原始细胞较治疗前降低50%,且可持续时间至少为3个月者为部分缓解(PR);骨髓象显示输血次数与原始细胞均减少,但未能达到PR标准者为血液学改善(HI);充分治疗后仍未能达到上述标准的患者或者骨髓无任何改善、甚至恶化的患者为未缓解(NR)。总有效率=CR%+PR%+HI%。
1.3 统计学方法本研究中的数据均采用SPSS19.0软件进行分析。数据计量以均数±标准差形式表示,比较采用t检验和卡方检验。P<0.05为差异具有统计学意义。
2 结果
2.1 基线资料本研究共纳入82例研究对象,其中观察组40例,对照组42例。表1结果提示两组患者的基线资料(包括年龄、性别、难治性贫血伴原始细胞增多RAEB、转变中的难治性贫血伴原始细胞增多RAEB-t及国际预后积分系统IPSS等)无显著差异(P>0.05)。

表1 两组患者的基线资料比较
2.2 两组患者的临床疗效表2结果提示观察组患者的总有效率(90.0%)明显高于对照组(71.4%)(P<0.05)。
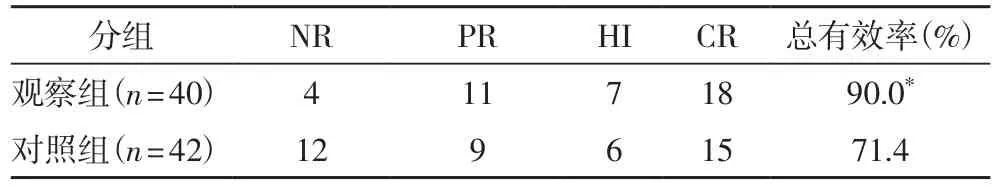
表2 两组患者的疗效比较
2.3 治疗前后两组患者的血清血管内皮生长因子(VEGF)水平的变化情况表3结果提示治疗前两组患者的VEGF水平无显著差异(P>0.05),治疗后观察组患者的VEGF水平明显低于对照组(P<0.01);治疗后同组患者的VEGF水平较治疗前显著降低(P<0.01)。

表3 两组患者治疗前后VEGF水平变化比较
2.4 两组患者的不良反应情况两组患者的耐受性均表现良好,均无由于出现不良反应而退出治疗的患者,同时也未出现与治疗相关性的死亡病例。表4结果提示两组患者的不良反应无显著差异(P>0.05)。
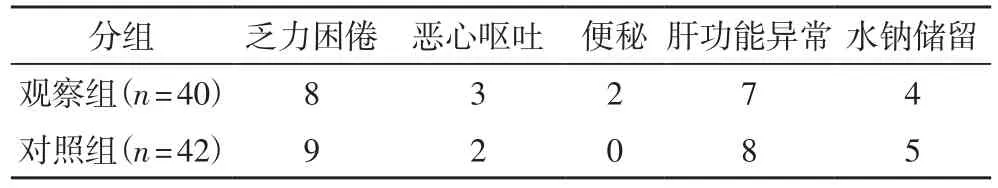
表4 两组患者的不良反应比较(例)
3 讨论
临床上,骨髓增生异常综合征(MDS)属于获得性造血干细胞恶性克隆性疾病,高危者会转化为急性白血病,此类患者大部分由于血细胞降低导致的并发症而死亡。MDS发病机制较为复杂。据报道,MDS早期阶段会出现正常克隆和异常克隆并存的情况,高增殖、高凋亡是其骨髓造血的主要表现,而晚期主要以异常克隆增殖为主,骨髓造血也以低凋亡与高增殖为主[3]。目前主要采用造血细胞生长因子+小剂量化疗+造血细胞生长因子的联合干预治疗、免疫抑制剂治疗、小剂量化疗及诱导分化治疗的方式治疗MDS患者,然而治疗效果却并不理想。最近,随着MDS病因学与分子遗传学的不断研究与发展,抗凋亡及骨髓移植疗法应运而生,然而临床上MDS患者大部分都存在不良核型改变的情况,而且病程较长及年龄偏大等因素会对MDS患者的长期生存情况产生不良的影响。
三氧化二砷(As2O3)通过诱导,可以促进和分化早期幼稚粒细胞发生细胞凋亡,其作用机制主要是谷胱甘肽中线粒体膜电位受损,可以较好地治疗急性早幼粒细胞白血病(APL)患者的复发[4]。据报道,As2O3一方面可以有效治疗新诊断急性白血病患者,另一方面还可以在一定程度上干预MDS[5]。此给联合用药临床干预MDS拓展了思路。阿糖胞苷(Ara-c)经由细胞膜上的核苷酶转运而进入细胞中,一部分经脱氧苷激酶(DCK)、DNA聚合酶及其它聚合酶作用合成了三磷酸腺苷(Ara-CTP),通过对DNA多聚酶的抑制来抑制DNA合成;另一部分可以被胞苷脱离氨酶(CCD)和脱氧胞苷脱离氨酶(DCC)分解失活[6,7]。本研究结果显示,观察组患者未缓解(NR)4粒,血液学改善(HI)7粒,部分缓解(PR)11粒,基本缓解(CR)18例,总有效率达90.0%,明显比对照组(71.4%)优秀,且差异显著。血管内皮生长因子(VEGF)是血管新生的一个重要细胞因子[8]。据报道,MDS新生血管的形成与白血病患者克隆刺激因子的分泌相伴随[9,10]。As2O3主要通过抑制血管生成来达到抗肿瘤的目的。本研究发现,As2O3+ Ara-c可以有效抑制VEGF的表达,治疗前两组患者的VEGF水平无显著差异,治疗后观察组患者的VEGF水平明显低于对照组;治疗后同组患者的VEGF水平较治疗前显著降低。本研究还发现,观察组和对照组的不良反应发生率无显著差异,提示As2O3+ Ara-c联合治疗可以有效提升MDS患者的三系血细胞,降低骨髓原始细胞的数量,有效改善HI,此外该方案耐受性较高,且不良反应发生率较低,是治疗MDS患者的有效治疗方式。
综上所述,As2O3+ Ara-c联合治疗MDS患者,不仅可以有效抑制VEGF的表达,而且治疗效果突出,不良反应发生率相对较低,值得临床推广应用。
[1] Roberts DA, Wadleigh M, McDonnell AM, et al. Low efficacy and high mortality associated with clofarabine treatment of relapsed/refractory acute myeloid leukemia and myelodysplastic syndromes[J]. Leuk Res, 2015, 39(2): 204-10.
[2] Wu L, Li X, Chang C, et al. Efficacy and toxicity of decitabine versus CHG regimen (low-dose cytarabine, homoharringtonine and granulocyte colonystimulating factor) in patients with higher risk myelodysplastic syndrome: a retrospective study[J]. Leuk Lymphoma, 2016, 57(6): 1367-74.
[3] El-Najjar I, Boumendil A, Luan JJ, et al. The impact of total body irradiation on the outcome of patients with follicular lymphoma treated with autologous stem-cell transplantation in the modern era: a retrospective study of the EBMT Lymphoma Working Party[J]. Ann Oncol, 2014, 25(11): 2224-9.
[4] 任翔, 刘飞, 全梅芳, 等.8-溴-7-甲氧基白杨素增强三氧化二砷对白血病U937细胞毒性[J]. 湖南师范大学学报(医学版), 2011, 08(4): 74-76, 83.
[5] Xu W, Wang Y, Tong H, et al. Downregulation of hTERT: an important As2O3 induced mechanism of apoptosis in myelodysplastic syndrome[J]. PLoS One, 2014, 9(11): e113199.
[6] Buckley SA, Othus M, Vainstein V, et al. Prediction of adverse events during intensive induction chemotherapy for acute myeloid leukemia or highgrade myelodysplastic syndromes[J]. Am J Hematol, 2014, 89(4): 423-8.
[7] Garcia-Manero G. Myelodysplastic syndromes: 2012 update on diagno-sis, risk-stratification, and management[J]. Am J Hematol, 2012, 87(7): 692-701.
[8] 朱德为, 刘庚勋, 李正贤. VEGF蛋白及mRNA在乳腺癌组织中的表达及意义[J]. 湖南师范大学学报(医学版), 2011, 08(4): 16-18, 53.
[9] Gupta P, Mulkey F, Hasserjian RP, et al. A phase II study of the oral VEGF receptor tyrosine kinase inhibitor vatalanib (PTK787/ZK222584) in myelodysplastic syndrome: Cancer and Leukemia Group B study 10105(Alliance)[J]. Invest New Drugs, 2013, 31(5): 1311-20.
[10] Gianelli U, Fracchiolla NS, Bucciarelli P, et al. High levels of vascular endothelial growth factor protein expression are associated with an increased risk of transfusion dependence in myelodysplastic syndromes[J]. Am J Clin Pathol, 2013, 139(3): 380-7.
The clinical value of As2O3+ Ara-c in treating the patients with MDS
Liu Hui
(The First Afficiated Hospital of Xi'an Medical Universty, Xi'an 710000, China)
ObjectiveOur retrospective study was aimed toanalyze the clinical effect and value of As2O3+ Ara-c in treating the patients with MDS.MethodsClinical data of 82 patients with MDSreceived treatment at our hospitalfrom May, 2014 to April, 2016 was retrospectivelyanalyzed. Patients included were divided into two groups at random, observe group (As2O3+ Ara-c, 40 cases) and control group (HA scheme, 42 cases). The general information, curative effect, the rate of side effect and the levels of VEGF before and after the treatment in two groups were compared.ResultsThe general information in two groups had no statistical difference. The total effective rate in observe group (90.0%) was obviously higher than that in control group (71.4%). Before the treatment, the levels of VEGF in two groups had no statistical difference. After the treatment, the level of VEGF in observe group was obviously lower than that in control group . The level of VEGF in the same group after treatment was obviously lower than that before treatment . The rate of side effectin two groups had no statistical difference .ConclusionThe As2O3+ Ara-c can increase the the number of three lines of blood cells of MDS patients, decrease the initial cell number of bone marrow. Meanwhile, the regimen had a high tolerance and lower rate of side effect. It’s worth promoting in clinical.
As2O3;Ara-c; myelodysplastic syndromes (MDS); vascular endothelial growth factor (VEGF)
R551.3
A
1673-016X(2016)06-0020-04
2016-08-16
刘卉,E-mail:86572077@qq.com
