骨的纤维结构不良克隆性分析
2016-03-03张惠箴蒋智铭
唐 娟,张惠箴,蒋智铭
(上海交通大学附属第六人民医院病理科,上海 200233)
骨的纤维结构不良克隆性分析
唐 娟,张惠箴,蒋智铭
(上海交通大学附属第六人民医院病理科,上海 200233)
目的:检测FD病变的克隆性起源,探讨其病变的性质。方法:采用基因组DNA抽提、PCR扩增及基因扫描的方法分析FD的克隆性。结果:在80例FD中,其中30例FD的HUMARA基因DNA扩增成功。基因扫描分析成功的10例FD中,2例FD为纯合子,5例FD为单克隆,3例FD为多克隆。结论:FD是一种单克隆性的病变。结合我们前期的实验研究(2例FD的GNAS1基因突变及1例FD恶变)提示FD是由于多种因素共同作用导致的骨发育成熟障碍的良性肿瘤性病变。
骨肿瘤;骨的纤维结构不良;克隆性;X染色体连锁雄激素受体基因
骨的纤维结构不良(FD)为临床中一种良性纤维性骨病,具有发病机制不明、病情进展缓慢以及非遗传性的特点,也被称作骨纤维异常增殖症。以往研究指出,FD属于一种非肿瘤性瘤样病变,近年来随着临床分子生物学的不断发展,人们对该疾病的认知有了更多的认识,对其发病本质、机制有了更多认知:(1)FD病变发生染色体克隆性畸变、异常[1,2];(2)FD病变发生GNAS1基因激活性突变[3,5];(3)FD中存在C-fos与c-myc原癌基因的过度表达[6,7]。本组研究主要对基于女性X染色体失活嵌合性雄激素受体基因位点的克隆性检测方法进行研究,分析80例女性患者FD的克隆性,以提供其肿瘤性增生的直接证据。
1 资料与方法
1.1 材料收集上海交通大学附属第六人民医院病理科2002年1月~2008年1月存档中女性FD石蜡组织80例,选取10例骨肉瘤和10例骨折后骨痂作为对照组。
1.2 方法石蜡组织切片经8 μm厚连续切片后,按QIAGEN 公司DNA 提取试剂盒说明书进行基因组DNA抽提。HpaII内切酶酶切提取的基因组DNA后,进行2次PCR扩增,HUMARA第一外显子的阅读框架内 CAG重复序列约100bp的上游位置的甲基化位点上游与短串联重复序列下游设计出上下游两对引物,其中,外侧上游引物序列如下:5'-GCT GTG AAG GTT GCT GTT CCT CAT-3';外侧下游引物序列如下:5'-CGT CCA AGA CCT ACC GAG GAG CTT-3',内侧上游引物:5'-TCC AGA ATC TGT TCC AGA GCG TGC-3',内侧下游游引物:5'-ATG GGC TTG GGG AGA ACC ATC CTC-3';在内侧上游引物5'末端应用上海生工生物技术公司合成的6-羧基荧光素进行标记。PCR反应条件详细如下:第一次反应条件:首先在95℃环境下预变性10min;然后在95℃环境下预变性45s,在63℃环境下退火60s,在72℃环境下延伸1min,共循环25次;其次在72℃环境下延伸10min,并放置于4℃状态保存。第二次反应条件:首先在95℃环境下预变性10min;然后在95℃环境下预变性45s,在63℃环境下退火60s,在72℃环境下延伸1min,共循环28次;其次在2℃环境下延伸10min,于4℃状态保存。第一次PCR使用外侧上、下游引物,第二次PCR使用内侧上、下游引物。第二次PCR反应体系中的模板是第一次PCR反应的反应产物。反应结束后,吸取PCR扩增产物于2%琼脂糖凝胶中电泳,检测扩增片断。将电泳后未纯化的PCR产物(250~300bp的条带)用无菌去离子水稀释,稀释比例为1∶20,使用DNA分析仪对PCR产物进行基因扫描。判定克隆性分析结果:(低分子量等位基因峰的面积/ 高分子量等位基因峰的面积)HpaII酶切前/(低分子量等位基因峰的面积/ 高分子量等位基因峰的面积)HpaII酶切后。认为肿瘤为单克隆性时,其比值>4或者<0.25。该肿瘤为单克隆性。
2 结果
2.1 临床资料80例女性随访未发生恶变的FD患者年龄7~74岁,平均年龄28岁。71例为单骨性FD,9例为多骨性FD。其中8例发生病理性骨折,9例合并动脉瘤样骨囊肿,1例为MAS即多骨性FD伴内分泌失调(图1A-F)。1例为60岁女性的Mazabraud综合症,大腿见一肿块,入院术前作影像学检查时偶尔发现同侧股骨上段髓内病变。

图1 A-F 多骨型FD。A-E:双侧骨盆、胫骨、股骨和头颅骨平片,显示髓腔内毛玻璃样、均质改变。F:镜下为梭形细胞及字母状不规则编织骨组织(HE染色,中倍放大)。
2.2 基因扫描结果80例FD基因组DNA,其中30例经PCR扩增雄激素受体基因成功,产生200~250bp的片断。基因组DNA经HapII酶切作用后,PCR扩增雄激素受体基因后进行电泳(用2% 琼脂糖凝胶),1~6号条带是HapII酶切前PCR产物电泳图,7~12条带是HapII酶切后PCR产物电泳图,HapII酶切后条带的紫外吸光度值比酶切前有所降低(图3)。30例扩增成功的PCR产物,经DNA分析仪得出结果:5例FD显示为单克隆性肿瘤,3例FD为多克隆性,2例FD为纯合子(表2)。其余20例FD中3例由于峰值太低,不能分出主、次峰,17例峰值太高,因此均不能用于判定肿瘤的克隆性。
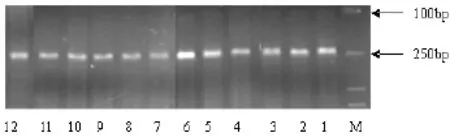
图3 PCR产物以及Marker的电泳图。1-6条带为HapII酶切前的PCR产物,7-12条带为HapII酶切后的PCR产物
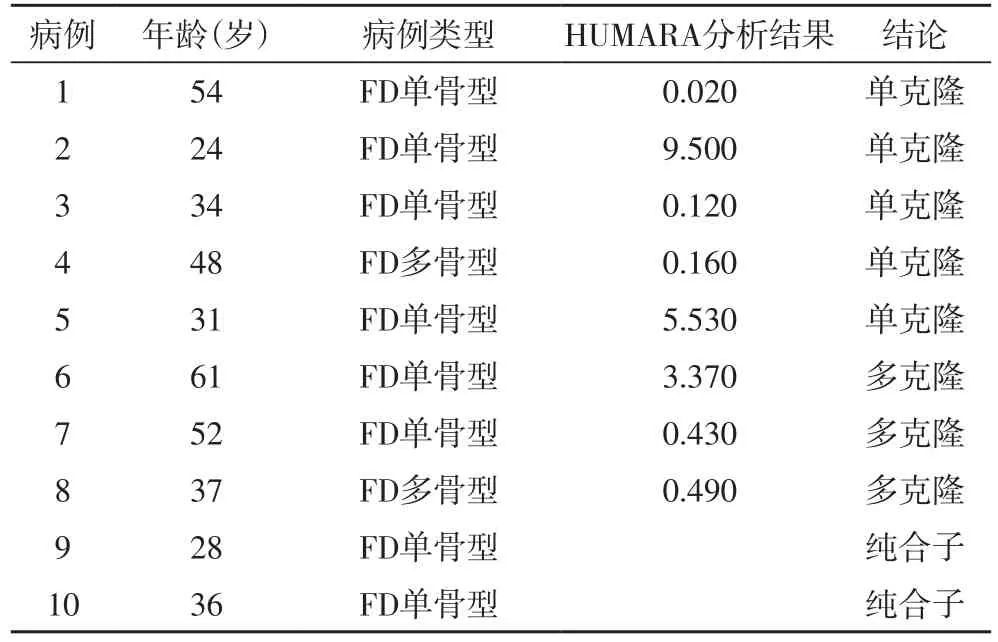
表2 FD克隆性分析的结果
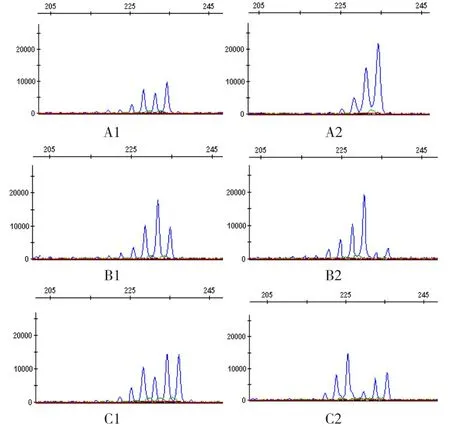
图4 A-C图A正常人血标本基因分析扫描结果:A1为正常人血标本内切酶(HpaII酶)酶切前,A2为正常人血标本内切酶(HpaII酶)酶切后,基因分析结果为3.330,属多克隆性。图B病例1基因分析扫描结果:B1为内切酶(HpaII酶)酶切前,B2为内切酶(HpaII酶)酶切后,基因分析结果为0.020,属单克隆性。图C病例6基因扫描:图C1为内切酶(HpaII酶)酶切前,图C2为内切酶(HpaII酶)酶切后,基因分析结果为3.370,为多克隆性。
3 讨论
3.1 临床中根据FD患者的临床特征将其分成两种类型
分别为单骨型和多骨型,其中单骨型为其中比较常见的类型,多骨型具有病变范围广的特点,对患者功能产生严重影响。国外文献报道单骨型FD占85%,多骨型FD占15%[5],好发于年轻人,平均确诊年龄为30岁[8],女性略多。通过对FD疾病发病机制进行分析研究发现,其生物学行为主要受到骨类型因素的影响,单骨型FD会随着骨骼的不断生长,病灶比例逐渐增大,直到骨骼停止发育,病变会逐渐静止;多骨型FD病灶会随着患者年龄的不断增长,病灶逐渐扩大,且合并MAS或MS的发病率较高。一般情况下,FD恶变率较低,骨肉瘤变是最常见的恶变组织学类型。Hoshi等[9]研究128例FD有4例发生恶变。Ruggieri等[10]统计1122例FD,其中28例发生肉瘤变。FD一般预后良好,少数病例术后有复发,但再次手术仍然有效,一般不考虑放疗,以免诱发肉瘤变。
通常采取手术疗法可有效矫正畸形,并预防病理性骨折,且还可将有临床症状的病灶彻底根除。但如行自体松质骨移植术或者病灶刮除术治疗时,由于自体松质骨在术后骨骼重建过程中易被发育不良结构的骨组织取代。
3.2 对FD克隆性分析反应性增生与肿瘤性增生进行准确鉴别一直给人们带来困扰。近年来,克隆性分析技术可较好解决该类难题,由于肿瘤具备的最显著特征为其均来自单克隆性细胞群体[11-13],即为同一个病变细胞,但正常、反应性增生组织具有多克隆性的特点。本次研究,通过对女性体细胞构成组织X染体失活嵌合性的分析结果进行显示,结果显示,可将病变克隆性准确显示出来,帮助鉴别病变是反应性或肿瘤性增生。Koizumi 和Mikami等[5]研究11例FD发现其中8例FD是单克隆性,2例FD为纯合子,1例扩增失败。张伟和巩丽[4]等研究21例FD发现其中19例是单克隆,其余2例是纯合子,实验结果未发现多克隆性FD。我们10例基因分析成功的FD中,5例FD是单克隆性,3例FD是多克隆性,其余2例FD为纯合子。以下分析3例多克隆性FD可能存在的原因:因FD是一种良性纤维骨性病变,治疗以病变刮除为主。本研究中病例均为病变刮除标本,在提取石蜡包埋标本中的基因组DNA时均未使用显微切割技术选取病变组织。重新回阅此3例多克隆性FD的HE切片发现:其中1例FD病变中含有骨折后骨痂成分,另外2例病变周边有部分横纹肌及脂肪组织的成分。因此我们推测这3例FD抽提的基因组DNA中混杂有周边正常的横纹肌及脂肪组织或反应骨痂组织而影响了结果的分析,导致基因分析出现假多克隆。本实验30例扩增成功标本中,只有10例进行基因扫描分析后出现HpaII酶切前及酶切后的扫描图,3例发现峰值过于低,不能分辨出主峰和次峰,17例峰值过于高,不能进行克隆性的分析。基因扫描中峰值过于低或者过于高的原因可能是:提取石蜡标本中的基因组DNA时,每例病变标本的编制骨组织与梭形细胞两者比例不同。编织骨组织较多而梭形细胞的量较少时,提取出的基因组DNA的浓度就偏低,反之则浓度偏高。我们进行基因扫描分析时均用无菌去离子水以1:20比例稀释,因而出现峰过于低或者过于高的情况而无法分析。本研究中有50例FD病变扩增失败,可能出现的原因可如下:第一,对骨组织病变取材时,根据病变骨的硬度,用强酸对病变骨进行脱钙的时间长短不一。由于DNA在酸性环境中不稳定,易导致病变的DNA出现变性、断裂和降解等情况,因此使用酸性脱钙液对病变骨组织的处理时间长短影响各个病例中DNA的降解程度。第二,脱钙液中福尔马林及甲酸均可影响DNA质量。Koshiba[14]等发现病理标本在福尔马林固定过程中的DNA降解是由于固定温度高、PH值低和甲酸的存在引起。在标本固定液中加盐或者适量降低温度可稳定氢键,可以防止DNA在酸性条件下变性。然而,即便加入氢氧化钠中和福尔马林,在室温下标本DNA仍然发生降解,提示福尔马林固定液本身会降解标本DNA。福尔马林降解DNA的机制及其预防措施有待深入研究。第三,病理标本的浸蜡时间过长和包埋温度过高,均可导致标本DNA变性产生单链的DNA片段。Pollandt[1]和Lumbroso[2]均检测到FD中GNAS1基因的突变,及我们前期研究的35例FD中检测到2例GNAS1基因的突变;Dal Cin和Sciot等[15]报道的11例FD中8例有克隆性染色体的变异;目前国内外均有研究证实在FD中存在原癌基因c-fos,c-myc的过度表达[17,18];Mikami和Koizumi[11]等研究11例FD发现其中8例为单克隆性,我们实验研究中检测到5例FD为单克隆性;以及FD偶可发生恶变,单骨型FD的恶变率约为0.5%,麦-奥综合症(MAS)中恶变率约4%[16,17],我们的前期实验研究中也发现1例FD发生肉瘤变。结合文献报道以及我们的实验研究结果,提示FD是一种良性肿瘤性的病变。
[1] Bieniasz J, Maj A, Noczynska A. Fibrous dysplasia of bone in a 12-year old girl[J]. Endokrynol Diabetol Chor Przemiany Materii Wieku Rozw, 2006, 12(1): 69-72.
[2] Lumbroso S, Paris F, Sultan C. Activating Gsα Mutations: Analysis of 113 Patients with Signs of McCune-Albright Syndrome—A European Collaborative Study[J]. Clin Endocrinol Metab, 2004, 89(5): 2107-2113.
[3] Dal Cin P, Sciot R, Brys P, et al. Recurrent chromosome aberrations in fibrous dysplasia of the bone: a report of the CHAMP study group. Chromosomes and morphology[J]. Cancer Genet Cytogenet, 2000, 122: 30-32.
[4] 巩丽, 张伟, 李艳红, 等. 利用女性X染色体失活嵌合性的磷酸甘油酸激酶及雄激素受体位点多态性检测骨纤维结构不良的克隆性[J]. 中华病理学杂志, 2007, 36: 592-595.
[5] Mikami M, Koizumi H, Ishii M, et al. The identification of monoclonality in fibrous dysplasis by methylation-specific polymerase chain reaction for the human androgen receptor gene[J]. Virchows Archiv, 2004, 444(1): 56-60.
[6] Candeliere GA, Glorieux FH, Prud’homme J, et al. Increased expression of the c-fos proto-oncogene in bone from patients with fibrous dysplasia[J]. N Engl J Med, 1995, 332: 1546-1551.
[7] 喻爱喜, 陈振光, 鲁德银, 等, 骨纤维结构不良中癌基因蛋白的表达及意义[J]. 中华实验外科学杂志, 1999, 16(2): 136-137.
[8] Matthew R, DiCaprio, William F. Enneking. Fibrous Dysplasia. Pathophysiology, Evaluation, and Treatment[J]. Bone Joint Surg. Am. , 2005, 87: 1848-1864.
[9] Hoshi M, Matsumoto S, Manabe J, et al. Malignant change secondary to fibrous dysplasia[J]. Int J Clin Oncol, 2006, 11: 229-235.
[10] Ruggieri P, Sim FH, Bond JR, et al. Malignancies in fibrous dysplasia [J]. Cancer, 1994, 73: 1411-1424.
[11] Mikami M, Koizumi H, Ishii M, et al. The identification of monoclonality in fibrous dysplasis by methylation-specific polymerase chain reaction for the human androgen receptor gene[J]. Virchows Archiv, 2004, 444(1): 56-60.
[12] Shroyer KR, Gudlaugsson EG. Analysis of clonality in archival tissves by polymerase chain reaction amplification of PGK1[J]. Hum Pathol, 1994, 25: 287-292.
[13] Willman CL, Busque L, Griffith BB, et al. Langerhans cell histiocytosis (histiocytosis X)-a clonal proliferative disease[J]. N Engl J Med, 1994, 331: 154-160.
[14] Koshiba M, Ogawa K, Hamazaki S, et al. The effect of formalin fixation on DNA and the extraction of high molecular weight DNA from fixed and embedded tissues[J]. Pathology Research and Practice, 1993, 189: 66-72.
[15] Dal Cin P, Sciot R, Brys P, et al. Recurrent chromosome aberrations in fibrous dysplasia of the bone: a report of the CHAMP study group. Chromosomes and morphology[J]. Cancer Genet Cytogenet, 2000, 122: 30-32.
[16] Albright F, Butter A M, Hampton A D. Syndrome characterized by osteitis fibrous disseminate, area of pigmentation and endocrine dysfunction, with precocious puberty in females: report of five case[J]. N Eng J Med, 1937, 216: 726-46.
[17] Schwartz D T, Alpert M. The malignant transformation of fibrous dysplasia[J]. Am J Med Sci, 1964, 247: 1-20.
Clone origins of fibrous dysplasia
Tang Juan, Zhang Hui-zhen, Jiang Zhi-ming
(Department of Pathology, The Sixth People's Hospital, Shanghai Jiao Tong University, Shanghai 200233, China)
bone tumor; fibrous dysplasia of bone; clonality; X-inactivation HUMARA
R738.1
A
1673-016X(2016)06-0010-04
2016-10-15
上海市卫生局科技发展基金资助项目(No.034042)
张惠箴,E-mail:liuyuanblzg@aliyun.com
[Abctract]ObjectiveTo investigate clonal origins of fibrous dysplasia.MethodsGenomic DNA extraction, PCR amplification and gene scanning were used to to investigate clonal origins of fibrous dysplasia.ResultsPCR amplification was successful in 30 of 80 FD cases. Gene sanning succssfull In 10 cases of FD, 2 cases were homozygote, 5 cases monoclonal, the other 3 cases were polyclonal.ConclusionFibrous dysplasia is a clona1, neoplastic process. Combined with our protophase experiment(two case of FD GNAS1 gene mutation and one case of FD with malignancy), prompted FD could be neoplasia disease which was caused by multiple factors leading to a failure of bone development disease.
