柔嫩艾美耳球虫2个抗药株的抗药性评估
2016-03-03谢雨翔韩红玉赵其平王自文徐帅兵朱顺海崔晓霞杨志远
谢雨翔,韩红玉,赵其平,王自文,董 辉,徐帅兵,朱顺海,崔晓霞,唐 敏,2,杨志远,2,黄 兵,3
(1. 中国农业科学院上海兽医研究所 农业部动物寄生虫学重点开放实验室,上海 200241;2. 上海师范大学生命与环境科学学院,上海 200234;3. 江苏省动物重要疫病与人兽共患病防控协同创新中心,扬州 225009)
·研究论文·
柔嫩艾美耳球虫2个抗药株的抗药性评估
谢雨翔1,韩红玉1,赵其平1,王自文1,董 辉1,徐帅兵1,朱顺海1,崔晓霞1,唐 敏1,2,杨志远1,2,黄 兵1,3
(1. 中国农业科学院上海兽医研究所 农业部动物寄生虫学重点开放实验室,上海 200241;2. 上海师范大学生命与环境科学学院,上海 200234;3. 江苏省动物重要疫病与人兽共患病防控协同创新中心,扬州 225009)
为检测实验室长期保存的柔嫩艾美耳球虫马杜拉霉素抗药株和地克珠利抗药株的遗传稳定性,采用鸡体试验法,以抗球虫指数、最适抗球虫活性百分率、病变记分减少率和相对卵囊产量4项指标,评价2个抗药株对地克珠利、癸氧喹酯、马杜拉霉素等3种抗球虫药物的抗药性,并以柔嫩艾美耳球虫敏感株为对照。结果显示,柔嫩艾美耳球虫敏感株对3种抗球虫药物均无抗药性,4项指标全部阴性。柔嫩艾美耳球虫马杜拉霉素抗药株对马杜拉霉素为完全耐药,4项指标全部阳性;对地克珠利、癸氧喹酯则表现为无抗药性,4项指标全部阴性。柔嫩艾美耳球虫地克珠利抗药株对地克珠利表现为完全耐药,4项指标全部阳性;对马杜拉霉素表现为中度耐药,2项指标阳性;对癸氧喹酯则表现为无抗药性,4项指标全部阴性。结果表明,在实验室已繁殖保存10余年的柔嫩艾美耳球虫2个抗药虫株对其诱导药物具有明显抗药性,实验室保种繁殖方法可行,虫株遗传稳定性良好,为利用该虫株进行球虫抗药性机制等相关研究奠定了基础。
柔嫩艾美耳球虫;地克珠利;马杜拉霉素;耐药性
鸡球虫病是由艾美耳属(Eimeria)球虫寄生引起的一种细胞内寄生性原虫病,严重危害鸡的生长发育,其发病率为20%~30%,死亡率为50%~70%,严重时可高达80%。Bhogal等[1]报道,全世界每年因鸡球虫病造成的损失达20亿美元。虽然球虫疫苗在球虫病防治中的使用量逐渐增加,但抗球虫药依然是球虫病防治的主要手段,全世界抗球虫药的年消费约3.2亿美元。在抗球虫药中,醚类离子载体抗生素类抗球虫药和化学合成类抗球虫药物的使用依然处于优势地位[2]。药物的长期使用,导致耐药性的产生似乎不可避免[3]。早在1954年,Waletzky等[4]就从野外分离出了几株对包括磺胺类在内的数种药物有抗药性的虫株,之后人们陆续从野外分离获得了许多对抗球虫药物具有抗药性的虫株[5-10]。
随着球虫抗药性的广泛产生,对球虫病的防治难度逐渐加大。为了有效控制鸡球虫病,各国学者对抗球虫药物和球虫抗药性进行了广泛的研究[11]。2004年,本实验室韩红玉等[12]成功诱导获得了柔嫩艾美耳球虫马杜拉霉素抗药株和地克珠利抗药株。至今该抗药虫株已在实验室繁殖保存10余年,为确定该虫株的遗传稳定性,本研究对实验室保存的2个抗药株进行了检测。
1 材料与方法
1.1 实验动物 艾拔益加肉鸡购自上海奉贤区某种鸡场,出壳当日运回上海兽医研究所实验动物房隔离饲养至11日龄。试验前进行粪检,确定无球虫感染后,方进行试验。
1.2 饲料 根据AA肉鸡营养标准自配,主要成份为玉米、小麦、豆粕等。
1.3 药物 0.5%地克珠利为广东容大生物工程有限公司生产,使用有效剂量:1 mg/kg,生产批号:201506001;6%癸氧喹酯预混剂为广东科润生物制药有限公司生产,使用有效剂量:30 mg/kg,生产批号:201505002;1%马杜拉霉素为广东容大生物工程有限公司生产,使用有效剂量:5 mg/kg,生产批号:201503002。3种药物均按其有效剂量分级拌入,饲料充分拌匀,备用。
1.4 球虫来源 柔嫩艾美耳球虫敏感株(资源编号:CAAS21111601)、柔嫩艾美耳球虫马杜拉霉素抗药株(资源编号:CAAS21111608)、柔嫩艾美耳球虫地克珠利抗药株(资源编号:CAAS21111609),均由中国农业科学院上海兽医研究所原虫病创新团队分离/诱导保存。
1.5 试验分组 试验设13个组,即柔嫩艾美耳球虫敏感株、柔嫩艾美耳球虫马杜拉霉素抗药株、柔嫩艾美耳球虫地克珠利抗药株分别饲喂3种药物(地克珠利、癸氧喹酯、马杜拉霉素)共9个组,3个虫株的感染不用药组和1个不感染不用药组,每组16只鸡,分为2笼,共计26笼208只鸡。
1.6 试验步骤 在肉鸡11日龄时进行单只称重,选体重相近的鸡随机分组,其体重范围为150~210 g,平均体重为(180.81±20.45)g。分组后9个用药组即开始饲喂拌药饲料,至试验结束。13日龄,除不感染不用药组外,其余12组:4组口服感染地克珠利耐药株,4组口服感染马杜拉霉素耐药株,4组感染敏感株,每只鸡感染孢子化卵囊量均为8.0×104个。感染后5~6 d,每天查血便并记录各组鸡的死亡情况。感染后6~7 d,每天称粪重,采粪便,计每克粪便卵囊数(oocycsts of pergram,OPG)。感染后7 d,全部称重剖杀,进行肠道病变计分,结束试验。
1.7 抗药性判定方法及标准 参照黄兵等[13]介绍的方法,以抗球虫指数(anticoccidial index, ACI)、病变计分减少率(reduction of lesion scores, RLS)、相对卵囊产量(relative oocysts production, ROP)、最适抗球虫活性百分率(percent of optimum anticoccidialactivity, POAA) 4项指标综合判定不同虫株对药物的抗药程度,每项指标用阴性(-)表示无抗药性,用阳性(+)表示有抗药性。ACI ≥ 160为阴性,ACI<160为阳性;RLS ≥ 50%为阴性,RLS<50%为阳性;ROP ≥15%为阳性,ROP<15%为阴性;POAA>50 %为阴性,POAA ≤ 50 %为阳性。4项指标中,全部为阴性判定为无抗药性,1项为阳性判定为轻度抗药,2项为阳性判定为中度抗药,3~4项为阳性判定为完全抗药。各项指标计算公式如下:
ACI =(相对增重率+存活率)-(病变值+卵囊值)
RLS =(感染不用药组平均病变计分-感染用药组平均病变计分)/(感染不用药组平均病变计分)×100%
ROP = 感染用药组平均卵囊百万数 / 感染不用药组平均卵囊百万数 × 100%
POAA =(感染用药组GSR-感染不用药组GSR)/(不感染不用药组GSR-感染不用药组GSR)×100 %,其中:GSR = 笼末重 / 笼初重。
2 结果
2.1 马杜拉霉素抗药株的测定结果 马杜拉霉素抗药株抗药性测定结果见表1。综合测定结果为该球虫株对地克珠利和癸氧喹酯4项判定指标均表现为阴性,即说明未产生抗药性,而对马杜拉霉素的指标达到完全抗药。
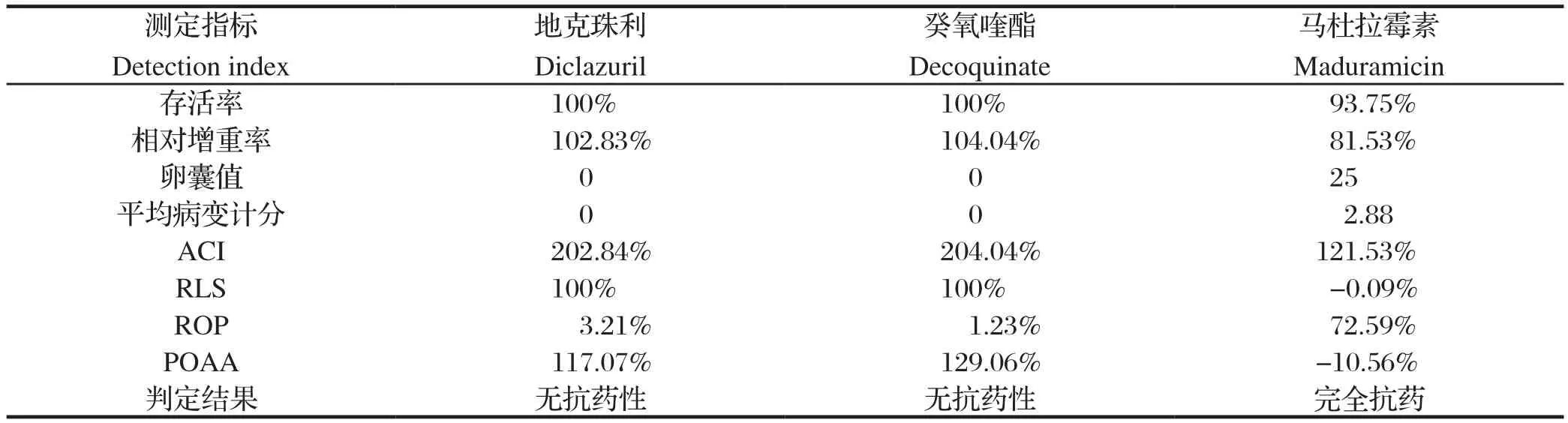
表1 马杜拉霉素抗药株抗药性测定结果Table 1 Drug resistance test results of maduramicin resistant strain of E. tenella
2.2 地克珠利抗药株的测定结果 地克珠利抗药株抗药性测定结果见表2。地克珠利4项指标全部达到抗药程度,表现为完全抗药;癸氧喹酯的4项指标均达到无抗药性标准;马杜拉霉素ROP和POAA两项指标达到抗药程度,表现为中度抗药。
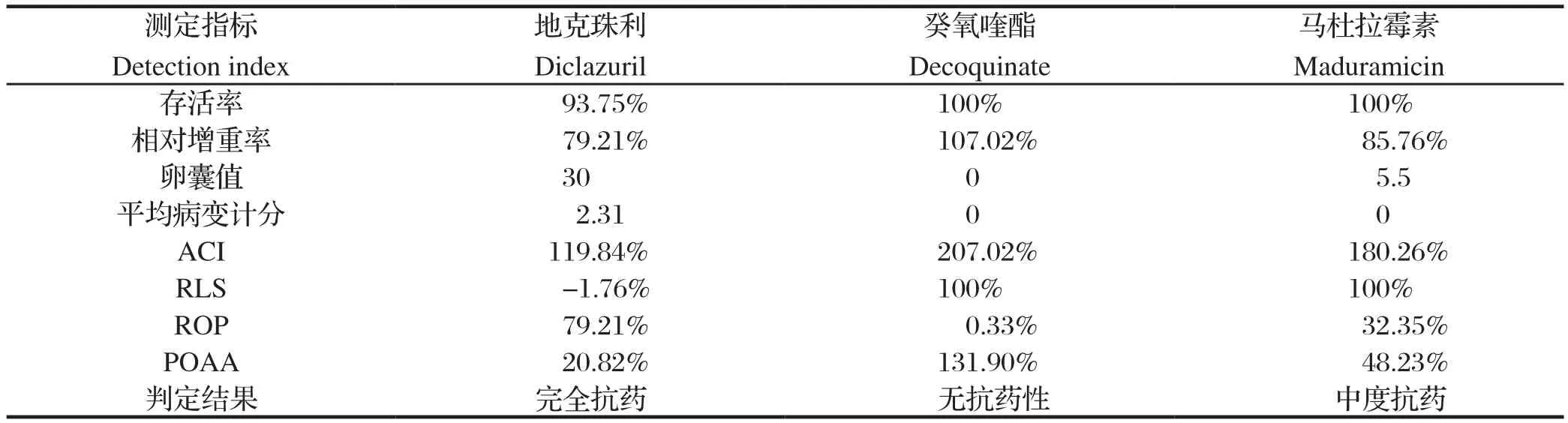
表2 地克珠利抗药株抗药性测定结果Table 2 Drug resistance test results of diclazuril resistant strain of E. tenella
2.3 敏感株球虫的测定结果 敏感株的抗药性测定结果见表3。地克珠利、癸氧喹酯、马杜拉霉素3种药物对该球虫均完全有效,4项指标均呈阴性,评定为无抗药性。
3 讨论
随着抗球虫药的频繁使用,导致球虫抗药性的问题日益严重,相关报道也屡见不鲜[7-10,14-16]。为在分子水平对球虫抗药性进行更加深入的研究,本研究对实验室长期保存的2个球虫抗药虫株进行了检测,以确定虫株在保存繁殖过程中抗药特性的遗传稳定性。
本研究选择了目前使用较为普遍的3种药物,即地克珠利、癸氧喹酯和马杜拉霉素。其中地克珠利属于三嗪类药物,曾因高效低毒而被广泛使用,然而由于药物长期的使用导致了球虫对其产生了广泛的耐药性[15,16]。癸氧喹酯属于喹诺酮类药物,在国内应用时间较地克珠利与马杜拉霉素来说时间并不长,但球虫对癸氧喹酯易产生耐药性,其耐药性问题在国外已有报道[17],国内也已诱导出对该药的耐药虫株[18],因此球虫对癸氧喹酯耐药性的问题也应引起重视。马杜拉霉素是一种聚醚类离子载体抗球虫药,在国内外已经使用超过20年,曾为鸡球虫病的防治发挥了非常重要的作用,但由于使用频率高,使球虫对其抗药性日渐严重,这些年已陆续有对马杜拉霉素产生耐药性的相关报道[19-24]。
目前,对于球虫抗药性评定,仍然没有一个统一的标准,不同研究者采用的标准可能有所不同。McDougald等[5,6]利用Johnson等[25]所述方法进行病变计分,以感染用药组和感染不用药组的病变计分来计算RLS,从而对球虫的抗药性进行判定。Jeffers等[26]利用POAA判定了火鸡和缓艾美耳球虫(E. meleagrimitis)对莫能菌素具有抗药性。在国内,孔繁瑶等[7]利用POAA、RLS、ROP等3项参数指标判定了15株柔嫩艾美耳球虫对5种抗球虫药的抗药性。黄兵等[13]则在POAA、RLS、ROP的基础上,增加了ACI,用4项指标对上海市9个区县10个鸡场的球虫,进行了6种常用抗球虫药物(地克珠利、氯苯胍、氯羟吡啶、氨丙啉、马杜拉霉素、莫能霉素)的抗药性检测。陈兆国等[21]对该4项指标判定球虫抗药性的准确性进行了评价,认为用ACI、RLS、POAA、ROP等4项指标来评定球虫抗药性是有效可靠的。随后,国内对球虫抗药性的检测都主要以这4项指标作为判定依据[28-32]。张香斋等[29]利用RLS、ROP、POAA、ACI判定了柔嫩艾美耳球虫秦皇岛分离株对克球粉、氨丙啉、马杜霉素、磺胺氯吡嗪钠、磺胺喹噁啉钠、地克珠利和尼卡巴嗪7种抗球虫药的耐药性。蒋禄峰等[33]利用RLS、ROP、POAA、ACI评定了河北省石家庄、沧州、保定、唐山等地的柔嫩艾美耳球虫分离株对氯羟吡啶、莫能菌素、地克珠利、妥曲珠利、磺胺喹噁啉 5 种常用抗球虫药的抗药性。本研究采用了RLS、POAA、ROP、ACI作为对3个虫株进行抗药性的评价指标。检测结果显示,在实验室繁殖保存了10余年的2个抗药性虫株,仍保持了良好的遗传稳定性,对其诱导药物具有完成抗药性,而敏感株对所测药物完全敏感,为利用该虫株进行球虫抗药性机理等相关研究提供了基础数据。
[1] Bhogal B S, Miller G A, Anderson A C, et al. Potential of a recombinant antigen as a prophylactic vaccine for day-old broiler chickens against Eimeria acervulina and Eimeria tenella infections[J]. Vet Immunol Immunop, 1992, 31(S3-4)∶ 323-335.
[2] Jenkins M C, O’Brien C N, Fuller L, et al. A rapid method for determining salinomycin and monensin sensitivity in Eimeria tenella[J]. Vet Parasitol, 2014, 206(3-4)∶ 153-158.
[3] Chapman H D. Biochemical, genetic and applied aspects of drug resistance in Eimeria parasites of the fowl[J]. Avian Pathol, 1997, 26(2)∶ 221-244.
[4] Waletzky E, Neal R, Hable I. A field strain of Eimeria tenella resistant to sulfonamides[J]. J Parasitol, 1954, 40(2)∶ 24.
[5] McDougald L R, Fuller L, Solis J. Drug-sensitivity of 99 isolates of coccidia from broiler farms[J]. Avian Dis, 1986, 30(4)∶ 690-694.
[6] McDougald L R, Da Silva J M L, Solis J, et al. A survey of sensitivity to anticoccidial drugs in 60 isolates of coccidia from broiler chickens in Brazil and Argentina[J]. Avian Dis, 1987, 31(2)∶ 287-292.
[7] 孔繁瑶, 宁长申, 殷佩云. 15株柔嫩艾美耳球虫Eimeria tenella对五种抗球虫药的抗药性调查研究[J]. 北京农业大学学报, 1994, 20(3)∶ 302-308.
[8] 李安兴, 谢明权, 蔡建平, 等. 广东省肉鸡柔嫩艾美耳球虫(E.tenella)抗药性调查[J]. 中山大学学报(自然科学版), 2000, 39(6A)∶ 138-144.
[9] 李佩国. 河北省鸡柔嫩艾美耳球虫地方株的耐药性检测[D]. 长春∶ 吉林大学, 2010.
[10] 蔡兰, 朱顺海, 赵其平, 等. 绍兴市5个鸡场球虫分离株抗药性试验[J]. 浙江农业学报, 2015, 27(4)∶ 532-536.
[11] 甘德培. 抗球虫药与球虫的抗药性研究进展[J]. 中国兽医寄生虫病, 1999, 7(2)∶ 53-56.
[12] 韩红玉, 赵其平, 陈兆国, 等. 柔嫩艾美耳球虫地克珠利抗药株和马杜拉霉素抗药株的试验室诱导[J]. 中国兽医学报, 2004, 24(2)∶ 138-140.
[13] 黄兵, 赵其平, 吴薛忠, 等. 上海地区鸡球虫对6种抗球虫药的抗药程度研究[J]. 中国兽医寄生虫病, 2001, 9(2)∶1-7.
[14] 苏子超. 临沂地区鸡球虫病流行病学调查及抗药性研究[D]. 泰安∶ 山东农业大学, 2012.
[15] 吴金凤, 曾明华, 王凤, 等. 安徽3个地区柔嫩艾美耳球虫对6种药物的抗药性[J]. 中国兽医寄生虫病, 2008, 16(6)∶22-25.
[16] 吴昌标, 郑文金, 陈金雄, 等. 柔嫩艾美耳球虫莆田株抗药性研究[J]. 经济动物学报, 2013, 17(1)∶ 19-22转26.
[17] Williams R B. Tracing the emergence of drug-resistance in coccidia (Eimeria spp.) of commercial broiler flocks medicated with decoquinate for the first time in the United Kingdom[J]. Vet Parasitol, 2006, 135(1)∶ 1-14.
[18] 潘虹, 林瑞庆, 舒丽, 等. 柔嫩艾美耳球虫癸氧喹酯耐药株的诱导研究[J]. 中国畜牧兽医, 2012, 39(9)∶ 191-194.
[19] Kawazoe U, Chapman H D, Shaw M. Sensitivity of field isolates of Eimeria acervulina to salinomycin, maduramicin, and a mixture of clopidol and methyl benzoquate in the chicken[J]. Avian Pathology, 1991, 20(3)∶ 439-446.
[20] 汪明, 孔繁瑶, 殷佩云, 等. 10株柔嫩艾美耳球虫对四种药物的抗药性检测[J]. 中国农业大学学报, 1996, 1(5)∶110-114.
[21] 于跃. 吉林市部分地区鸡球虫病流行病学调查及综合防制技术研究[D]. 北京∶ 中国农业科学院, 2007.
[22] 许金俊, 陶建平, 彭金彪, 等. 柔嫩艾美耳球虫扬州分离株对8种抗球虫药的抗药性[J]. 畜牧与兽医, 2008, 40(1)∶18-22.
[23] 李蕴玉, 李佩国, 张香斋, 等. 柔嫩艾美耳球虫石家庄株的生物学特性与抗药性研究[J]. 中国兽医学报, 2012, 32(2)∶ 223-227.
[24] 周飞亚, 黄月月, 李琳, 等. 安徽3株柔嫩艾美耳球虫对5种抗球虫药的耐药性检测[J]. 中国兽医学报, 2015, 35(10)∶ 1614-1621.
[25] Johnson J, Reid W M. Anticoccidial drugs∶ lesion scoring techniques in battery and floor-pen experiments with chickens[J]. Exp Parasitol, 1970, 28(1)∶ 30-36.
[26] Jeffers T K, Bentley E J. Experimental development of monensin resistance in Eimeria meleagrimitis[J]. Poul Sci, 1980, 59(8)∶ 1731-1735.
[27] 陈兆国,黄兵,赵其平,等. 四项球虫抗药性判定指标的准确性评价[J]. 中国兽医寄生虫病, 2001, 9(4)∶ 38-42. [28] 钟立军. 吉林省部分地区鸡球虫病流行病学调查及抗药性研究[D]. 长春∶ 吉林大学, 2005.
[29] 张香斋, 张艳英, 贾青辉, 等. 秦皇岛株柔嫩艾美耳球虫对7种常用抗球虫药的耐药性[J]. 西北农林科技大学学报(自然科学版), 2008, 36(7)∶ 14-18.
[30] 韦园园. 广西部分地区鸡球虫抗药性的研究[D]. 南宁∶广西大学, 2012.
[31] 王中宝. 安徽三个地区柔嫩艾美耳球虫耐药性分析[D].合肥∶ 安徽农业大学, 2013.
[32] 蒋禄峰, 常丽云, 张晶, 等. 河北省部分地区柔嫩艾美耳球虫野外分离株耐药性检测[J]. 中国动物保健, 2015, 17(6)∶ 78-81.
RESISTANT ASSESSMENT OF MADURAMICIN RESISTANT STRAIN AND DICLAZURIL RESISTANT STRAIN OF EIMERIA TENELLA
XIE Yu-xiang1, HAN Hong-yu1, ZHAO Qi-ping1, WANG Zi-wen1, DONG Hui1, XU Shuai-bing1, ZHU Shun-hai1, CUI Xiao-xia1, TANG Min1,2, YANG Zhi-yuan1,2, HUANG Bing1,3
(1. Key Laboratory of Animal Parasitology of Ministry of Agriculture, Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China; 2. College of Life and Environment Sciences, Shanghai Normal University, Shanghai 200234, China; 3. Jiangsu Co-innovation Center for Prevention and Control of Important Animal Infectious Diseases and Zoonoses, Yangzhou 225009, China)
In order to detect the drug resistance of Eimeria tenella (E. tenella) maduramicin resistant strain, diclazuril resistant strain and drug sensitive strain to three drugs which include diclazuril, decoquinate and maduramicin, the body-testing method was used for evaluating the effect, including anticoccidial index (ACI), reduction of lesion scores (RLS), relative oocyst production (ROP) and percent of optimum anticoccidial activity (POAA). The results revealed that drug sensitive strain was sensitive to the three drugs and all indicators was negative. Maduramicin resistant strain was serious resistance to maduramicin and all indicators was positive, but it was sensitive to diclazuril and decoquinate and all indicators was negative. Diclazuril resistant strain was serious resistance to diclazuril and all indicators was positive, it was also middle resistance to maduramicin and two indicators was positive, but it was sensitive to decoquinate and allindicators was negative. These results show that the two drug-resistant strains of E. tenella that be propagated and kept for more than 10 years in the laboratory have obvious resistance to maduramicin and diclazuril, respectively, which will indicate that the method that E. tenella propagated and saved in the lab is feasible and the drug-resistance of durg-induced strain can be inherited stably, and it will provide an experimental foundation for drug-resistant mechanism research.
Eimeria tenella;diclazuril;maduramicin;drug resistance
S852.723
A
1674-6422(2016)06-0050-06
2016-09-08
中央级公益性科研院所基本科研业务费专项资金项目(2016JB10)
谢雨翔,女,硕士研究生,兽医学专业
黄兵,E-mail:hb@shvri.ac.cn
