纳豆芽孢杆菌代谢产γ-聚谷氨酸液体发酵中试研究
2016-03-01陈卫锋刘成更李文孝
陈卫锋,秦 涛,刘成更,李文孝,马 齐
(1.陕西省科学院酶工程研究所,陕西西安 710600;2.西北生物农业中心,陕西西安 710043)
纳豆芽孢杆菌代谢产γ-聚谷氨酸液体发酵中试研究
陈卫锋1,秦 涛1,刘成更1,李文孝1,马 齐2
(1.陕西省科学院酶工程研究所,陕西西安 710600;2.西北生物农业中心,陕西西安 710043)
以纳豆芽孢杆菌(Bacillus subtilis natto)HSF1410为发酵菌株,在前期发酵条件基础上,利用10 L发酵罐优化发酵培养基和供氧条件,再进行500 L发酵罐中试试验,中试γ-聚谷氨酸最高产量达32.4 g/L。
γ-聚谷氨酸;发酵;中试生产
γ-聚谷氨酸(Poly γ-glutamic acid,γ-PGA)是由D-谷氨酸和L-谷氨酸单体以酰胺键形式缩合而成的一种氨基酸聚合物。γ-PGA具有可降解性、成膜性、保湿性、可食性等特点,在医药、环保、食品、化妆品及农业等领域具有广阔的应用前景[1-3]。
γ-PGA可以通过化学合成[4]、天然产物提取以及微生物发酵而得,微生物发酵法[5]与前2种方法相比,不仅生产成本低,而且生产过程污染小,适合大规模生产,因此采用微生物发酵法生产聚谷氨酸成为目前研究方向的主流,现在绝大多数γ-PGA产品由利用芽孢杆菌[6]发酵、提取分离得到。
试验以纳豆芽孢杆菌(Bacillus subtilis natto)HSF1410为生产菌株,在摇瓶发酵产γ-PGA最佳培养基和培养条件及10 L发酵罐小试的基础上,进行500 L发酵罐中试研究,确定其最适发酵工艺参数。
1 试验材料和方法
1.1 试验材料
纳豆芽孢杆菌(Bacillus subtilis natto)HSF1410,由陕西师范大学食品工程与营养科学学院提供;葡萄糖、酵母粉、K2HPO4,NH4Cl,MgSO4,天津市科密欧化学试剂有限公司提供。
GRJB-10D型10 L发酵罐,镇江格瑞生物工程有限公司产品;500 L发酵罐,陕西美乐设备有限公司产品;UV-2802SH型紫外可见分光光度计,上海尤尼柯仪器有限公司产品;NDJ-5型黏度测定仪,北京东西器材有限公司产品;S1100型高效液相色谱仪,美国Agilent公司产品。
(1)液体种子培养基。液体LB培养基,pH值7.0,于121℃条件下蒸汽灭菌20 min。
(2)原发酵培养基。葡萄糖30 g/L,NH4Cl 4 g/L,L-谷氨酸钠15 g/L,酵母粉1 g/L,K2HPO43 g/L,MgSO40.2 g/L,无水 CaCl20.2 g/L,pH值 7.0,于121℃下蒸汽灭菌20 min。
(3)优化培养基。用玉米淀粉经液化和糖化部分替代原发酵培养基中的葡萄糖,用玉米浆部分替代酵母粉,灭菌同原发酵培养基。
1.2 试验方法
1.2.1 10 L发酵罐液体发酵条件的优化
(1)灭菌。采用高压蒸汽灭菌,灭菌温度121℃,灭菌时间20 min。
(2)接种。用氨水调节pH值至6.8左右,接入菌种,再调节pH值至7.0,接种量约为1%。
(3)培养。发酵温度28℃,风量1∶0.5,压强0.05 MPa,pH值7.0,发酵时间2 h,光密度0.35~0.50,可转入发酵。
将纳豆芽孢杆菌HSF1410接种于液体LB摇瓶种子培养基中,以转速160 r/min,温度37℃摇床培养18 h,即为种子液。按照2%的接种量接种至10 L发酵罐中,发酵培养基的装液量为55%,通气量为2 vvm,对发酵过程中的温度、转速及补料方式进行优化。整个发酵过程中,每4 h取1次样,检测发酵液中菌体生物量、聚谷氨酸合成酶活力、γ-PGA含量,以此确定最优的10 L罐发酵工艺。
1.2.2 500 L发酵罐液体发酵方法
(1)灭菌。采用高压蒸汽灭菌,灭菌温度121℃,灭菌时间20 min。
(2)接种。用氨水调节pH值至7.0左右,接种量约为2%。
(3)培养。发酵温度37℃,通风量、罐压和搅拌转速根据溶氧的要求调节溶氧水平。补料分批发酵时,当残糖含量低于20 g/L时补充糖液,以维持残糖含量为10~20 g/L,发酵过程中每隔4 h取样进行各种参数测定。
1.2.3 分析方法
(1)细胞生长测定。采用比浊法,以发酵培养基作为参比溶液,于波长600 nm处测定发酵液的吸光度(OD600)。
(2)发酵液中γ-PGA含量的检测[7]。按照γ-PGA的凝胶渗透色谱(GPC)检测方法分析各编号菌株发酵液中产物的浓度;采用GPC法,将发酵液稀释25倍后过0.22 μm滤膜去除菌体,用1100Series型高效液相色谱仪进行分析;TSK-gelG5000PWxl-CP型色谱柱,10 μm,7.8 mm×30 mm(TOSOH,日本);流动相:0.015 mol/L Na2HPO4-KH2PO4,0.15 mol/L NaCl溶液,pH值7.0;流速0.4 mL/min;检测波长220 nm;γ-PGA标准品(Vedan,中国台湾)。
(3)残糖测定。采用改良裴林氏法[8]。
2 结果与讨论
2.1 发酵培养基配方优化
2.1.1 玉米淀粉添加量的优化
在前期摇瓶液化发酵得出发酵培养基配方确定葡萄糖浓度25 g/L,试验采用玉米淀粉部分替代葡萄糖进行10 L发酵罐试验。玉米淀粉按液化酶和糖化酶的使用说明经过酶水解,玉米淀粉与葡萄糖质量总计为20 g/L,玉米淀粉与葡萄糖按一定比例添加,按照接种量2%,发酵温度37℃,发酵pH值7.0,通过分批次调节通风量、罐压和搅拌转速将溶氧控制在20%~25%,发酵52~54 h,测残糖含量和γ-PGA产量。
玉米淀粉添加量对γ-PGA产量的影响见图1。
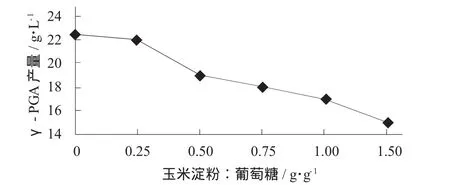
图1 玉米淀粉添加量对γ-PGA产量的影响
由图1可知,随着玉米淀粉添加量的增大,γ-PGA产量明显减少。在玉米淀粉与葡萄糖添加比例在0.25时,γ-PGA产量降低不明显,说明此发酵可以部分利用玉米淀粉水解的糖作为碳源。
玉米淀粉添加量对底物转化率的影响见表1。
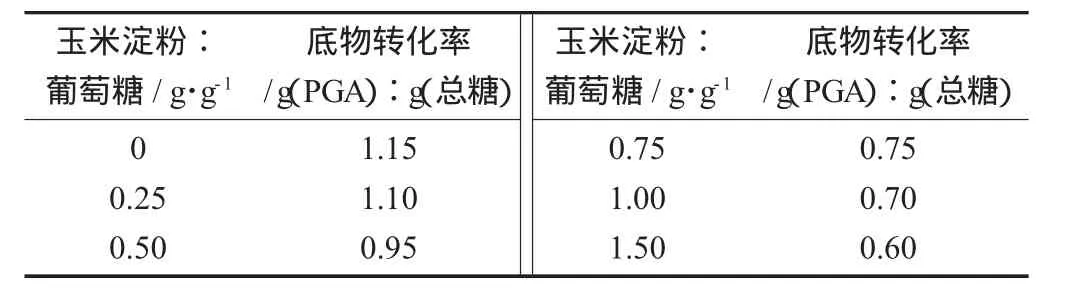
表1 玉米淀粉添加量对底物转化率的影响
玉米淀粉水解后,在发酵液中也是葡萄糖,底物转化率是指γ-PGA的合成量与玉米淀粉和葡萄糖之合的比值。由表1可知,随着玉米淀粉添加比例提高,糖的底物转化率也随之下降,但是在玉米淀粉添加量为0.25 g时转化率下降不明显。更进一步证明,玉米淀粉可以部分替代葡萄糖作为碳源。
2.1.2 玉米浆添加量的确定
摇瓶发酵得出发酵培养基配方确定酵母粉2 g/L,试验采用玉米浆部分替代酵母粉进行10 L发酵罐试验。玉米浆与酵母粉按一定比例添加,接种量2%,发酵温度37℃,发酵pH值7.0,通过分批次调节通风量、罐压和搅拌转速将溶氧控制在20%~25%,发酵52~54 h,测γ-PGA产量。
玉米浆添加量对γ-PGA产量的影响见图2。
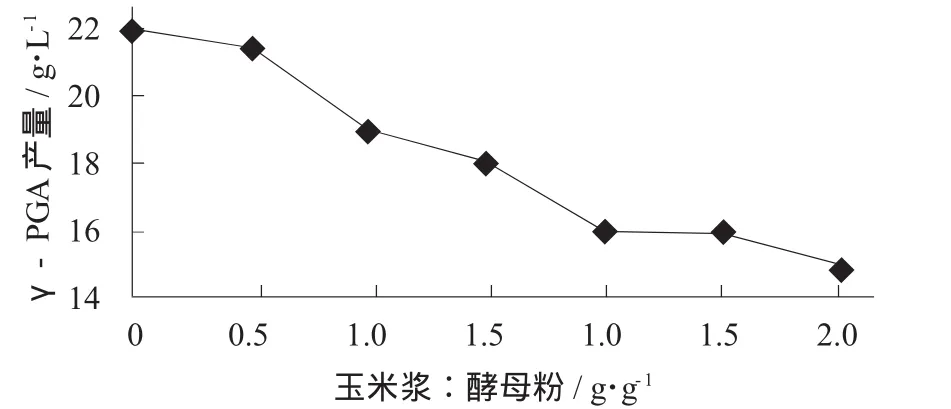
图2 玉米浆添加量对γ-PGA产量的影响
由图2可知,随着玉米浆添加量的增大,γ-PGA产量明显减少。在玉米浆与酵母粉添加比例为0.5时,γ-PGA产量降低不明显,说明此发酵可以部分利用玉米浆替代酵母粉。
2.2 分批控制溶氧10 L罐小试
在已经确定的各项发酵参数条件下,在10 L发酵罐上进行溶氧控制的研究,分别调节通气量、罐压、搅拌转速,分阶段控制溶氧参数。在延滞期(0~6 h)控制20%溶氧,在对数生长期(6~20 h)控制45%溶氧,进入稳定期(20 h以后) 控制20%溶氧。
分段控制溶氧与恒定溶氧对生物量的影响见图3。
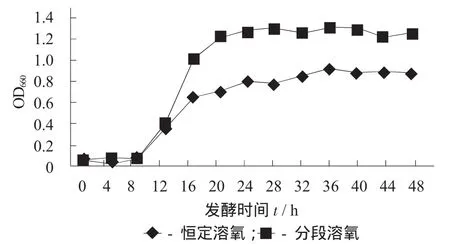
图3 分段控制溶氧与恒定溶氧对生物量的影响
由图3可知,分段控制溶氧明显能提升发酵液生物量,菌种生长总体水平有较大幅度提高。
2.3 500 L发酵中试
分段控制溶氧与恒定溶氧对γ-PGA产量的影响见图4。
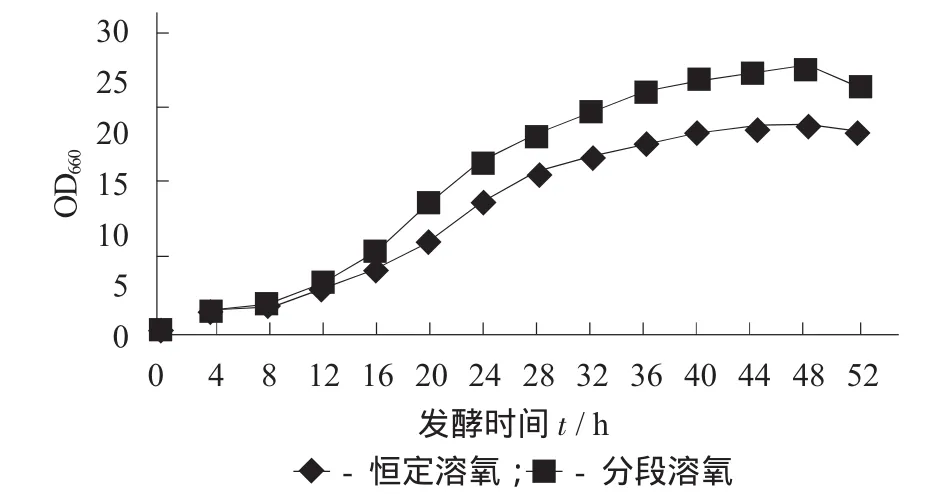
图4 分段控制溶氧与恒定溶氧对γ-PGA产量的影响
由图4可知,分段控制溶氧提高了γ-PGA的产量。
2.3 500 L罐中试放大
为了评价10 L罐发酵工艺的稳定性和可行性,在500 L罐中对发酵工艺进行放大试验。
500 L中试发酵试验见表2。
500 L罐中试产量在49~51 h达到最大,分别32.4,30.6,29.6 g/L,第3批次相对前2批次在接种时间上稍推迟,使得菌龄增长,但是仍未出对数生长期,导致菌种的生物量也相对前2批次增高,但
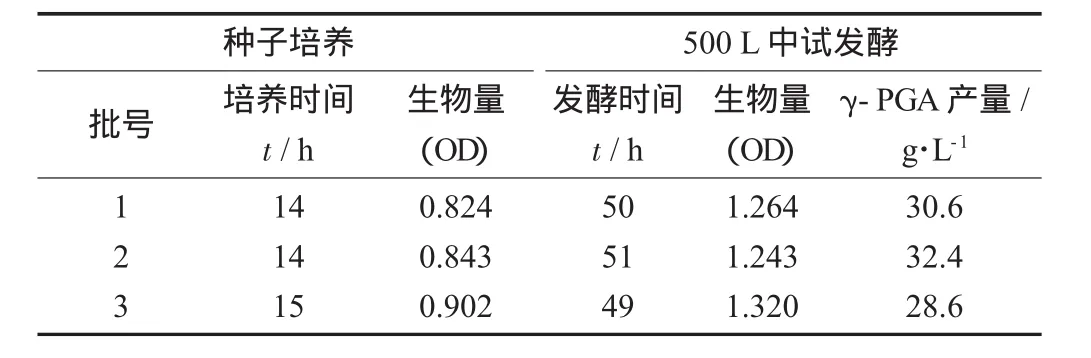
表2 500 L中试发酵试验
[1]Bhatt R,De Vries P,Tulinsky J,et al.Synthesis and in vivo antitumor activity of poly(L-glutamic acid) conjugates of 20S-camptothecin[J].Journal of Medicinal Chemistry,2003,46(1):190-193.
[2]Sun M H,Park C,Kim C J,et al.Natural and ediblebiopolymer poly γ-glutamic acid:synthesis,production,and applications[J].The Chemical Record,2005(6):352-366.
[3]鞠蕾,马霞.γ-聚谷氨酸的应用进展 [J].中国酿造,2011(9):1-4.
[4]曹名锋,金映虹,解慧,等.聚谷氨酸的微生物合成、相关基因及应用展望 [J].微生物学通报,2011,38(3):388-395.
[5]Yokoigawa K,Sato M,Soda K.Simple improvement in是在同样的发酵条件下,最终γ-PGA产量减少,这说明菌种过度生长会对代谢产物累积量有影响。
500 L中试放大,γ-PGA累积量3批次平均值为30.5 g/L,相对于10 L罐γ-PGA平均产量25.8 g/L提高了18.2%,这可能是由于扩大发酵体积提高了发酵液的传质效率,从而改善了微生物的生长环境,使得代谢物累积量增设。
3 结论
(1)在发酵过程中,用葡萄糖质量25%的玉米淀粉可以部分替代葡萄糖,用酵母粉质量50%的玉米浆可以部分替代酵母粉,这样产业化发酵生产可以相对控制成本。
(2)在发酵过程中采用分段控氧的供氧工艺,即通过分别调节通气量、罐压、搅拌转速,分阶段控制溶氧参数,在延滞期(0~6 h) 控制为20%溶氧,在对数生长期(6~20 h)控制为45%溶氧,进入稳定期(20 h以后)控制为20%溶氧,可以有效地提高γ-PGA发酵累积量。
(3)将10 L罐发酵工艺放大到500 L罐,发酵结果代谢产物量明显提升,证明了发酵工艺稳定可行,为γ-PGA的工业化生产奠定了基础。目前,尚无报道中试或产业化为γ-PGA发酵工艺,试验的发酵水平达到了产业化生产水平,具有良好的工业化前景。
freeze-tolerance of bakers'yeast with poly γ-glutamate[J]. Journal of Bioscience and Bioengineering,2006(3):215-219.
[6]程艳玲,赵玉娥,王海玉.生物降解型聚谷氨酸的研究进展 [J].北京联合大学学报(自然科学版),2008(2):45-49.
[7]吕莹,郝紫徽,李虹.γ-聚谷氨酸的分离提纯 [J].食品与发酵工业,2005,31(2):133-134.
[8]梁金钟,王风青.微生物发酵法合成高分子聚合物 γ-PGA的研究 [J].北京工商大学学报(自然科学版),2011,29(1):24-29.◇
Pilot Scale Fermentation of γ-Poly Glutamic Acidby Bacillus Subtilis Natto HSF1410
CHEN Weifeng1,QIN Tao1,LIU Chenggeng1,LI Wenxiao1,MA Qi2
(1.Enzyme Engineering Research Institute of Shaanxi Academy of Sciences,Xi'an,Shaanxi 710600,China;
2.Nerthwest Bio-agriculture Ceuter,Xi'an,Shaanxi 710043,China)
Bacillus subtilis natto HSF1410 is taken as start strains for fermentation,on the basis of the early stage of the fermentation conditions,10 L fermentation tank is used to optimize the fermentation culture medium and oxygen supply conditions,then pilot production of poly γ-glutamic acid is carried out use 500 L fermentation tank,pilot γ-PGA maximum yield of 32.4 g/L.
γ-PGA;fermentation;pilot production
TQ922.1
A
10.16693/j.cnki.1671-9646(X).2016.12.031
1671-9646(2016)12b-0018-03
2016-10-12
陕西省科学院基础应用项目支持(2011K-13);陕西省农业科技创新项目支持(2011K02-03)。
陈卫锋(1971— ),男,本科,助理研究员,研究方向为微生物菌种选育及发酵工程。
