慢性心衰大鼠CD4+CD25+Treg细胞Kv1.3钾通道电流变化
2016-03-01刘长江李少华邵培培程路峰
刘长江, 武 洋, 李少华, 邵培培, 程路峰
(新疆医科大学基础医学院药理学教研室, 乌鲁木齐 830011)
慢性心衰大鼠CD4+CD25+Treg细胞Kv1.3钾通道电流变化
刘长江, 武洋, 李少华, 邵培培, 程路峰
(新疆医科大学基础医学院药理学教研室, 乌鲁木齐830011)
摘要:目的观察慢性心衰大鼠脾脏CD4+CD25+调节T细胞(Treg)电压依赖性Kv1.3钾通道电流变化,为心衰发生、发展的免疫学机制提供证据。方法将25只健康雄性SD大鼠随机分为冠脉结扎的慢性心衰组(CHF组,n=18)和不结扎冠脉的对照组(Control组,n=7),手术结扎冠脉前降支建立心衰模型,通过超声心动图、血流动力学、血浆脑尿钠肽(BNP)及心肌Masson染色的检测确定心衰模型,应用免疫磁珠分离两组大鼠脾脏CD4+CD25+Treg细胞,采用全细胞膜片钳技术分别记录CHF组与Control组CD4+CD25+Treg细胞Kv1.3通道电流变化。结果CHF组左室射血分数(LVEF)为(39.3±10.0)%,较Control组[(84.5±3.7)%]明显降低(P<0.01);左室舒张末压(LVEDP)为(4.4±0.3) mmHg,较Control组[(11.6±1.4) mmHg]显著降低(P<0.01);血浆BNP水平为(562.0±22.0) μg/L,较Control组[(366.2±21.9) μg/L]显著升高(P<0.01)。Masson染色中,Control组红染的心肌细胞较多,细胞条纹清晰,CHF组大量蓝染的胶原纤维取代心肌纤维成条索状。CHF组大鼠CD4+CD25+Treg细胞Kv1.3钾通道峰值电流密度为(272.7±27.7) pA/pF,较Control组的(65.6±6.4) pA/pF明显增大(P<0.01)。两组大鼠CD4+CD25+Treg细胞膜电容分别为(1.67±0.14) pF和(2.07±0.18) pF,差异无统计学意义(P>0.05)。结论CHF组CD4+CD25+Treg细胞Kv1.3通道峰值电流密度增大,提示其可能参与慢性心衰的发生和发展。
关键词:慢性心衰; Kv1.3钾通道; 全细胞膜片钳; CD4+CD25+Treg细胞
心力衰竭(心衰)是由于心脏器质或功能性疾病损害心室充盈和射血能力而引起的一种复杂临床综合征,是各种心脏病的严重阶段。近年来有关研究发现以细胞因子网络失衡为标志的免疫激活和炎症反应在心力衰竭的发生、发展中起着重要作用[1-3]。CD4+CD25+调节性T(Treg)细胞维持免疫耐受性和控制免疫反应,有研究表明静脉注射Treg细胞能够减轻高血压小鼠心室肥厚和降低心肌纤维化,改善心室重塑[4]。Kv1.3钾通道主要分布于T淋巴细胞膜,调节T淋巴细胞激活、增殖、分化和细胞因子分泌的重要通道,是免疫调节的靶点[5]。因此,研究Kv1.3钾通道对炎症时Treg细胞的调节作用则显得颇为有意义。本研究应用全细胞膜片钳技术研究心衰大鼠Treg细胞Kv1.3钾通道的电流变化,拟为今后对心力衰竭的免疫学机制进行深入研究提供一定的依据。
1材料与方法
1.1材料
1.1.1实验动物25只健康普通级SD大鼠,雄性,体质量(200 ± 20)g,按体质量随机分为慢性心衰组(CHF组,n=18)和对照组(Control组,n=7),由新疆医学实验动物中心提供[许可证号:SCXK(新)2011-0004],饲养于新疆医科大学第一附属医院科技楼动物饲养室(AAALAC认证),温度23℃~25℃,湿度40%~50%,12 h/12 h明暗交替饲养。
1.1.2主要试剂大鼠脾脏组织淋巴细胞分离液HISTOPAQUE®-1083(Sigma, 美国),小鼠抗大鼠Biotin CD4和小鼠抗大鼠PE CD25 (Becton Dickinson, 美国)、抗-PE磁珠和抗-Biotin MultiSort Kit (Miltenyi Biotec, 德国) RPMI1640(Hyclone, 美国),培养基胎牛血清(Gibco, 美国),异氟烷吸入麻醉剂(瑞沃德,深圳),大鼠血浆脑钠尿肽(BNP)试剂盒和Masson三色染色试剂盒(森贝伽,南京)等。
1.1.3仪器彩色多普勒超声心动图仪(HP 5500,美国),超声探头(Philips S12,荷兰),酸度计(Sartorius PB-10, 德国),精密电子天平(Mettler Toledo XS205, 瑞士),膜片钳放大器(Heka EPC-10, 德国),三维推进器(Burleigh PCS-5000,加拿大),倒置显微镜(Leica, 德国),玻璃电极拉制仪(Narishige PC-10, 日本),小动物麻醉机(Matrx VIP 3000, 美国),BL-420F生物机能实验系统和HX-200动物呼吸机(泰盟,成都)等。
1.1.4溶液配制细胞外液配制(mM):150 NaCl、4. 5 KCl 、1.0 CaCl2、1.0 MgCl2和10 HEPES,用NaOH调至pH 7.35;Kv1.3钾通道电极内液配制(mM):150 KCl、1.0 CaCl2、1.0 MgCl2、10 HEPES和10 EGTA,用KOH调至pH值7.2;磁珠分选缓冲液配制: pH 7.2 PBS、2 mM EDTA、0.5% BSA。
1.2方法
1.2.1建立大鼠心衰模型冠脉结扎大鼠前降支建立心衰模型[6]。CHF组大鼠采用3%戊巴比妥钠(3 mL/kg体质量)腹腔注射麻醉,连接BL-420F生物机能实验系统记录大鼠Ⅱ导联心电图,自制气管导管经呼吸道连接动物呼吸机。左胸去毛并常规消毒后,显微镜下于左第3~4肋间开胸,结扎前降支,心电示波器显示胸前导联 ST 段显著提高,T波高耸,心前区变白,闭胸,挤压胸廓排气,撤呼吸机,观察大鼠呼吸,整个操作过程在10 min内完成。手术完毕后,继续观察至大鼠麻醉清醒,连续给予青霉素3 d以抗细菌感染。
1.2.2心功能测定、心肌组织病理学检查和血浆BNP含量测定异氟烷吸入麻醉后,应用超声心动图仪及探头经胸检测全心功能,颈动脉插管后连接BL-420F生物机能实验系统检测左心室功能,测定左心室舒张末压(LVEDP)、左室射血分数(LVEF)完毕后,腹主动脉取血,离心取上清血浆,酶联免疫分析大鼠BNP含量[7]。无菌条件下取出脾脏,用于分离CD4+CD25+Treg淋巴细胞。再取出心脏,用PBS缓冲液冲尽血液,分离左心室后,中部横向剪开,切取约1 mm厚度心脏,取心脏非梗死区心肌组织于4%多聚甲醛缓冲溶液中固定,常规脱水,石蜡包埋切片后进行Masson染色。
1.2.3免疫磁珠分选获得CD4+CD25+Treg淋巴细胞3%戊巴比妥钠(3 mL/kg体质量)腹腔注射麻醉,无菌条件下摘取脾脏,眼科剪清除多余的纤维组织,经200目筛研磨,过滤。按照大鼠脾脏淋巴细胞分离液说明书操作,制备脾脏淋巴细胞悬液,按照厂家推荐剂量及说明书,加入Biotin mouse Anti-Rat CD4,经MidiMACS分选器,阳性分选CD4+T淋巴细胞,释放磁珠后,于所得的CD4+T细胞中再加入PE mouse Anti-Rat CD25,阳性分选CD25+T淋巴细胞,经MidiMACS分选器分选最终得到CD4+CD25+Treg淋巴细胞。
1.2.4全细胞膜片钳记录参照文献[8]采用全细胞膜片钳方法,电压钳模式下记录两组大鼠CD4+CD25+Treg淋巴细胞Kv1.3钾通道电流的变化。将几滴细胞悬浮液滴加于细胞浴槽,待细胞沉降并贴壁牢固后,细胞外液灌流清洗细胞。使用EPC 10放大器通过12位AID和D/A数据转换器与计算机连接,刺激信号及电流、电压输人信号的采集均由软件控制。微电极内注入适当的电极内液,电极入水阻抗为3~6 MΩ。调节三维操纵器使电极尖端与细胞膜表面形成>1 GΩ封接,再施加负压吸破细胞膜形成全细胞记录,对液接电位和电容电流予以补偿,最终形成稳定电流基线。形成全细胞记录模式后,膜电位钳制在-70 mV,CD4+CD25+Treg淋巴细胞Kv1.3钾通道予以-80~+80 mV斜率刺激,刺激时长为400 ms,记录得到Kv1.3钾通道的电流-电压(I-V)曲线。实验室温控制在(20±2)℃。

2结果
2.1CHF组与Control组大鼠心功能、心肌组织病理学检查和血浆BNP含量比较18只大鼠经冠脉前降支结扎后,室颤死亡3只,麻醉过量1只,其余全部存活。根据文献[9]以Ⅱ导联心电图(ECG)显示ST段显著升高(图1)为冠脉结扎成功,8 w后大鼠多普勒超声检测心功能,以LVEF<40%为慢性心衰模型成功标志,纳入6只设为CHF组。右颈动脉插管入左心室测得心功能指标LVEDP均值>11.6 mmHg。CHF组大鼠血浆BNP水平明显高于Control组,差异有统计学意义(表1)。心肌组织Masson染色结果显示,Control组大鼠红染的心肌细胞较多,细胞条纹清晰,有少量蓝染的胶原纤维和细胞核;CHF组则呈现出稀疏红染的心肌纤维,大量蓝染的胶原纤维取代心肌纤维成条索状,有的被包绕成团片状(图2),表明大鼠心衰模型成功建立。
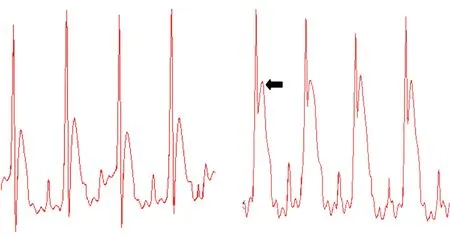
结扎后表现为缺血性ST 段抬高,右图箭头所示

组别只数LVEF/%LVEDP/mmHgBNP/(μg/L)Contr0l组784.5±3.74.4±0.3366.2±21.9CHF组639.3±10.011.6±1.4562.0±22.0t值2.42.62.3P值<0.01<0.01<0.01
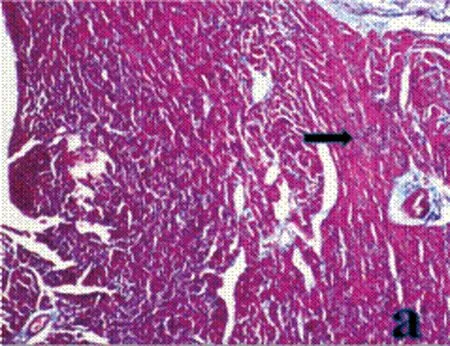
a: Control组
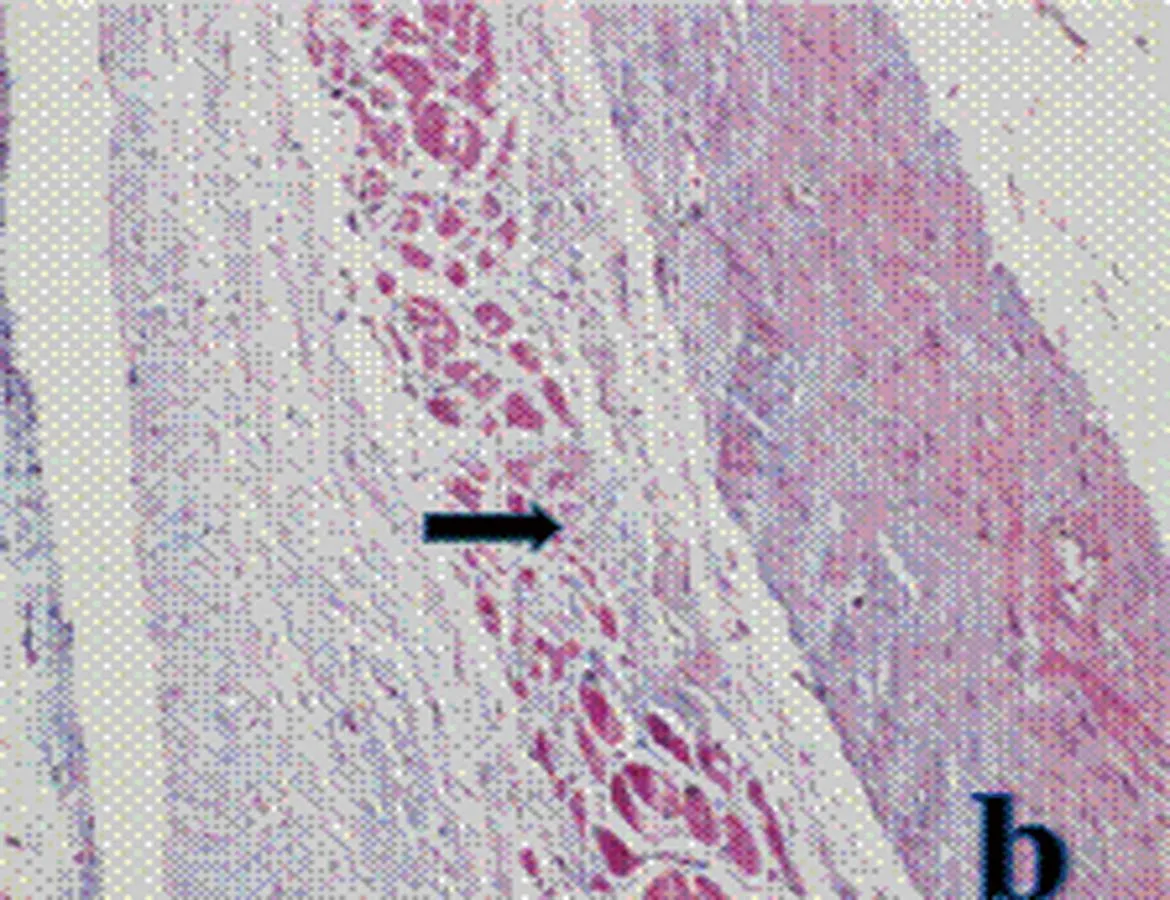
b: CHF组
图2两组大鼠心肌Masson染色
2.2两组大鼠脾脏CD4+ CD25+ Treg细胞Kvl. 3钾通道峰值电流密度及膜电容的比较全细胞膜片钳模式测定Treg细胞Kv1.3钾通道I-V曲线为1条外向逐渐增大的曲线,与文献[8]报道一致(图3),呈电压依赖性和时间依赖性,符合Kv1.3钾通道的电流特性。此模式下,CHF组大鼠CD4+CD25+Treg细胞Kv1.3钾通道电流峰值电流密度为[(272.65±27.70) pA/pF, 细胞个数,n=10],是Control组[(65.58±6.36) pA/pF,细胞个数,n=8]的4倍多,差异具有统计学意义(P<0.01) (图4)。CHF组和Control组测得膜电容分别为(1.67±0.14) pF和(2.07±0.18) pF,差异无统计学意义(图5)。

图3 两组大鼠CD4+CD25+Treg细胞Kv1.3钾通道I-V曲线
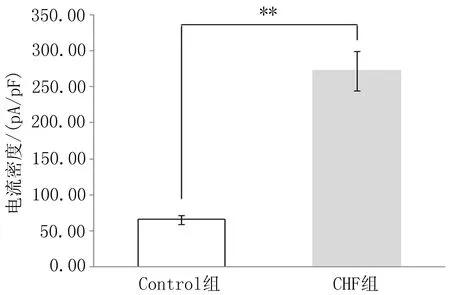
图4 两组大鼠CD4+CD25+Treg细胞Kv1.3钾通道电流密度比较与Control组比较,**P<0.01

图5 两组大鼠CD4+CD25+Treg细胞膜电容大小比较
3讨论
随着人口老龄化进程的加快及高血压、冠心病等常见心脑血管病发病率的上升,心力衰竭(CHF)的患病率正逐渐升高。据统计,全球每千人中就有9名心衰患者,约60%的患者在确诊5年内死亡,其发病率和死亡率给世界医疗事业带来巨大的压力和经济损失,严重威胁人类的生命健康[7]。
CHF发展是由多种细胞因子参与,近年发现以细胞因子网络失衡为标志的免疫激活和炎症反应在心力衰竭的发生、发展中起着重要作用,这可能是CHF新的发病机制[2,10-11]。炎症因子,如白细胞介素-4(IL-4)、白细胞介素-17(IL-17)等的过度表达将导致心脏炎性反应增强,不仅可通过影响心肌细胞的收缩性和传导性,诱导心肌凋亡、纤维化,促进心肌重构;而且可促进动脉粥样硬化、氧化应激、NO损伤、细胞凋亡等导致内皮功能障碍,从而加速心力衰竭的发生、发展。由此可见,心力衰竭的发生和发展一直伴随着炎症反应的过度激活,这种过度的激活导致心脏失代偿,加剧了心衰的恶化。因此,减少不必要的T淋巴细胞活化或增强Treg细胞调节作用将可能作为治疗心力衰竭的新目标[3,12]。
有关研究证实电压依赖性钾通道Kv1.3通道在效应性T细胞活化中的决定性作用,以及高表达Kv1.3通道的T淋巴细胞亚群在T细胞介导的自身免疫性疾病中起关键性致病作用[13-15]。由于Kv1.3钾通道主要分布于T淋巴细胞,参与了细胞膜复极化、胞内钙信号的调节、T淋巴细胞活化和细胞凋亡等一系列重要的生理过程[16],特异性阻断Kv1.3通道则不影响其他细胞功能和正常的T细胞免疫性,选择性阻断或基因敲除Kv1.3通道,将抑制效应性T 淋巴细胞的活化及其效应功能,所以Kv1.3阻滞剂为治疗慢性炎症和自身免疫性疾病提供一个潜在靶向治疗[17]。而本研究显示CHF组CD4+CD25+Treg细胞Kv1.3钾通道峰值电流密度明显大于Control组,提示高Kv1.3通道电流密度可能调节CD4+CD25+Treg细胞功能活性,并通过增加Kv1.3钾通道的电流密度,参与慢性心衰的发生、发展。
综上所述,特异性阻断CD4+CD25+Treg细胞Kv1.3通道可能为心衰的治疗提供新的途径,但具体的作用机制仍需进一步实验研究。
参考文献:
[1]Torre Amione G. Immune activation in chronic heart failure[J]. Am J Cardiol, 2005, 95(11):3-8.
[2]Li N, Bian H, Zhang J, et al. The Th17/Treg imbalance exists in patients with heart failure with normal ejection fraction and heart failure with reduced ejection fraction[J]. Clin Chim Acta,2010, 411(23-24):1963-1968.
[3]Tang TT, Ding YJ. Defective circulating CD4+CD25+Foxp3+CD127 low regulatory T-cells in patients with chronic heart failure[J]. Cell Physiol Biochem, 2010, 25(4-5):451-458.
[4]Kvakan H, Kleinewietfeld M, Qadri F, et al. Regulatory T cells a meliorate angiotensinⅡ-induced cardiac damage[J]. Circulation, 2009, 119(22):2904 -2912.
[5]Panyi G. Biophysical and pharmacological aspects of K+channels in T lymphocytes[J]. Eur Biophys J, 2005, 34(6):515-529.
[6]Samsamshariat SA,Ahmad Samsamshariat ZA,Movahed MR.A novel method for safe and accurate left anterior descending coronary artery ligation for research in rats[J]. Cardiovasc Revasc Med, 2005, 6(3):121-123.
[7]周白瑜. 2014 版《心衰治疗指南》肯定NT-proBNP临床应用价值[J]. 中华心血管杂志, 2014, 19(4):320.
[8]张邱兵, 张源明, 程路峰, 等. 新疆哈萨克族高血压病患者外周血T淋巴细胞电压依赖性钾通道及钙激活钾通道的电流变化[J]. 中华心血管杂志, 2013, 41(12):1020-1024.
[9]Shao Y, Redfors B, Omerovic E. Modified technique for coronary artery ligation in mice [J]. J Vis Exp. 2013, 29(73):1-4.
[10]Moro-García MA, Echeverría A, Galán-Artímez MC, et al. Immunosenescence and inflammation characterize chronic heart failure patients with more advanced disease[J]. Int J Cardiol, 2014, 174(3):590-599.
[11]Reina-Couto M, Carvalho J, Valente MJ, et al. Impaired resolution of inflammation in human chronic heart failure[J]. Eur J Clin Invest, 2014, 44(6):527-538.
[12]Fukunaqa T, Soejima H, Irie A, et al. Expression of interferon-g and interleukin-4 production in CD4+T cells in patients with chronic heart failure[J]. Heart Vessels, 2007, 22(3):178-183.
[13]Rus H, Pardo CA, Hu L, et al. The voltage-gated potassium channel Kvl.3 is highly expressed on inflammatory infiltrates in multiple sclerosis brain[J]. PNAS, 2005, 102(31):11094-11099.
[14]Beeton C, Wulff H, Standifer NE, et al. Kv1.3 channels are a therapeutic target for T cell-mediated autoimmune diseases[J]. PNAS, 2006, 13(46):17414 -17419.
[15]Nicolaou SA, Szigligeti P, Neumeier L, et al. Altered dynamics of Kv1.3 channel compartmentalization in the immunological synapse in systemic lupus erythematosus[J]. Immunol, 2007, 179(1):346-356.
[16]Nicolaou SA, Neumeier L, Steckly A, et al. Localization of Kv1.3 channels in the immunological synapse modulates the calcium response to antigen stimulation in T lymphocytes[J]. Immunol, 2009, 183(10):6296-6302.
[17]Wang J, Xiang M. Targeting potassium channels Kv1.3 and KCa3.1 routes to selective immunomodulators in autoimmune disorder treatment[J]. Pharmacotherapy, 2013, 33(6):515-528.
(本文编辑杨晨晨)
The change of Kv1.3 potassium channel current in CD4+CD25+Tcells of chronic heart failure rat
LIU Changjiang, WU yang, LI Shaohua, SHAO Peipei, CHENG Lufeng
(DepartmentofPharmacology,PreclinicalMedicineCollege,XinjiangMedicalUniversity,
Urumqi830001,China)
Abstract:ObjectiveTo observe current changes of voltage-dependent potassium channel (Kv 1.3 channel) in CD4+CD25+regulatory T (Treg) cells derived from spleen of chronic heart failure (CHF) rat and provide evidence for immunological mechanism of the occurrence and development of CHF. MethodsLeft anterior descending coronary artery was ligated to induce CHF in SD rats. CD4+CD25+Treg cells were isolated from spleen of CHF rat by magnetic-activated cell sorting. Whole-cell patch clamp technique was employed to check the current changes of Kv l.3 channel between CHF and control rats. ResultsCompared with Control group, LVEF in CHF group was decreased (39.3±10% vs 84.5±3.7%) as same as that of LVEDP (4.4±0.3 mmHg vs 11.6±1.4 mmHg), while plasma BNP level of CHF group was increased (562.0±22.0 μg/L vs 366.2±21.9 μg/L), all of which differences had statistical significance (P<0.01). For Masson trichrome staining, in control group myocardial cells were red with stripe clear, while a lot of blue collagen fibers instead of myocardial fibers in CHF group. And compared with control group, the CD4+CD25+Treg cell Kv1.3 potassium channel peak current density of CHF group was significantly increased (272.65±27.70 pA/pF vs 65.58±6.36 pA/pF, P<0.01), however, the membrane capacitance had no significant difference (1.67±0.14 pF vs 2.07±0.18 pF, P>0.05). ConclusionThe CD4+CD25+Treg cell Kv1.3 channel peak current density of CHF group increased, which was suggested may be involved in the occurrence and development of CHF.
Keywords:chronic heart failure (CHF); Kv1.3 Potassium channel; Whole-cell patch clamp; CD4+CD25+regulatory T (Treg) cells
[收稿日期:2015-10-08]
doi:10.3969/j.issn.1009-5551.2016.02.010
中图分类号:R331.3
文献标识码:A
文章编号:1009-5551(2016)02-0169-05
作者简介:刘长江(1987-),男,在读硕士,研究方向:心血管药理。通信作者:程路峰,男,博士,教授,硕士生导师,研究方向:心血管药理,E-mail:lewis_clf@163.com。
基金项目:国家自然科学基金(8136049)
