突发性聋患者糖皮质激素治疗前后外周血单个核细胞Nrf2表达分析*
2016-02-23齐慧戴艳红后婕周琼琼魏先梅杨烨佘万东
齐慧 戴艳红 后婕 周琼琼 魏先梅 杨烨 佘万东
突发性聋患者糖皮质激素治疗前后外周血单个核细胞Nrf2表达分析*
齐慧1戴艳红1后婕1周琼琼1魏先梅1杨烨1佘万东1
【摘要】目的探讨突发性聋(sudden sensorineural hearing loss,SSNHL)患者体内转录因子NF-E2相关因子2(nuclear factor erythroid2 related factor,Nrf2)的变化及其与糖皮质激素(glucocorticoid, GC)抵抗的关系。 方法分离30例SSNHL患者治疗前后外周血单个核细胞(peripheral blood mononuclear cells, PBMCs),提取总RNA,采用实时荧光定量PCR(quantitative real time PCR,QRT-PCR)方法检测其PBMCs中Nrf2 mRNA的表达量。根据就诊时间及用药情况将这30例SSNHL患者分为初发组(7例)和难治组(23例);难治组又根据听力恢复是否≥15 dB分为GC有效组(10例)及抵抗组(13例);选择10例听力正常的志愿者为对照组;比较各组SSNHL患者治疗前后Nrf2 mRNA表达量及与GC抵抗的关系。结果①30例患者中,治疗前难治组、初发组Nrf2 mRNA表达量分别为0.520±0.049、0.514±0.052,两组间差异无统计学意义(F=0.052,P=0.911),但均低于对照组(0.607±0.106)(F=6.483,P=0.004);②治疗前难治组中GC有效组、抵抗组患耳0.25~8 kHz平均听阈(pure tone average, PTA)分别为81.75±13.28和91.80±13.79 dB HL,治疗后分别为54.67±15.65和89.87±13.98 dB HL。治疗后GC有效组Nrf2 mRNA表达量(0.560±0.051)较治疗前(0.510±0.028)有所上调(t=3.007, P=0.015),而GC抵抗组Nrf2 mRNA表达量(0.519±0.054)较治疗前(0.526±0.060)无明显变化(t=0.485, P=0.636)。结论Nrf2表达上调或下降可能参与SSNHL的发生发展;难治性SSNHL患者GC抵抗的机制可能与Nrf2低表达相关,上调Nrf2可能改善难治性SSNHL患者对GC的敏感性和预后。
【关键词】突发性聋; 糖皮质激素;NF-E2相关因子2;外周血单个核细胞
网络出版时间:2015-12-3010:55
网络出版地址:http://www.cnki.net/kcms/detail/42.1391.R.20151230.1055.002.html
突发性聋 (sudden sensorineural hearing loss,SSNHL)极为常见,但具体发病机制仍然不明,目前认为可能与病毒感染、血管因素、自身免疫和代谢紊乱等相关[1]。糖皮质激素(glucocorticoid, GC)是目前较为公认治疗突发性聋有效的药物[1~4],但经过积极治疗后,仍有部分患者听力无明显改善,提示部分患者可能存在GC抵抗[5,6]。组蛋白去乙酰基酶2(histone deacetylase 2, HDAC2)作为一种能够从组蛋白N-乙酰化赖氨酸上去除乙酰基的酶,可通过调控组蛋白的乙酰化水平,影响染色体重塑,被认为是炎症性疾病GC抵抗的重要因素[7]。本课题组前期研究发现,经过鼓室灌注GC加全身抗氧化剂治疗后,约半数突发性聋患者的外周单个核细胞(peripheral blood mononuclear cells,PBMCs)中HDAC2 表达增加,听力改善,而GC治疗无效患者HDAC2蛋白活性是下降的,提示HDAC2下调可能是难治性SSNHL患者激素抵抗的重要原因[8,9],但其下调的原因尚不明确。有研究表明转录因子NF-E2相关因子2(nuclear factor erythroid2 related factor,Nrf2)的下调可使HDAC2蛋白活性降低,从而导致患者GC抵抗[10]。Nrf2作为一种抗氧化转录因子,在抵制各种压力环境下导致的氧化应激(oxidative Stress,OS)中发挥关键作用[11]。生理条件下,Nrf2在细胞质中与Kelch样ECH联合蛋白1(kelch-like ECH-associated protein1, Keap1)结合,被泛素化。在氧化应激刺激时,Nrf2与Keap1解离而发生活化[12],活化的Nrf2进入细胞核,与抗氧化反应元件(ARE)结合,启动ARE下游的基因转录和表达,以抵抗内外界的有害刺激[13]。本研究在前期研究[8,9]的基础上,应用实时荧光定量PCR(quantitative real time PCR,QRT-PCR)方法检测SSNHL患者GC治疗前后PBMCs中Nrf2 mRNA的表达量,探讨其表达变化及其与GC抵抗的关系。
1资料与方法
1.1研究对象及分组研究对象为2014年7月至2015年5月于南京大学医学院附属鼓楼医院确诊并收治的SSNHL患者30例,其中男15例,女15例,年龄24~74岁,平均43.93±15.41岁。纳入标准:符合中华医学会耳鼻咽喉头颈外科学分会制定的突发性聋诊断标准[14],0.5~4 kHz平均听阈(pure tone average, PTA)>60 dB HL,无感音神经性聋家族史;均为单耳发病,排除了中耳、蜗后病变或有明确病因引起的感音神经性听力损失;排除中途退出研究或失访者。
根据有无接受10天以上的常规治疗(包括全身使用GC、改善微循环、营养神经等)分为初发组(7例)和难治组(23例)。所有患者发病至接受此次治疗的时间间隔为2~57天,其中初发组患者平均为3.85±1.06天,难治组患者平均为23.17±16.43天;难治组又根据发病后三个月时受损频率(0.25~8 kHz)PTA改善是否≥15 dB分为GC有效组和GC抵抗组[8,9]。选取听力正常、无耳部疾病的鼻中隔偏曲志愿者10例作为正常对照组,其中男6例,女4例,年龄19~36岁,平均26.20±5.38岁。本研究获得南京大学医学院附属鼓楼医院医学伦理委员会批准。
1.2治疗方法初发组患者全身静脉滴注甲强龙(海正辉瑞公司)(80 mg/天×4天,然后40 mg/天×3天,20 mg/天×3天),难治组患者经鼓膜置管鼓室给予甲强龙(40 mg/ml,海正辉瑞公司)(20 mg/天×10天)[6]。所有患者均同时接受银杏叶提取物注射液、单唾液酸四己糖神经节苷脂钠连续治疗10天。10天后复查纯音听阈,每月随访观察鼓膜及听力改善情况。
1.3QRT-PCR法检测PBMCs中Nrf2 mRNA表达在取得受试者同意后,分别于治疗前、治疗后第10天采集患者组及对照组空腹外周血20 ml,放入含有EDTA抗凝的试剂管内,采用密度梯度离心法分离PBMCs;按照Trizol法(Invitrogen公司)提取总RNA,使用前用紫外分光光度计测其浓度和纯度。根据TAKARA公司试剂盒Prime Script RT Master Mix说明书操作,以5 μl总RNA为模板,进行逆转录,反应条件为37 ℃ 15 min,85 ℃ 5 sec,合成cDNA,-20 ℃冰箱保存备用。
QRT-PCR检测Nrf2 mRNA表达:GAPDH及Nrf2引物由TAKARA公司合成(表1),按TAKARA SYBR Premix EX TaqII说明书配备模板,上机(ABI StepOnePlusTMReal-Time PCR System)扩增,以GAPDH作为内参,对Nrf2 mRNA表达进行相对定量。反应条件:PCR循环参数设定为95 ℃预变性30秒,95 ℃变性5秒,60 ℃退火/延伸34秒,循环40次,扩增反应结束后,进行融解曲线分析,判定是否有非特异性扩增产物的存在。计算Nrf2及GAPDH基因的Ct值,两者之差即为△Ct值,再进行2-△Ct计算,即作为评价Nrf2 mRNA相对表达水平的指标。

表1 RT-PCR引物序列
1.4统计学方法使用SPSS18.0统计软件分析数据, 本组资料符合正态分布,治疗前初发组、 难治组与对照组的组间差异采用单向方差分析,治疗前初发组与难治组之间采用独立样本T检验,同一组治疗前后结果比较采用配对t检验。P<0.05为差异有统计学意义。
2结果
2.1初发组、难治组SSNHL患者治疗效果初发组和难治组治疗后0.25~8 kHz平均PTA较治疗前均有所提高(表2),总有效率为50%,其中初发组有效率为71.43%(5/7),难治组有效率为43.47%(10/23)。
表2初发、难治组SSNHL患者治疗前后PTA
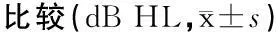

组别例数(例)治疗前治疗后T值P值初发组792.73±18.7666.15±28.563.178<0.001难治组2384.71±16.5072.21±23.154.0710.019合计3088.47±14.9871.66±24.263.798<0.001
2.2治疗前SSNHL患者PBMC中Nrf2 mRNA表达量治疗前初发组、难治组Nrf2 mRNA表达量(分别为0.514±0.052和0.520±0.049)均低于对照组(0.607±0.106),差异有统计学意义(F=6.483,P=0.004);初发组(0.514±0.052)与难治组Nrf2 mRNA表达量差异无统计学意义(T=0.052,P=0.911)。
2.3难治性SSNHL患者中GC有效组、无效组治疗前后PTA及Nrf2 mRNA表达量难治组中治疗后GC有效10例(有效组),GC无效13例(无效组),治疗后GC有效组患者PBMC中Nrf2 mRNA表达量有所上调(P<0.05),而GC无效组患者Nrf2 mRNA表达量治疗前后差异无统计学意义(P>0.05),治疗前GC有效组与GC无效组间Nrf2 mRNA表达量差异无统计学意义,治疗后两组间差异也无统计学意义(均为P>0.05)(表3)。

±s)
注:*与同组治疗前Nrf2 mRNA比较,P<0.05,**与同组治疗前PTA比较,P<0.01
3讨论
有报道指出SSNHL患者体内活性氧(reactive oxygen species,ROS)升高[15],而抗氧化治疗可有效提高SSNHL患者GC治疗的效果[16],提示氧化应激可能参与了SSNHL的发生发展,而Nrf2作为一种抗氧化转录因子,在机体内主要通过抵制氧化应激,抵抗内外界的有害刺激[13]。本研究结果显示治疗前初发组、难治组突聋患者PBMC中Nrf2 mRNA的表达量均低于正常对照组,提示Nrf2可能参与SSNHL的发生发展。正常情况下,Nrf2表达可以抵消机体升高的氧化应激[13,17],所以当Nrf2下调时,体内氧化-抗氧化平衡被打破,升高的氧化应激使耳蜗内ROS增多,诱发耳蜗毛细胞和螺旋神经节细胞凋亡或死亡,导致耳聋的发生[18~20]。而升高的ROS,使得细胞内低氧诱导因子1α(hypoxia inducible factor-1α,HIF1α)升高[21],HIF1α通过加强信号通路转导,进而增加炎症因子的表达,导致疾病的发生发展[17,22]。本研究中,治疗前难治组SSNHL患者与初发组患者之间PBMC中Nrf2 mRNA表达量无统计学差异,可能原因是难治性SSNHL患者在第一次接受常规治疗后,体内抗氧化能力尚未提高,听力无明显改善,故Nrf2 mRNA的表达量与初诊患者相比无明显提高。
前期研究提示HDAC2蛋白活性下调可能是SSNHL患者发生GC抵抗的原因之一[8,9],但其下调的原因不明。有报道指出氧化应激能明显降低HDAC酶的活性,打破组蛋白乙酰化/去乙酰化平衡,阻断GC的抗炎效应[12];也有证据显示Nrf2减少能够降低HDAC2蛋白的表达和活性[11,23],从而导致患者GC不敏感;Nrf2可以通过调控HDAC2去亚硝基化,导致炎症基因转录抑制,从而提高GC敏感性[10]。Adenuga等[24]在Nrf2与HDAC2相关性研究中发现,Nrf2基因敲除(Nrf2-/-)小鼠肺内的HDAC2水平明显下降,HDAC2基因的转录受Nrf2活性的调节,Nrf2缺失可导致HDAC2的水平降低,降低HDAC2去乙酰化的活性。本研究发现,GC有效组患者治疗后Nrf2 mRNA的表达量较治疗前有所上调(P<0.05),而GC无效组治疗前后Nrf2 mRNA的表达量无明显变化,与前期研究中显示的难治性SSNHL患者HDAC2蛋白活性的变化一致,提示Nrf2可能参与GC抵抗;因而考虑Nrf2 mRNA表达下调可能参与HDAC2蛋白的活性下降,与其他研究报道的Nrf2与HDAC2相关性相符[10,4,24,25]。GC有效组患者听力均有提高,Nrf2 mRNA表达量也有所上调,提示Nrf2上调可能有助于改善SSNHL患者的预后。在后期实验中需要增加样本量,增加观察指标,以便进一步的深入研究证实。
参考文献4
1Stachler RJ, Chandrasekhar SS, Archer SM, et al. Clinical practice guideline: sudden hearing loss[J]. Otolaryngol Head Neck Surg,2012,146:S1.
2中国突发性聋多中心临床研究协作组.中国突发性聋分型治疗的多中心研究[J].中华耳鼻咽喉头颈外科杂志,2013, 48:355.
3Wei BP, Stathopoulos D, O'Leary S. Steroids for idiopathic sudden sensorineural hearing loss[J]. Cochrane Database Syst Rev,2013,7.doi:10.1002/14651858.
4Schreiber BE , Agrup C , Haskard DO, et al. Sudden sensorineural hearing loss[J]. Lancet,2010,375:1203.
5Nakagawa T, Sakamoto T, Hiraumi H, et al. Topical insulin-like growth factor 1 treatment using gelatin hydrogels for glucocorticoidresistant sudden sensorineural hearing loss: a prospective clinical trial[J]. BMC Med,2010,8:76.
6She W, Dai Y, Du X, et al. Hearing evaluation of intratympanic methylprednisolone perfusion for refractory sudden sensorineural hearing loss[J].Otolaryngol Head Neck Surg,2010,142:266.
7Barnes PJ , Adack IM. Glucocorticoid resistance in inflammatory diseases[J]. Lancet,2009, 373:1905.
8Hou J, She W, Du X, et al. Histone deacetylase 2 in sudden sensorineural hearing loss patients in response to intratympanic methylprednisolone perfusion[J]. Otolaryngol Head Neck Surg,2015,doi:10.177/0194599815606911.
9后婕, 戴艳红, 谢利生,等.难治性突发性聋患者外周血单个核细胞内HDAC2表达与其预后的相关性分析[J]. 听力学及言语疾病杂志,2014,22:559.
10Malhotra D, Thimmulappa RK, Mercado N, et al. Denitrosylation of HDAC2 by targeting Nrf2 restores glucocorticosteroid sensitivity in macrophages from COPD patients[J]. J Clin Invest,2011, 121:4289..
11Strom J, Xu B, Tian X, et al. Nrf2 protects mitochondrial decay by oxidative stress[J]. FASEB J,2015, doi:10.1096/fi.14-268904.
12Biswal S, Thimmulappa RK, Harvey CJ. Experimental therapeutics of Nrf2 as a target for prevention of bacterial exacerbations in COPD[J]. Proc Am Thorac Soc,2012, 9:47.
13Kim SJ, Park C, Han AL, et al. Ebselen attenuates cisplatin-induced ROS generation through Nrf2 activation in auditory cells[J]. Hear Res,2009, 251:70.
14中华医学会耳鼻咽喉头颈外科学分会,中华耳鼻咽喉头颈外科杂志编辑委员. 突发性聋的诊断和治疗指南[J].中华耳鼻咽喉头颈外科杂志, 2015, 50: 443.
15Capaccio P, Pignataro L, Gaini LM, et al. Unbalanced oxidative status in idiopathic sudden sensorineural hearing loss[J]. Eur Arch Otorhinolaryngol,2012,269:449..
16Yang CH, Ko MT, Peng JP, et al. Zinc in the treatment of idiopathic sudden sensorineural hearing loss[J]. Laryngoscope,2011,121:617.
17Wiegman CH, Li F, Clarke CJ, et al. A comprehensive analysis of oxidative stress in the ozone-induced lung inflammation mouse model[J]. Clin Sci (Lond), 2014 ,126:425.
18王璐, 丁大连, 孙虹,等. 对内耳氧化抗氧化失衡的反思[J].临床耳鼻咽喉头颈外科杂志,2013, 22:965.
19Chang J, Jung HH, Yang JY, et al. Protective effect of metformin against cisplatin-induced ototoxicity in an auditory cell line[J]. J Assoc Res Otolaryngol,2014,15:149.
20Du Z, Yang Y, Hu Y, et al. A long-term high-fat diet increases oxidative stress, mitochondrial damage and apoptosis in the inner ear of D-galactose-induced aging rats[J]. Hear Res,2012, 287:15.
21Hielscher A, Gerecht S. Hypoxia and free radicals: Role in tumor progression and the use of engineering-based platforms to address these relationships[J]. Free Radical Biology and Medicine,2015,79:281.
22Riva C, Donadieu E, Magnan J, et al. Age-related hearing loss in CD/1 mice is associated to ROS formation and HIF target proteins up-regulation in the cochlea[J]. Exp Gerontol,2007, 2:327.
23Ito K, Hanazawa T, Tomita K, et al. Oxidative stress reduces histone deacetylase2 activity and enhances IL-8 gene expression: role of tyrosine nitration[J]. Biochem Biophys Res Commun,2004,315:240.
24Adenuga D, Caito S, Yao H, et al. Nrf2 deficiency influences susceptibility to steroid resistance via HDAC2 reduction[J].Biochem Biophys Res Commun,2010,403:452.
25Mercado N, Thimmulappa R, Thomas CM, et al. Decreased histone deacetylase 2 impairs Nrf2 activation by oxidative stress[J]. Biochem Biophys Res Commun,2011, 406:292.
(2015-09-14收稿)
(本文编辑李翠娥)
·临床研究·
Study of the Expression of Nrf2 in Peripheral Blood Mononuclear Cells From Sudden
Deafness Patients Treated with Methylprednisolone
Qi Hui, Dai Yanhong, Hou Jie, Zhou Qiongqiong, Wei Xianmei, Yang Ye, She Wandong
(Department of Otolaryngology-Head and Neck Surgery, the Affiliated Drum Tower
Hospital, Medical School of Nanjing University,Nanjing,210008,China)
【Abstract】ObjectiveTo evaluate the expression of Nrf2 and the relationship in patients with sudden deafness.MethodsPBMCs were collected from 10 hearing normal volunteers (control group) and 30 sudden sensorineural hearing loss patients before and after treatment with methylprednisolone for 10 days. We divided the SSNHL patients into 2 groups (Initial treatment group and difficult-to-treat group)according to their visit time and treatment way. We also divided the difficult-to-treat SSNHL patients into 2 groups(GC sensitive group and GC insensitive group)according to their hearing recovery. Quantitative Real Time PCR was used to detect the expression level of Nrf2 mRNA in PBMCs. The data were analyzed with SPSS 18.0 software.ResultsBefore accept treatment, the expression level of Nrf2 mRNA in PBMCs from Initial treatment group and difficult-to-treat group were below
*国家自然科学基金(81271074),江苏省临床医学科技专项(BL2014002),江苏省第十批“六大人才高峰项目”(WSN-009),南京市国际联合研究项目(2012sd311038)联合资助
1南京大学医学院附属鼓楼医院耳鼻咽喉科(南京210008)
control group whereas there was no obvious difference between the two groups. The Nrf2 mRNA expression in GC sensitive group increased whereas The Nrf2 mRNA expression in GC insensitive group had no obvious change after 10 days treatment with methylprednisolone.ConclusionNrf2 may take part in the generation and development in SSNHL. Difficult-to-treat SSNHL with corticosteroid in-sensitivity may have relationship with the lower Nrf2 expression. We speculate that increasing the expression of Nrf2 may improve the effect of glucocorticoids and has a positive effect for hearing improvement.
【Key words】SSNHL;Glucocorticoid resistance;Nrf2;PBMCs
通讯作者:佘万东(Email:shewandong@163.com)
作者简介:齐慧,女,安徽人,研究生,主要研究方向为听力学基础与临床。
【中图分类号】R764.43+3
【文献标识码】A
【文章编号】1006-7299(2016)01-0001-04
DOI:10.3969/j.issn.1006-7299.2016.01.001
