内质网应激在顺铂诱导离体小鼠耳蜗毛细胞凋亡中的作用*
2016-02-23张晓周明生于利王爱梅
张晓 周明生 于利 王爱梅
内质网应激在顺铂诱导离体小鼠耳蜗毛细胞凋亡中的作用*
张晓1周明生1于利1王爱梅1
【摘要】目的研究内质网应激(endoplasmic reticulum stress,ERS)在顺铂诱导离体培养小鼠耳蜗毛细胞凋亡中的作用。方法选取出生后 3 d的健康昆明小鼠380只(760耳),分离出耳蜗基底膜760条,体外培养24 h后,随机分为对照组和4、8、16 μg/ml顺铂组,每组190条,对照组加入2 ml新鲜培养基,顺铂组分别加入2 ml含不同浓度顺铂(4、8、16 μg/ml)的新鲜培养基,再继续培养24 h后,应用Hoechst 33258荧光染色观察耳蜗毛细胞凋亡情况,并应用Western blot检测ERS标志物葡萄糖调节蛋白78(glucose-regulated protein 78,GRP78)和内质网凋亡途径标志物半胱氨酸天冬氨酸蛋白酶-12(cysteinyl aspartate specific proteinase 12,caspase-12)在耳蜗毛细胞中的表达。 结果4、8、16 μg/ml顺铂组耳蜗毛细胞凋亡率分别为10.53%±0.50%、27.12%±2.64%和60.01%±2.75%,均高于对照组(3.67%±0.76%),呈现明显的量效关系;不同浓度顺铂组耳蜗GRP 78和caspase-12的蛋白表达水平亦较对照组明显增高(P<0.01),并随顺铂浓度增大而显著增强(P<0.01)。结论顺铂可诱发小鼠耳蜗毛细胞ERS,ERS可能在其诱导的小鼠耳蜗毛细胞凋亡中发挥了作用。
【关键词】内质网应激;顺铂;耳蜗;凋亡;小鼠
网络出版时间:2015-12-2815:12
网络出版地址:http://www.cnki.net/kcms/detail/42.1391.R.20151228.1512.010.html
*辽宁省自然科学基金资助项目(2014022029)
1辽宁医学院生理学教研室(锦州121001)
顺铂是临床上常用的高效化疗药物,具有很强的耳毒性,其机制与触发耳蜗内氧自由基的过量生成并最终导致耳蜗毛细胞凋亡有关[1]。研究表明,在顺铂诱导耳蜗细胞凋亡的过程中有线粒体和死亡受体这两条细胞凋亡途径参与[2];最近发现,内质网途径是顺铂诱导细胞凋亡的一种新型途径[3]。内质网是真核细胞中最重要的负责蛋白质合成与折叠的细胞器,其可受缺氧、药物毒性、氧化应激等因素影响,导致其功能受损,从而产生内质网应激(endoplasmic reticulum stress,ERS)[4];在此过程中,ERS特异性标志蛋白葡萄糖调节蛋白78(glucose-regulated protein 78,GRP78)持续高表达,并最终激活半胱氨酸天冬氨酸蛋白酶-12(cysteinyl aspartate specific proteinase 12,caspase-12),触发内质网凋亡途径,导致细胞凋亡[5, 6]。ERS是否参与了顺铂诱导的小鼠耳蜗毛细胞凋亡,目前尚不清楚。据此,本研究拟通过观察顺铂对离体培养小鼠耳蜗毛细胞的凋亡作用,并检测顺铂干预的离体培养小鼠耳蜗中ERS特异性标志蛋白GRP78和caspase-12的表达,初步探讨ERS在顺铂诱导离体小鼠耳蜗细胞凋亡中的作用,为临床防护顺铂的耳毒性提供参考。
1材料与方法
1.1实验材料实验动物为生后3 d的健康昆明小鼠380只(760耳),雌雄不限,由辽宁医学院实验动物中心提供;顺铂和牛血清白蛋白购自美国Sigma公司,DMEM/F12培养基购自美国Hyclone公司,Hoechst 33258购自上海碧云天生物技术研究所,羊抗GRP 78抗体购自美国Santa Cruz公司,兔抗caspase-12抗体购自美国Cell Signaling Technology 公司;Mini-PROTEAN电泳仪由美国Bio-Rad公司生产,MCO-15A型CO2培养箱由日本SANYO公司生产,BX41研究级正置荧光显微镜由日本Olympus公司生产。
1.2实验方法
1.2.1耳蜗基底膜培养将小鼠用75 %乙醇喷洒消毒,断头后沿矢状缝剪开颅骨,除去脑组织,暴露出颅底。体视显微镜下取出小鼠耳蜗,移入预冷的Hanks液中,去除耳蜗壳,依次剥离螺旋韧带、前庭膜以及血管纹等结构,分离出整个基底膜,共分离760条耳蜗基底膜。在培养皿中滴入10 μl胶原凝胶液,室温下放置15~20 min。待胶原凝胶液凝固后,加入含1%牛血清白蛋白的DMEM/F12培养基1 ml,然后将分离的基底膜平铺到凝胶表面,在37 ℃、5% CO2培养箱中孵育,4 h后再加入1 ml培养基,直至覆盖凝胶。然后将培养皿放回培养箱中继续培养24 h[7]。
1.2.2实验分组及离体顺铂耳毒性模型制备经培养24 h后,弃去原培养基,将基底膜随机分为对照组和4、8、16 μg/ml顺铂组,每组190条,对照组加入2 ml新鲜培养基,其余3组分别加入2 ml含有不同浓度顺铂(4 μg/ml、8 μg/ml和16 μg/ml)的新鲜培养基,继续培养24 h后终止实验。每组随机取10条基底膜用于Hoechst 33258荧光染色,其余的每30条基底膜合为一份标本,每组共6份标本,用于进行Western blot以检测GRP 78和caspase-12的表达。
1.2.3Hoechst 33258荧光染色及耳蜗凋亡毛细胞计数终止实验后吸出培养基,用PBS漂洗基底膜,然后缓慢加入4 %多聚甲醛,4 ℃下固定过夜。次日,PBS漂洗后加入0.25 %Triton X-100溶液,室温下处理30 min。PBS漂洗后加入Hoechst 33258溶液(2.5 μg/ml)室温避光染色10 min。PBS漂洗后,将基底膜连同凝胶一起放在滴有抗荧光淬灭封片剂的载玻片上,盖上盖玻片,荧光显微镜下观察耳蜗毛细胞的凋亡情况,以细胞核呈高亮状态、出现核固缩、核碎裂的毛细胞判定为凋亡毛细胞。在荧光显微镜下,将各组耳蜗基底膜由底端向顶端随机选取200个毛细胞,计数其中凋亡的毛细胞个数,并根据公式:毛细胞凋亡率=凋亡毛细胞数/200×100%,计算出毛细胞凋亡百分率。
1.2.4Western blot检测GRP78和caspase-12的表达向标本中加入RIPA裂解液,0 ℃下超声粉碎30 s,然后4 ℃下离心25 min(12 000 rpm/min)。取上清并测定蛋白含量。灌胶后每条泳道加入40 μg蛋白样品,经SDS聚丙烯酰胺凝胶电泳后转膜,再置于10%牛血清白蛋白封闭液中,4 ℃下摇床孵育1 h。然后分别加入抗GRP78和caspase-12抗体(均为1:1 000稀释),4 ℃下摇床过夜。次日,TBST冲洗后加入辣根过氧化物酶标记的二抗(1:1 000稀释),4 ℃下摇床孵育1 h。TBST冲洗后滴加ECL显色剂,曝光、显影后得到电泳条带。应用Image-Pro Plus 6.0 软件读取各电泳条带的灰度值,以β-actin作为内参照物,GRP78/β-actin和caspase-12/β-actin比值分别代表GRP78和caspase-12的蛋白表达水平。
1.3统计学方法应用SPSS 19.0统计软件对实验数据进行分析,各组间数据比较采用单因素方差分析及SNK检验,以P<0.05表示差异有统计学意义,P<0.01表示差异有显著统计学意义。
2结果
2.1各组离体小鼠耳蜗毛细胞的凋亡比较Hoechst 33258荧光染色结果显示,对照组小鼠耳蜗毛细胞核多呈淡蓝色,核内染色质分布比较均匀(图1a),而顺铂组小鼠耳蜗毛细胞核多呈亮蓝色,核内染色质边缘化、凝集成块状或呈不规则碎片状;并且随着顺铂浓度的逐渐增大,破碎的细胞核显著增多(图1b~1d)。对照组耳蜗毛细胞凋亡率为3.67%±0.76%,而不同浓度顺铂组毛细胞凋亡率较对照组明显增高(P<0.01),并呈现出明显的量效关系(表1)。
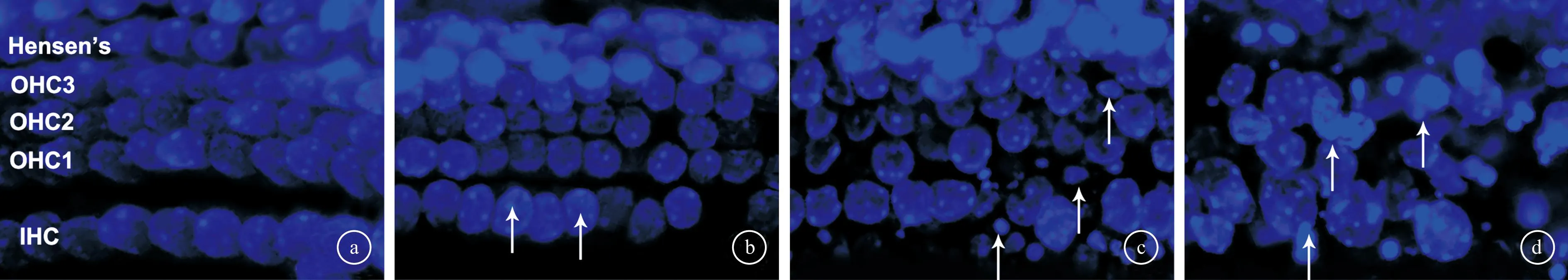
图1 各组离体小鼠耳蜗毛细胞凋亡检测 (Hoechst 33258荧光染色,bar=20 μm)

±s,n=10)
注:*与对照组比较,P<0.01;#与4 μg/ml顺铂组比较,P<0.01;▲与8 μg/ml顺铂组比较,P<0.01
2.2各组离体小鼠耳蜗毛细胞GRP 78和caspase-12的表达Western blot 检测结果显示,对照组小鼠耳蜗毛细胞ERS标志性蛋白GRP78和caspase-12的电泳条带较弱,而不同浓度顺铂组GRP78和caspase-12的电泳条带明显深于对照组(图2)。半定量分析结果显示,不同浓度顺铂组GRP78/β-actin比值和caspase-12/β-actin比值均较对照组明显增大(P<0.01),即GRP78和caspase-12的蛋白表达水平均较对照组明显增高(P<0.01),并且随着顺铂浓度的逐渐增高而显著增强,呈现明显的量效关系(P<0.05)(表2)。

图2 各组离体小鼠耳蜗毛细胞GRP 78和caspase-12电泳条带
A. 对照组;B. 4 μg/ml顺铂组;C. 8 μg/ml顺铂组;D. 16 μg/ml顺铂组
表2各组离体小鼠耳蜗毛细胞GRP 78和caspase-12


组别GRP78/β-actin比值caspase-12/β-actin比值对照组35.88±0.6516.65±0.084μg/ml顺铂组44.09±0.43*31.34±0.11*8μg/ml顺铂组64.40±0.85*#56.63±0.40*#16μg/ml顺铂组83.12±0.37*#▲60.01±0.51*#▲
注:*与对照组比较,P<0.01;#与4 μg/ml顺铂组比较,P<0.01;▲与8 μg/ml顺铂组比较,P<0.01
3讨论
凋亡是细胞的一种基本生物学现象,是在多基因严格控制下的细胞主动争取有序死亡的过程,以维持细胞的内环境稳态。然而,射线、药物等多种因素都能诱导细胞凋亡的异常增多,从而引发疾病。研究表明,诱导耳蜗细胞凋亡是顺铂产生耳毒性损伤的重要机制之一[1, 2],顺铂水解产物的主要靶点是DNA,导致DNA链内和链间发生交联,形成加合物,从而使DNA的结构发生变形,细胞内某些蛋白可以识别DNA的这些变形损伤并与之相互作用,进而启动了细胞凋亡途径[8]。DNA特异性荧光染料Hoechest 33258可与细胞核DNA进行非嵌入式结合,使细胞核着色,在紫外光激发下呈现明显的蓝色荧光;本研究选用Hoechest 33258荧光染色观察顺铂对离体新生小鼠耳蜗毛细胞的凋亡作用,结果显示,对照组偶有毛细胞凋亡,而不同浓度顺铂组凋亡毛细胞则较对照组明显增多,并且随着顺铂浓度的逐渐增高,毛细胞凋亡率亦显著升高,表明顺铂已诱导离体小鼠耳蜗毛细胞发生凋亡。
研究表明,顺铂诱导耳蜗细胞凋亡的途径可分为内源性(线粒体)途径与外源性(死亡受体)途径,这两条途径最终都依赖于caspase的激活而引起细胞凋亡[2]。近年来发现,内质网途径是顺铂诱导细胞凋亡的一种新型途径[3];内质网作为一个重要的细胞器,主要参与内分泌蛋白和膜蛋白的翻译、合成、折叠及修饰等过程;当药物、毒素、氧自由基等多种生理或病理刺激导致蛋白质在细胞内没有正确折叠时,则大量的错误折叠/未折叠蛋白在内质网腔内堆积,从而扰乱内质网的正常功能,产生ERS,这时,ERS主要通过启动未折叠蛋白反应(unfolded protein response,UPR)以达到缓解应激、保护细胞的作用。然而,ERS持续存在时,UPR将不能修复细胞损伤,最终激活内质网凋亡途径诱导细胞凋亡。GRP 78作为第一个被发现的内质网分子伴侣,既参与UPR的调控,也参与ERS的启动和细胞凋亡的发生,因此,GRP 78的高表达已成为细胞ERS存在的标志[9]。Caspase-12是caspase家族中唯一定位于内质网的成员,仅特异性地在ERS介导的凋亡途径中被活化,而在线粒体或死亡受体介导的凋亡途径中则不被活化,故caspase-12是ERS介导细胞凋亡的标志分子。谢静等[10]观察到老年大鼠耳蜗中caspase-12水平显著升高,提示内质网特异性凋亡途径参与了老年性聋的发生和发展;此外,该实验在用D-半乳糖制备的衰老模型大鼠耳蜗细胞中观察到GRP 78的高表达,提示拟老化大鼠模型中内耳代谢紊乱诱导了ERS反应,GRP 78参与了内耳损伤的过程[11]。薛秋红等[12]报道强噪声可诱导豚鼠耳蜗螺旋神经节细胞凋亡,同时伴随GRP 78和caspase-12的高表达,提示ERS参与了强噪声诱导的豚鼠耳蜗细胞凋亡。本研究结果显示,给予不同浓度顺铂后,离体新生小鼠耳蜗毛细胞凋亡率明显升高,同时GRP 78和caspase-12的蛋白表达水平也明显增强,与对照组比较有显著性差异;并且随着顺铂浓度的逐渐增大,毛细胞凋亡率及GRP 78和caspase-12的蛋白表达水平亦显著增高,呈现明显的量效关系。由此提示顺铂可诱发小鼠耳蜗毛细胞ERS,ERS参与了顺铂诱导的小鼠耳蜗毛细胞凋亡。至于ERS发挥作用的具体机制及其相关分子通路,尚有待今后进一步深入探讨。
参考文献4
1Schacht J, Talaska AE, Rybak LP. Cisplatin and aminoglycoside antibiotics: hearing loss and its prevention [J]. Anat Rec (Hoboken), 2012, 295: 1837.
2Op de Beeck K, Schacht J, Van Camp G. Apoptosis in acquired and genetic hearing impairment: the programmed death of the hair cell [J]. Hear Res, 2011, 281: 18.
3Gao Z, Liu G, Hu Z, et al. Grape seed proanthocyanidin extract protects from cisplatin-induced nephrotoxicity by inhibiting endoplasmic reticulum stress-induced apoptosis [J]. Mol Med Rep, 2014, 9: 801.
4Lee J, Ozcan U. Unfolded protein response signaling and metabolic diseases [J]. J Biol Chem, 2014, 289: 1203.
5Rao RV, Peel A, Logvinova A, et al. Coupling endoplasmic reticulum stress to the cell death program: role of the ER chaperone GRP78 [J]. FEBS Lett, 2002, 514: 122.
6Rao RV, Hermel E, Castro Obregon S, et al. Coupling endoplasmic reticulum stress to the cell death program Mechanism of Caspase activation [J]. J Biol Chem, 2001, 276: 33869.
7王爱梅, 许涛, 刘双月, 等. α-硫辛酸对卡那霉素致离体小鼠耳蜗毛细胞损伤的防护作用[J]. 中国老年学杂志, 2013, 33: 4751.
8Gao X, Kong L, Lu X, et al. Paraspeckle protein 1 (PSPC1) is involved in the cisplatin induced DNA damage response-role in G1/S checkpoint[J]. PLoS One,2014,9:e97174.
9Park YJ, Yoo SA, Kim WU. Role of endoplasmic reticulum stress in rheumatoid arthritis pathogenesis [J] . J Korean Med Sci, 2014, 29: 2.
10谢静, 罗凌慧. 内质网应激在老年大鼠耳蜗细胞凋亡中的作用[J]. 中国耳鼻咽喉头颈外科, 2008, 15: 569.
11谢静, 罗凌惠, 薛秋红, 等. 内质网分子伴侣GRP78在拟老化大鼠耳蜗中变化的研究[J]. 临床耳鼻咽喉头颈外科杂志, 2010, 24: 28.
12薛秋红, 何坚, 陈佳, 等. 内质网应激反应参与强噪声诱导豚鼠耳蜗螺旋神经节细胞凋亡的研究[J]. 武汉大学学报(医学版), 2012, 33: 169.
(2015-01-01收稿)
(本文编辑李翠娥)
·实验研究·
The Role of Endoplasmic Reticulum Stress in Cisplatin-Induced Apoptosis
of Mouse Cochlear Hair Cell in Vitro
Zhang Xiao, Zhou Mingsheng, Yu Li, Wang Aimei
(Department of Physiology, Liaoning Medical University, Jinzhou, 121001, China)
【Abstract】ObjectiveTo investigate the role of endoplasmic reticulum stress (ERS) in cisplatin-induced apoptosis in mouse cochlear hair cells in vitro.MethodsA total of 760 cochlear basilar membranes from healthy Kunming mice at postnatal day 3 were isolated and cultured for 24 hours, then randomly divided into the control group and the cisplatin groups (4 μg/ml, 8 μg/ml and 16 μg/ ml) , each group contained 190 basilar membranes. Four groups were continually cultured for another 24 hours. Cochlear hair cell apoptosis was determined by Hoechst 33258 staining. The protein expressions of glucose-regulated protein 78 (GRP78, a marker of ERS) and cysteinyl aspartate specific proteinase 12 (caspase-12, a marker of apoptosis) were determined by Western blot.ResultsThe percent of apoptotic hair cells in the 3 cisplatin groups (10.53%±0.50%,27.12%±2.64% and 60.01%±2.75%, respectively) was greater than that of in the control group (3.67%±0.76%), showing a clear dose-response relationship (P<0.01). Furthermore, cisplatin dose-dependently increased the expression levels of GRP 78 and caspase-12 (all P<0.01, vs. control). ConclusionOur results suggest that cisplatin induces ERS in the mouse coch hair cells, which may play a role in the cisplatin-induced cochlear hair cell apoptosis.
【Key words】Endoplasmic reticulum stress;Cisplatin;Cochlea;Apoptosis;Mouse
通讯作者:王爱梅(Email: aimeiwang88@163.com)
作者简介:张晓,女,河北人,硕士研究生,主要研究方向为听觉生理与病理。
【中图分类号】R764.43
【文献标识码】A
【文章编号】1006-7299(2016)01-0054-04
DOI:10.3969/j.issn.1006-7299.2016.01.013
