儿茶素对胃癌细胞SGC-7901和MGC-803迁移及侵袭的影响*
2016-02-23杜培培刘宗文张钰浩尚淑芳贾丹辉
杜培培,刘宗文,张 艳#,张钰浩,尚淑芳,贾丹辉
1)郑州大学基础医学院药理学教研室 郑州 450001 2)郑州大学第二附属医院肿瘤放疗科 郑州 450014 3)郑州大学临床医学系 郑州 450052
儿茶素对胃癌细胞SGC-7901和MGC-803迁移及侵袭的影响*
杜培培1),刘宗文2),张艳1)#,张钰浩3),尚淑芳1),贾丹辉1)
1)郑州大学基础医学院药理学教研室 郑州 4500012)郑州大学第二附属医院肿瘤放疗科 郑州 4500143)郑州大学临床医学系 郑州 450052
关键词胃癌;酸敏感离子通道;阿米洛利;儿茶素
摘要目的:探讨儿茶素是否作用于酸敏感离子通道(ASICs),进一步研究儿茶素是否通过ASICs对胃癌细胞迁移和侵袭产生影响。 方法:采用MTT法检测儿茶素(0、50、100、200、400 μmol/L)对胃癌细胞SGC-7901和MGC-803增殖的影响。将细胞分为对照组,100 μmol/L阿米洛利组,50、100、200 μmol/L儿茶素组,采用免疫细胞化学方法检测ASIC1的表达情况,Transwell实验和划痕实验检测细胞的迁移和侵袭情况。采用全细胞膜片钳技术观察对照组、100 μmol/L阿米洛利组、400 μmol/L儿茶素组细胞的电流情况。 结果:ASIC1在各组细胞中均有表达,并且与SGC-7901细胞相比, MGC-803细胞中ASIC1的表达较低(P<0.05);与对照组相比,儿茶素可以抑制ASIC1的表达,并且儿茶素的抑制作用弱于阿米洛利的抑制作用(P均<0.05)。与SGC-7901细胞相比,MGC-803细胞的侵袭和迁移能力较弱(P均<0.05);与对照组相比,儿茶素可减弱2种胃癌细胞的侵袭能力和迁移能力,并且儿茶素的抑制作用弱于阿米洛利的抑制作用(P均<0.05)。MGC-803细胞的ASICs电流小于SGC-7901细胞的ASICs电流(P<0.05);与对照组相比,儿茶素可使ASICs电流减弱,并且儿茶素的抑制作用弱于阿米洛利的抑制作用(P均<0.05)。结论:儿茶素可以通过抑制ASICs的表达抑制胃癌细胞的迁移和侵袭。
AbstractAim: To investigate the effects of catechin on ASICs, and explore the effects of catechin on invasion and metastasis of gastric carcinoma cells. Methods: The SGC-7901 and MGC-803 cells were treated with 0,50,100,200,and 400 μmol/L catechin and the proliferation of the cells were observed by MTT.The SGC-7901 and MGC-803 cells were allocated into control group, 100 μmol/L amiloride group, 50, 100, 200 μmol/L catechin groups;the expression of ASIC1 protein was detected by immunocytochemistry,and the changes of cell invasion and metastasis were detected by wound-healing migration assay and Transwell migration assay, respectively. Finally, the ASICs current was analyzed by the whole cell patch clamp.Results: Expression of ASIC1 protein in MGC-803 cells was lower that in SGC-7901 cells(P<0.05).Compared with the control group, catechin reduced ASIC1 expression,and the inhibitive effect of catechin on ASIC1 expression was weaker than that of Amiloride (P<0.05). The invasion and metastasis ability of MGC-803 cells were weaker than that of SGC-7901 cells(P<0.05).Compared with the control group,catechin could reduce invasion and metastasis ability of MGC-803 and SGC-7901 cells, and the inhibitive effect of catechin was weaker than that of Amiloride(P<0.05). The ASICs current of MGC-803 was lower than that of SGC-7901 cells(P<0.05).Compared with the control group,catechin could reduce ASICs current of MGC-803 and SGC-7901 cells,and the inhibitive effect of catechin was weaker than that of Amiloride(P<0.05).Conclusion: Catechin could inhibit invasion and metastasis ability of gastric carcinoma cells by reducing the expression of ASICs.
胃癌是常见的恶性肿瘤之一,复发率很高。研究[1]表明,胃癌的生物学行为与某些分子指标有关。胃癌侵袭转移的程度是影响预后的主要因素[2],而肿瘤转移的特性是肿瘤治疗的难点[3]。肿瘤细胞的侵袭和转移是一个复杂和多步骤的连续发展过程[4]。研究[5]表明,组织酸化在肿瘤细胞的侵袭和转移中起着至关重要的作用,而酸敏感离子通道(ASICs)是细胞膜上一类可以被酸性溶液直接激活的通道蛋白,抑制ASICs表达可以抑制胶质瘤细胞的侵袭转移;阿米洛利作为ASICs的抑制剂可以减弱胶质瘤细胞的侵袭转移。儿茶素是一种黄烷醇类化合物,具有较明显的抗癌作用[6],可抑制肿瘤增殖,促进肿瘤细胞的凋亡[7-10];同时也可抑制肿瘤细胞的侵袭转移[11-13]。该研究采用全细胞膜片钳方法及体外侵袭生物学实验观察儿茶素对ASICs的作用,以及对胃癌细胞侵袭和迁移能力的影响,从而为儿茶素治疗胃癌提供新的理论依据。
1材料与方法
1.1细胞与试剂胃癌细胞(SGC-7901、MGC-803)由河南省医学研究所馈赠。ASIC1抗体(北京博奥森生物有限公司),阿米洛利、儿茶素(美国Sigma公司)。
1.2MTT法检测胃癌细胞的生存率将2种胃癌细胞分别以 5×104mL-1接种在96孔板中;24 h后换为无血清DMEM高糖培养液,调整儿茶素浓度为0(对照)、50、100、200、400 μmol/L,各浓度设定培养时间为24 h;终止培养前4 h,每孔加20 μL MTT、150 μL二甲基亚砜,30 min后用酶标仪(检测波长为490 nm)检测各孔吸光度值,以对照组的细胞生存率为1计算2种细胞的生存率。实验重复3次。
1.3免疫细胞化学方法检测ASIC1的表达将2种胃癌细胞培养于24孔板中,调整阿米洛利终浓度为100 μmol/L,儿茶素终浓度为50、100、200 μmol/L,另设对照组和阴性对照组,培养48 h后用40 g/L的多聚甲醛固定20 min;按SP试剂盒说明进行操作;每张爬片观察5个高倍视野,阳性细胞的胞膜和胞质为棕黄色,胞核为蓝色,计数100个细胞中的阳性细胞数,计算阳性率。实验重复3次。
1.4细胞迁移能力的测定参照文献[14],取2种胃癌细胞按每孔5×105个细胞接种于6孔板,划痕,PBS清洗。加入含药或者不含药的无血清培养基(分组同1.3),在 0、24 h 分别于倒置显微镜下拍照,与0 h比较计算24 h细胞迁移的距离,以SGC-7901对照组细胞的迁移率为1计算各组细胞的迁移率。实验重复3次。
1.5细胞侵袭能力的测定参照文献[15],细胞分组同1.3,每孔加入16稀释胶40 μL,放入37 ℃培养箱中30 min;调整细胞密度为1×106mL-1,每孔加200 μL细胞悬液;24孔板下室加含体积分数30%新生牛血清的DMEM培养基600 μL;200倍镜下每孔取5个视野拍照,记录穿膜细胞数并求平均值。实验重复3次。
1.6全细胞膜片钳观察细胞的ASICs电流将细胞分为对照组、100 μmol/L阿米洛利组和400 μmol/L儿茶素组,培养24 h,待细胞贴壁且状态良好时进行检测。电极内液包含:100 mmol/L葡萄糖酸钾、30 mmol/L KCl、10 mmol/L NaCl、20 mmol/L HEPES、0.5 mmol/L EGTA、4 mmol/L ATPNa2;细胞外液包含:125 mmol/L NaCl、5 mmol/L KCl、1.2 mmol/L MgSO4、1 mmol/L CaCl2、1 mmol/L NaH2PO4、10.5 mmol/L葡萄糖、32.5 mmol/L HEPES。实验时将细胞置于35 mm培养皿中,加入细胞外液1 mL,放置在倒置显微镜平台上;使充满电极内液的玻璃微电极尖端吸附在细胞膜上,给予负压,电压钳制在-60 mV,破膜5 min后开始检测电流。实验重复3次。
1.7统计学处理应用SPSS 19.0处理数据,应用单因素方差分析和LSD-t检验比较各组细胞生存率、ASIC1阳性表达率、迁移侵袭能力、ASICs电流的差异,检验水准α=0.05。
2结果
2.1MTT法检测不同浓度的儿茶素对胃癌细胞生存率的影响结果见表1。
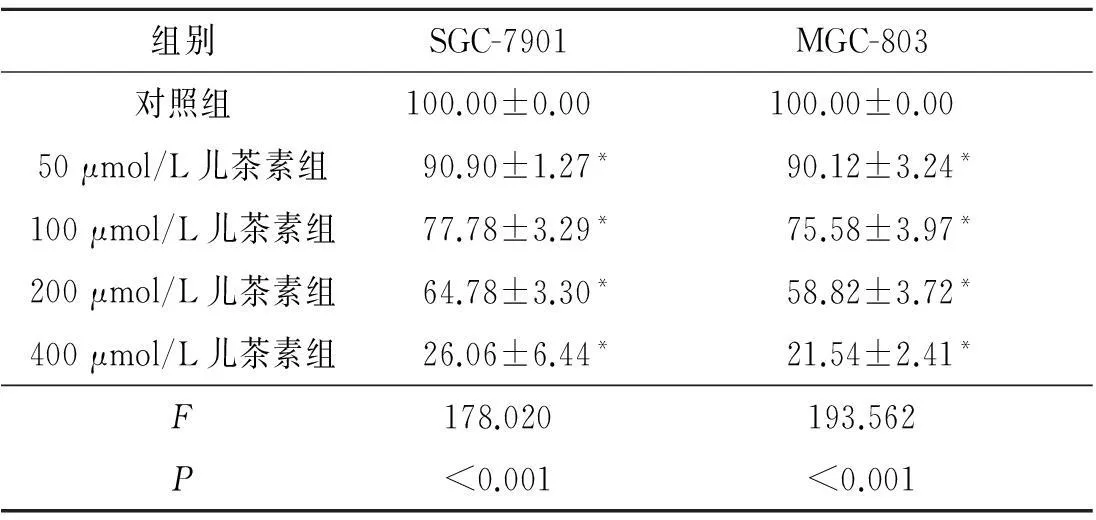
表1 各组细胞生存率的比较(n=3) %
*:与对照组相比,P<0.05。
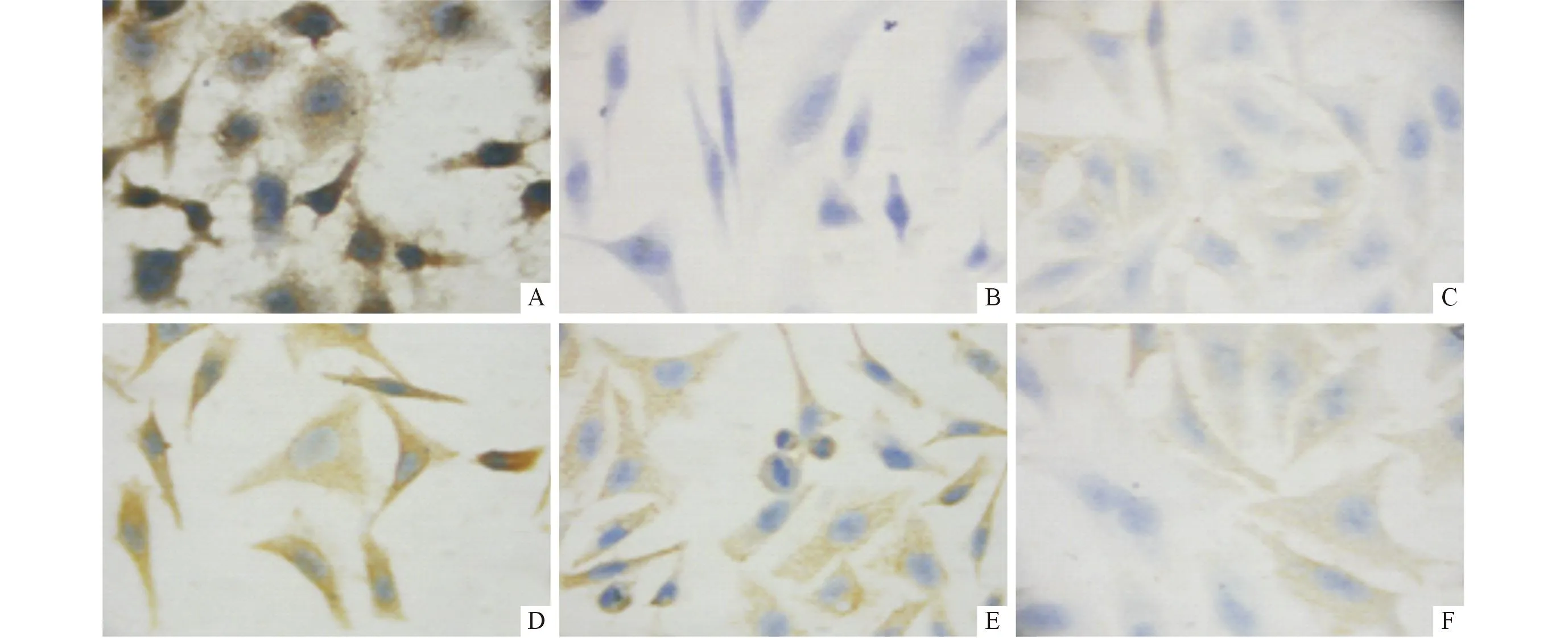
A:对照组;B:阴性对照组;C:100 μmol/L阿米洛利组;D:50 μmol/L儿茶素组;E:100 μmol/L儿茶素组;F:200 μmol/L儿茶素组。图1 各组SGC-7901细胞中ASIC1的表达(SP,×400)
2.2各组细胞中ASIC1的表达情况结果见图1、2和表2。
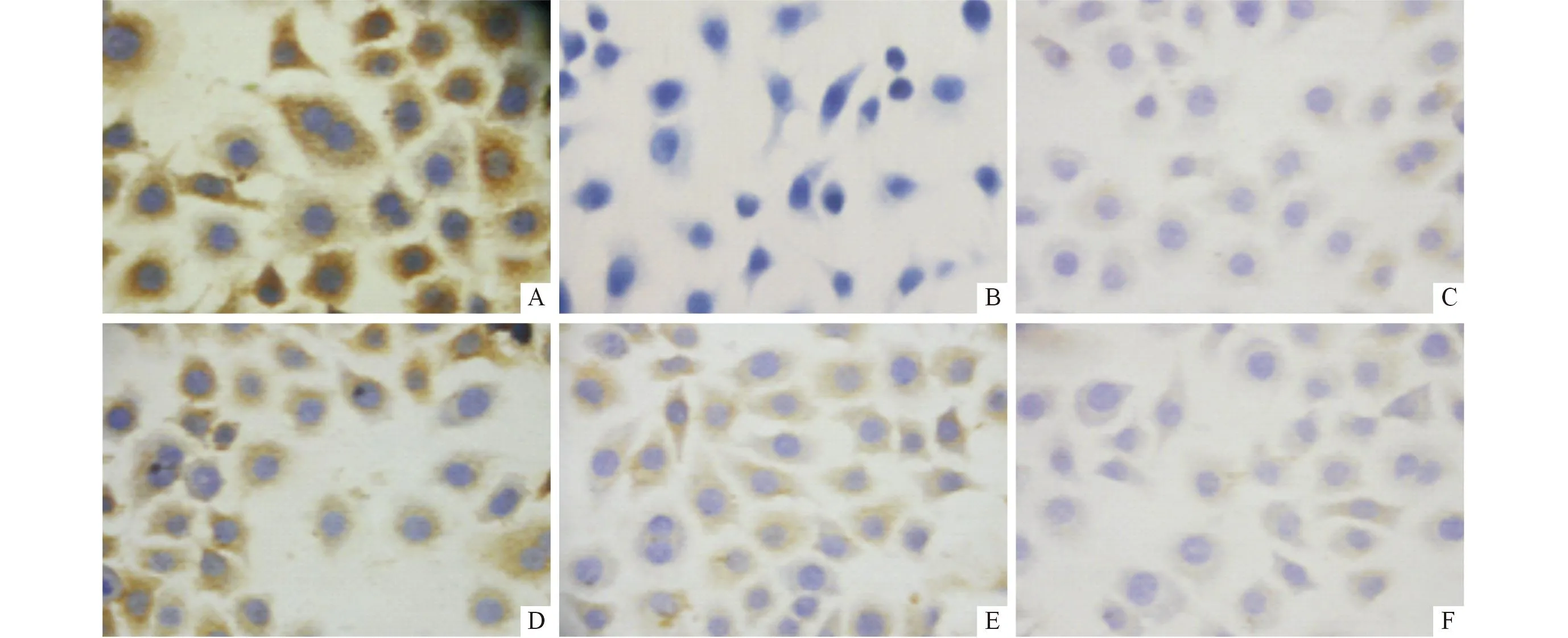
A:对照组;B:阴性对照组;C:100 μmol/L阿米洛利组;D:50 μmol/L儿茶素组;E:100 μmol/L儿茶素组;F:200 μmol/L儿茶素组。图2 各组MGC-803细胞中ASIC1的表达(SP,×400)

表2 各组细胞ASIC1阳性表达率的比较(n=3) %
*:与对照组相比,P<0.05;#:与100 μmol/L阿米洛利组相比,P<0.05;▲:与SGC-7901对照组相比,P<0.05。
2.3各组细胞迁移能力的比较结果见表3。
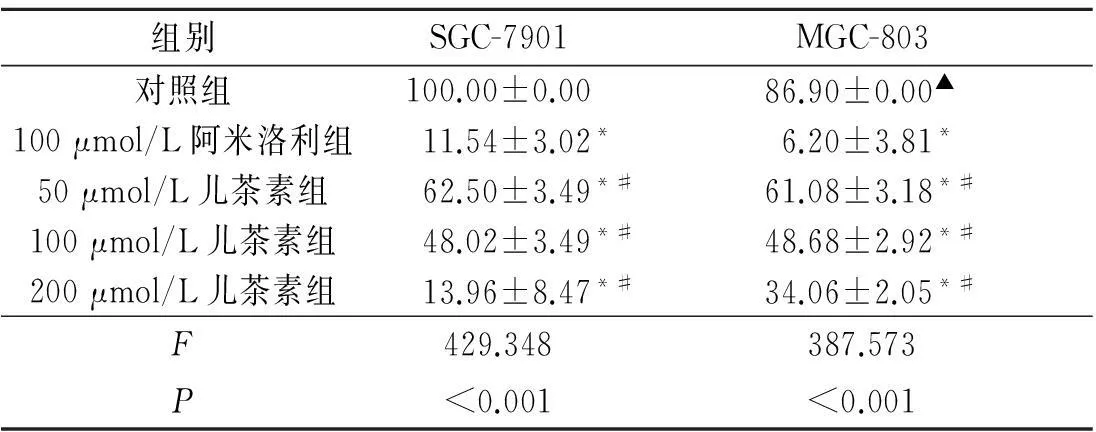
表3 各组细胞迁移率的比较(n=3) %
*:与对照组相比,P<0.05;#:与100 μmol/L阿米洛利组相比,P<0.05;▲:与SGC-7901对照组相比,P<0.05。
2.4各组细胞侵袭能力的比较结果见表4。
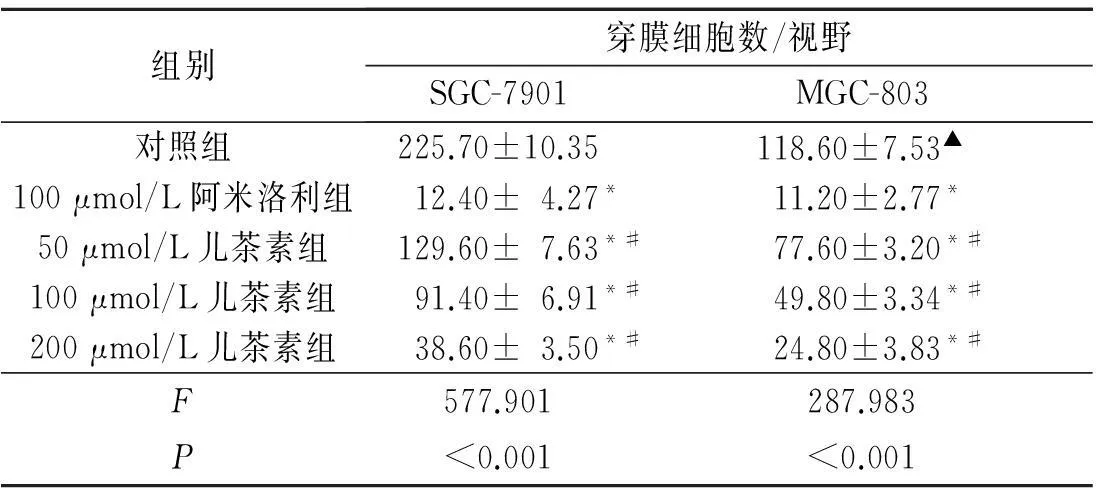
表4 各组细胞侵袭能力的比较(n=3)
*:与对照组相比,P<0.05;#:与100 μmol/L阿米洛利组相比,P<0.05;▲:与SGC-7901对照组相比,P<0.05。
2.5各组细胞ASICs电流强度的比较结果见表5。

表5 各组细胞ASICs电流强度的比较(n=3) pA
*:与对照组相比,P<0.05;#:与100 μmol/L阿米洛利组相比,P<0.05;▲:与SGC-7901对照组相比,P<0.05。
3讨论
胃癌的复发率和病死率较高,其中胃癌的侵袭转移是导致其复发的主要原因。侵袭转移是恶性肿瘤的重要生物学行为,是影响抗肿瘤治疗及预后的重要因素之一[16]。ASICs是细胞膜上由细胞外H+直接激活的通道蛋白,目前,已有6个ASICs亚基被克隆,分别是 ASIC1a、1b、2a、2b、3和4[17]。研究[18]表明其在脑缺血等伴有组织酸化的病理状态中发挥作用,当脑缺血发生时,细胞周围的pH从7.4降至6.0甚至更低,这样就刺激ASIC1a开放,介导钙内流,诱导神经元凋亡从而促使神经元损伤。研究[19]表明,组织酸化和乏氧是肿瘤微环境的重要生物学特征。肿瘤的微环境乏氧和酸化与脑缺血组织酸化具有相似的病理基础。ASICs在神经胶质瘤细胞中有表达,它的表达与神经胶质瘤的发生发展密切相关[20]。也有研究[21]发现在腺样囊性癌细胞和组织中均有ASICs的表达,但是在正常组织中并未见ASICs的明显表达。
该研究中免疫细胞化学检测结果显示,在2种胃癌细胞SGC-7901和MGC-803中均有ASIC1的表达,说明ASICs可能与胃癌的发生发展有一定关系;SGC-7901细胞是中分化高转移胃癌细胞,而MGC-803细胞是低转移胃癌细胞,2种细胞的侵袭转移能力有差别,推测胃癌细胞的侵袭转移可能与ASICs的表达有一定关系。儿茶素是一种天然的植物提取药物,有潜力成为抗癌药物[22],它可以抑制脑胶质瘤细胞U215的增殖[23], 在一定程度上也可抑制人肝癌细胞的增殖和迁移并诱导其凋亡[24]。该研究结果表明,儿茶素可以抑制胃癌细胞ASIC1的表达,减弱ASICs电流,并且还可抑制细胞的转移和侵袭。这为临床上采用儿茶素治疗胃癌提供了一定的理论依据,但是具体机制还有待进一步的研究。
参考文献
[1]张延新,刘喜民,陈奎生,等.胃癌组织中KISS-1和基质金属蛋白酶-9蛋白的表达[J].郑州大学学报(医学版),2010,45(3):384
[2]罗庚求,文继舫,李景和,等.Twist对胃癌细胞系MKN28迁移和侵袭能力的影响[J].中南大学学报(医学版),2008,33(2):174
[3]王倩荣,刘文超.肿瘤微环境与肿瘤转移[J].中国肿瘤生物治疗杂志,2011,18(5):569
[4]LI RK,ZHAO WY,FANG F,et al.Lysyl oxidase-like 4 (LOXL4) promotes proliferation and metastasis of gastric cancer via FAK/Src pathway[J].J Cancer Res Clin Oncol,2015,141(2):269
[5]KAPOOR N,BARTOSZEWSKI R,QADRI YJ,et al.Knockdown of ASIC1 and epithelial sodium channel subunits inhibits glioblastoma whole cell current and cell migration[J].J Biol Chem,2009,284(36):24526
[6]TSANG WP,KWOK TT.Epigallocatechin gallate up-regulation of miR-16 and induction of apoptosis in human cancer cells[J].J Nutr Biochem,2010,21(2):140
[7]KÜRBITZ C,HEISE D,REDMER T,et al.Epicatechin gallate and catechin gallate are superior to epigallocatechin gallate in growth suppression and anti-inflammatory activities in pancreatic tumor cells[J].Cancer Sci,2011,102(4):728
[9]周晓,王晔恺,周吉航,等.表没食子儿茶素没食子酸酯对Hela细胞的诱导凋亡作用及靶点蛋白质研究[J].中华中医药学刊,2012,30(1):194
[10]SINGH BN,SHANKAR S,SRIVASTAVA RK.Green tea catechin, epigallocatechin-3-gallate(EGCG):mechanisms, perspectives and clinical applications[J].Biochem Pharmacol,2011,82(12):1807
[11]SINGH AK,SETH P,ANTHONY P,et al.Green tea constituent epigallocatechin-3-gallate inhibits angiogenic differentiation of human endothelial cells[J].Arch Biochem Biophys,2002,401(1):29
[12]张玉艳,沈生荣.茶儿茶素抑制肿瘤血管生成的作用[J].细胞生物学杂志,2005,27(3):267
[13]RIEGER-CHRIST KM,HANLEY R,LODOWSKY C,et al.The green tea compound, (-)-epigallocatechin-3-gallate downregulates N-cadherin and suppresses migration of bladder carcinoma cells[J].J Cell Biochem,2007,102(2):377
[14]ROOJ AK,MCNICHOLAS CM,BARTOSZEWSKI R,et al.Glioma-specific cation conductance regulates migration and cell cycle progression[J].J Biol Chem,2012,287(6):4053
[15]ZHOU H,ZHANG B,ZHENG J,et al.The inhibition of migration and invasion of cancer cells by graphene via the impairment of mitochondrial respiration[J].Biomaterials,2014,35(5):1597
[16]石建华,刘纯伦,潘敏,等.Zileuton对胃癌SGC-7901细胞侵袭转移的影响[J].中国药理学通报,2010,26(7):957
[17]KRISHTAL O.The ASICs: signaling molecules? modulators?[J].Trends Neurosci,2003,26(9):477
[18]XIONG ZG,ZHU XM,CHU XP,et al.Neuroprotection in ischemia:blocking calcium-permeable acid-sensing ion channels[J].Cell,2004,118(6):687
[19]杜钢军,时小燕.治疗癌症的新途径:靶向肿瘤微环境[J].抗癌之窗,2012,38(1):78
[20]BERDIEV BK,XIA J,MCLEAN LA,et al.Acid-sensing ion channels in malignant gliomas[J].J Biol Chem,2003,278(17):15023
[21]叶金海,高隽,吴煜农,等.酸敏感离子通道在唾液腺腺样囊性癌中的表达[J].中国口腔颌面外科杂志,2007,5(3):204
[22]王文华,何晓松.EGCG抗肿瘤作用与STAT3信号通路的研究进展[J].现代医药卫生,2013,29(2):216
[23]梁丽琴,金刚,党建章,等.儿茶素对脑胶质瘤细胞U251增殖的抑制作用及机制初探[J].实用医学杂志,2011,27(9):1526
[24]吴育晶,金娟,胡姗姗,等.儿茶素对人肝癌细胞HepG2的影响[J].中国药理学通报,2010,26(12):1598
Effects of catechin on invasion and metastasis in gastric carcinoma cells SGC-7901 and MGC-803
DUPeipei1),LIUZongwen2),ZHANGYan1),ZHANGYuhao3),SHANGShufang1),JIADanhui1)
1)DepartmentofPharmacology,CollegeofBasicMedicalSciences,ZhengzhouUniversity,Zhengzhou4500012)DepartmentofRadiationOncology,theSecondAffiliatedHospital,ZhengzhouUniversity,Zhengzhou4500143)DepartmentofClinicalMedicine,ZhengzhouUniversity,Zhengzhou450052
*河南省高等学校重点科研项目基础研究计划基金资助项目15A310031;郑州市科技创新团队基金资助项目131PCXTD628
Key wordsgastric carcinoma;ASICs;amiloride;catechin
中图分类号R735.2
通信作者#,女,1968年4月生,博士,教授,研究方向:肿瘤药理学,E-mail:zhangyan055@zzu.edu.cn
doi:10.13705/j.issn.1671-6825.2016.01.013 [8]RATHORE K,CHOUDHARY S,OA,et al.Green tea catechin intervention of reactive oxygen species-mediated ERK pathway activation and chronically induced breast cell carcinogenesis[J].Carcinogenesis,2012,33(1):174
