酵母双杂交技术筛选杜氏盐藻cDNA文库中与S-腺苷高半胱氨酸水解酶相互作用的蛋白*
2016-02-23李庆华张彦婷朱立强柴丹丹关方
李庆华,张彦婷,朱立强,柴丹丹,关方
1)郑州大学生命科学学院 郑州 450001 2)郑州大学第二附属医院检验科 郑州 450014
酵母双杂交技术筛选杜氏盐藻cDNA文库中与S-腺苷高半胱氨酸水解酶相互作用的蛋白*

1)郑州大学生命科学学院 郑州 4500012)郑州大学第二附属医院检验科 郑州 450014
关键词S-腺苷高半胱氨酸水解酶;酵母双杂交;蛋白相互作用;免疫共沉淀
摘要目的:应用酵母双杂交技术筛选杜氏盐藻cDNA文库中能与S-腺苷高半胱氨酸水解酶(dsSAHH)相互作用的蛋白。方法:将构建好的pGBKT7-dsSAHH诱饵载体转化至酵母细胞Y187,与转化有杜氏盐藻cDNA文库的酵母细胞AH109杂交,从杜氏盐藻cDNA文库中筛选出能与dsSAHH相互作用的蛋白质。扩增所得基因片段全长,并在原核内表达该融合蛋白。随后采用Far-western blot、His pull-down及免疫共沉淀方法验证dsSAHH与目的蛋白在体内、外的相互作用。结果:以dsSAHH为诱饵筛选出3个阳性克隆,扩增得到dsRACK1、dsMetAP1和dseEF1α 3个新基因。His pull-down和免疫共沉淀体内外实验证实dsRACK1能与dsSAHH相互作用。结论:dsRACK1是dsSAHH的相互作用蛋白。
AbstractAim: To isolate and identify the proteins that interact with S-adenosyhomocystine hydrolase(dsSAHH) in Dunaliella salina(D.salina) cDNA library. Methods: The constructed bait vector pGBKT7-dsSAHH was transformed to yeast cell Y187 and then the Y187 cells hybridized with yeast AH109 cells which contained the cDNA library of D.salina. The proteins that interacted with dsSAHH of D.salina were screened and identified using yeast two-hybrid technology. Then, the full length of screened gene was cloned and the fusion proteins of aimed gene were expressed in E.coli. Finally, the interaction was confirmed by Far-western blot, His pull-down, and co-immunoprecipitation in vitro and in vivo. Results: Three new genes, including dsRACK1, dsMetAP1, and dseEF1α, were screened. Out of them, dsRACK1 interacted with dsSAHH,which was confirmed by Far-western bolt and His pull-down. Conclusion: dsSAHH could interact with dsRACK1.
S-腺苷高半胱氨酸水解酶(S-adenosyhomocystine hydrolase, SAHH)是生物体内广泛存在的一种蛋白水解酶,是甲基化通路中催化S-腺苷高半胱氨酸水解的惟一酶[1]。鉴于它在调节生物体转甲基化反应中的核心位置,目前已经被选作多种新药研发的重要潜在作用靶点[2]。单细胞绿藻杜氏盐藻是一种高度耐盐的单细胞真核生物,具有一对等长的鞭毛。研究[3]发现杜氏盐藻SAHH(dsSAHH)蛋白参与了杜氏盐藻鞭毛的组装过程。为了进一步研究dsSAHH在杜氏盐藻鞭毛组装过程中的作用机制,作者利用已构建酵母双杂交的诱饵载体pGBKT7-dsSAHH[4]对杜氏盐藻cDNA文库进行筛选来钓取与dsSAHH相互作用的蛋白质,为研究杜氏盐藻中甲基化过程以及甲基化过程在杜氏盐藻鞭毛组装过程中的作用打下基础。
1材料与方法
1.1 材料DH5α、杜氏盐藻cDNA文库、pET28a(+)载体和pGEX 6p-1载体均为郑州大学细胞生物学研究室保存;pMD18-T载体、限制性内切酶EcoRⅠ、Hind Ⅲ、BamHⅠ、NotⅠ和DNA Marker 均购于大连TaKaRa公司;YPD液体和固体培养基以及DO Supplement系列均购于上海睿星基因技术有限公司;Yeast Nitrogen Base、X-α-gal、DMSO、IPTG、Ni-IDA SefinoseTM试剂盒和GST-IDA SefinoseTM试剂盒等均购于上海生工生物工程技术服务有限公司。酵母菌株AH109及Y187、酵母双杂交所用载体、对照质粒、酵母质粒提取试剂盒均购于Clontech公司。
1.2SAHH相互作用蛋白的筛选
1.2.1诱饵载体筛选cDNA文库将含有pGBKT7-SAHH诱饵载体的Y187酵母细胞和1 mL文库菌共培养,并镜检是否形成三叶草状配子,然后分别取200 μL的杂交液涂布50个直径15 cm的SD/-Trp-Leu-His-Ade/3-AT(5 mmol/L)培养基,30 ℃孵育6~8 d。待在SD/-Trp-Leu-His-Ade/3-AT(5 mmol/L)/X-α-gal的四缺培养基上长出克隆后,挑取直径大于2 mm的白色或粉色菌落并再次划线于SD/-Trp-Leu-His-Ade/3-AT(5 mmol/L)/X-α-gal的四缺培养基上,多次传代并稳定表达的为阳性克隆。合成pGADT7载体上多克隆位点两端序列作为上下游引物:STMARTⅢ,5’-AAGCAGTGGTATCAACG CAGAGTGGCCATTATGGCC-3’;CDSⅢ,5’-TCTA GAGGCCGAGGCGGCCGACATG-3’。并以此对引物对阳性克隆进行菌落PCR扩增,亚克隆至pMD18-T载体,而后转化DH5α,酶切鉴定并比对结果。
1.2.2回交实验选择含有dsRACK1的酵母菌落,划线到新的SD/-Trp-Leu-His-Ade/3-AT(5 mmol/L)固体培养基,选择直径大于2 mm 的酵母菌落提取质粒。然后将其提取的酵母质粒转化DH5α并涂布含有Ampr的LB固体培养基,然后提取质粒,用限制性内切酶Hind Ⅲ酶切鉴定正确后送公司测序。
将提取的猎物质粒pGADT7-dsRACK1与诱饵载体pGBKT7-dsSAHH用醋酸锂法共转化酵母细胞AH109,涂布于SD/-Trp-Leu培养基,同时做阳性对照(质粒pGBKT7-53和 pGADT7-Rec-LargeT)和阴性对照(质粒pGBKT7-53与pGADT7-Rec-Lam)实验。培养3~5 d长出白色克隆后,将其划线到SD/-Trp-Leu-His-Ade/X-α-gal培养基上,继续培养并观察结果。
1.3dsSAHH相互作用蛋白的验证
1.3.1dsRACK1基因扩增及蛋白质表达和纯化采用Trizol试剂法提取杜氏盐藻总RNA[5],采用TaKaRa 公司的5’RACE试剂盒合成5’RACE模板,设计RACK1 5’引物,扩增RACK1的全长。然后设计引物构建重组表达载体pGEX 6p-1-dsRACK1。将pGEX 6p-1-dsRACK1重组质粒和已构建的pET28a-dsSAHH分别转化BL21 DE3[6],挑取单菌落分别接种到含有相应抗生素的4 mL LB培养基中,37 ℃振荡培养约8 h后,以150接种扩大培养2 h后加入IPTG(终浓度为0.05 mmol/L),16 ℃过夜诱导蛋白表达。收集细菌后超声磨碎,收集沉淀和上清,SDS-PAGE检测蛋白,考马斯亮蓝G-250染色,确定重组蛋白的大小及是否为可溶性蛋白质。
将含有目的蛋白质的可溶性蛋白质分别进行纯化,pGEX 6p-1-dsRACK1含有GST标签,使用GST-IDA Sefinose试剂盒纯化dsRACK1;pET28a(+)-dsSAHH上含有His标签,用Ni-IDA Sefinose试剂盒纯化dsSAHH。
1.3.2Far-western blot实验将纯化的dsRACK1蛋白经SAS-PAGE后,将凝胶上的蛋白质用半干法转至硝酸纤维素膜上后,并进行膜上的原位逐步复性[7]:将膜依次在盐酸胍浓度依次降低(6.0、3.0、1.0、0.1 mol/L)的复性缓冲液TNAB中温育30 min后,将膜转移至TNAB中4 ℃过夜。然后将膜放置在纯化的SAHH蛋白质封闭液中孵育3 h,TBST漂洗3次后再与SAHH多克隆抗体(一抗)封闭液室温振荡孵育1 h,室温下用TBST洗膜,再与辣根过氧化物标记的山羊抗兔抗体(二抗)室温温育1 h,最后用ECL发光显色后曝光扫描。
1.3.3His pull-down及非变性聚丙烯酰胺凝胶电泳将纯化的SAHH蛋白质重新挂柱,然后将纯化的dsRACK1加入到预装柱中,4 ℃过夜孵育,然后用洗脱液将多余的dsRACK1洗脱,最后用洗脱液将dsSAHH从柱子上洗脱下来,收集蛋白质。
将pull-down洗脱的蛋白质用4×上样Buffer稀释,配制60 g/L的非变性聚丙烯酰胺凝胶(不含SDS),为防止蛋白质变性,将电泳槽置于冰上,100 V电压不加样品预跑1 h后再加入样品,浓缩胶电压为200 V,分离胶电压为250 V,凝胶用考马斯亮蓝G-250染色、扫描。
1.3.4免疫共沉淀分别构建pCMV-HA-dsSAHH和pCMV-Myc-dsRACK1质粒,经鉴定正确后,提取大量质粒。按照说明书,pCMV-HA-dsSAHH和pCMV-Myc-dsRACK1质粒共同转染至COS-7细胞中。培养2 d后提取COS-7细胞总蛋白,将细胞裂解产物与已和Myc抗体孵育过的琼脂糖蛋白小珠A充分混合,用洗脱液将免疫复合物洗脱,用已制备的抗-dsSAHH抗体采用Western blot检测免疫复合物中的dsSAHH,而共转染pCMV-HA和pCMV-Myc的COS-7蛋白为阴性对照。
2结果
2.1诱饵载体同cDNA文库双杂交转化有诱饵质粒pGBKT7-dsSAHH的酵母细胞Y187与转化pGADT7-文库质粒的酵母细胞AH109杂交20 h后,取少量的杂交液镜检可看到三叶草状的二倍体酵母细胞,说明酵母双杂交成功。
酵母双杂交液涂布SD/-Trp-Leu-His-Ade/3-AT的培养基进行初步筛选,培养6~8 d后,挑取255个较大的克隆划线SD/-Trp-Leu-His-Ade/3-AT/X-α-gal培养基,后经过多次稳定传代得到8个阳性克隆。以CDS Ⅲ和STMART Ⅲ为引物对阳性克隆进行PCR扩增, 连接载体酶切测序,通过Blast得到3个可能与dsSAHH相互作用的克隆,经测序后初步鉴定为dsRACK1、甲硫氨酰氨肽酶(dsMetAP1)和真核延伸因子1α(dseEF1α)(图1)。
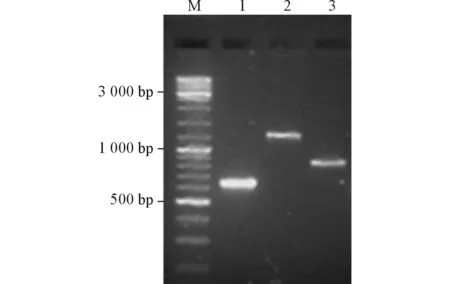
M:Marker;1:dsRACK1;2:dseEF1α;3:dsMetAP1。图1 以CDS Ⅲ和STMART Ⅲ为引物对阳性克隆酵母行PCR检测结果
2.2回交实验验证dsSAHH与dsRACK1在酵母内相互作用提取pGADT7-dsRACK1质粒,Hind Ⅲ酶切结果见图2,测序结果提示正确。

1: pGADT7-dsRACK1酶切结果;2:pGADT7-dsRACK1;M:Marker。图2 质粒pGADT7-dsRACK1被Hind Ⅲ酶切的结果
将提取的酵母质粒pGADT7-dsRACK1和诱饵质粒pGBKT7-dsSAHH用醋酸锂法共转化酵母细胞AT109并涂布SD/-Trp-Leu-His-Ade/3-AT培养基培养3~5 d,挑取生长良好的菌落再次划线SD/-Trp-Leu-His-Ade/3-AT/X-α-gal培养基培养,细胞生长良好且变蓝。
2.3与dsSAHH相互作用蛋白的验证
2.3.1dsRACK1全长的获得及蛋白表达采用5’RACE试剂盒合成的5’RACE模板,设计引物扩增得到RACK1基因序列全长957 bp(GenBank:JN540811)。并成功构建带有GST标签的融合表达载体pGEX 6p-1-dsRACK1(图3),同时诱导表达了pGEX 6p-1-dsRACK1和pET28a(+)-dsSAHH,通过一系列条件优化均获得了可溶性的融合蛋白,并分别进行了纯化(图4)。
2.3.2体外验证dsSAHH与dsRACK1的相互作用
①Far-western blot:结果见图5A,dsRACK1在膜上变性的条件下可以和dsSAHH相互作用。②非变性聚丙烯酰胺凝胶电泳:结果见图5B,在2个蛋白大小上面还有一团聚合状的蛋白质存在,说明dsRACK1和dsSAHH在体外活性条件下存在相互作用。
2.3.3体内验证dsSAHH与dsRACK1的相互作用
将pCMV-HA-dsSAHH和pCMV-Myc-dsRACK1质粒共转到Cos-7细胞,dsSAHH和dsRACK1在Cos-7细胞中共表达(图5C),即dsSAHH和dsRACK1在细胞内也能相互作用。
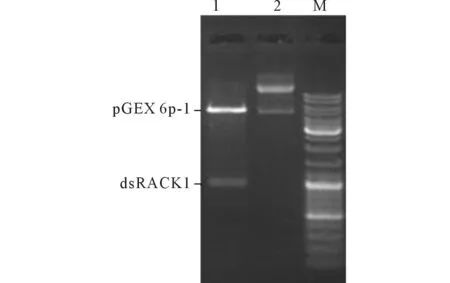
1:pGEX 6p-1-dsRACK1酶切结果;2:pGEX 6p-1-dsRACK1质粒;M:Marker。图3 pGEX 6p-1-dsRACK1酶切图

M:Marker;1:pET28a(+)空载体纯化结果;2:dsSAHH纯化结果(左)。M:Marker;1:dsRACK1纯化结果(右)。图4 dsSAHH和dsRACK1纯化

A:Far-western blot结果,NC表示阴性对照;B:pull-down结果,1和2为洗脱下来的相互作用蛋白;C:免疫共沉淀结果。图5 dsSAHH和dsRACK1相互作用的验证结果
3讨论
在酵母双杂交系统中,酵母细胞作为真核细胞为2个相互作用的蛋白质提供了更接近于天然构象和功能的蛋白[7-8]。其相互作用比较灵敏,假阳性较高,因此需要进一步的实验来验证酵母双杂交的结果,一般方法有pull-down和免疫共沉淀。
该研究用已构建的pGBKT7-dsSAHH诱饵载体在Y187酵母细胞中表达了dsSAHH蛋白,与含有杜氏盐藻cDNA文库的AH109酵母细胞进行了2次杂交:第1次筛选出了dsRACK1,第2次筛选出了dsRACK1以及dsMetAP1和dseEF1α共3个蛋白质。通过了2次杂交实验减少了酵母双杂交的假阳性,因此作者选择了dsRACK1来进行回交实验,并且对dsRACK1进行蛋白表达,通过Far-western blot和pull-down实验证明dsRACK1与dsSAHH在体内、外都存在相互作用。
为了更好地了解dsSAHH和dsRACK1之间的相互作用,作者分别将dsSAHH和dsRACK1氨基酸序列在NCBI上进行比对,结果发现dsSAHH具有保守的NAD+结合位点,这与它的水解功能是密不可分的,而dsRACK1的蛋白序列包含一个WD40结构域,是WD40家族蛋白。RACK1最初被认为是蛋白激酶C的受体[9],酵母和哺乳动物中RACK1的信号转导和翻译调控作用已得到证实[10],但目前认为RACK1同多个信号蛋白有关系[11-15]。基于该研究结果,作者推测dsSAHH可能通过与dsRACK1相互作用参与鞭毛的组装过程。在后续的研究中作者将要制备dsRACK1的抗体,通过分子生物学手段来研究dsRACK1在杜氏盐藻鞭毛再生中的作用及dsSAHH-dsRACK1的相互作用对鞭毛再生的影响。
参考文献
[1]TEHLIVETS O,MALANOVIC N,VISRAM M,et al.S-adenosyl-L-homocysteine hydrolase and methylation disorders: yeast as a model system[J].Biochim Biophys Acta,2013,1832(1):204
[2]ZHOU J,BI C,CHEONG LL,et al.The histone methyltransferase inhibitor, DZNep, up-regulates TXNIP, increases ROS production, and targets leukemia cells in AML[J].Blood,2011,118(10):2830
[3]阎赟梦,李庆华,李杰,等.杜氏盐藻S腺苷高半胱氨酸水解酶基因的克隆及功能分析[J].郑州大学学报(医学版),2011,46(4):517
[4]柴丹丹,李庆华,阎赟梦,等.杜氏盐藻S腺苷高半胱氨酸水解酶酵母双杂交诱饵载体的构建及自激活和毒性检测[J].郑州大学学报(医学版),2012,47(1):16
[5]贾岩龙,尹雅玲,邱乐乐,等.实时荧光定量聚合酶链反应检测杜氏盐藻突变株中硝酸盐还原酶基因的表达[J].新乡医学院学报,2012,29(8):575
[6]阎赟梦.杜氏盐藻S-腺苷高半胱氨酸水解酶基因SAHHase在鞭毛长度调控中的作用[M].郑州:郑州大学出版社,2011.
[7]WITTEVELDT J,VERMEESCH AM,LANGENHOF M,et al.Nucleocapsid protein VP15 is the basic DNA binding protein of white spot syndrome virus of shrimp[J].Arch Virol,2005,150(6):1121
[8]DREES BL.Progress and variations in two-hybrid and three-hybrid technologies[J].Curr Opin Chem Biol,1999,3(1):64
[9]ADAMS DR,RON D,KIELY PA.RACK1,a multifaceted scaffolding protein:structure and function[J].Cell Commun Signal,2011,9:22
[10]GANDIN V,SENFT D,TOPISIROVIC I,et al.RACK1 function in cell motility and protein synthesis[J].Genes Cancer,2013,4(9/10):369
[11]CHANG BY,CONROY KB,MACHLEDER EM,et al.RACK1,a receptor for activated C kinase and a homolog of the β subunit of G proteins,inhibits activity of src tyrosine kinases and growth of NIH 3T3 cells[J].Mol Cell Biol,1998,18(6):3245
[12]YAO F,LONG LY,DENG YZ,et al.RACK1 modulates NF-κB activation by interfering with the interaction between TRAF2 and the IKK complex[J].Cell Res,2014,24(3):359
[13]SMITH L,LITMAN P,KOHLI E,et al.RACK1 interacts with filamin-A to regulate plasma membrane levels of the cystic fibrosis transmembrane conductance regulator[J].Am J Physiol Cell Physiol,2013,305(1):C111
[14]ZEIDNER LC,BUESCHER JL,PHIEL CJ.A novel interaction between glycogen synthase kinase-3α(GSK-3α) and the scaffold protein receptor for activated C-kinase 1(RACK1) regulates the circadian clock[J].Int J Biochem Mol Biol,2011,2(4):318
[15]DENG YZ,YAO F,LI JJ,et al.RACK1 suppresses gastric tumorigenesis by stabilizing the β-catenin destruction complex[J].Gastroenterology,2012,142(4):812
*科技部国际科技合作基金资助项目2007DFA01240;河南省高等学校重点科研项目计划15A310028,15A180022
Screening of proteins that interact with S-adenosyhomocystine hydrolase by yeast two-hybrid assay inDunaliellasalinacDNA library

1)CollegeofLifeSciences,ZhengzhouUniversity,Zhengzhou4500012)ClinicalLaboratory,theSecondAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450014
Key wordsS-adenosyhomocystine hydrolase;yeast two-hybrid;protein interaction;co-immunoprecipitation
中图分类号Q781
通信作者#,女,1969年2月生,博士,教授,研究方向:生物医学,E-mail:guanfangxia@126.com
doi:10.13705/j.issn.1671-6825.2016.01.002
