Fe3O4@SiO2-NH2磁性复合材料对水中全氟化合物的检测研究
2016-02-23王永花胡良锋陆光华
聂 阳,王永花,胡良锋,洪 诚,陆光华
(河海大学 环境学院,浅水湖泊综合治理与资源开发教育部重点实验室,江苏 南京 210098)
研究报告
Fe3O4@SiO2-NH2磁性复合材料对水中全氟化合物的检测研究
聂阳,王永花*,胡良锋,洪诚,陆光华
(河海大学环境学院,浅水湖泊综合治理与资源开发教育部重点实验室,江苏南京210098)
摘要:利用三步法(热溶剂还原法,硅烷化和氨基功能化)制备了Fe3O4@SiO2-NH2磁性纳米复合材料用于水体中全氟化合物的萃取,结合超高效液相色谱-串联三重四极杆质谱(UPLC-MS/MS)技术,建立了水体中7种典型全氟化合物的检测方法。通过扫描电镜(SEM)、透射电镜(TEM)和傅立叶红外光谱(FT-IR)等手段对材料进行表征,详细研究了解析溶剂、解析溶剂体积、解析时间、吸附时间和pH值等因素对萃取效率的影响。结果表明:氨基被成功修饰在Fe3O4@SiO2纳米粒子的表面,Fe3O4@SiO2-NH2磁性纳米材料对目标全氟化合物有较好的萃取效果,在萃取时间为20 min,解析溶剂为3 mL×4含0.28%氨水的甲醇,解析时间为5 min,pH 5.0时,萃取效率最佳。在最优实验条件下,全氟化合物的检出限为0.2~0.5 ng/L,线性范围为1~500 ng/L。方法用于实际水体中目标全氟化合物的检测,样品的加标回收率不低于82.0%。
关键词:Fe3O4@SiO2-NH2;全氟化合物;超高效液相色谱-串联质谱;环境水样
全氟化合物(Perfluorinated chemicals,PFCs)是一类具有重要应用价值的含氟有机化合物,广泛应用于化工、纺织、涂料、皮革、合成洗涤剂、厨具制造、纸制食品包装材料等工业和民用领域[1-2]。在多个国家和地区的河水、生活用水以及城市工业污水中均检出PFCs[3-5],浓度水平普遍在ng/L级,个别地区甚至达到μg/L级。由于环境中PFCs含量低,基质复杂,因此选择合理有效的预处理方法对于提高PFCs的检测灵敏度和准确度尤为必要。
Fe3O4@SiO2磁性复合材料因具有比表面积大、活性位点丰富及磁性高等优点而受到广泛关注。目前,功能化Fe3O4@SiO2复合材料在生物医学[6-7]、催化[8-9]方面的应用较多。复合材料在环境中的应用近几年才受到关注,主要用于水环境中重金属污染离子的检测[10-11],对于水环境中有机污染物的检测应用则报道较少。为改善Fe3O4@SiO2磁性吸附材料对水环境中PFCs的吸附性能,提高其对PFCs的吸附效率,可在Fe3O4@SiO2磁性材料表面进行氨基(-NH2)功能化改性。氨基活性基团对PFCs具有较强的静电作用,改性后的磁性纳米材料可有效地选择性吸附水中的PFCs。本文成功合成了Fe3O4@SiO2-NH2磁性纳米复合材料,对比了Fe3O4,Fe3O4@SiO2及Fe3O4@SiO2-NH2对水中PFCs的吸附效果,优化了影响吸附效果的主要因素,结合超高效液相色谱-串联三重四极杆质谱,建立了Fe3O4@SiO2-NH2磁性纳米材料快速测定水体中7种典型PFCs的方法,并应用于实际水体中目标PFCs的检测。
1实验部分
1.1试剂与仪器
六水合氯化铁(FeCl3·6H2O)、乙二醇、氨水(25%)、丙酮、冰醋酸、醋酸铵(分析纯,南京化学试剂公司);全氟己酸(PFHxA)、全氟庚酸(PFHpA)、全氟辛酸(PFOA)、全氟壬酸(PFNA)、全氟癸酸(PFDA)、全氟十一酸(PFUdA)、全氟十二酸(PFDoA)均购自美国Alfa公司;正硅酸乙酯(TEOS)、3-氨基丙基三乙氧基硅烷(Kp50)均为色谱纯,购自美国Sigma-Aldrich公司;甲醇、乙腈(色谱纯,美国Merck公司)。
超高效液相色谱-串联三重四极杆质谱仪(Agilent 1290 Infinity UPLC-Agilent 6460 Triple Quad,美国Agilent公司),MF-A10超纯水仪(美国Millipore公司),S-4800NⅡ扫描电镜仪(日本日立公司),JEM-200CX透射电镜仪(日本JEOL公司),EDAX TEAM能谱分析仪(日本日立公司),NEXUS870傅立叶红外仪(德国Nicolet公司)。
1.2Fe3O4@SiO2-NH2磁性纳米复合材料的制备
Fe3O4@SiO2-NH2的合成原理[12-13]见图1,具体步骤分为3步:
①Fe3O4的合成采用热溶剂还原法[14]:称取3.6 g FeCl3·6H2O溶解于80 mL乙二醇中形成澄清溶液,称取12 g醋酸钠溶于20 mL乙二醇溶液至澄清后再逐滴加至上述溶液中,在氩气保护下进行搅拌,待恒温加热磁力搅拌器加热至185 ℃后持续反应48 h,自然冷却,产物离心(10 000 r/min) 15 min或用磁铁磁性分离后,使用无水乙醇和纯水分别清洗数次,最后用真空干燥箱干燥;②硅烷化:取上述合成的约50 mg Fe3O4粉末溶于40 mL乙醇中,并超声1 h使其分散。而后加入约2 mL氨水NH3·H2O(25%),再逐滴加入硅烷偶联剂TEOS,并持续超声反应5 h。所得到的纳米粒子在强磁铁下或11 000 r/min离心15 min,再分别用水和丙酮清洗1次和2次,最终材料再用真空干燥箱在室温下干燥30 min左右,得到灰色粉末(Fe3O4@SiO2)约100 mg;③氨基功能化:取100 mg第②步得到的粉末溶解于100 mL甲醇-水(85∶15)混合溶液中,同时用1 mol/L HCl调至pH 4.5左右,超声约2 h后,逐滴加入约1 mmol的硅烷偶联剂(3-氨基丙基三乙氧基硅烷,Kp50)和数滴冰醋酸,继续超声约2 h后,用强磁铁或 5 300 r/min离心15 min,并用水和丙酮分别洗1次和2次,最后用真空干燥箱在室温下干燥30 min左右,得到复合材料Fe3O4@SiO2-NH2约95~100 mg。
1.3Fe3O4@SiO2-NH2磁性纳米复合材料的表征
使用扫描电镜(SEM)、透射电镜(TEM)观察纳米复合材料的形貌特征,通过能谱分析仪(EDAX)分析材料表面各元素所占的比例,运用傅立叶红外光谱(FT-IR)推测纳米复合材料的基团。
1.4UPLC-MS/MS测定条件
液相色谱条件:流动相为乙腈(A)和2 mmol/L醋酸铵溶液(B);流速为0.3 mL/min,进样量为5 μL。梯度洗脱程序:0~0.5 min,80% B;0.5~2.5 min,80%~60% B;2.5~6 min,60%~40% B;6~7 min,40%~10% B;7~7.5 min,10%~80% B。
质谱条件:电喷雾离子源,负离子模式(ESI),多反应离子监测(MRM)。
ESI-MS/MS的主要工作参数:干燥气温度325 ℃,干燥气流量6 L/min,喷雾气压力35 psi,鞘气温度350 ℃,鞘气流量9 L/min,毛细管电压4 000 V,喷口喷嘴电压500 V。
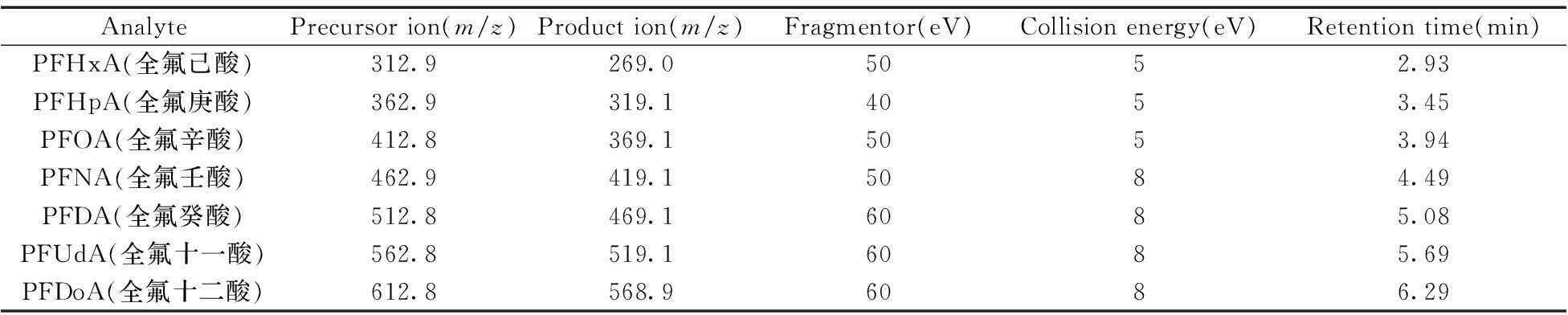
表1 全氟化合物的质谱参数
1.5PFCs的检测
取约20 mg磁性纳米复合材料粉末加至100 mL水样中,混合液室温下振荡20 min,磁吸分离材料颗粒,将3 mL×4解析液加入材料中,解析5 min,解析液氮吹浓缩至1 mL后,用于UPLC-MS/MS分析。
2结果与讨论
2.1Fe3O4@SiO2-NH2磁性纳米复合材料的表征
2.1.1扫描电镜与透射电镜图2是Fe3O4@SiO2-NH2磁性复合材料的SEM和TEM图。由图2A可见,所得产物外观呈球形,形状规则,表面较光滑。为了进一步确认复合粒子结构,对其进行TEM表征。由图2B可以看出,Fe3O4@SiO2-NH2复合粒子为核-壳结构,其中黑色部分为Fe3O4,周围灰色的部分对应电子密度较低的无定形SiO2包覆层,材料的粒径约500 nm。
2.1.2能谱分析通过EDAX能谱分析,表2给出了Fe3O4,Fe3O4@SiO2和Fe3O4@SiO2-NH2材料表面各元素所占比例。由表2可知,Fe3O4粒子表面最主要的成分是Fe和O;Fe3O4@SiO2粒子表面由于包裹了TEOS,导致其表面Fe的比例很小(12.07%),而O和Si成为主要元素,尤其是O,这是因为其表面含有大量的—OH,Fe3O4@SiO2-NH2因被Kp50进行氨基功能化修饰,其表面N的含量增加,Fe的含量继续减少,表明其功能化修饰包裹成功。
2.1.3傅立叶红外光谱分析(FT-IR)Fe3O4,Fe3O4@SiO2和Fe3O4@SiO2-NH2粒子的FT-IR光谱如图3所示。3 421 cm-1和567 cm-1处是三者的共有峰,分别代表—OH的伸缩振动和Fe—O键的吸收峰[15],而在1 089 cm-1处,Fe3O4@SiO2和Fe3O4@SiO2-NH2两种材料均存在较大且较宽的Si—O—Si伸缩振动峰[13,16],表明氨基功能化后未改变材料的内部结构。此外,在1 637 cm-1处的峰代表—OH的弯曲振动吸收峰[17],N—H伸缩和弯曲振动的峰分别位于1 488 cm-1和3 357 cm-1[18],说明—NH2已成功修饰在Fe3O4@SiO2纳米粒子的表面。
2.2不同材料的萃取效果比对
为了验证功能化材料对PFCs的萃取效果,分别对Fe3O4,Fe3O4@SiO2和Fe3O4@SiO2-NH23种吸附材料进行萃取效率比较(如图4)。结果显示,Fe3O4@SiO2-NH2材料的萃取性能最佳,主要原因为:Fe3O4@SiO2-NH2粒子表面含有大量的—NH2,可与PFCs的—COOH及—F产生氢键作用[19];同时,带正电荷的Fe3O4@SiO2-NH2粒子还可与带负电荷的PFCs 通过静电作用结合从而增强萃取效率[15]。
2.3萃取条件的优化
2.3.1解析溶剂与解析时间的选择为了提高解析效率,消除记忆效应,选择合适的解析溶剂非常重要,解析溶剂的作用主要是破坏氟的亲和力,从而解析出目标物。本研究选择甲醇[20]、乙腈[21]和含0.28%氨水的甲醇[15]作为解析溶剂进行效果比较,发现采用含0.28%氨水的甲醇时,Fe3O4@SiO2-NH2对PFCs的萃取效果最好(图5A)。解析过程是一个平衡过程,解析时间过长会导致分析物重新吸附,从而降低萃取效率。由图5B可知,当解析时间为5 min时,Fe3O4@SiO2-NH2对PFCs的解析效率最高,且未见记忆效应。
2.3.2解析溶剂体积的选择解析溶剂体积变化主要通过改变洗脱次数来实现。本研究选择1 mL、3 mL×1(3 mL洗脱1次,依次类推)、3 mL×2、3 mL×3、3 mL×4和3 mL×5等洗脱溶剂体积进行对比试验。结果显示,当解析溶剂体积为3 mL×4时,Fe3O4@SiO2-NH2材料对PFCs的解析效果最好(图6A)。
2.3.3萃取时间的选择萃取过程是一个平衡过程,萃取效率主要依赖于萃取剂和样品溶液之间的质量传递,而质量传递与时间相关。时间过短时萃取不完全,时间过长则有可能导致分析物重新释放到溶剂中。实验结果显示,随着萃取时间的增加,萃取效率呈先上升后下降的趋势,在20 min 时,Fe3O4@SiO2-NH2材料对PFCs的萃取效率最高。
2.3.4溶液pH值的选择 溶液pH值是影响萃取效果的关键因素,通常溶液pH值通过影响材料和目标物的电荷特性来影响材料对目标物的吸附[22]。已有研究表明[23],当pH>7.0时,Fe3O4@SiO2-NH2纳米粒子带负电,且电负性随着pH值的增大而增大,而PFCs本身带负电,所以Fe3O4@SiO2-NH2纳米粒子与PFCs之间的静电排斥作用会影响吸附效果。由图6B可以看出,pH>7.0时,pH值越大,吸附效果越差。pH<7.0时,Fe3O4@SiO2-NH2纳米粒子带正电,可与带负电的PFCs通过静电作用结合,并以pH 5.0时的吸附效果最好。
综上所述,本实验的最优萃取条件为:萃取时间20 min,解析溶剂为3 mL×4含0.28%氨水的甲醇,解析时间为5 min,pH值为5.0。
2.4线性范围、检出限、精密度及加标回收率
在优化条件下,考察了方法对7种PFCs的线性范围、检出限(LODs)、精密度及加标回收率。以待测物的定量离子峰面积为纵坐标,待测物的质量浓度为横坐标进行线性回归。按信噪比(S/N)为3确定方法的检出限(LOD),结果见表3。7种PFCs的线性范围较宽,相关系数(r2)均不小于0.948,LOD为0.2~0.5 ng/L,相对标准偏差(RSD,n=3)不大于9.8%,加标回收率不低于82.0%。
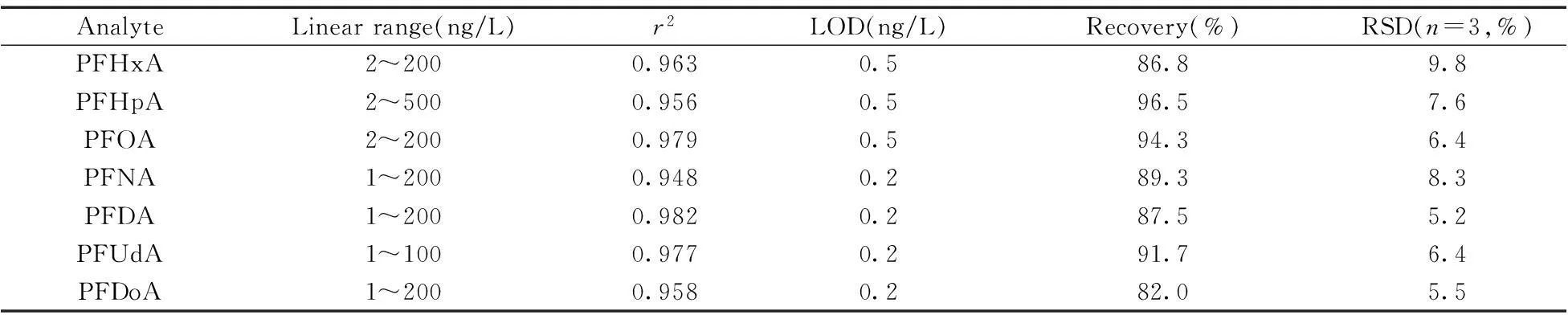
表3 方法的线性范围、相关系数、检出限、回收率和相对标准偏差
2.5实际水样的分析
分别对南京地区雨水、秦淮河、北太湖和徐州某地地下水中的目标PFCs进行检测。水样先过滤去除大颗粒的杂质,各取100 mL利用Fe3O4@SiO2-NH2磁性材料在最优条件下进行萃取,检测结果见表4。结果显示,北太湖和秦淮河中目标PFCs的浓度较高,最高浓度达137.44 ng/L,而南京地区雨水和徐州某地地下水的污染浓度较低,且徐州某地的地下水样中PFUdA和PFDoA均低于检出限。4种水样中,PFOA的浓度均为最高,可能与PFOA的大量生产和广泛使用有关[24]。
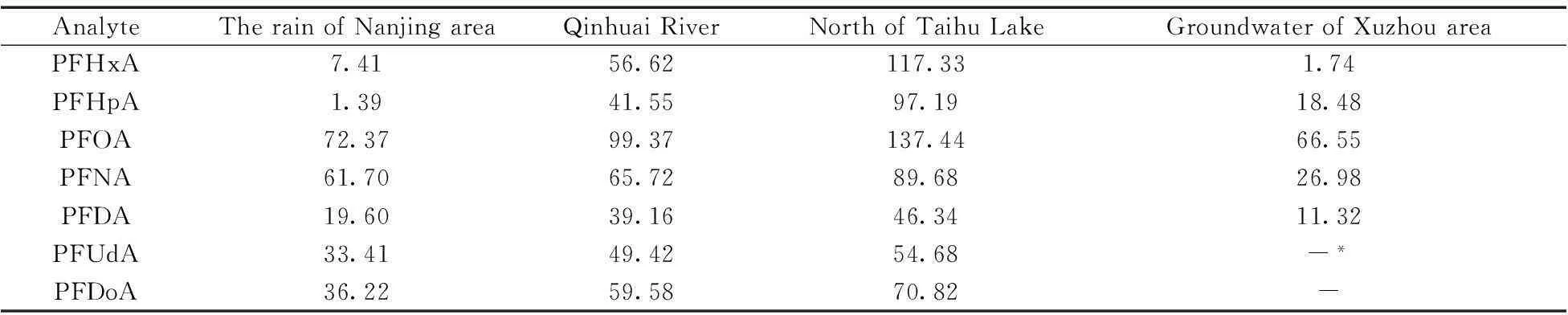
表4 南京地区雨水、秦淮河、北太湖和徐州地区地下水中的全氟化合物浓度(ng/L)
*no detected
3结论
本研究利用三步法成功合成了Fe3O4@SiO2-NH2磁性纳米复合材料,并以其作为萃取材料,对水环境中的目标PFCs进行检测。优化了影响萃取效果的主要因素,结合UPLC-MS/MS建立了水环境中7种典型痕量PFCs的检测方法。该方法可以满足水中痕量污染物的分析要求,并已成功用于实际水样中目标全氟化合物的分析检测。
参考文献:
[1]Shoeib M,Harner T,Vlahos P.Environ.Sci.Technol.,2006,40(24):7577-7583.
[2]Li J,Zhang H,Chai Z F,Shen J C,Yang B.J.Instrum.Anal.(李静,张鸿,柴之芳,沈金灿,杨波.分析测试学报),2014,33(10):1109-1115.
[3]Thompson J,Eaglesham G,Reungoat J,Poussade Y,Bartkow M,Lawrence M,Mueller J F.Chemosphere,2011,82:9-17.
[4]Skutlarek D,Evner M,Fraber H.Environ.Sci.Pollut.Res.Int.,2006,13(5):299-307.
[5]Yang L P,Zhu L Y,Liu Z T.Chemosphere,2011,83:806-814.
[6]Huang J,Zhao R,Wang H,Zhao W Q,Ding L Y.Biotechnol.Lett.,2010,32(6):817-821.
[7]Wang F,Pauletti G M,Wang J T,Zhang J M,Ewing R C,Wang Y L,Shi D L.Adv.Mater.,2013,25(25):3485-3489.
[8]An C H,Ming X J,Wang J Z,Wang S T.J.Mater.Chem.,2012,22:5171-5176.
[9]Nabid M R,Bide Y,Niknezhad M.ChemCatChem,2014,6(2):538-546.
[10]Deng S B,Ting Y P.Environ.Sci.Technol.,2005,39:8490-8496.
[11]Huang S H,Chen D H.J.Hazard.Mater.,2009,163(1):174-179.
[12]Giakisikli G,Anthemidis A N.Anal.Chim.Acta,2013,789:1-16.
[13]Wang X,Meng L Y,Dai Y,Zou J L.ActaSci.Circum.(王雪,孟令友,代莹,邹金龙.环境科学学报),2013,33(8):2193-2198.
[14]Jiang W,Chen X B,Niu Y J,Pan B C.J.Hazard.Mater.,2012,243:319-325.
[15]Zhang X L,Niu H Y,Pan Y Y,Shi Y L,Cai Y Q.J.ColloidInterfaceSci.,2011,362:107-112.
[16]Wang J H,Zheng S R,Shao Y,Liu J L,Xu Z Y,Zhu D Q.J.ColloidInterfaceSci.,2010,349:293-299.
[17]Du G H,Liu Z L,Xia X,Chu Q,Zhang S M.J.Sol-gelSci.Technol.,2006,39(3):285-291.
[18]Yang Y,Guo X,Wei K W,Wang L J,Yang D D,Lai L F,Cheng M L,Liu Q.J.Nanopart.Res.,2014,16(1):1-10.
[19]Xu Z X,Zhang J,Cong L,Meng L,Song J M,Zhou J,Qiao X G.J.Sep.Sci.,2011,34:46-52.
[20]Zhang X L,Niu H Y,Pan Y Y,Shi Y L,Cai Y Q.Anal.Chem.,2010,82:2363-2371.
[21]Liu Q,Shi J B,Wang T,Guo F,Liu L H,Jiang G B.J.Chromatogr.A,2012,1257:1-8.
[22]Wei J,He Y X,Wang S.J.Instrum.Anal.(危晶,何奕轩,王邃.分析测试学报),2012,31(10):1223-1228.
[23]Goss K U.Environ.Sci.Technol.,2008,42:456-458.
[24]Post G B,Cohn P D,Cooper K R.Environ.Res.,2012,116(3):93-117.
Determination of Perfluorinated Compounds in Water Using Fe3O4@SiO2-NH2Magnetic Nanoparticles CompositesNIE Yang,WANG Yong-hua*,HU Liang-feng,HONG Cheng,LU Guang-hua
(Key Laboratory of Integrated Regulation and Resources Development of Shallow Lakes of Ministry of Education,
College of Environment,Hohai University,Nanjing210098,China)
Abstract:Fe3O4@SiO2-NH2magnetic nanoparticles composites were successfully synthesized by three-step method,and used as adsorbents for the extraction and analysis of seven typical perfluorinated compounds(PFCs) in water solution.In combination with ultra-high performance liquid chromatography-tandem triple quadrupole mass spectrometry(UPLC-MS/MS),a method to determine seven typical perfluorinated compounds in water was established.The synthesized material was characterized by TEM,SEM and FT-IR.The influencing factors including desorption solvent,volume of desorption solvent,desorption time,extraction time and pH value of solution were investigated.The result showed that amino was successfully modified on the surface of Fe3O4@SiO2magnetic nanoparticles.Fe3O4@SiO2-NH2magnetic nanoparticles composites exhibited a good extraction effect on the target perfluorinated compounds,and the optimum extraction efficiency was achieved as follows:extraction time:20 min,desorption solvent:3 mL×4 0.28% ammonia methanol solution,desorption time:5 min,and pH value:5.0.Under the optimum conditions,the calibration curves of seven perfluorinated compounds were linear in the range of 1-500 ng/L,with limits of detection of 0.2-0.5 ng/L.The method was applied in the detection of target perfluorinated compounds in real water with spiked recoveries no less than 82.0%.
Key words:Fe3O4@SiO2-NH2;perfluorinated compounds;ultra-high performance liquid chromatography tandem mass spectrometry(UPLC-MS/MS);environmental water samples
中图分类号:O657.63;TL281
文献标识码:A
文章编号:1004-4957(2016)01-0001-07
doi:10.3969/j.issn.1004-4957.2016.01.001
通讯作者:*王永花,博士,讲师,研究方向:环境痕量分析新技术,Tel:025-83786696,E-mail:mgflora@gmail.com
基金项目:中国博士后特别基金(2013T60496);中国博士后基金(2012M511194);江苏高校优势学科建设工程资助项目
收稿日期:2015-05-28;修回日期:2015-07-05
