新疆首次临床分离新生隐球菌菌株分子鉴定、基因分型及体外药物敏感性研究
2016-02-22尤丽吐孜许合热提哈地丽亚哈斯木王晓东邓淑文帕丽达阿布利孜
尤丽吐孜·许合热提 哈地丽亚·哈斯木 王晓东 邓淑文 帕丽达·阿布利孜
(1.新疆医科大学第一附属医院皮肤科,乌鲁木齐 830053;2.第二军医大学上海长征医院真菌研究所,上海 200003)
·论著·
新疆首次临床分离新生隐球菌菌株分子鉴定、基因分型及体外药物敏感性研究
尤丽吐孜·许合热提1哈地丽亚·哈斯木1王晓东1邓淑文2帕丽达·阿布利孜1
(1.新疆医科大学第一附属医院皮肤科,乌鲁木齐 830053;2.第二军医大学上海长征医院真菌研究所,上海 200003)
目的 对新疆首次临床分离的5株新生隐球菌进行分子鉴定、RAPD-PCR基因分型及体外药物敏感性研究。方法 5株新生隐球菌分子鉴定采用核糖体DNA大亚基 (LSU rDNA)D1/D2基因区域分子鉴定。分子分型采用引物SEQ-6结合RAPD-PCR法扩增5株新疆临床分离新生隐球菌菌株及5株由上海长征医院提供分离自上海新生隐球菌菌株,根据扩增产物带型进行基因型判定。采用临床实验室标准化协会 (CLSI)的酵母微量液基稀释法 (M27-A3)测定5株新疆临床分离新生隐球菌菌株对6种抗真菌药 (伏立康唑、伊曲康唑、两性霉素B、特比萘芬、氟康唑、5-氟胞嘧啶)的体外敏感性。结果 5株新疆临床分离隐球菌菌株经过D1/D2区域序列分析在基因Bank中比对后鉴定为新生隐球菌。5株新疆临床分离新生隐球菌和5株上海新生隐球菌菌株经RAPD-PCR法扩增,带型显示分为A、B、C、D 4个基因型,其中新疆5株菌株A型1株、其余4株均为B型,上海菌株B型为1株,C型3株、D型1株,5株新疆临床分离新生隐球菌株对伏立康唑、伊曲康唑、两性霉素B、特比萘芬的MIC值 (μg/mL)范围依次为:0.062 5~0.25、0.25~1、0.125~0.5、1~2,对氟康唑、5-氟胞嘧啶MIC值较高,MIC值范围依次为:4~16、8~32。结论 新疆临床分离5株隐球菌株采用D1/D2基因序列鉴定为新生隐球菌。RAPD-PCR分型显示新疆临床分离5株新生隐球菌株以B型基因型为主。A型和B型对伏立康唑、两性霉素B敏感,对伊曲康唑、特比萘芬剂量依赖型敏感,对氟康唑、5-氟胞嘧啶耐药。
新生隐球菌;新疆;RAPD-PCR基因分型;体外药物敏感性
[Chin J Mycol,2016,11(6):327-331]
新生隐球菌作为侵袭性真菌感染的重要病原真菌,严重危害人类健康。尤其是在合并HIV感染、造血干细胞移植、血液系统恶性肿瘤、长期用糖皮质激素或肿瘤化疗的患者,其患病率和死亡率更高[1]。国内外对隐球菌病基因分型及药物敏感性等方面均有相关报道[2-6],在国外主要见于AIDS人群,如在非洲的AIDS人群中,隐球菌病的发病率高达30%[7],且有隐球菌病暴发流行的报道。在我国,隐球菌病呈散发性,多数为免疫受损的人群[8],主要分布于广西省、河南省、云南省以及上海市、广西省、云南省、广东省、北京市[9-12]等发达城市,至今新疆未见报道。本研究首次报道了5株新疆首次临床分离新生隐球菌的分子鉴定,描述新疆新生隐球菌基因型特点及5株新疆临床分离菌株对两性霉素B、伊曲康唑、氟康唑、5-氟胞嘧啶、伏立康唑、特比萘芬的抗真菌药的体外敏感性,为临床正确诊断,治疗隐球菌病提供科学依据。
1 材料与方法
1.1 材料
菌株来源 5株临床分离新生隐球菌,分离自新疆医科大学第一附属医院,其中XYZ6008a、XYZ6008b均分离自同一患者治疗前后两次发病时的皮肤组织。5株临床分离新生隐球菌,分离自上海长征医院,作为参考菌株 (见表1)。
抗真菌药物 6种抗真菌药物分别是购自Sigma公司的两性霉素B、伊曲康唑、5-氟胞嘧啶、伏立康唑、特比萘芬和购自辉瑞制药公司的氟康唑。
1.2 方法
分子鉴定 形态学初步鉴定:包括脑脊液墨汁染色直接显微镜下观察,和接种于马铃薯葡萄糖琼脂培养基,37℃培养72 h观察菌落形态。
将形态鉴定为隐球菌的菌落接种到200 μL InstaGene提取液中震荡混匀,56℃加热10 min后100℃孵育8 min,3 500 r/min离心5 min,上清液为DNA,置-20℃保存备用。经生理学特征鉴定为新生隐球菌的10株菌进行LSU rDNA 25S D1/D2区域的序列分析确切鉴定 (见表2)。反应体系和反应条件略。扩增产物用SUPRECTM-02 (TaKaRa)纯化,BigDyeTM Terminator Cycle Sequencing Ready Reaction (Applied Biosystems,FosterCity,CA,USA)标记后ABIPRISM3100仪序列测定[13]。
表1 本研究所有新生隐球菌菌株信息
Tab.1 Information of theCryptococcusneoformansstrains in this study

序号菌株地区标本诊断基因型1XYZ6007新疆脑脊液隐球菌性脑膜炎A2XYZ6008a新疆皮肤组织白血病伴皮肤隐球菌病B3XYZ6008b新疆皮肤组织白血病伴皮肤隐球菌病B4XYZ6004新疆脑脊液隐球菌性脑膜炎B5XYZ6005新疆脑脊液隐球菌性脑膜炎B680379上海脑脊液隐球菌性脑膜炎B7ZP910上海脑脊液隐球菌性脑膜炎C8827016上海脑脊液隐球菌性脑膜炎C9HX17上海脑脊液隐球菌性脑膜炎C10HX19上海脑脊液隐球菌性脑膜炎D
注:XYZ.新疆医科大学第一附属医院真菌保藏中心,余由第二军医大学上海长征医院真菌研究所提供
表2 D1/D2区域的PCR引物序列及RAPD-PCR随机引物序列
Tab.2 D1/D2 area of PCR amplification primers and RAPD-PCR random primer sequence

引物名称序列NL-15'-GCATATCAATAAGCGGAGGAAAAG-3'NL-4m5'-GGTCCGTGTTTCAAGACG-3'SEQ-65'-CCCGTCAGCA-3'
RAPD-PCR反应体系及条件 采用随机引物SEQ-6扩增新生隐球菌的DNA产物。PCR反应体系20 μL,包括:DNA模板3 μL,2×Taq PCR Master Mix (dNTP、HCl、KCl、MgCl2)10 μL,引物 (见表2)0.4 μL、双蒸水6.6 μL。PCR反应条件:94℃预变性5 min,94℃变性1 min,36℃退火1 min,72℃延伸2 min,40个循环;72℃延伸10 min。取8 μL PCR产物在含EB的1.5%琼脂糖凝胶上100 V电泳25 min,紫外灯下观察结果。
5株临床分离菌株的体外药物敏感试验 试验前5株受试菌均接种PDA培养72 h使其活化,用无菌棉签头部轻轻滚动拭取已活化菌株放入2 mL的含0.05%Tween40的0.85%无菌生理盐水中混匀,静置3~5 min,根据M27-A3标准,用分光光度计测530 nm的OD值,再将菌悬液用RPMI-1640液体培养基稀释50倍,最终得到所需2倍的接种菌悬液浓度 (0.5×104~5×104CFU/mL)。选用ATCC22019 (近平滑念珠菌)作为药敏质控菌株。采用美国临床和实验室标准协会 (CLSI)方案[14]对两性霉素B、伊曲康唑、氟康唑、5-氟胞嘧啶、伏立康唑、特比萘芬 (购自Sigma公司的两性霉素B、伊曲康唑、5-氟胞嘧啶、伏立康唑、特比萘芬和购自辉瑞制药公司的氟康唑)体外药物敏感性微量液基稀释法 (M27-A3)。结果判定在显微镜下进行。所有菌株均进行2次重复试验。
最低抑菌浓度 (MIC)的判定标准:在显微镜下观察,与阳性对照孔对比,完全抑制,无生长的最低浓度。将5株新疆临床分离菌在35℃培养72 h判定最低抑菌浓度:在显微镜下观察,与阳性对照孔对比,完全抑制,无生长的最低浓度。
2 结 果
2.1 菌株分子鉴定
墨汁染色镜检,可见到透明荚膜包裹着菌细胞,菌细胞常有出芽,但不生成假菌丝,马铃薯葡萄糖琼脂培养基 (PDA),37℃培养72 h生成酵母型菌落,初呈白色,1周后转淡黄或棕黄、湿润黏稠,状似胶汁。每一株临床分离菌株扩增D1/D2区域序列在基因BANK核酸序列数据库中进行同源性序列搜索比对,进一步通过分子序列证实所有菌株为新生隐球菌。
2.2 RAPD-PCR扩增
本研究中的10株新生隐球菌显示了4个基因型 (见图1)。A型有1株为新疆临床分离株;B型有5株:分别是4株新疆临床分离株和1株上海株;C型有3株:3株上海株;D型为1株上海株。
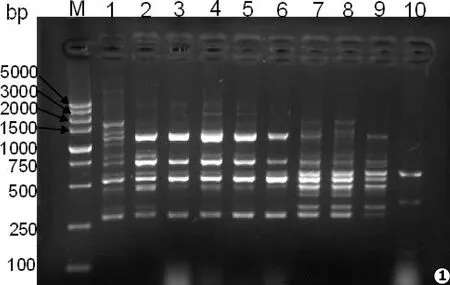
图1 新生隐球菌经PCR-RAPD基因分型琼脂糖凝胶电泳图 (M.标准DNAMaker;1.XYZ6007,即A型;2-6.XYZ6008a、XYZ6008b、XYZ6004、XZY6005、80379,即B型;7-9.ZP910、827016、HX17,即C型;10.HX19,即D型
Fig.1 Electrophoresis of PCR products:M.maker;lanel 1.XYZ6007 (typeA);lanel 2-6.XYZ6008a,XYZ6008b,XYZ6004,XZY6005,80379 (typeB);lanel 7-9.ZP910,827016,HX17 (typeC);lanel 10.HX19 (typeD)
5株新疆临床分离新生隐球菌对6种抗真菌药物体外药敏MIC值见表3,MIC值由低到高依次为:伏立康唑0.062 5~0.25 μg/mL、伊曲康唑0.25~1 μg/mL、两性霉素B 0.125~0.5 μg/mL、特比萘芬1~2 μg/mL,对氟康唑、5-氟胞嘧啶MIC值较高,MIC值范围依次为:4~16 μg/mL、8~32 μg/mL。
3 讨 论
隐球菌病是由隐球菌引起的一种严重深部真菌病,新生隐球菌为隐球菌属重要致病菌种。新生隐球菌包括格鲁比、新生和格特变种,2002年,Kwon-Chung[15]等将格特变种上升至种的水平,并命名为格特隐球菌,现已被国际上接受。隐球菌主要侵犯中枢神经系统、肺脏,亦可侵犯皮肤、骨骼等器官,世界各地均有流行,每年约造成62万人死亡[16]。在国外隐球菌病主要见于AIDS人群,比如在美国隐球菌病发病人群中有7%~8%是艾滋病患者[7],在非洲的AIDS人群中,隐球菌病的发病率高达30%,且有隐球菌病暴发流行的报道[17],在我国,主要好发于免疫功能低下的人群,如大剂量使用糖皮质激素及抗肿瘤化疗药物的患者、ADIS患者等。该病起病隐匿,病死率极高,预后差,因此快速准确的检测新生隐球菌感染对于疾病治疗有重要价值,分子流行病学研究也显得日益重要。
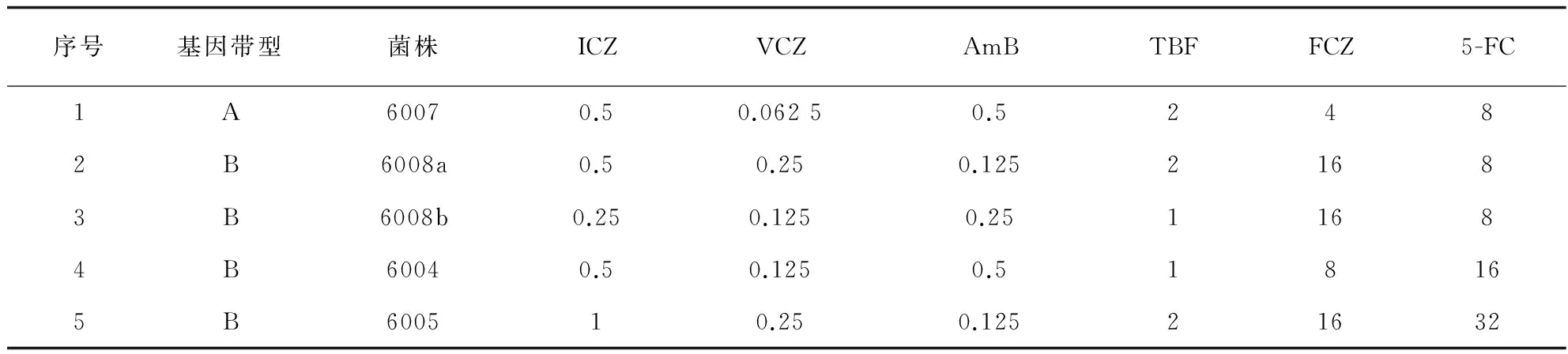
表3 新疆临床分离新生隐球菌对抗真菌药物的MIC值
注:ICZ.伊曲康唑,VCZ.伏立康唑,AmB.两性霉素B,TBF.特比萘芬,FCZ.氟康唑,5-FC.5-氟胞嘧啶
早在1993年Meyer等就应用PCR指纹技术对酵母菌进行种和株的鉴定[18],1999年Meyer等对世界多国的共356株隐球菌进行分型[19]。2008年,陈江汉等[20]检测中国16个省,1980~2006年收集的120株标本,应用PCR指纹技术将129株隐球菌分为相应的8个基因型,与文献报道[21]的全球新生隐球菌的基因型一致。在国内的隐球菌病感染大部分来自脑脊液,中枢神经系统感染合并肺隐球菌病,其病死率高达55%[22]。因此早期开展有效的抗真菌治疗对于患者的预后和转归十分重要。在新疆至今未见新生隐球菌基因分型、体外药敏试验方面的报道。
本文分析了新疆医科大学第一附属医院首次临床分离5株新生隐球菌,通过分子分型,进一步分析基因型,将上海5株临床分离新生隐球菌作为参考菌株,以期了解新疆新生隐球菌的分子流行病学特征及体外抗真菌药物敏感性。本文参考Reginaldo等[23]用随机引物SEQ-6结合RAPD-PCR法具体分析了新生隐球菌的基因多态性,选用引物SEQ-6结合RAPD-PCR方法对10株新生隐球菌进行了PCR扩增,结果显示4种基因型,即A、B、C、D。本研究中的5株新疆临床分离菌株与上海5株菌有完全相同的基因型,也有交叉重叠的型,新疆菌株以B型为主,作为参考的上海菌株以C型为主,两个地区基因型明显不同,新疆有自己独立的基因型。
本研究参照CLSIM27-A3方案,评价了5株分离自新疆的新生隐球菌对两性霉素B、伊曲康唑、氟康唑、5-氟胞嘧啶、伏立康唑、特比萘芬的最低抑菌浓度MIC值。结果显示受试菌株对伏立康唑 (0.062 5~0.25 μg/mL)、两性霉素B (0.125~0.5 μg/mL)敏感,对伊曲康唑 (0.25~1 μg/mL)、特比萘芬 (1~2 μg/mL)剂量依赖,对氟康唑 (4~16 μg/mL)、5-氟胞嘧啶 (8~32 μg/mL)耐药,与文献报道一致[12]。本研究中伏立康唑对5株新疆菌株的MIC值均低,符合美国食品与药物管理局批准上市的新型三唑类药物伏立康唑对新生隐球菌具有较好的体外敏感性[24]。基因型A和B对上述药物的敏感性无明显差异,因此基因型与药物敏感性无明显相关性。
本研究中新疆医科大学第一附属医院临床分离5株菌中2株菌 (XYZ6008a、XYZ6008b)均分离于同一慢性白血病患者的前后两次的皮肤溃疡处,用引物SEQ-6扩增的条带完全一致于对抗真菌药的体外敏感性也基本一致,提示治疗前的菌株和治疗后复发的皮损分离株为同一个菌株,考虑为前次治疗不彻底复发。
[1] Srikanta D,Santiago-Tirado FH,Doering TL.Cryptococcusneoformans:historical curiosity to modem pathogen[J].Yeast,2014,31(2):47-60.
[2] Sidrim JJ,Costa AK,Cordeiro RA,et al.Molecular methods for the diagnosis and characterization ofCryptococcus:a review[J].Can J Microbiol,2010,56(6):445-458.
[3] Rodero L,Cordoba S,Cahn P,et al.InvitrosusceptibiIity studies ofCryptococcusneoformansisoIated from patients with no cIinicaI response to amphotericin B therapy[J].Antimicrob Chemother,2000,45(2):239-242.
[4] 李竹青,邵经政,廖万清,等.中国致病性新型隐球菌血清型的研究[J].中华医学检验杂志,1987,l0(6):350-352.
[5] Mitchell TG,Perfect JR.Cryptococcosis in the era of AIDS 100 years after the discovery ofCryptococcusneoformans[J].Clin Microbiol Rev,1995,8(4):515-548.
[6] 苏逸丹,汪师贞,翁心华,等.新型隐球菌临床与环境分离株对抗真菌药物敏感性的比较及血清分型[J].中华医学杂志,2000,80(6):448-449.
[7] Stephen C,Lester S,Black W,et al.Muhispeeies outbreak of cryptococcosis on southern Vancouver Island.British Columbia[J].Can Vet J,2002,(43):792-794.
[8] 顾菊林,温海,陈江汉,等.隐球菌性脑膜炎39例临床分析[J].临床皮肤科杂志,2005,34(12):801-803.
[9] 戚建明,陈江汉,杨军,等.129株新型隐球菌基因型及感染人群研究[J].中国感染与化疗杂志,2013,13(6):481-484.
[10] 边富宁,吴媛,于栓宝,等.广西贵港地区2009-2012年新生隐球菌和格特隐球菌临床分离株基因分型与毒力特性研究[J].中国流行病学杂志,2015,36(5):491-495.
[11] 张米,雷素云,高丽.艾滋病患者培养检出新型隐球菌的分布特点及其耐药分析[J].世界最新医学信息文摘,2015,15(2):102-103.
[12] 冯晓博,姚志荣,蔡建国,等.80株新生隐球菌的体外药物敏感试验分析[J].中华传染病杂志,2009,27(5):268-272.
[13] 帕丽达·阿布利孜,哈木拉提·吾甫尔,TakashiYaguchi,等.新疆地区白念珠菌基因型分析及其体外药物敏感性研究[J].中国真菌学杂志,2011,6(1):10-14.
[14] 陈宏,温海,徐红,等.两性霉素B 和5-氟胞嘧啶的体外联合药敏试验[J].第二军医大学学报,2003,24(4):453-454.
[15] Kwon-Chung KJ,Boekhout T,Fell JW.et al.Proposal to conserve the nameCryptococcusgattiiagainstC.hondurianusandC.Bacillisporus(Basidiomycota,Hymenomycetes,Tremellomycetidae)[J].Taxon,2002,5l(4):804-806.
[16] 潘搏,陈敏,潘炜华,等.隐球菌形态学变化及其致病机制[J].微生物感染,2012,7(2):121-125.
[17] Dismukes WE.Cryptococcal meningitis in patient with AIDS[J].J Infect Dis,1988,157( 4):624-628.
[18] Velegraki A,Kiosses VG,Kansouzidou A,et al.Prospective use of RFLP analysis on amplifiedCryptococcusneoformansURA5 gene sequences for rapid identification of varieties and serotypes in clinical samples[J].Med Mycol,2001,39(5):409-417.
[19] Meyer W,Aanensen D.M,Boekhout T,et al.Consensus multi-locus sequence typing scheme forCryptococcusneoformansandCryptococcusgattii[J].Med Mycol,2009,47(6):56l-570.
[20] Chen J,Varma A,Diaz MR,et al.Cryptococcusneoformansstrains and infection in apparently immunocompetent patients China[J].Emerg Infect Dis,2008,14(5):755-762.
[21] Jarvis JN,Harrison TS.Pulmonary cryptococcosis[J].Semin Respir Crit Care Med,2008,29(2):141-150.
[22] Denning DW,Hope WW.Therapy for fungal diseases:opportunities and priorities[J].Trends Microbiol,2010,18(5):195-204.
[23] Dos Santos Pedroso R,Ferreira JC,da Costa KR,et al.Comparison of primers for RAPD-PCR environmenta lisolates ofCryptococcusneoformans,Cryptococcusalbidus,Cryptococcuslaurentiicomplex[J].Braz J Microbiol,2012,43(3):951-958.
[24] 廖勇,杨蓉娅.伏立康唑治疗隐球菌病的研究进展[J].中国真菌学杂志,2011,6(3):180-184.
[本文编辑] 王 飞
·消息·
Molecular identification and genotyping andinvitrodrug sensitivity study of the first five clinical isolates ofCryptococcusneoformansin Xinjiang
Yultuz·Xohrat1,Kadirye·Kasim1,WANG Xiao-dong1,DENG Shu-wen2,Prida·Abliz1
(1.DermatologyoftheFirstAffiliatedhospitalofXinjiangMedicalUniversity,Urumqi830053;2.TheFungusInstituteofShanghaiChangzhenghospital,Shanghai200003)
Objective For the first time to perform the molecular identification,RAPD-PCR genotyping andinvitrodrug sensitivity study of 5 clinical strains ofCryptococcusneoformansin Xinjiang.Methods Molecular classification using primer SEQ-6 from big subunit ribosomal DNA (LSU rDNA) D1/D2 gene region and RAPD-PCR method were applied in 5 strains of clinical isolated XinjiangCryptococcusneoformansstrains and 5Cryptococcusstrains provided by Shanghai Changzheng hospital.Sensitivityinvitroof 5 clinical isolated XinjiangCryptococcusneoformansstrains of the above 6 kinds of antifungal drugs (Voriconazole,itraconazole,amphotericin B,terbinafine,fluconazole,5-fluorine cytosine )were judged according to clinical laboratory standards institute (CLSI) trace liquid dilution method of yeast (M27-A3).Result The 5 strains of Xinjiang were identified asCryptococcusneoformansthrough D1/D2 region sequence analysis.All 10 strains are divided into A,B,C,D 4 genotype by RAPD-PCR.One Xinjiang strain was type A,the rest 4 strains were type B;Among 5 Shanghai strains,1 strain was type B,3 strainswere type C,1 strain was typeD.For the 5 Xinjiang clinicalCryptococcusneoformansstrains,to the MIC value ranges of voriconazole,itraconazole,amphotericin B and terbinafine were as following:0.062 5-0.25 μg/mL,0.25-1 μg/mL,0.125-0.5 μg/mL,1-2 μg/mL,respectively;MIC value ranges of fluconazole,5-fluorine cytosine MIC value were much higher as:4-16 μg/mL,8-32 μg/mL,respectively.MIC values of genotype A and B to voriconazole were 0.062 5-0.125 μg/mL.Conclusion The 5 Xinjiang clinical isolates ofCryptococcuswere identified asCryptococcusneoformansusing D1/D2 genes analysis.RAPD-PCR revealed these clinicalCryptococcusneoformansstrain in Xinjiang with priority given to type B genotypes.Type A and type B isolates weremore sensitive to voriconazole,amphotericin B,itraconazole and terbinafine.
Cryptococcusneoformans;Xinjiang;RAPD-PCR genotyping;antifungal sensitivity
国家自然科学基金 (81360237)
尤丽吐孜·许合热提,女 (维吾尔族),硕士,住院医师.E-mail:m13899841261@163.com
帕丽达·阿布利孜,E-mail:palidae@aliyun.com
R 379.5
A
1673-3827(2016)11-0327-05
2016-09-01
