新建辅助生殖实验室的鼠胚实验报告
2016-02-17高亚可杜姗姗
高亚可 杜姗姗
(1 南方医科大学附属深圳恒生医院生殖医学中心,深圳市 518000,E-mail:gaoyake_2008@163.com;
论著·基础研究
新建辅助生殖实验室的鼠胚实验报告
高亚可1杜姗姗2
(1 南方医科大学附属深圳恒生医院生殖医学中心,深圳市 518000,E-mail:gaoyake_2008@163.com;
2 广西大学动物繁殖研究所,南宁市 530000)
目的 探讨用鼠胚实验对新建辅助生殖实验室的培养体系进行评估的可行性。方法 对昆明系小鼠进行体内、体外受精实验,观察常规培养条件下不同受精方式来源小鼠胚胎的发育情况以及不同培养环境对小鼠体外受精胚胎发育的影响,并计算受精率、卵裂率及囊胚率。结果 常规培养条件下,体内受精组的受精率和卵裂率均显著高于体外受精组(P<0.05),两组囊胚率比较差异无统计学意义(P>0.05)。在体外受精中,三气培养组的卵裂率和囊胚率显著高于两气培养箱组(P<0.05),两组受精率比较,差异无统计学意义(P>0.05)。结论 小鼠体内、体外受精获得的受精卵均有较高的成胚率,鼠胚培养可对新建辅助生殖实验室的培养体系进行评估。常规培养条件下体内受精胚胎的发育潜能优于体外受精,而体外受精胚胎在三气培养环境下的发育潜能优于两气培养环境。
鼠胚实验;体外受精;体内受精;两气培养;三气培养;辅助生殖实验室;小鼠
体外受精(in vitro fertilization,IVF)与胚胎移植是治疗不孕不育的一项重要人类辅助生殖技术,体外受精实验室是这一技术能够有效开展的极为重要的部分,高效稳定的实验室环境对于胚胎的生长发育及IVF的成功率都起着至关重要的作用[1]。鼠胚实验(mouse embryo assay,MEA)是目前最常用于IVF实验室耗材、培养基和设备质量控制的生物学方法,适用于新建或新启动周期的IVF实验室的质量控制[2]。南方医科大学附属深圳恒生医院生殖医学中心IVF实验室于2014年8月建成,经过前期的洁净消毒和“热处理”后[3],中心从2015年2~4月,在新实验室环境下对昆明小白鼠进行体内受精和体外受精实验,现报告如下。
1 材料与方法
1.1 实验动物 无特定病原体级昆明小白鼠及小鼠饲料购自广东省医学实验动物中心,许可证号:SCXK(粤)2013-0002。雌鼠4~8周龄,体重20~40 g;雄鼠8~10周龄,体重40~50 g。实验前对小鼠适应性喂养1周,喂养环境26℃恒温,饮用水为桶装纯净水。
1.2 药品与试剂 孕马血清促性腺激素(pregnant mare serum gonadotropin,PMSG;批号:140913)、人绒毛膜促性腺激素(human chorionic gonadotrophin,HCG;批号:150209)购自宁波第二激素厂。透明质酸酶(批号:021772)、卵子-胚胎缓冲液(批号:505432)、受精处理液(批号:505382)、卵裂胚胎培养液(批号:505448)、囊胚培养液(批号:505395)、超纯培养油(批号:500183)等采用瑞典Vitrolife G5 Series 序贯培养液。
1.3 耗材与设备 培养皿(批号:4054008)、离心管(批号:4085007)、移液管(批号:3309883)、玻璃巴氏德吸管(批号:24424)等一次性耗材为美国BD Falcon公司产品;氮气(N2)纯度为999.95%,CO2纯度为99.999%;丹麦IVFTECH恒温百级工作站(型号:Sterile180),日本Astec CO2培养箱(型号:Astec APM-50D),日本Olympus倒置显微镜(型号:Olympus 1X71)、体视显微镜(型号:Olympus SZX10)及相差显微镜(型号:Olympus CX41),德国Eppendorf台式低速离心机(型号:5702)等。
1.4 实验方法
1.4.1 小鼠超排卵和鼠卵的采集:于下午17时对每只雌鼠腹腔内注射PMSG 10 IU,48 h后腹腔内注射HCG 10 IU,次日上午8 ∶00采用颈椎脱臼法处死雌鼠。无菌工作台内取出小鼠卵巢及输卵管,于卵子-胚胎缓冲液中洗涤2遍,体视显微镜下用1 ml注射器轻轻划破膨大的输卵管壶腹部,让卵子团自动逸出。
1.4.2 鼠精的采集和处理:采用颈椎脱臼法处死雄鼠,无菌工作台内取出小鼠附睾及部分输精管,于卵子-胚胎缓冲液中洗涤2遍,体视显微镜下用1 ml注射器从附睾尾部向前轻轻挤出输精管中的精子(若精子数量不足,可用注射器刺破附睾获取精子),用巴氏吸管快速吸出精子悬液,将精子悬液缓慢加入装有受精处理液的离心管底部,置于培养箱中上游处理60 min。
1.4.3 体外受精:收集获能后的上层精子,相差显微镜下观察精子活力及浓度,使用精子计数板对精子计数。取出受精皿,将精子悬液加入到放有卵子团的受精液滴中并调整精子浓度约为1×106/ml,完成受精过程。
1.4.4 体内受精:于下午17时将注射HCG后的雌鼠与雄鼠(1 ∶1)合笼,次日早晨观察雌鼠阴道栓形成情况。将形成阴道栓的雌鼠颈椎脱臼处死,无菌工作台内取出小鼠卵巢及输卵管,在体视显微镜下取出合子团(方法同鼠卵采集)。
1.4.5 原核胚的发育观察:在体外受精中,精卵孵育8 h后观察原核胚的形成情况,统计受精率;对于体内受精,将收集的合子团置于透明质酸酶液滴(10倍稀释后)中,轻轻吹打10~20 s以脱去卵丘颗粒细胞,观察原核胚的形成情况,统计受精率。
1.4.6 卵裂期胚胎和囊胚的培养:将收集的原核胚洗涤后转入卵裂胚胎培养液滴中,培养液滴体积为50 μl,可放入5~10(胚胎过多会导致胚胎营养不足)枚胚胎;第3天将胚胎转入囊胚培养液滴中继续培养。
1.5 统计学分析 采用SPSS 19.0软件进行数据处理,计数资料比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 常规培养条件下不同来源小鼠受精卵发育情况的比较 常规两气培养条件下(37℃、6% CO2、饱和湿度),小鼠体内受精实验共进行了38个周期,获卵1 283枚,受精1 189枚;小鼠体外受精实验共进行了41个周期,获卵1 331枚,受精1 152枚。体内受精组的受精率、卵裂率均显著高于体外受精组(P<0.05),两组囊胚率比较,差异无统计学意义(P>0.05),见表1。

表1 常规培养条件下不同来源小鼠受精卵发育情况的比较
2.2 不同培养环境对小鼠体外受精胚胎发育情况的影响 三气培养(37℃、6% CO2、5% O2、饱和湿度)条件下,小鼠体外受精共进行了45个周期,获卵1 593枚,受精1 377枚。三气培养组的小鼠卵裂率和囊胚率均显著高于两气培养组(P<0.05),两组的受精率差异无统计学意义(P>0.05),见表2。

表2 不同培养环境下小鼠体外受精胚胎发育情况的比较
2.3 小鼠体外受精胚胎的培养观察 在体外受精过程中,小鼠卵子团在精子的作用下(图1A),外周卵丘颗粒细胞逐渐脱落。卵子正常受精后,受精卵内清晰可见雌、雄原核的形成(图1B)。随后受精卵进入卵裂期,可见2个对称卵裂球,卵裂球大小均一、无碎片(图1C)。受精后第2天胚胎进入4细胞期,可见4个卵裂球呈四面体对称,大小均一、形态规则、无碎片(图1D)。第3天胚胎进入8细胞期,可见8个大小均一的卵裂球,形态相对规则,无碎片(图1E)。第4天后胚胎进入融合期,卵裂球互相融合,紧密联系在一起,分不清单个卵裂球的界限(图1F),随后胚胎进入早期囊胚阶段,开始形成囊胚腔,囊胚腔的体积小于胚胎体积(图1G)。第5天胚胎进入扩张囊胚阶段,囊胚腔完全占据了胚胎的体积,胚胎总体积明显变大,透明带变薄,滋养层细胞结构致密,内细胞团细胞数目较多,排列紧密,随后胚胎进入孵化囊胚阶段,囊胚的一部分开始从透明带中逸出(图1H)。

A 小鼠精子和卵子团 B 小鼠受精卵 C 小鼠2细胞期胚胎
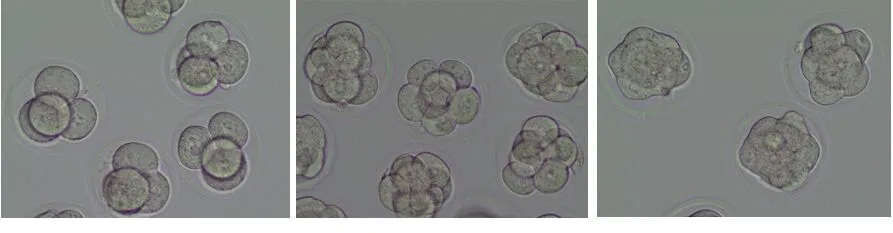
D 小鼠4细胞期胚胎 E 小鼠8细胞期胚胎 F 小鼠融合期胚胎

G 小鼠早期囊胚 H 小鼠孵化期囊胚
图1 小鼠卵母细胞的体外受精及胚胎发育情况(×200)
3 讨 论
尽管IVF的历史已有30多年,但目前全世界仍缺乏建立IVF实验室的统一标准[2]。MEA已经成为评估新建IVF实验室环境条件和培养体系质量好坏的最为常用的质控方法,通过对不同阶段胚胎发育情况的连续观察,在反映胚胎发育潜能的同时,可以检测培养室的环境条件,包括空气质量、温度、湿度及各种耗材、培养液、培养箱内环境和实验人员的技术水平等[4]。在本实验中,通过体内或体外受精方式获得的小鼠受精胚胎,均能在两气或三气培养环境中发育至囊胚阶段,均保持了较高的卵裂率和囊胚率,且胚胎发育状况良好,各项指标趋于稳定,符合MEA的质控要求[5],表明鼠胚培养可对新建辅助生殖实验室的培养体系进行评估。
通过对常规培养条件下小鼠体内受精、体外受精胚胎发育情况的比较,我们发现体内受精组的受精率和卵裂率均显著高于体外受精组(P<0.05),这可能是由于受精前卵母细胞所处环境的不同对受精和胚胎早期发育过程产生了影响。在体内环境中,卵母细胞处于一个无光、恒温、恒湿、低氧的环境中,母体内分泌、子宫及输卵管会分泌一些物质促进受精的完成,而在体外环境中,卵母细胞不具备任何保护和屏障功能,可能暴露于含有害气体的空气中,面临温度、渗透压、pH等变化的应激,降低了精卵结合的机会,使受精率下降[3]。在精子的选择上,体内受精过程中精子从生殖道到达输卵管,要经过严格的自然选择,而体外受精则需要对精液人工处理,对精子的自然选择是有限的,同时体外操作过程中也会增加氧自由基水平,使精子质膜的脂质发生过氧化反应,影响精子获能和顶体反应的发生。此外,体外受精方式增加了配子和受精卵在体外培养的时间,卵子老化、过熟、氧化损伤和物理损伤增加,可能导致受精卵在细胞周期的转化剂微管蛋白、纺锤体的形态上存在异常以及非整倍体增加,导致受精卵不卵裂[6]。
在不同培养环境的实验中,我们发现三气培养环境与两气培养环境的受精率无显著差异(P>0.05),但三气培养下的卵裂率和囊胚形成率显著高于两气培养(P<0.05),这一结果与Ciray等[7]的研究结果相似。这可能是由于三气培养中O2的体积分数仅为5%,而在常规的两气培养中约为20%,前者更接近体内发育环境。Fischer等[8]的研究表明,多数哺乳动物输卵管和子宫内的氧气浓度体积分数仅为2%~8%,远低于空气中的氧气浓度。Dumoulin等[9]在人类囊胚培养过程中发现对于8细胞期以前的胚胎,采用两种O2浓度培养并无明显差异,但在5% O2环境中,人类囊胚的形成率会显著提高。这一结论与本实验结果有所不同,这可能与不同物种胚胎各阶段对培养环境的耐受性不同有关,此外也可能跟实验样本量有限有关,还有待进一步研究。Leoni等[10]的研究发现人卵子在20% O2的高氧条件下授精后,其囊胚的发育潜能会遭到破坏;过氧化物的产生可能会影响胚胎早期的代谢及基因表达,而这种损害可能在桑椹胚期或囊胚期明显表现,最终影响囊胚形成[11]。高氧环境(20% O2)对胚胎体外发育的影响机制目前尚不明确,有学者认为,高氧环境可能会产生更多的活性氧,包括超氧阴离子、过氧化氢、羟基等导致胚胎 DNA 损伤、线粒体改变、脂质过氧化及蛋白氧化修饰等,从而影响胚胎的发育潜能[8]。
综上所述,在常规培养条件下,小鼠体内、体外受精获得的受精卵均有较高的成胚率,鼠胚培养可对新建辅助生殖实验室的培养体系进行评估;体内受精后胚胎的发育潜能优于体外受精,体外受精胚胎在三气培养环境下的发育潜能优于两气培养环境。
[1] Morbeck DE.Importance of supply integrity for in vitro fertilization and embryo culture[J].Semin Reprod Med,2012,30(3):182-190.
[2] 黄国宁,刘东云,韩 伟.辅助生殖技术实验室的建设及其质量控制[J].中国实用妇科与产科杂志,2010,26(10):755-758.
[3] 黄国宁,孙海翔.体外受精-胚胎移植实验室技术[M].北京:人民卫生出版社,2012:15-37.
[4] Stamatkin CW,Roussev RG,Stout M,et al.Preimplantation Factor(PIF) correlates with early mammalian embryo development-bovine and murine models[J].Reprod Biol Endocrinol,2011,9:63.
[5] Revil T,Gaffney D,Dias C,et al.Alternative splicing is frequent during early embryonic development in mouse[J].BMC Genomics,2010,11:399.
[6] Penzias AS.Recurrent IVF failure:other factors[J].Fertil Steril,2012,97(5):1 033-1 038.
[7] Ciray HN,Akeoy T,Yaramanci K.In vitro culture under physiologic oxygen concentration improves blastocyst yield and quality:a prospective randomized survey on sibling oocytes[J].Fertil Steri,2009,91(4 Suppl):1 459-1 461.
[8] Fischer B,Bavister BD.Oxygen tension in the oviduct and uterus of rhesus monkeys,hamsters and rabbits[J].J Reprod Fertil,1993,99(2):673-679.
[9] Dumoulin JCM,Meijers CJ,Bras M,et al.Effect of oxygen concentration on human in-vitro fertilization and embryo culture[J].Hum Reprod,1999,14:465-469.
[10]Leoni GG,Rosati I,Succo S,et al.A low oxygen atmosphere during IVF accelerates the kinetic of formation of in vitro produced ovine blastocysts[J].Reprod Domest Anim,2007,42:299-304.
[11]Meintjes M,Chantilis SJ,Douglas JD,et al.A controlled randomized trial evaluating the effect of lowered incubator oxygen tension on live births in a predominantly blastocyst transfer program[J].Hum Reprod,2009,24(2):300-307.
A report on mouse embryo assay of new assisted reproductive laboratory
GAOYa-ke,DUShan-shan
(1ReproductiveMedicineCenter,ShenzhenHengshengHospitalAffiliatedtoSouthernMedicalUniversity,Shenzhen518000,China; 2ResearchInstituteofAnimalReproduction,GuangxiUniversity,Nanning530000,China)
Objective To explore the feasibility of mouse embryo assay applied to the assessment of culture system in the new assisted reproductive laboratory.Methods Kunming mice were selected and used for in vivo and in vitro fertilized experiments.The development of mouse embryos achieved from different fertilization modes on routine cultural conditions was observed.And the effect of different cultural conditions on the fertilized mouse embryos in vitro was also assessed.Then the fertilization rate,cleavage rate and blastocyst rate were calculated.Results On the routine cultural condition,the fertilization rate and cleavage rate of in vivo fertilization group were significantly higher than those of in vitro fertilization group(P<0.05),and there was no statistical difference in the blastocyst rate between two groups(P>0.05).In in vitro fertilization,the cleavage rate and blastocyst rate of tri-gas culture group were significantly higher than those of two-gas culture group(P<0.05),and there was no statistical difference in the fertilization rate between two groups(P>0.05).Conclusion The mouse oosperm of in vivo or vitro fertilization can obtain quite high live embryo rate,and the mouse embryo culture can be used to evaluate the culture system in the new assisted reproductive laboratory.On the routine cultural condition,the potential of development of in vivo fertilization-embryo is superior to that of in vitro fertilization-embryo.And the potential of development of in vivo fertilization-embryo on the tri-gas culture condition is superior to that on two-gas culture condition.
Mouse embryo assay,In vitro fertilization,In vivo fertilization,Two-gas culture,Tri-gas culture,Assisted reproductive laboratory,Mouse
高亚可(1987~),男,硕士,助理研究员,研究方向:生殖胚胎学。
R-322
A
0253-4304(2016)03-0304-04
10.11675/j.issn.0253-4304.2016.03.03
201512-12
2015-02-25)
