冬凌草甲素对胆管癌QBC939细胞增殖、凋亡及端粒酶活性的影响
2016-02-17丁明勇王卫星
丁明勇 王卫星
(武汉大学人民医院肝胆腹腔镜外科,武汉市 430060,E-mail:dingmingyongwk@sina.com)
论著·基础研究
冬凌草甲素对胆管癌QBC939细胞增殖、凋亡及端粒酶活性的影响
丁明勇 王卫星
(武汉大学人民医院肝胆腹腔镜外科,武汉市 430060,E-mail:dingmingyongwk@sina.com)
目的 探讨冬凌草甲素对胆管癌细胞系QBC939细胞增殖、凋亡及端粒酶活性的影响。方法 采用不同浓度冬凌草甲素(0、10、20、40、80、100 μmol/L)处理QBC939细胞24、48、72 h,MTT法测定QBC939细胞活力并计算增殖抑制率;不同浓度冬凌草甲素(0、20、40、80 μmol/L)处理QBC939细胞48 h后,分别采用流式细胞仪检测细胞周期和凋亡率,Western Blot法检测QBC939细胞B淋巴细胞瘤-2蛋白(Bcl-2)、Bcl-2相关X蛋白(Bax)的表达,端粒酶重复序列扩增法检测QBC939细胞的端粒酶活性。结果 QBC939细胞增殖抑制率随冬凌草甲素的药物浓度升高、作用时间延长而升高;与0 μmol/L冬凌草甲素组相比,其他浓度冬凌草甲素组的S期细胞比例降低;0、20、40、80 μmol/L冬凌草甲素组QBC939细胞的凋亡率分别为0.5%、14.8%、25.8%及37.7%;Western Blot结果显示随着药物浓度的升高,QBC939细胞的Bax表达量逐渐升高,Bcl-2表达量逐渐降低;其他浓度冬凌草甲素组QBC939的端粒酶活性均低于0 μmol/L冬凌草甲素组,且QBC939细胞的端粒酶活性随冬凌草甲素浓度的升高而降低(P<0.05)。结论 冬凌草甲素可抑制QBC939细胞增殖并诱导其凋亡,其作用机制可能与抑制Bcl-2表达以降低端粒酶活性有关。
胆管癌;冬凌草甲素;QBC939细胞;增殖;凋亡;端粒酶活性;B淋巴细胞瘤-2蛋白
冬凌草甲素又称为延命草宁、冬凌草素,其为从冬凌草中提取出来的有效活性成分,是一种以贝壳杉烯为骨架的四环二萜类化合物。药理学实验发现其具有抗炎、降血压、抗菌等多种药理活性[1]。近年来,大量研究证实冬凌草甲素对食管癌、肝癌、膀胱癌及肺癌等多种肿瘤细胞均具有明显的抑制作用[2-5]。而目前有关冬凌草甲素对胆管癌细胞作用的文献资料相对较少。本研究以胆管癌QBC939细胞为研究对象,观察冬凌草甲素对QBC939细胞增殖、凋亡及端粒酶活性的影响,并分析其可能的作用机制。
1 材料与方法
1.1 主要材料 细胞株:胆管癌QBC939细胞购自中国科学院上海细胞库,由武汉大学中心实验室冻存。主要试剂:冬凌草甲素购自上海诗丹德生物技术有限公司(纯度>98%,批号20131201),用二甲基亚砜(dimethyl sulphoxide,DMSO) 配制成10 mmol/L(DMSO的终浓度小于0.1%)的母液,-20℃保存;胎牛血清购自杭州四季青公司(批号140412),DMEM培养液购于碧云天生物技术研究所(批号20131123);AnnexinV/PI凋亡检测试剂盒购于Bender公司;端粒酶检测试剂盒(Telo TAGGG Telomerase PCR ELISA)购自德国Roche公司(批号20140314);四甲基偶氮唑盐(methyl thiazolyl tetrazolium,MTT)试剂盒(批号20140311)、辣根酶标记山羊抗兔或山羊抗鼠IgG购自武汉博士德生物科技有限公司(批号2014401);B淋巴细胞瘤-2蛋白(B-cell lymphoma-2,Bcl-2)、Bcl-2相关X蛋白(Bcl-2 associated X,Bax)及β-肌动蛋白(β-actin)抗体购自Cell Signaling Technology公司(批号分别为20131221、20140212、20140128)。
1.2 方法
1.2.1 细胞培养:细胞接种到培养瓶中,置于37℃含5% CO2的细胞培养箱中培养,2~3 d后观察培养基颜色及培养瓶内细胞生长情况,若培养基颜色变淡而细胞未长满则将培养瓶从培养箱中取出,在无菌操作台上操作,弃去培养基,用磷酸缓冲盐溶液(phosphate buffered saline,PBS)清洗2~3遍,加入适量新培养基,继续放入培养箱中培养。
1.2.2 MTT法检测细胞活力:取3块96孔板,每块板上划分为6个区域用于接种6组细胞,每组细胞含3个复孔,同时准备好细胞计数板;将处于对数生长期的细胞用胰酶消化后,用完全培养基重悬成细胞悬液;各组细胞按2 000/孔接种于96孔板上,每孔加培养基100 μl,铺板过程中确保每个孔接种的细胞数目一致,铺板完成后将96孔板放入37℃、5% CO2的培养箱中;细胞贴壁后各组分别加入冬凌草甲素终浓度为0 μmol/L、10 μmol/L、20 μmol/L、40 μmol/L、80 μmol/L、100 μmol/L的培养液,其中0 μmol/L浓度组设为对照组。3块培养板分别培养24 h、48 h、72 h,在培养终止前4 h,每孔内加入10 μl 5 mg/ml的MTT,4 h后弃去培养液,每孔加入100 μl的DMSO终止反应。用振荡器振荡10 min后,在酶标仪上检测490 nm的吸光度,即A值。根据公式计算细胞增殖抑制率:细胞抑制率(%)=[1-(实验组平均A值-调零孔A值)/(对照组平均A值-调零孔A值)]×100%。
1.2.3 流式细胞仪检测细胞周期:将对数生长期的细胞接种于6孔板中,贴壁后弃上清。将细胞分为5组,实验组分别加入含冬凌草甲素(终浓度为0 μmol/L、20 μmol/L、40 μmol/L、80 μmol/L)的培养液,对照组加入等量培养液,放置培养箱中继续孵育48 h后收集细胞,加入70%乙醇,4℃固定,放置过夜,次日放入37℃水中放置30 min,加入碘化丙啶(propidium iodide,PI),避光4℃孵育15 min。筛网过滤后流式细胞仪检测细胞周期分布。
1.2.4 流式细胞仪检测细胞凋亡:细胞接种及分组方法同“1.2.3”,收集细胞,收集培养上清于5 ml离心管中,用D-Hanks液洗涤细胞1次后用胰酶消化细胞,消化完全后收集细胞于同一5 ml离心管中,以1 500 r/min离心5 min,弃去上清。PBS洗涤细胞沉淀1次,同样以1 500 r/min离心5 min,收集细胞。再用结合缓冲液(1×)洗涤细胞沉淀1次,以1 500 r/min离心5 min后收集细胞,加入染色缓冲液(1×)重悬细胞,调整细胞密度为5×106个/ml左右。取5 μl Annexin V-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)加入100 μl细胞悬液进行染色,室温下避光放置10 min,将染色后的细胞悬液置于流式上机管中,用流式细胞仪检测各组细胞凋亡率。
1.2.5 Western Blot检测Bax、Bcl-2蛋白表达变化:细胞接种及分组方法同“1.2.3”,收集细胞,用冷的PBS洗涤3遍,弃去PBS,加入三去污蛋白裂解液,置于冰上裂解30 min,用双蒸水泡过的细胞刮收集瓶中液体于离心管中,4℃,12 000 r/min离心10 min,吸取上清,置于-80℃冰箱储存。氰基丙烯酸正丁酯(butylcyanoacrylate,BCA)法测定蛋白质浓度,加入5×上样缓冲液至提取的细胞蛋白样品中,沸水煮沸5 min使蛋白质变性。将胶板固定在电泳架上,加入电泳缓冲液,每孔加入40 μg蛋白样品,同时在两侧的上样孔中加入5 μl蛋白标记作为分子量参照。电泳结束后转膜至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜,5%脱脂奶粉封闭1 h,根据条带蛋白分布不同加入1 ∶1 000稀释的兔抗人Bax及Bcl-2蛋白,放入4℃冰箱内摇床上孵育过夜,其中β-actin为内参。次日采用洗膜洗涤缓冲液洗膜后,根据一抗来源不同分别加入1 ∶1 000稀释的辣根酶标记的山羊抗兔二抗,室温放置2 h,再次洗膜洗涤缓冲液洗膜,使用电化学发光试剂,在室温下孵育聚偏二氟乙烯膜后放入暗盒中,暗室红灯下曝光1 min,然后显影,定影,对胶片进行拍照分析,观察胶带上条带蛋白的显影。
1.2.6 端粒酶重复序列扩增法检测端粒酶活性:根据端粒酶检测试剂盒说明书进行操作,即细胞接种及分组方法同“1.2.3”,收集细胞,用冷的PBS洗涤3遍,弃去PBS,加入裂解液,置于冰上裂解30 min,4℃下1 600 r/min 离心20 min,小心取上清液,-80℃保存;取待测样品50 μg,靶位区域扩增多态性(target region amplification polymorphism,TRAP)-聚合酶链式反应(polymerase chain reaction,PCR)扩增,取5 μl扩增产物行产物杂交和ELISA检测。酶标仪上检测加入终止液30 min内450 nm的吸光值,根据试剂盒内标的A值和控制模板的A值,得到所测样本的相对定量数值。
1.3 统计学分析 采用SPSS 17.0软件进行统计学分析,计量资料以(x±s)表示,多组均数的比较采用方差分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 不同浓度冬凌草甲素对QBC939细胞增殖的影响 在各个时间点,A490值随冬凌草甲素的浓度升高而降低(P<0.05);QBC939细胞的增殖抑制率随冬凌草甲素的药物浓度升高、作用时间延长而升高。见表1。

表1 不同浓度冬凌草甲素组QBC939细胞的增殖抑制率(x±s)
注:各时间点,组间两两比较,P均<0.05。
2.2 冬凌草甲素对QBC939细胞周期的影响 0 μmol/L、20 μmol/L、40 μmol/L、80 μmol/L的冬凌草甲素处理QBC939细胞48 h后,流式细胞仪检测细胞周期分布结果显示,与0 μmol/L冬凌草甲素组相比,其他浓度冬凌草甲素组的S期细胞比例降低,见图1。

图1 不同浓度冬凌草甲素组QBC939细胞周期
A:0 μmol/L冬凌草甲素组;B:20 μmol/L冬凌草甲素组;C:40 μmol/L冬凌草甲素组;D:80 μmol/L冬凌草甲素组。
2.3 冬凌草甲素对QBC939细胞凋亡的影响 0 μmol/L冬凌草甲素组凋亡率仅为0.5%,20 μmol/L、40 μmol/L、80 μmol/L冬凌草甲素处理QBC939细胞48 h后,细胞凋亡率上升,分别为14.8%、25.8%及37.7%,提示冬凌草甲素能诱导QBC939细胞凋亡。见图2。
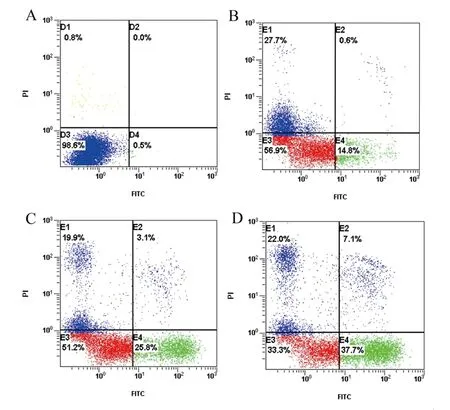
图2 不同浓度冬凌草甲素组QBC939细胞凋亡率A:0 μmol/L冬凌草甲素组;B:20 μmol/L冬凌草甲素组;C:40 μmol/L冬凌草甲素组;D:80 μmol/L冬凌草甲素组。左下象限(D3/E3)为正常细胞;左上象限(D1/E1)为坏死细胞,右上象限(D2/E2)为早期凋亡细胞,右下象限(D4/E4)为晚期凋亡细胞。
2.4 冬凌草甲素对QBC939细胞凋亡相关蛋白Bcl-2、Bax表达的影响 Western Blot结果显示随着药物浓度的升高,促凋亡蛋白Bax表达量逐渐升高,而抗凋亡蛋白Bcl-2表达量逐渐降低,见图3。

图3 不同浓度冬凌草甲素组QBC939细胞的Bax、Bcl-2表达
2.5 冬凌草甲素对QBC939细胞端粒酶相对活性的影响 各浓度冬凌草甲素组QBC939的端粒酶相对活性比较,差异有统计学意义(P<0.05),其他浓度冬凌草甲素组QBC939的端粒酶相对活性均低于0 μmol/L冬凌草甲素组,且QBC939的端粒酶相对活性随冬凌草甲素浓度的升高而降低(P<0.05),见表2。

表2 不同浓度冬凌草甲素作用后QBC939细胞的端粒酶相对活性(x±s)
注:组间两两比较,P均<0.05。
3 讨 论
近年来流行病学研究发现,胆管癌的发病率呈上升趋势[6]。手术切除仍是目前最有效的治疗方法。但胆管癌恶性程度高,起病隐匿,临床上早期诊断困难,多数患者就诊时就已经处于晚期;且由于肝门部胆管癌所在解剖部位复杂,手术难度较大,临床上根治性手术率较低,仅30%左右,同时,根治性手术后患者5年生存率仅13.4%~25.75%。因此需要进一步探讨新的治疗方法。许多天然化合物不断地被发现并应用于人类疾病治疗的研究。冬凌草甲素是从冬凌草中提取出来的有效活性成分,本研究发现,冬凌草甲素在10~100 μmol/L浓度范围,对胆管癌QBC939细胞的增殖抑制作用呈时间和浓度依赖性,即药物浓度越高、作用时间越长,其发挥增殖抑制效果亦越好。细胞增殖是通过细胞周期的运转来实现的,本研究中流式细胞仪检测细胞周期分布的结果显示,与0 μmol/L冬凌草甲素组相比,其他浓度冬凌草甲素组的S期细胞比例降低,表明冬凌草甲素可阻滞QBC939细胞G1期行进和G1/S转换,提示冬凌草甲素可能通过阻滞细胞周期抑制细胞增殖;此外,本研究结果显示,冬凌草甲素处理后QBC939细胞的凋亡率升高,凋亡率随洋务浓度升高而升高,提示冬凌草甲素可促进QBC939细胞凋亡,且呈剂量依赖性。这些结果表明冬凌草甲素可能通过阻滞细胞周期、抑制细胞增殖并诱导细胞凋亡发挥抗肿瘤作用。
本研究进一步探讨了冬凌草甲素诱导细胞凋亡的机制。Bcl-2是重要的凋亡调节蛋白,主要存在于线粒体、内质网和核膜上,Bcl-2的过表达可导致细胞持续增殖,进而引起肿瘤的发生。研究发现在多种肿瘤细胞中Bcl-2均成过表达状态[7]。Bcl-2可通过增强线粒体膜电位,保持线粒体内外膜的完整性,并抑制钙离子释放,阻止核酸内切酶活化等多种机制抑制细胞凋亡,在肿瘤发生及发展中扮演着重要角色[8-9]。此外,Bcl-2还可通过与细胞外调节蛋白激酶通路相互作用,调节细胞凋亡[10]。研究证实,抑制或阻断Bcl-2表达可促进细胞凋亡,患者生存期亦可明显延长[11];Bax属于是Bcl-2家族,但其作用与Bcl-2相反,Bax即可与自身形成同源二聚体,又可与Bcl-2相互结合形成异源二聚体,研究发现,抗凋亡蛋白Bcl-2表达上调时可促进自身与Bax结合形成异源二聚体,发挥抗凋亡作用,Bcl-2表达下调时,则出现相反的效应;即细胞Bcl-2/Bax比例改变可调节细胞凋亡[12],此外,Bax还可通过直接激活死亡效应因子半胱氨酸蛋白酶,改变细胞膜通透性促进细胞凋亡。本研究结果显示,冬凌草甲素处理QBC939细胞48 h后,可引起细胞促凋亡蛋白Bax表达量逐渐升高,而抗凋亡蛋白Bcl-2表达量则逐渐降低,且呈剂量依赖性。
端粒酶是由RNA和蛋白组成的特殊的反转录酶,可以端粒DNA的3c末端为引物,以自身RNA为模板,在S期的线粒体末端添加端粒DNA中TTAGGG重复序列,弥补细胞分裂DNA复制过程中端粒的缩短,维持端粒长度和DNA稳定。正常细胞中,端粒的结合蛋白和相关蛋白可负性调节端粒长度,抑制端粒酶活性[13]。变异细胞激活端粒酶后,可借其稳定染色体末端结构的功能,帮助细胞跳过凋亡临界状态,成为不死细胞。因此,端粒酶激活可引起细胞无限增殖、细胞永生化,导致肿瘤的发生[14]。本实验结果显示,冬凌草甲素处理QBC939细胞48 h后,端粒酶活性随着药物浓度的升高而逐渐降低。有研究表明在凋亡过程中,细胞的完整性受到破坏可影响到端粒酶的表达及活性,或端粒酶活性受凋亡相关基因的调控[15]。凋亡抑制基因Bcl-2可调控端粒酶活性,当Bcl-2表达上调时,端粒酶活性增强,反之减弱[16]。提示冬凌草甲素可能通过下调Bcl-2减弱端粒酶活性,进而抑制细胞增殖并诱导细胞凋亡。
综述所述,冬凌草甲素在体外能抑制胆管癌QBC939细胞增殖并促进其凋亡,其作用机制可能与下调Bcl-2、减弱端粒酶活性有关。但是,本研究未探讨冬凌草甲素对正常胆管上皮细胞是否存在毒性,以及体内毒性实验及体内抗肿瘤实验。在下一步的实验中我们将进一步探讨冬凌草甲素对体内外毒性试验及体内抗肿瘤作用,为临床应用于胆管癌的治疗提供理论依据。
[1] Ku CM,Lin JY.Anti-inflammatory effects of 27 selected terpenoid compounds tested through modulating Th1/Th2 cytokine secretion profiles using murine primary splenocytes[J].Food Chem,2013,141(2):1 104-1 113.
[2] 刘俊保,岳静宇,唐引引.冬凌草甲素对EC9706细胞增殖、凋亡的影响[J].郑州大学学报:医学版,2014,49(1):8-11.
[3] 王海艳,朱志兵.冬凌草甲素通过激活ATM蛋白诱导人肝癌HepG2细胞G2/M细胞周期阻滞[J].中国老年学杂志,2014,34(15):4 271-4 273.
[4] 温鹏路,马 亮,葛光炬,等.人β防御素-1联合冬凌草甲素对膀胱癌T24细胞生长抑制作用的研究[J].肿瘤学杂志,2014,20(12):1 006-1 011.
[5] 柳悄然,张在云,于晓明,等.冬凌草甲素对人肺癌 NCI-H460细胞侵袭和迁移的影响[J].中国病理生理杂志,2014,30(8):1 497-1 500,1 518.
[6] Khan SA,Thomas HC,Davidson BR,et al.Cholangiocarcinoma[J].Lancet,2005,366(9 493):1 303-1 314.
[7] Reed JC.Bcl-2-family proteins and hematologic malignancies:history and future prospects[J].Blood,2008,111(7):3 322-3 330.
[8] Gogada R,Prabhu V,Amadori M,et al.Reseratrol induces p53-independent,X-linked inhibitor of apoptosis protein(XIAP)-mediated Bax protein oligomerization on mitochondria to initiate cytochrome c release and caspase activation[J].J Biol Chem,2011,286(33):28 749-28 760.
[9] Pucci B,Bertani F,Karpinich NO,et al.Detailing the role of Bax translocation,cytochrome c release,and perinuclear clustering of the mitochondria in the killing of HeLa cells by TNF[J].J Cell Physiol,2008,217(2):442-449.
[10]Luanpitpong S,Chanvorachote P,Stehlik C,et al.Regulation of apoptosis by Bcl-2 cysteine oxidation in human lung epithelial cells[J].Mol Biol Cel,2013,24(6):858-869.
[11]Mäkinen K,Loimas S,Hakla T,et al.Tumour suppressor protein(p53),apoptosis inhibiting protein(Bcl-2) and proliferating cell nuclear antigen(PCNA) expressions in a rat pancreatic tumour model[J].Anticancer Res,2007,27(1A):23-26.
[12]Kim KY,Seol JY,Jeon GA,et al.The combined treatment of aspirin and radiation induces apoptosis by the regulation of Bcl-2 and caspase-3 in human cervical cancer cells[J].Cacer Lett,2003,189(2):157-166.
[13]Flores I,Blasco MA.The role of telomeres and telomerase in stem cell aging[J].FEBS Lett,2010,584(17):3 826-3 830.
[14]Sharma HW,Maltese JY,Zhu X,et al.Telomeres,telomerase and cancers:is the magic bullet real?[J].Anticancer Res,1996,16(1):511-515.
[15]秦云才,亓玉琴,司君利,等.紫杉醇体外诱导人胃癌细胞凋亡及对端粒酶活性的影响[J].前卫医药杂志,2001,18(4):255-257.
[16]Mandal M,Kumar R.Bcl-2 modulates telomerase activity[J].J Biol Chem,1997,272(22):14 183-14 187.
Effects of oridonin on cell proliferation,apoptosis and telomerase activity of cholangiocarcinoma cell line QBC939
DINGMing-yong,WANGWei-xing
(DepartmentofHepatobiliaryandLaparoscopicSurgery,RenminHospitalofWuhanUniversity,Wuhan430060,China)
Objective To explore the effect of oridonin on the proliferation,apoptosis and telomerase activity of cholangiocarcinoma cell line QBC939.Methods QBC939 cells were treated by oridonin with different concentrations(0,10,20,40,80 and 100 μmol/L) for 24,48 and 72 hours.The viability of QBC939 cells was determined by MTT assay,and then the inhibitory rate for cell proliferation was calculated.After QBC939 cells treated by oridonin with different concentrations(0,20,40 and 80 μmol/L) for 48 hours,the cell cycle and apoptosis rate were analyzed by flow cytometry,and the expression levels of B-cell lymphoma-2(Bcl-2) and Bcl-2 assaciated X(Bax) protein in QBC939 cells were detected by Western Blot,and telomerase activity of QBC939 cells was measured by telomerase repeat amplification protocol.Results The inhibitory rate for QBC939 cell proliferation increased with the increase of concentration and acting time of oridonin.Compared to 0 μmol/L oridonin group,the other oridonin groups obtained lower percentages of S-phase cells.The apoptosis rates of QBC939 cells in 0 μmol/L,20 μmol/L,40 μmol/L and 80 μmol/L oridonin group were 0.5%,14.8%,25.8% and 37.7% respectively.The results of Western Blot showed that Bax expression increased gradually and Bcl-2 decreased gradually in QBC939 cells with the increase of drug concentration.The telomerase activity of QBC939 cells in the other oridonin groups was lower than that in 0 μmol/L oridonin group,and the telomerase activity of QBC939 cells reduced with the increase of origin in concentration(P<0.05).Conclusion Oridonin can inhibit the cell proliferation and induce the cell apoptosis in QBC939 cells,and the mechanism may be associated with the reduction of telomerase activity by inhibiting Bcl-2 expression. 【Key words】 Cholangiocarcinoma,Oridonin,QBC939 cell,Proliferation,Apoptosis,Telomerase activity,B-cell lymphoma-2 protein
丁明勇(1980~),男,在读硕士研究生,研究方向:肝胆胰疾病诊疗。
王卫星(1960~),男,博士,主任医师,教授,研究方向:肝胆胰疾病的诊疗,E-mail:wangweixinggd@sina.com。
R 735.8
A
0253-4304(2016)03-0308-05
10.11675/j.issn.0253-4304.2016.03.04
2015-10-18
2016-01-07)
