ING4、PHDs在低氧性肺动脉高压大鼠中的表达及意义分析
2016-02-15孙永彪朱佳苏宗义李丽张忠双
孙永彪朱 佳苏宗义李 丽张忠双▲
1.石河子大学医学院,新疆石河子832000;2.新疆维吾尔自治区人民医院呼吸科,新疆乌鲁木齐830000;3.解放军驻石河子大学选培办,新疆石河子 832000;4.石河子大学医学院基础医学系,新疆石河子 832000
ING4、PHDs在低氧性肺动脉高压大鼠中的表达及意义分析
孙永彪1△朱 佳2苏宗义3李 丽4张忠双4▲
1.石河子大学医学院,新疆石河子832000;2.新疆维吾尔自治区人民医院呼吸科,新疆乌鲁木齐830000;3.解放军驻石河子大学选培办,新疆石河子 832000;4.石河子大学医学院基础医学系,新疆石河子 832000
目的对低氧性肺动脉高压大鼠(HPH)中的ING4和PHDs的表达水平及其意义进行探讨。方法利用低氧性肺动脉高压大鼠模型,检测不同缺氧时间点上的大鼠右心室肥大指数(RVHI)、平均肺动脉压(mPAP)以及观察肺小动脉重塑(HPVR)。采用RT-PCR和Western blot检测ING4、PHDs以及HIF-1α的mRNA表达水平及蛋白表达水平。结果结果显示,从缺氧第7天开始实验组大鼠的mPAP显著高于空白对照组(P<0.05),且第14天达到最高值,且大鼠的RVHI也开始增加,且已形成右心室肥厚和官腔狭窄。在mRNA水平上ING4、PHD2以及PHD3的表达在缺氧第3天开始显著增高(P<0.05),且HIF-1α在起初无显著变化直到第14天才开始增高(P<0.05),而PHD1的mRNA表达水平在缺氧后与空白对照组相比,无显著差异(P>0.05);在蛋白水平上ING4的蛋白表达水平在缺氧第7天时表达显著增高(P<0.05),PHD2、PHD3以及HIF-1α的蛋白表达水平在缺氧第3天开始增高(P<0.05),而PHD1的蛋白表达水平在缺氧起初无显著变化,直到第14天时,与空白对照组比较,有显著降低,且随后一直维持较低水平(P<0.05)。结论在低氧性肺动脉高压大鼠中ING4和PHDs的表达变化会影响低氧性肺动脉高压的产生和发展。
ING4;PHDs;低氧性肺动脉高压;大鼠
慢性肺源性心脏病为一种临床上常见的肺心病,严重危害着患者的健康和生命,其中85%的慢性肺源性心脏病均是由慢性阻塞性肺部疾病(COPD)发展而来的。肺动脉高压是引起慢性肺源性心脏病的根本原因,且缺氧是引起肺动脉高压的关键因素,因此研究缺氧性肺动脉高压(hypoxic pulmonary hypertension,HPH)的发病机制是治疗慢性肺源性心脏病的关键措施[1]。有研究表明,肺动脉平滑肌细胞的凋亡和增殖失衡是低氧性肺血管重塑发生发展的重要细胞机制,而低氧诱导因子-1(HIF-1)是导致此平衡失衡的关键分子[2-3]。还有研究表明,氧感受器-HIF脯氨酰羟化酶(PHDs)是HIF-1α氧依赖性降解的限速酶,也是催化特定脯氨酸残基羟基化的关键[4]。最新发现的一种候补肿瘤抑制蛋白ING4具有与PHD蛋白家族类似的结构,也能参与肿瘤形成和细胞凋亡DNA修复以及细胞周期控制等多种反应过程[5]。本研究利用低氧性肺动脉高压大鼠模型,对低氧性肺动脉高压大鼠中的ING4、PHDs以及HIF-1α的表达水平及其意义进行了探讨。
1 材料与方法
1.1 实验动物及材料
Wistar大鼠选用体重(250±30)g,10周龄,雌性,购自新疆医科大学动物中心(许可证编号SCXK新2003-0001),动物质量符合一级标准。RNA提取试剂盒购自TIANGEN公司,兔抗人ING4、PHDs、HIF-1α抗体及GAPDH抗体均购自Santa Cruz公司。
1.2 方法
1.2.1 大鼠分组 按体重大小,将大鼠平均分成5组,每组含有10只大鼠,分别为H3(缺氧3d)、H7(缺氧7d)、H14(缺氧14d)、H21(缺氧21d)以及空白对照组。各实验组,每天均进行8h间断缺氧,而对照组则正常氧气供应,其他饲养条件均相同。
1.2.2 肺动脉压测定 首先以1%戊巴比妥钠腹腔注射麻醉大鼠,然后通过压力传感器连接Powerlab(美国匹兹堡 AD器械有限公司)进行压力测定,进而计算大鼠的平均肺动脉压力(mPAP)。
1.2.3 右室肥厚指数测定 将测完mPAP的大鼠在麻醉状态下处死,剖开胸腔取出心脏,在4%甲醛中固定2d。沿房室沟切除心房及大血管根部,再沿到后室间沟将右心室游离壁分离,吸干水分后分别称取右室(RV)和左室+室间隔(LV+S)的重量,以计算右室肥厚指数(RVHI),该指数反应右心室肥厚变化[6]。
1.2.4 肺小血管形态观察 取大鼠肺部做石蜡切片,每只大鼠选取三张切片,每张切片均含有直径100μm左右的非小动脉五支,随后采用朗珈PAS9000病理图像分析软件进行肺动脉管壁面积/管总面积(WA%)以及管腔面积/管总面积(LA%)的测定。这些测定结果可作为肺小血管重塑指标。
1.2.5 ING4、PHDs以 及HIF-1α 免 疫 组 化 检测 经切片与烤片、脱蜡置水以及抗原微波修复后,用3% H2O2清除内源性过氧化物酶,室温放置10min,用PBS清洗3遍后,封闭15min。随后滴加一抗和二抗,DAB/SABC显色,苏木素复染后经酒精梯度脱水,透明,封片,光镜观察。每张切片随机选取5个视野进行拍照。
1.2.6 RT-PCR方法检测ING4、PHDs以及HIF-1α的mRNA水平 采集小鼠肺动脉并用RNA提取试剂盒提取细胞总RNA,再将提取的RNA反转录成cDNA,并在-20℃保存备用。使用Primer5.0软件设计引物(表1)。随后进行电泳检测,并利用凝胶图像分析仪对条带进行半定量后计算检测条带的吸光度和GAPDH的吸光度比值。

表1 引物
1.2.7 western blot方 法 检 测 ING4、PHDs以及HIF-1α的表达水平 采集小鼠肺动脉,并用RIRA裂解液裂解细胞,按照试剂盒说明书提取细胞总蛋白,随后进行SD-PAGE,再经转膜后,用脱脂乳封闭1h,随后加入兔抗人ING4、PHDs、HIF-1α以及GAPDH抗体,洗膜后再加入二抗孵育1h,随后采用ECL显色,最后用凝胶成像仪拍照观察。
1.3 统计学方法
所得数据均使用SPSS19.0进行统计分析。以t检验来表示组间计量资料对比,正态计量资料以()表示,用P<0.05表示差异具有统计学意义。
2 结果
2.1 不同缺氧时间对低氧性肺动脉高压大鼠模型平均肺动脉压力(mPAP)、右心室肥厚(RVHI)及肺血管重塑的影响
研究结果显示,从缺氧第7天开始实验组大鼠的mPAP显著高于空白对照组(P<0.05),且第14天达到最高值,随后直到21天仍处于较高水平;从缺氧第14天开始实验组大鼠的RVHI显著高于空白对照组(P<0.05),且已形成右心室肥厚;缺氧第7天就可观察到直径100μm的肺小动脉中层平滑肌的增生、管壁增厚以及管腔狭窄,直到第14天平滑肌增生开始显著,管腔进一步狭窄(P<0.05)。见表2。

表2 平均肺动脉压力(mPAP)、右心室肥厚(RVHI)及肺血管重塑的指标
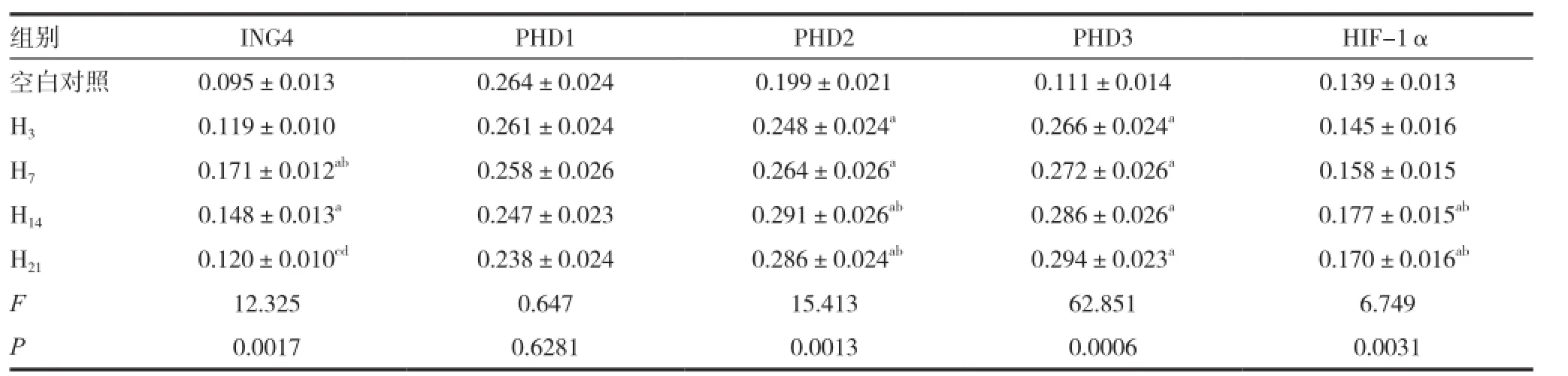
表3 ING4、PHDs以及HIF-1α的mRNA表达水平
2.2 免疫组化结果
研究结果显示,ING4的表达在缺氧第7天时表达显著增高,在缺氧第14天达到了最高峰(P<0.05)。PHD1的表达在缺氧起初无显著变化,直到第14天时,与空白对照组比较,有显著降低,且随后一直维持较低水平;PHD2的表达在缺氧第3天开始增高,在缺氧第14天达到最高点,随后一直保持较高水平;PHD3的表达在缺氧第3天开始增高,随之一直保持较高水平,直到缺氧第14天开始有所下降,但均高于空白对照组(P<0.05)。HIF-1α的表达在缺氧第3天开始增高,在缺氧第7天达到最高点,随后有所下降(P<0.05)。
2.3 ING4、PHDs以及HIF-1α的mRNA表达水平
研究结果显示,ING4的mRNA表达水平在缺氧第3天后开始增高,缺氧第7天可达到最高峰,随后有所下降,但均高于空白对照组(P<0.05)。PHD1的mRNA表达水平在缺氧后与空白对照组相比,无显著差异;PHD2的mRNA表达水平在缺氧第3天开始增高,在缺氧第14天达到最高点,随后一直保持较高水平;PHD3的mRNA表达水平与PHD2的mRNA表达水平的趋势相一致(P<0.05)。HIF-1α的mRNA表达水平在缺氧第3天和第7天无显著变化,而在缺氧第14天开始增高,且显著高于空白对照组(P<0.05)。见表3。
2.4 ING4、PHDs以及HIF-1α的蛋白表达水平
研究结果显示,ING4的蛋白表达水平在缺氧第7天时表达显著增高,在缺氧第14天达到了最高峰(P<0.05)。PHD1的蛋白表达水平在缺氧起初无显著变化,直到第第14天时,与空白对照组比较,有显著降低,且随后一直维持较低水平;PHD2的蛋白表达水平在缺氧第3天开始增高,在缺氧第14天达到最高点,随后一直保持较高水平;PHD3的蛋白表达水平在缺氧第3天开始增高,随之一直保持较高水平,直到缺氧第14天开始有所下降,但均高于空白对照组(P<0.05)。HIF-1α的蛋白表达水平在缺氧第3天开始增高,在缺氧第7天达到最高值,随后一直保持较高水平(P<0.05)。见表4,图1。

表4 NG4、PHDs以及HIF-1α的蛋白表达水平

图1 NG4、PHDs以及HIF-1α的蛋白表达
2.5 各项检测指标之间的相关性分析
直线相关分析结果表明,在缺氧状态下,ING4蛋白表达量与HIF-1α以及RVHI、mPAP、WA%呈负相关,而与PHDs呈正相关,r=0.581,P=0.0017<0.05。
3 讨论
慢性肺源性心脏病是一种严重危害着患者的健康和生命的肺心病,大部分均是由慢性阻塞性肺部疾病(COPD)发展而来。肺动脉高压、肺血管狭窄以及右心室肥厚均是引起慢性肺源性心脏病的根本原因[7-8]。因此研究引起上述病变的发病机制是治疗慢性肺源性心脏病的关键措施。有研究表明,肺动脉平滑肌细胞的凋亡和增殖失衡是低氧性肺血管重塑发生发展的重要细胞机制,而低氧诱导因子-1(HIF-1)是导致此平衡失衡的关键分子,也可以说是调控肺血管重塑发生的“分子开关”[9-11]。本研究利用低氧性肺动脉高压大鼠模型,也对低氧性肺动脉高压大鼠中的HIF-1α的表达水平及其意义进行了检测。结果显示,HIF-1α的蛋白表达水平在缺氧第3天开始增高,在缺氧第7天达到最高值,随后一直保持较高水平。同时,从缺氧第7天开始实验组大鼠的mPAP显著高于空白对照组(P<0.05),且第14天达到最高值,且大鼠的RVHI也开始增加,且已形成右心室肥厚和官腔狭窄。这与上述研究结果相一致,表明HIF-1α表达水平会影响肺血管重塑发生。
还有研究表明,氧感受器-HIF脯氨酰羟化酶(PHDs)可通过催化HIF-1α亚基402/564位脯氨酰残基羟基化,这是其与pVHL结合的识别信号,当二者结合后会启动HIF-1α的降解过程,因此PHDs是HIF-1α氧依赖性降解的限速酶,也是催化特定脯氨酸残基羟基化的关键[12]。最新发现的一种候补肿瘤抑制蛋白ING4具有与PHD蛋白家族类似的结构,也能参与肿瘤形成和细胞凋亡DNA修复以及细胞周期控制等多种反应过程[13-15]。本研究结果还显示,在mRNA水平上ING4、PHD2以及PHD3的表达在缺氧第3天开始显著增高(P<0.05),而PHD1的mRNA表达水平在缺氧后与空白对照组相比,无显著差异(P>0.05);蛋白水平的结果与mRNA水平相似。这与上述研究结果也相一致。表明,缺氧确实是产生肺动脉高压和发生血管重塑的重要原因。而且ING4的表达与PHDs蛋白不完全相关,二者共同作用于抑制HIF-1α表达。
综上所述,在低氧性肺动脉高压大鼠中ING4和PHDs的表达变化会影响低氧性肺动脉高压的产生和发展,且需要进步一研究其发病机制和相互调节关系。
[1] 崔建华.缺氧性肺动脉高压形成机制的研究进展[J].西北国防医学杂志,2013(3):251-255.
[2] 陈云荣,戴爱国,胡瑞成,等.慢性阻塞性肺疾病患者肺小血管低氧诱导因子1α与其羟化酶表达[J].中国应用生理学杂志,2012(3):234-238.
[3] 姚青,李筠,张鹏,等.缺氧诱导因子-1和缺氧诱导因子-2:结构、功能及调节[J].生命科学,2011(8): 753-761.
[4] 杨丰旭.PHD2在大肠杆菌内的表达与体外活性分析[D].大连:大连工业大学,2014:45-47.
[5] 代魏魏,唐丽萍,卢文.ING4基因的抗肿瘤作用研究进展[J].现代肿瘤医学,2016,24(17):2827-2830.
[6] 蒋永亮,聂金,刘蕾,等.ING4、PHDs以及HIF-1α在低氧性肺动脉高压大鼠中的表达变化[J].中国组织化学与细胞化学杂志,2014,23(2):117-124.
[7] 邱骅婧,吴维,刘占举.缺氧在肠黏膜炎症损伤过程中的病理生理机制[J].世界华人消化杂志,2013(7):591-596.
[8] 聂金. ING4及MORG1调控缺氧诱导因子脯氨酸羟化酶在缺氧性肺动脉高压形成中的作用[D].衡阳:南华大学, 2008:27-34.
[9] 赵琛,谭斐.低氧诱导因子-1激活的调节[J].生命科学,2013(1):40-46.
[10] ZN Demidenko,MV Blagosklonny. The purpose of the HIF-1/PHD feedback loop: to limit mTOR-induced HIF-1α[J]. Cell Cycle,2011,10(10): 1557-62.
[11] 李佩尧,张成岗.细胞内低氧感受器:缺氧诱导因子-1脯氨酰羟化酶研究进展[J].生理科学进展,2007,38(1): 62-65.
[12] 张跃奇.慢性低氧性肺动脉高压大鼠儿茶酚抑素的表达变化[D].温州:温州医科大学,2015:40-45.
[13] 赵海舟.ING4、HIF-1α在直肠癌中的表达及意义[D].郑州:郑州大学,2014:39-43.
[14] 李君,富建华,薛辛东,等.低氧性肺动脉高压大鼠低氧诱导因子-1α表达及其意义[J].国际儿科学杂志,2014(3):305-309.
[15] 李悦,杨向红.ING4对缺氧状态下血管内皮细胞增殖、迁移及HIF-1α表达的抑制作用[J].现代肿瘤医学,2016,24(22): 3551-3556.
The expression and significanceof ING4 and PHDs in hypoxic pulmonary hypertensive rats
SUN Yongbiao1ZHU Jia2SU Zongyi3LI Li4ZHANG Zhongshuang4
1.Medical College of Shihezi University, Shihezi 832000, China;2.Department of Respiratory Medicine, The People's Hospital of Xinjiang Uygur Autonomous Region, Urumqi 832000, China; 3.The Selection and Training Office of Chinese People's Liberation Army for National Defense Students, Shihezi University, Shihezi 832000, China; 4.Department of Basic Medical Sciences of Medical College of Shihezi University, Shihezi 832000, China;
ObjectiveTo discuss the significance that the Expression of ING4 and PHDs in rats with hypoxic pulmonary hypertension.MethodsTo detect the value of RVHI、mPAP、HPVR of rat at different hypoxia time points by establishing rat model of hypoxic pulmonary hypertension.ResultsThe mPAP of the experimental group was significantly higher than that of the blank control group(P<0.05) from the 7th day of hypoxia, and reached the highest value on the 14th day, and the RVHI of the rats began to increase and formed right ventricular hypertrophy and bureaucratic stenosis. The expression of ING4, PHD2 and PHD3 increased significantly at the 3rd day after hypoxia(P< 0.05), and HIF-1α did not change significantly at the beginning(P< 0.05). The expression of ING4 protein was significantly increased at the 7th day of hypoxia(P<0.05), PHD2 and PHD3(P<0.05), and the protein level of ING4 was significantly higher in the hypoxia group than that in the blank control group(P<0.05), and protein expression of HIF-1α increased at day 3 of hypoxia (P< 0.05), and the protein expression level of PHD1 did not change at the beginning of hypoxia until day 14. Compared with the blank control group, , And then maintained a low level(P< 0.05).ConclusionThe Expression changes of ING4 and PHDs of Hypoxic pulmonary hypertension rats can affect the generation and development of hypoxic pulmonary hypertension.
INQA;PHDs;Hypoxic pulmonary hypertensive; Rats
R-332
A
2095-0616(2016)21-29-05
2016-09-12)
国家自然科学基金(81660271);第十五期石河子大学大学生训练计划(SRP2017064)。
△石河子大学医学院2014级临床医学本科
▲通讯作者
