干细胞标志物CD133与胃癌临床特征的相关性研究
2016-02-15吴冬冬赵庆洪
鲁 明 付 波 马 翔 吴冬冬 赵庆洪
南京医科大学第二附属医院普外科,江苏南京 210011
干细胞标志物CD133与胃癌临床特征的相关性研究
鲁 明 付 波 马 翔 吴冬冬 赵庆洪▲
南京医科大学第二附属医院普外科,江苏南京 210011
目的探讨CD133蛋白表达与胃癌患者临床特征以及预后之间的关系。方法使用免疫组化染色方法检测我院118例胃癌患者手术切除的病灶组织中CD133表达情况,并检索相关数据库对已报道的CD133表达与胃癌临床特征的研究做系统性荟萃分析,进一步验证我们的结果。结果免疫组化结果显示胃癌患者CD133蛋白表达阳性率为28.81%(34例/118例)。CD133表达与患者年龄、性别、肿瘤直径、分化程度、Lauren’s分型无关(P>0.05);但与胃癌患者肿瘤的浸润深度、淋巴结转移及TNM分期明显相关(P<0.05)。Meta分析结果显示胃癌肿瘤浸润越深(OR=0.36,95%CI=0.26~0.49,P<0.0001);有淋巴结转移(OR=0.36,95%CI=0.26~0.50,P<0.0001);以及TNM分期越高(OR=0.32,95%CI=0.24~0.42,P<0.0001),CD133蛋白阳性表达率越高。并且CD133阳性表达提示胃癌患者预后不良(HR=2.21,95% CI=1.52~3.22)。结论CD133表达与胃癌浸润深度,淋巴转移,临床分期以及预后显著相关,也许能够作为未来胃癌治疗的新的分子靶点。
CD133;肿瘤干细胞;胃癌;免疫组化;荟萃分析
胃癌是全世界发病率最高的恶性肿瘤之一,在癌症相关死亡原因中居第三位[1]。胃癌的发生是一个多因素,多机制,多途径共同作用的结果。肿瘤干细胞理论为肿瘤的发病机制提出了全新的阐释,随着对肿瘤干细胞的深入研究,寻找其特异性的标志物成为研究热点。CD133是一个5跨膜结构域的单链糖蛋白,它是一种在正常干细胞和肿瘤干细胞表面广泛表达的糖蛋白。CD133作为一种肿瘤干细胞标志物已被发现于肺癌、结肠癌、肝癌、乳腺癌等多种肿瘤,但其生物学功能仍不明确。有研究探索了CD133的表达与胃癌患者临床病理特征以及预后之间的关系,但结论尚不统一,存在较多争议[2-4]。因此,为了更好的了解CD133在胃癌发病机制中的作用以及CD133蛋白的表达与胃癌临床病理特征之间的关系,本研究采用免疫组化(ICH)方法检测CD133蛋白在胃癌中的表达水平,同时本研究收集相关文献,通过Meta分析方法系统性评价CD133表达与胃癌临床病理特征以及患者预后的关系,为胃癌的诊治及判断预后评估提供循证医学证据,也为胃癌将来的靶向治疗提供新思路。
1 资料与方法
1.1 一般资料
1.1.1 病例选择 选取南京医科大学第二附属医院普外科胃癌术后(2014年12月~2016年8月)经病理科切片所保存的原发性胃癌患者组织切片,标本均经我院病理科医师证实确认,术后病理分期参照美国癌症联合委员会(AJCC)及国际抗癌联盟(UICC)第七版TNM分期标准。胃癌患者共118例,其中男84例,女34例;中位年龄62岁(42~85岁)。所有的患者均具有完整的病理资料,并且术前均未接受放化疗或免疫治疗,详细情况见表1。
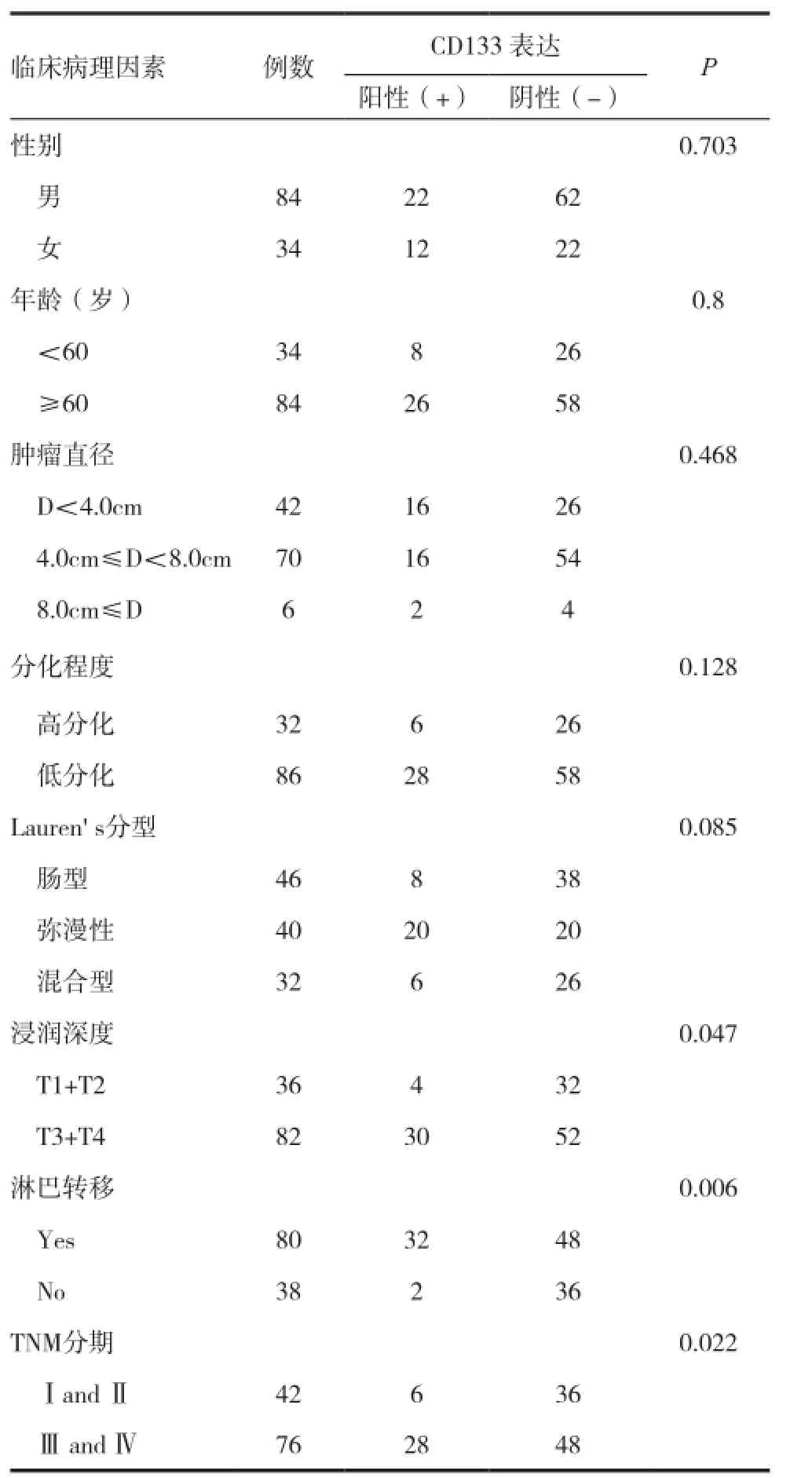
表1 CD133 蛋白的表达与胃癌临床病理特征之间的关系
1.1.2 实验试剂 兔抗人CD133单克隆抗体(北京奥博森生物技术有限公司),通用型二抗试剂盒(北京中衫金桥生物技术有限公司),Triton试剂(Vetec,美国),抗原修复液(南京凯基生物科技发展有限公司),DAB 显色液(迈新试剂,中国)。梯度乙醇、苏木素染液、二甲苯、过氧化氢液、中性树胶及封片由南京医科大学第二附属医院病理科提供。
1.2 方法
1.2.1 免疫组化技术 标本用10%甲醛溶液固定,分别行HE染色和免疫组织化学染色(ABC法)。常规脱蜡,梯度乙醇脱水,微波炉加热抗原修复,3%H2O2灭活内源性过氧化物酶,PBS冲洗,孵一抗、二抗,DAB显色,苏木精复染,树脂封片。
1.2.2 染色结果判定 免疫组化的染色结果由两位病理科医生在双盲的情况下独立读取。CD133定位于细胞膜上,阳性表达表现为浅黄色、棕黄色或棕褐色。随机选取4个高倍视野,根据阳性细胞百分比及阳性细胞染色强弱计算免疫组化染色评分[5]:(1)无阳性细胞为 0分,阳性细胞总数<25%为1分,25%~49%为2分,≥50%为3分;(2)无着色为 0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。(1)(2)两项乘积即为其免疫组化评分,<3分为阴性,≥3分为阳性见图1。
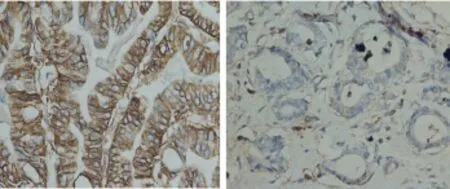
图1 CD133在胃癌及正常黏膜组织中的表达水平(免疫组化×400)
1.2.3 检索策略 检索PubMed,EMBASE,Web of Science数据库。检索时间至2016年8月1日,语言限制为英语。检索词为:“CD133”或“prominin-1”和“gastric cancer”或“gastric tumor”。检索策略均采用主题词同自由词相结合的方法进行全面综合的检索。同时对纳入的相关文献的参考文献也进行仔细回溯,以避免可能遗漏的类似研究。
1.2.4 文献纳入排除标准 纳入标准:(1)均为公开发表的研究 CD133 在胃癌中的表达与胃癌临床病理特征或胃癌患者生存预后之间相关性的研究;(2)研究中所有的胃癌患者均经过病理检查确诊并且 CD133 蛋白的表达检测方法为免疫组织化学(IHC)法;(3)研究能够提供相应的数据信息;(4)纳入研究语言仅限定为英语。排除标准:(1)文献不能够提供所需要的相关研究数据;(2)评论、综述和动物研究以及其他非人类研究;(3)数据重复或重复发表的文献。

表2 纳入研究文献的基本特征
1.2.5 文献质量评估 纳入文献的质量评价使用病例-对照研究的NOS(Newcastle Ottawa Scale)评价标准来进行评估。包括以下项目:病例组和对照组的选择方法、可比性、接触暴露评估方法。
1.2.6 数据提取 所有纳入研究的相关数据信息均有两位人员独立进行提取,并收集相关数据信息。对于无法直接获得生存期相关数据信息的研究,我们使用Parmar等[6]和Tierney等[7]所报道的统计分析方法进行计算,或者对文献中提供的Kaplan-Meier生存曲线使用 GetData Graph Digitizer2.26(http://getdata-graph-digitizer.com)提取数据计算相应的风险比(HR)及其对应的 95%的可信区间(CI)。
1.2.7 统计学方法 CD133蛋白表达与胃癌临床病理特征之间的关系采用χ2检验,检验水准α=0.05,且P<0.05认为差异有统计学意义。通过风险比(HR)和95%可信区间(CI)计算CD133蛋白的表达水平与胃癌患者的生存预后的相关性。研究中的异质性使用Q检验和I2检验。如果P≥0.10且I2≤50%,表明纳入的各研究结果之间存在一致性,此时采用固定效应模型;如果P<0.10,I2>50%,表示纳入的各研究结果之间存在较大的异质性,选择随机效应模型。所有的统计分析使用SPSS17.0和Stata12.0软件进行。
2 结果
2.1 胃癌组织中CD133蛋白表达与其临床病理特征的关系
CD133蛋白的表达与胃癌临床病理特征之间的关系详见表1。统计分析结果显示:胃癌组织中CD133蛋白的表达与胃癌肿瘤的浸润深度、淋巴结转移及TNM分期有明显相关性,差异有统计学意义(P<0.05)。而与患者的性别、年龄、肿瘤大小、组织类型及组织分化程度均无明显相关性(P>0.05)。
2.2 Meta分析结果
2.2.1 纳入研究的基本特征 最终共检索到相关研究文献108篇,逐层筛选后,最后9篇文献被纳入本次研究之中见图2。纳入的9篇相关研究[2-4,8-13],包含了1316例胃癌患者。所有的研究均来自亚洲国家。各研究均分布在2010~2014年之间。纳入文献的基本特征详见表2。
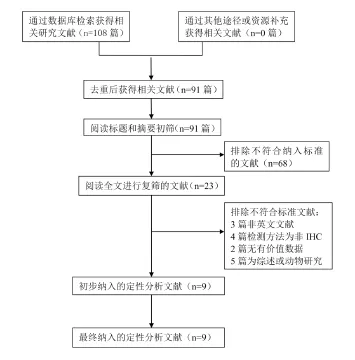
图2 纳入文献筛选流程及结果图
2.2.2 合并效应量分析 分析结果显示胃癌男性组vs胃癌女性组与胃癌低龄组vs胃癌高龄组(OR=1.35,95%CI=0.92~1.96,P=0.121);胃癌高中分化组vs胃癌低分化组(OR=0.96,95%CI=0.58~1.60,P=0.889);说明胃癌组织中CD133蛋白的表达与患者性别年龄,胃癌组织分化程无关。
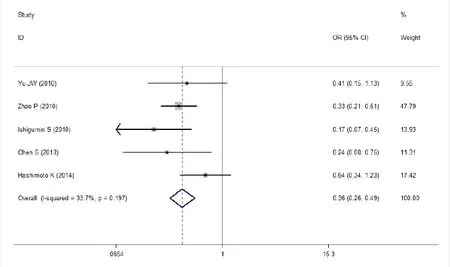
图3 胃癌中浸润深度T1~T2组vs浸润深度T3~T4组CD133蛋白表达比较Meta分析
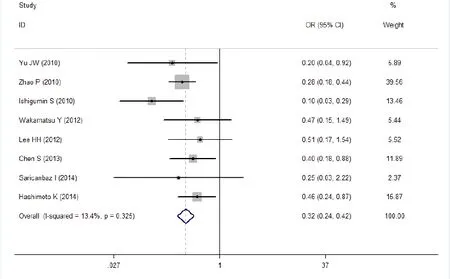
图4 Ⅰ~Ⅱ期胃癌组vsⅢ~Ⅳ期胃癌组CD133蛋白表达比较Meta分析

图5 无淋巴结转移组vs有淋巴结转移组CD133蛋白表达比较Meta分析
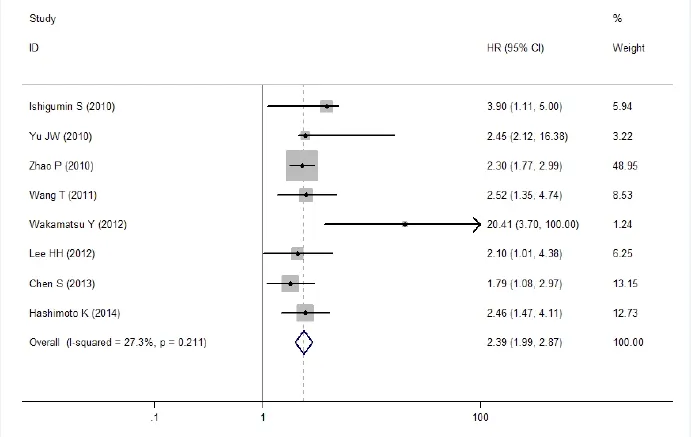
图6 CD133阳性表达组vs CD133阴性表达组患者总生存预后比较Meta分析
有5篇研究报道了胃癌浸润深度T1~T2组vs胃癌浸润深度T3~T4组组织中CD133蛋白的表达情况。其结果显示两组间的差异具有统计学意义(OR=0.36, 95%CI=0.26~ 0.49,P< 0.0001),(P=0.197,I2=33.7%<50%)。表明T3~T4组胃癌病人的CD133蛋白表达阳性率高于T1~T2组,详见图3。
有8篇研究报道了Ⅰ~Ⅱ期胃癌组vs Ⅲ~Ⅳ期胃癌组组织中CD133蛋白的表达情况。其结果显示两组间的差异具有统计学意义(OR=0.32,95%CI=0.24~ 0.42, P< 0.0001),(P=0.325,I2=13.4%<50%)。表明Ⅲ~Ⅳ期胃癌组CD133蛋白的表达阳性率高于Ⅰ~Ⅱ期胃癌组,详见图4。
有6篇研究报道了胃癌无淋巴结转移组vs胃癌伴淋巴结转移组组织中CD133蛋白的表达情况。其结果显示两组间的差异具有统计学意义(OR=0.36,95%CI=0.26~ 0.50, P< 0.0001),(P=0.475,I2=0%<50%)表明胃癌伴有淋巴结转移组CD133蛋白的表达阳性率高于胃癌无淋巴结转移组,详见图5。
在纳入的所有文献中,有8篇研究报道了胃癌组织中CD133蛋白的表达与胃癌患者总体生存预后之间的关系。数据显示,CD133阳性vs CD133阴性,两组间的差异具有统计学意义(OR=2.39,95% CI=1.99~2.87, P<0.001)。同时,使用多因素和单因素分类进行统计分析,结果显示CD133 蛋白阳性表达胃癌患者总体生存时间低于CD133蛋白阴性表达患者(HR = 2.21,95%CI = 1.52~3.22和HR=2.45,95%CI=1.98~3.02),提示CD133蛋白表达阳性率与胃癌患者生存预后有关,胃癌患者CD133 蛋白表达阳性提示预后不良,详见图6。
3 讨论
胃癌是一种具有高发生率和死亡率的恶性肿瘤,其发生发展是一个长期的过程,与多种因素有关。随着对肿瘤发病机制研究的深入,人们发现肿瘤细胞在表面标志、细胞性质以及信号转导通路等方面与干细胞具有许多相似之处,并且具有干细胞特性的细胞较正常细胞更容易发生突变而成为肿瘤发生的起始细胞。CD133是目前用于各种肿瘤干细胞研究的热点标志物之一, 是一种跨膜糖蛋白,属于prominin家族成员之一。CD133已在多种肿瘤中获得了广泛的研究,并且研究证实其与结直肠癌及胰腺癌的肿瘤进展密切相关[14]。栾可峰等[15]在研究口腔鳞癌发现CD133阳性细胞比CD133阴性细胞具有更强侵袭力和转移能力。现研究证实CD133阳性的肿瘤细胞具有干细胞的特性,包括自我更新、无限繁殖和多向分化的潜能[16],同时还具有显著的致瘤能力。由于CD133在胃癌中的生物学功能及具体机制尚不明确,因此对CD133与胃癌关系的研究成为近年来的新热点。在众多研究中有关CD133蛋白的表达与胃癌临床病理特征及胃癌患者的生存预后之间的关系的研究质量参差不齐,结果尚不统一,仍存在很大的争议。
本研究的免疫组化结果显示,胃癌组织中CD133的表达阳性率与患者年龄,性别,肿瘤大小及肿瘤的组织学分级无关。但随着胃癌肿瘤浸润深度、淋巴结转移和肿瘤TNM分期的增高,CD133蛋白表达水平也明显升高,提示CD133蛋白表达和胃癌侵袭转移呈正相关。
柳少光等[17]对CD133在胃癌组织中表达进行了系统行评价发现CD133 蛋白在胃癌组织中的表达比癌旁组织及正常胃组织高,而且其表达与淋巴结转移、远处转移及临床分期等明显相关,说明 CD133 可能在胃癌发生、发展过程中起重要作用。但由于其样本量偏少,结论具有一定的局限性。现为了进一步明确CD133表达和胃癌临床特征之间关系,同时验证我们的实验结果,对已报道的CD133表达与胃癌临床特征相关文献进行系统性Meta分析。我们发现肿瘤的浸润深度越深、有淋巴结转移和TNM分期越高的患者CD133表达阳性率越高,CD133表达与性别、年龄及肿瘤分化程度之间的无统计学意义[18],这与我们研究结果相一致。同时我们还发现,和CD133阴性表达的患者相比CD133 的阳性表达的患者其生存预后较差(HR=2.21,95%CI= 1.52~3.22)。总体而言,CD133 蛋白的表达与胃癌的临床病理特征以及胃癌患者的生存预后具有密切的相关性,这与CD133在动物和细胞中的研究结果相一致。
然而本研究仍然存在一些不足。首先,纳入实验研究的118例胃癌患者样本量相对较小,并且缺乏长期的随访资料。因此我们通过检索相关文献进行系统性meta分析,在一定程度上扩大了验证的样本量,弥补了样本量的不足,同时根据现有研究结果间接的分析CD133表达与胃癌患者预后的关系,使我们的结论更可信、全面。其次,虽然限制免疫组化(IHC)为唯一的蛋白检测方法,但不同的研究中对于限定 CD133 蛋白阳性表达的截断值不同,这可能导致不同研究之间存在异质性。另外,所有纳入研究的相关文献均来自亚洲国家,这与胃癌在亚洲国家高发有关,但该项差异限制了本结果在亚洲以外其他人群中的应用。
综上所述,CD133蛋白的表达与胃癌临床病理特征之间的关系具有显著相关性,胃癌肿瘤浸润越深,有淋巴结转移,TNM分期越高,CD133蛋白表达阳性率越高等。此外Meta分析的结果提示CD133蛋白阳性表达的胃癌患者具有较差的预后。以上结果表明CD133 在胃癌组织中表达对判断肿瘤侵袭和转移具有一定的临床意义,可作为胃癌患者潜在的生存预后的指标,也许能够为未来胃癌靶向治疗开辟新的路径。
[1] Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012 [J]. CA: a cancer journal for clinicians,2015, 65(2): 87-108.
[2] YU JW, ZHANG P, WU JG, et al. Expressions and clinical significances of CD133 protein and CD133 mRNA in primary lesion of gastric adenocacinoma [J]. Journal of experimental & clinical cancer research : CR, 2010,29:141.
[3] Zhao P, Li Y, Lu Y. Aberrant expression of CD133 protein correlates with Ki-67 expression and is a prognostic marker in gastric adenocarcinoma [J]. BMC cancer,2010, 10:218.
[4] Wang T, Ong CW, Shi J, et al. Sequential expression of putative stem cell markers in gastric carcinogenesis [J]. British journal of cancer, 2011, 105(5): 658-665.
[5] 张子杰.乳腺癌中CD44、CD133+细胞表达及其与临床特征相关性研究 [J]. 临床和实验医学杂志, 2014,14: 1166-1168.
[6] Parmar MK, Torri V, Stewart L. Extracting summary statistics to perform meta-analyses of the published literature for survival endpoints [J]. Statistics in medicine,1998, 17(24): 2815-2834.
[7] Tierney JF, Stewart LA, Ghersi D, et al. Practical methods for incorporating summary time-to-event data into metaanalysis [J]. Trials, 2007, 8:16.
[8] Hashimoto K, Aoyagi K, Isobe T, et al. Expression of CD133 in the cytoplasm is associated with cancer progression and poor prognosis in gastric cancer [J]. Gastric cancer : official journal of the International Gastric Cancer Association and the Japanese Gastric Cancer Association,2014, 17(1): 97-106.
[9] Chen S, Hou JH, Feng XY, et al. Clinicopathologic significance of putative stem cell marker, CD44 and CD133, in human gastric carcinoma [J]. Journal of surgical oncology, 2013, 107(8): 799-806.
[10] Saricanbaz I, Karahacioglu E, Ekinci O, et al. Prognostic significance of expression of CD133 and Ki-67 in gastric cancer [J]. Asian Pacific journal of cancer prevention :APJCP, 2014, 15(19): 8215-8219.
[11] IShigami S, Ueno S, Arigami T, et al. Prognostic impact of CD133 expression in gastric carcinoma [J]. Anticancer research, 2010, 30(6): 2453-2457.
[12] Wakmatsu Y, Sakamoto N, OO H Z, et al. Expression of cancer stem cell markers ALDH1, CD44 and CD133 in primary tumor and lymph node metastasis of gastric cancer [J]. Pathology international, 2012, 62(2): 112-119.
[13] Lee HH, Seo KJ, An CH, et al. CD133 expression is correlated with chemoresistance and early recurrence of gastric cancer [J]. Journal of Surgical Oncology, 2012,106(8): 999-1004.
[14] 姜林鹤, 宋云骏, 刘运江, 等. CD133在结直肠癌组织中的表达及其与患者预后关系的研究 [J]. 临床和实验医学杂志, 2015, 9(10): 723-25.
[15] 栾可峰, 李新新, 孙学辉, 等. 舌鳞状细胞癌组织中CD44和CD133的表达及临床意义 [J]. 湖北名族学院学报(医学版), 2016, 33(3): 17-20.
[16] Ma S, Tang KH, Chan YP, et al. miR-130b Promotes CD133(+) liver tumor-initiating cell growth and selfrenewal via tumor protein 53-induced nuclear protein 1 [J]. Cell Stem Cell, 2010, 7(6): 694-707.
[17] 柳少光, 高寅生, 候亚勃, 等. CD133在胃癌组织中的表达及临床意义的系统评价 [J]. 中国循证医学杂志, 2014, 14(3): 349-354.
[18] 法凯,孙涛.胃癌干细胞的研究进展[J]. 疑难病杂志,2015,14(1):97-99.
Correlation research between stem cell marker CD133 and clinical features of gastric cancer patients
LU Ming FU Bo MA Xiang WU Dongdong ZHAO Qinghong
Department of General Surgery, the Second Affiliated Hospital of Nanjing Medical University, Nanjing 210011, China
ObjectiveTo explore the association between the expression of CD133 and the clinical features of gastric cancer patients.MethodsThe expression of CD133 protein in gastric cancer tissues of 118 patients were detected by immunohistochemical (ICH) staining. A meta-analysis was performed to further validate the correlation of CD133 expression with the clinical characteristics of gastric cancer patients.ResultsThe results of ICH indicated that the positive expression rate of CD133 in gastric cancer tissues was 28.81% (34/118). The expression of CD133 was not associated with the age, sex, tumor diameter, differentiation and Lauren’ s types (P>0.05), but it was correlated with depth of invasion, lymphatic metastasis and clinical stages (P< 0.05). In addition, in our meta-analysis, we found the expression rate of CD133 was higher in T3,T4 of invasion depth (OR=0.36, 95%CI=0.26–0.49, P<0.0001), and it was positive of lymphatic metastasis (OR=0.36, 95%CI=0.26–0.50, P<0.0001) and III, IV of clinical stage (OR=0.32, 95%CI=0.24–0.42, P<0.0001). Positive expression of CD133 was related to worse prognosis (HR=2.21, 95%CI=1.52-3.22).ConclusionThe expression of CD133 was associated with depth of invasion, lymphatic metastasis, clinical stages and poor outcome of gastric cancer. CD133 may act as a new molecular target for treatment of gastric cancer in the future.
CD133; Cancer stem cell; Gastric cancer; ICH; Meta-analysis
R735.2
A
2095-0616(2016)21-22-07
2016-09-17)
▲通讯作者
