过表达mitf基因腺相关病毒的构建与鉴定
2016-02-15史珣贝林昶杨仕明吴南
史珣贝林昶杨仕明吴南
1福建医科大学附属第一医院耳鼻咽喉-头颈外科,福建省耳鼻咽喉研究所(福州350005)
2解放军总医院耳鼻咽喉头颈外科,解放军耳鼻咽喉研究所,聋病教育部重点实验室(北京100853)
·技术与方法·
过表达mitf基因腺相关病毒的构建与鉴定
史珣贝1林昶1杨仕明2吴南2
1福建医科大学附属第一医院耳鼻咽喉-头颈外科,福建省耳鼻咽喉研究所(福州350005)
2解放军总医院耳鼻咽喉头颈外科,解放军耳鼻咽喉研究所,聋病教育部重点实验室(北京100853)
目的获得能够过表达小眼畸形相关转录因子(mitf)的重组腺相关病毒载体,用于mitf基因突变相关疾病的基因治疗。方法利用PCR扩增获得目的基因,构建携带目的基因mitf的重组腺相关病毒载体,利用人工脂质体法将pAAV-RC,pHelper,以及pAAV-GFP系列载体转染到HEK293细胞中,采用细胞内质粒DNA同源重组法进行重组腺相关病毒载体构建,利用柱纯化法纯化病毒载体,qPCR法测定重组腺相关病毒载体滴度,病毒载体感染HEK293细胞进行病毒有效性及安全性鉴定,real-time PCR与western blot法进行mitf表达的鉴定。结果PCR扩增和测序结果一致证实成功获得目的基因并且成功构建mitf基因腺相关病毒载体,测得高水平病毒滴度1.0*10^12vg/ml,病毒载体感染HEK293细胞转染效率为86.3%,并未发现HEK293细胞死亡,Real-time PCR及Western blot检测构建Mitf基因转录mRNA与表达的蛋白与正常MITF一致。结论成功构建的携带mitf基因的重组腺相关病毒载体为未来进行mitf突变导致的遗传性疾病的基因治疗提供新思路。
MITF;腺相关病毒;基因治疗
Foundation item:National 863 project young scientists(2014AA020510);the National Natural Science Foundation of China(NSFC# 81271082,81400472).Special Cultivating and Developing Program of Beijing Science and Technology Innovation Base(z151100001615050);Key Projects of Fujian Provincial Science and Technology Department(2014I0003);Innovation and drive power engineering project of China association for science and technology(2016CXQD01).
Declaration of interest:The authors report to no conflicts of interest.
小眼畸形相关转录因子(MITF)位于小鼠6号染色体,人类染色体3p12.3–14.1位点,由Mitf基因编码的含有419个氨基酸,分子量大小约为46kDa,具有组织特异性的,含有碱性螺旋-环-螺旋亮氨酸拉链(bHLH-Zip)的二聚体结构[1-3]。Mitf通过bHLH-Zip结构域识别位于靶基因启动子区上的E-box特异序列(CATGTG),结合后启动下游靶基因的转录[4]。MITF对于黑色素细胞,视网膜色素上皮细胞,肥大细胞以及破骨细胞的发育以及维持细胞形态都有重要的作用[5]。因此,MITF突变会造成多种疾病发生,例如Waardenburg综合征,视网膜退行性变,先天小眼球病等疾病。以往研究中使用的动物模型大多是啮齿类动物(小鼠、大鼠、豚鼠等),或是灵长类动物,啮齿类动物在遗传学方面与人类相差甚远,而灵长类动物则存在伦理学问题。猪是除灵长类以外跟人类进化关系最相近的物种,并且没有灵长类动物伦理方面问题,因此以猪为动物模型的科学研究逐渐增多,在繁殖生理学、转基因、皮肤生理学、干细胞移植等方面都已经进行了广泛的研究[6-7]。因此本实验根据正常猪的mitf基因设计引物,经PCR扩增目的基因MITF,重组腺相关病毒载体构建、包装、纯化、滴度测定以及表达鉴定,成功构建过表达mitf腺相关病毒载体,为未来在mitf基因突变疾病的基因治疗中奠定基础。
1 材料与方法
1.1 材料
AAV-CAG-ZsGreen载体由汉恒生物公司提供,NheI和KpnI酶购自Fermentas公司,T4连接酶购自Fermentas公司,大肠杆菌菌株stbl3购自Tiangen公司,抽提质粒试剂盒购自康为世纪,胰酶购自Hy⁃clone公司,HEK293细胞由汉恒生物公司提供,Li⁃pofiterTM转染试剂由汉恒生物公司提供,DNase I及蛋白酶K购自Fermentas公司,Trizol购自Gibco公司,RIPA裂解液购自碧云天公司,PVDF膜购自Millipore公司,MITF双抗购自Invitrogen公司,β-actin购自In⁃vitrogen公司,SDS-PAGE分离胶购自国药集团化学试剂有限公司。
1.2 方法
1.2.1 重组腺相关病毒的构建
根据已知目的基因MITF(sus scrofa,Gene ID:NM_ 001038001.1)cDNA序列设计合成基因扩增引物,利用化学合成法获取目的基因。目的片断插入Nhe I和Kpn I位点,由CAG启动子调控表达,CAG启动子后为多克隆位点区,载体中含有ZsGreen标记基因,PCR扩增MITF基因,引物设计为F5’-ATATGCTAG⁃CACGCGTGCCACCATGCTGGAAATG-TAGAATATAAT-3’,R5’-ATATGGTACCGCAAGCATGCTCGGTTTCTTCCAT-3’。
AAV-CAG-ZsGreen载体用Nhe I和Kpn I酶切,酶切完成后进行胶回收。利用PCR高温变性94℃20s,低温退火55℃20s,引物延伸72℃90s,共25个循环,获得的目的基因MITF片段,在T4连接酶作用下与载体进行连接反应。氨苄霉素抗性板上37℃培养过夜,在感受态细胞大肠杆菌菌株stbl3中转化。转化后的MITF平板挑菌,37℃250转/分钟摇菌14小时,菌液进行PCR鉴定,将阳性克隆菌液送测序公司测序,进行测序结果比对。
1.2.2 腺相关病毒包装
用抽提质粒试剂盒大量提取质粒,0.25%胰酶加入到HEK293细胞中充分消化细胞,加入预先预热过的10%DMEM混匀,取出50μl细胞悬液再次加入10%DMEM,即为10倍稀释,混匀,取10ul细胞于计数板中计数。计数板共4大格16小格。观察细胞密度,80-90%满即可进行转染。将加入LipofiterTM转染试剂的含有pAAV-RC 10μg,pHelper 20μg,以及pAAV-GFP系列载体的混合物共转染AAV-293细胞。转染后72h,将培养皿中所有细胞用收于离心管中,将离心管在液氮及37℃水浴反复冻融三次。离心收集含病毒的上清液。用全能核酸酶处理37℃孵育1h,离心取上清液,得到的AAV病毒液加入树脂柱进行柱纯化,收集最终得到的纯化后的病毒,于-70°C保存。
1.2.3 重组AAV-MITF滴度的鉴定
DNase I及蛋白酶K反应液消化AAV病毒样品。用PCR缓冲液将稀释标准品稀释成不同拷贝梯度105、106、107、108、109、1010。QPCR测定,反应体系为2X mix 4.8μl,引物-F 0.4μl,引物-R 0.4μl,模板1μl,水3μl。经一次95°C 180s预变性后,94°C 30s变性,62°C 30s退火,72°C 30s延伸,进行40个循环,利用统计软件数据分析。
1.2.4 重组AAV-MITF感染HEK293细胞
传代HEK293细胞至96孔板,直至10^4细胞/孔进行转染。次日,纯化后的重组AAV-MITF-GFP转染HEK293细胞,每孔加入5μl过表达mitf重组腺相关病毒载体。转染后三天荧光显微镜下观察细胞转染情况。
1.2.5 重组AAV-MITFReal-timePCR及westernblot检测
取目的病毒和等滴度的对照病毒感染HEK293细胞,48小时后回收细胞。一部分细胞先后加入裂解液Trizol混匀裂解,提取RNA。95℃180s预变性后,经过高温退火94℃15s,低温变性60℃30s,引物延伸72摄氏度30s,共40个循环。利用紫外分光光度计检测RNA提取质量,并通过RNA琼脂糖凝胶电泳分析。剩下一部分细胞加入1mlRIPA裂解液10μlPMSF,充分裂解离心,取上清液。配置10% SDS-PAGE分离胶,5%浓缩胶,将上清液加入上样孔中,以110V恒压条件电泳,直至出现溴酚蓝指示剂,停止电泳。将PVDF膜预先用5%牛血清室温封闭1h,以110V恒压将胶上的蛋白转导PVDF膜上,用MITF一抗(1:1000)及β-actin(1:1000)4℃过夜孵育,TBST洗膜3遍后加入二抗(1:1000)室温孵育1h,进行Western-blot蛋白检测。
2 结果
2.1 重组腺相关病毒AAV-MITF的构建及鉴定
利用PCR获取MITF目的基因(图1),MITF长度为1242bp,插入到pAAV-CAG-ZsGreen过表达载体,插入位点为Nhe I和Kpn I位点,由CAG启动子调控表达,载体中含有ZsGreen标记基因。重组腺相关病毒由氨卞霉素挑选出阳性克隆菌液,菌液进行PCR鉴定(图2)。DNA测序结果显示克隆MITF基因与正常MITF基因序列一致。
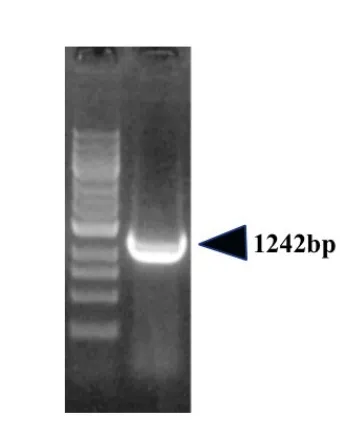
图1 PCR获取目的基因MITFFig.1 Target gene MITF via PCR
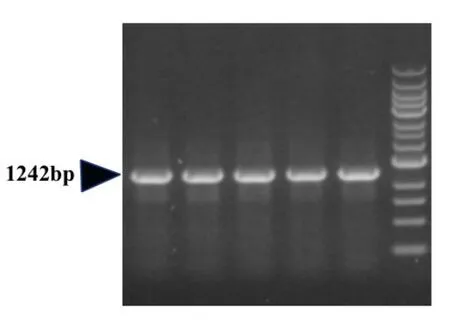
图2 单克隆PCR鉴定结果Fig.2 Results of monoclonal PCR identification
2.2 重组腺相关病毒AAV-MITF的滴度测定
统计软件得到原始数据,计算标准曲线的函数公式及R平方值。根据曲线的函数公式,计算待测AAV样品对应的拷贝数对数X,进一步换算成拷贝数10X及病毒滴度vg/ml。测得mitf病毒滴度为1.0* 10^12vg/ml。
2.3 重组腺相关病毒AAV-MITF感染HEK293细胞
重组腺相关病毒AAV-MITF转染HEK293细胞3天后,在荧光显微镜下持续观察96h转染结果。图中显示随机选取96孔板中的3孔转染病毒载体后在荧光显微镜下观察白光和对应区域荧光下的观察结果(图3)。计数每孔中出现绿色荧光的细胞数后取平均值,计算出有86.3%的HEK293细胞被成功转染,未发现转染病毒后出现HEK293细胞死亡现象。

图3 AAV-MITF感染293细胞情况(图1、2、3分别为随机3孔细胞在同一区域白光和对应荧光的观察结果)Fig.3 AAV-MITF infection in 293 cells(Figures3(1),(2),(3) are the results of the observation of the white light and the corresponding fluorescence in the same region,respectively)
2.4 MITF基因Real-timePCR鉴定及Westernblot鉴定
病毒感染293细胞48小时后回收一部分细胞进行总RNA提取,经检测目的基因病毒载体AAV-MITF及对照病毒载体经紫外分光光度计测得OD260/OD280及OD260/OD230比值均在正常范围内,表示RNA在提取分别测得RNA浓度为382ng/ μl,306ng/μl(图1)。提取后的总RNA进行qPCR检测,RNA琼脂糖凝胶电泳分析结果如下(图5)。另一部分细胞制备蛋白样品进行western-blot检测,经免疫反应、化学发光成像后,结果显示AAV-MITF可以在293细胞中稳定表达MITF蛋白(图6)。
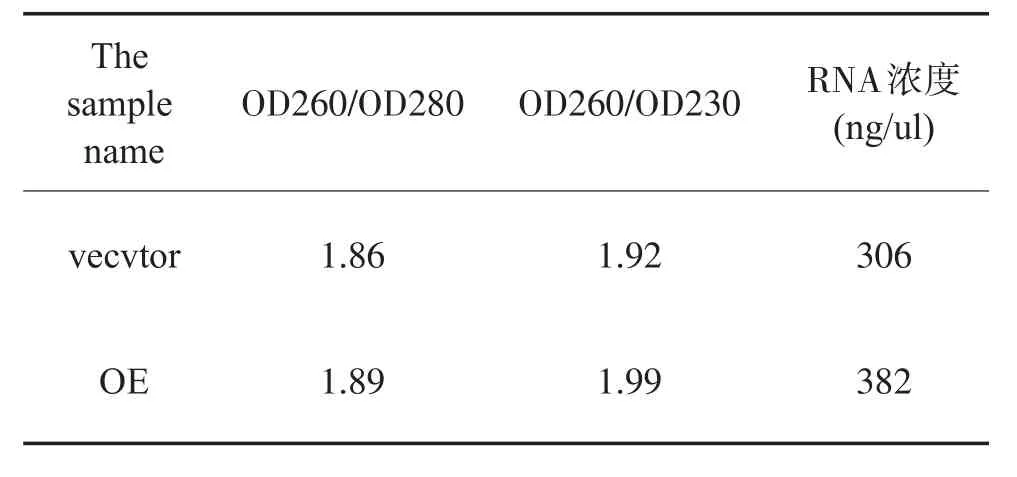
表4 紫外分光光度计检测RNA提取质量检测结果Table 4 UV spectrophotometer detection of RNA extraction quality test results
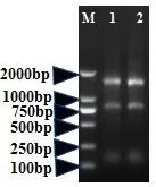
图5 RNA琼脂糖凝胶电泳分析结果Fig.5 Results of RNAagarose gel electrophoresis(M:DL2000 DNA ladder,条带自上而下为2000bp 1000bp 750bp 500bp 250bp 100bp;1:vector;2:OE)

图6 western blot检测mitf表达情况Fig.6 Western blot detection of mitf expression(1:vector;2:MITF过表达样品)
3 讨论
MITF基因具有多启动子,它至少有9种不同的启动子-外显子结构来决定MITF的不同类型,因此MITF存在不同亚型,它由第一个外显子以及不同启动子决定,下游外显子是相同的,而不同亚型表达在不同细胞内[5,8]。MITF-M mRNA特异性表达在黑色素细胞中以及黑色素瘤细胞中,在其他细胞类型中没有发现,包括人类视网膜色素上皮细胞[9]。MITF-M与特异性的色素酶基因(酪氨酸酶TYR,酪氨酸酶相关蛋白TYRP,多巴色素互变异构酶DCT)作用,调控黑色素细胞的存活与分化[1]。MITF在多种组织器官中都对于特定细胞的发育与分化起到至关重要的作用。Paula Hertwig从接受X射线66号治疗的小鼠后代中出现的小眼白色小鼠中发现并且介绍了第一个小鼠Mitf突变,直至目前已经发现了超过24种自发和诱导的Mitf等位基因突变位点[10]。Mitf突变会导致多种遗传性疾病,例如研究较为广泛的Waardenburg综合征。Waardenburg综合征分为四型,其中Waardenburg综合征II型是一种先天性遗传性疾病,表现为先天性聋,色素异位。我们研究团队在中国重庆荣昌县发现一个与人类Waardenburg综合征表型高度一致的猪种,已经确定荣昌猪的耳聋突变家系就是由于MITF突变导致,并且进一步研究表明是由于MITF-M出现插入突变导致。内耳的黑色素细胞位于血管纹的中间细胞,血管纹的主要功能是分泌钾离子产生内淋巴电位。根据文献研究表明MITF-M突变的白化荣昌猪毛细胞和静纤毛缺失,血管纹变薄,只剩两层细胞结构,检测不到可识别的ABR波形,内淋巴电位(EPs)和钾离子浓度都低于正常猪。由于EPs和高钾环境是毛细胞将机械能转换成电能的主要驱动力,所以EPs减少及钾离子浓度减低会造成极重度耳聋[11]。遗传性耳聋目前主要通过助听器及人工耳蜗植入方式治疗,虽取得一定的治疗效果,但是花费巨大,因此科学家们将基因治疗作为遗传性耳聋治疗的研究重点。本实验中我们通过查找猪来源MITF的片段设计引物,进行PCR扩增获取MITF目的基因,单克隆CPR鉴定结果以及测序结果表明构建的MITF基因与野生型MITF基因一致,这表明此构建的过表达mitf重组腺相关病毒载体可以为未来进行以白化荣昌猪为动物模型进行遗传性耳聋基因治疗提供研究基础。
在以往的研究中,曾经有研究者通过重组腺病毒载体包载野生型mitf基因转染B16小鼠黑色素瘤细胞以及人类黑色素细胞[12]。但腺病毒不能整合到宿主的基因组中,并且会产生较强的免疫原性[13]。而腺相关病毒(adeno-associated virus,AAV)是一类单链线状DNA缺陷型病毒,是目前所发现的动物病毒中最小的病毒,其基因组DNA小于5kb,无包膜,外形为裸露的20面体颗粒[14]。在病毒载体中它的优势在于:1.安全性高;2.免疫原性弱;3.宿主范围广;4.物理性质稳定;5.表达稳定[13]。所以腺相关病毒是目前基因治疗中常用的载体之一,并且已经取得了初步的研究结果。Omar Akil利用Vglut3基因敲除小鼠模型,将AAV1-VGLIT3-GFP导入小鼠耳蜗中,成功使耳聋小鼠ABR阈值恢复至正常范围内,并且至少持续7w,其中有两只小鼠可以保持1年半[13,15]。因此本实验选用腺相关病毒包载目的基因mitf,利用双酶切方法构建过表达mitf基因重组腺相关病毒载体,并进行了纯化及滴度测定,证明此构建的过表达Mitf重组腺相关病毒载体具有有效滴度。转染HEK293细胞结果显示绿色荧光蛋白在HEK293细胞中的表达率为86.3%,并且无HEK293细胞死亡现象,证明病毒载体具有安全性和有效性。Western blot及RT-PCR检测证明过表达mitf基因重组腺相关病毒载体可以有效转录出正常Mitf基因的mRNA并且可以表达出正常的MITF蛋白,大小为46KDa。本次研究首次成功构建过表达mitf重组腺相关病毒载体,这一载体的构建不仅为白化荣昌猪遗传性耳聋的基因治疗提供基础,也为未来进行MITF突变导致的其他遗传性疾病的基因治疗提供新思路。
1 张华,陈红胜,李家大等.MITF基因突变致II型Wardenburg综合征发病的实验研究[J].听力学及言语疾病杂志,2014,22(4): 378-385.
Zhang H,Chen HS,Li JD,et al.Experimental Studies On Pathogene⁃sis of Waardenburg Syndrome Type II Resulting from Microphthal⁃mia-Associated Transcription Factor Gene Mutations[J].Journal of Audiology and Speech Pathology,2014,22(4):378-385.
2 Hodgkinson,C.A.et al.Mutations at the mouse microphthalmia lo⁃cus are associated with defects in a gene encoding a novel basic-he⁃lix-loop-helix-zipper protein[J].Cell,1993,74(2):395-404.
3 Widlund HR,Fisher DE.Microphthalamia-associated transcription factor:a critical regulator of pigment cell development and survival [J].Oncogene,2003,22(20):3035-41.
4 Meadows NA,Sharma SM,Faulkner GJ,et al.The expression of Clcn7 and Ostm1 in osteoclasts is coregulated by microphthalmia transcrip⁃tion factor[J].J Biol Chem,2007,282(3):1891-904.
5 Shibahara S,Takeda K,Yasumoto K.Microphthalmia-associated tran⁃scription factor(MITF):Multiplicity in structure,function,and regu⁃lation[J].J Investig Dermatol Symp Proc,2001,6(1):99-104.
6 陈伟,陈磊,杨仕明.荣昌猪遗传性听力缺陷家系的发掘与应用[J].中华耳科学杂志,2016,14(1):10-14.
Chen W;ChenL;YangSM.Excavation and application ofthe Rongchang Pig hereditary pedigree connected to hearing defects[J]. Chinese Journal of Otology,2016,14(1):10-14.
7 Vodicka,P;Smetana,K;Dvorankova,B.The Miniature Pig as an Ani⁃mal Model in Biomedical Research[C].Stem Cell Biology:Develop⁃ment and Plasticity,2004,1049:161-171.
8 Hershey CL,Fisher DE.Genomic analysis of the Microphthalmia lo⁃cus and identification of the MITF-J/Mitf-J isoform[J].Gene,2005, 347(1):73-82.
9 任丽丽,郭维维,杨仕明.MITF与Waardenburg综合征[J].中华耳科学杂志,2013,11(1):145-150.
Ren LL,Guo WW,Yang SM.MITF and Waardenburg syndrome[J].Chi⁃nese Journal of Otology,2013,11(1):145-150.
10 Steingrímsson E,Copeland NG,Jenkins NA.Melanocytes and mi⁃cropgthalmia thanscription factor network[J].Annu Rev Genet,2004, 38:365-411.
11 Chen L,Guo WW,Ren LL,et al.A de novo silencer causes elimination of MITF-M expression and profound hearing loss in pigs[J].BMC Bi⁃ology,2016,14(52):1-15.
12 Gaggioli C,Buscà R,Abbe P,et al.Microphthalmia-associated tran⁃scription factor(MITF)is required but is not sufficient to induce the expression of melanogenic genes.Pigment Cell Res,2003,16:374-382
13 史珣贝,吴南,郭维维等.腺相关病毒在遗传性非综合征感音神经性耳聋基因治疗上的应用[J].中华耳科学杂志,2016,14(1):37-42.
Shi XB,Wu N,Guo WW,et al.Application of Adeno-Associated Vi⁃rus Gene Vectors in hereditary non-syndromic sensorineural hear⁃ing loss[J].Chinese Journal of Otology,2016,14(1):37-42.
14胡维新主编.医学分子生物学(第二版)[M]2014:313-317.
Hu WX.Medical molecular biology(second edition)[M]2014:313-317.
15 Akil,O.S.,R.P.Burke,K.Wang,et al.Restoration of hearing in the VGLUT3 knockout mouse using virally mediated gene therapy.Neu⁃ron,2012,75(2):283-93.
Construction and qualification of recombinant mitf adeno-associated virus gene vector
SHI Xunbei1,LIN Chang1,YANG Shiming2WU Nan2
1 Department of Otolaryngology,First Affiliated Hospital,Fujian Medical University,Fuzhou 350005,China
2 Department Otolaryngology-Head and Neck Surgery,Oto-Neurobiology Centre,Institute of Otolaryngology,Chinese PLA General Hospital,Beijing 100853,China
ObjectiveTo construct a recombinant adeno-associated virus vector for potential gene therapy for mitf mutations.MethodsWe acquired the target gene via PCR amplification.pAAV-RC,pHelper and pAAV-GFP were transfected into HEK293 cells using the artificial liposome method and the recombinant adeno-associated virus vector product was purified via column purification.Titers of the recombinant adeno-associated virus vector were determined by qPCR.The recombinant adeno-associated virus vector was used to infect 293 cells.Real-time PCR and western blot were used to identify expression of the recombinant adeno-associated virus vector carrying mitf.ResultsPCR amplification and DNA sequencing illustrated that the target gene and recombinant adeno-associated virus vector were constructed successfully with high titers (1.0*10^12 vg/ml).Recombinant adeno-associated virus vectors infected 293 cells successfully with an expression efficiency of 86.3%.No cell death was found.The constructed mitf gene was equivalent to the normal mitf gene based on real-time PCR and western blot results.ConclusionThe recombinant adeno-associated virus vector carrying mitf provides a new way of gene therapy for hereditary diseases caused by mitf mutations.
MITF,adeno-associated virus vector,gene therapy
R764
A
1672-2922(2016)06-841-5
2016-12-04审核人:翟所强)
10.3969/j.issn.1672-2922.2016.06.027
国家863青年科学家项目(2014AA020510);国家自然科学基金(面上项目81271082,青年基金81400472);北京科技创新基地培育与发展专项(z151100001615050);福建省科技厅重点项目(2014I0003);中国科协创新驱动助力工程(2016CXQD01)。
史珣贝,研究生,研究方向:毛细胞再生及基因治疗
吴南,Email:maxpanda1979@126.com
