欧前胡素肝微粒体代谢动力学和细胞色素P450代谢表型分析
2016-02-14庄笑梅
蹇 阳,陈 琳,原 梅,庄笑梅,李 桦
(军事医学科学院毒物药物研究所,抗毒药物与毒理学国家重点实验室,北京 100850)
欧前胡素肝微粒体代谢动力学和细胞色素P450代谢表型分析
蹇 阳,陈 琳,原 梅,庄笑梅,李 桦
(军事医学科学院毒物药物研究所,抗毒药物与毒理学国家重点实验室,北京 100850)
目的 研究呋喃香豆素活性成分欧前胡素在人和大鼠肝微粒体的代谢稳定性和酶促动力学,并分析细胞色素P450(CYP)酶的代谢表型。方法 将欧前胡素分别与人和大鼠肝微粒体在37℃与不同辅酶因子孵育,应用液相色谱-串联质谱(LC-MS/MS)法测定孵育液中剩余的欧前胡素含量,分析其代谢稳定性及代谢消除反应类型,并计算酶促动力学参数——米氏常数(Km)和最大反应速率(Vmax)。应用重组人源CYP同工酶(CYP1A2,CYP2B6,CYP2C8,CYP2C9,CYP2C19,CYP2D6和CYP3A4)及其特异性抑制剂,确定欧前胡素的CYP酶代谢表型。结果 在人和大鼠肝微粒体中,欧前胡素主要依赖于还原性辅酶Ⅱ(NADPH)的Ⅰ相代谢消除,30 min代谢转化率分别为69.7%和94.5%,代谢消除半衰期t1/2分别为18.9±0.6和(2.8± 0.4)min,经外推得到的肝清除率(Clh)分别是16.9±0.1和(51.9±0.4)mL·min-1·kg-1,Km分别为13.60±0.16和(14.00±0.24)μmol·L-1,Vmax分别为2928±96和(8434±27)nmol·min-1·g-1。欧前胡素在大鼠肝微粒体的消除显著快于人肝微粒体(P<0.01)。欧前胡素在肝微粒体的Ⅰ相代谢是由多个CYP同工酶介导的,经整体归一化法评价得到CYP1A2,CYP2B6,CYP2C19和CYP3A4的代谢贡献率分别为20.4%,7.3%,10.5%和61.8%。结论 欧前胡素在肝微粒体中主要发生多个CYP酶介导的Ⅰ相代谢,其中CYP3A4和CYP1A2的贡献率>20%。
欧前胡素;肝微粒体;细胞色素P450酶;代谢
欧前胡素是呋喃香豆素类的活性成分,属于6,7-呋喃香豆素类,天然存在于伞形科常用中药白芷、独活和北沙参中,是其主要药效成分,也是临床上广泛使用的藿香正气水、龙葵银消片和元胡止痛片等多种中药制剂的重要活性成分[1-2],具有镇痛、抗肿瘤、舒张血管、抗炎和抗菌的功效[3-4]。我们前期研究发现,欧前胡素是中药白芷中含量最高的呋喃香豆素成分,也是大鼠经胃白芷提取液后血浆中的主要成分[5]。欧前胡素的动物药代动力学已有较多的研究[6-7]。应用液相-高分辨质谱联用技术,在口服欧前胡素的大鼠尿样中可检测到数十个代谢产物,其中以氧化产物为主[8],表明欧前胡素在大鼠体内能发生广泛的代谢。但欧前胡素在人体内外的代谢性质以及所参与的代谢酶未见报道。
呋喃香豆素是一类重要的中药活性成分。近年来,这类成分与细胞色素P450同工酶(cyto⁃chrome P450 enzyme,CYP)之间的相互作用引起关注[9],其对 CYP3A4,CYP2D6,CYP1A2和CYP2C19等多种CYP酶均有不同程度的抑制作用[10-14]。我们前期研究发现,大鼠经灌胃白芷提取物(4.5 g·kg-1)后,欧前胡素是血浆中的主要呋喃香豆素活性成分,血药浓度可达2.5 mg·L-1水平,口服生物利用度约为42%[5]。欧前胡素对CYP酶各亚型有广泛的抑制作用,是CYP1A2和CYP2B6的强抑制剂,CYP2C19,CYP3A4,CYP2C9和CYP2D6的中等或弱抑制剂[15],提示欧前胡素在临床上与其他中药和西药合用时,具有基于CYP酶抑制相互作用的风险。因此,研究欧前胡素的肝代谢性质并了解介导其代谢消除的主要代谢酶,对于指导临床合理用药、减少因代谢性相互作用引起的毒性作用具有重要意义。
本研究应用液相色谱-串联质谱联用(LC-MS/ MS)法及肝微粒体和重组人源CYP,比较欧前胡素在人肝微粒体(human liver microsomes,HLM)和大鼠肝微粒体(rat liver microsomes,RLM)的代谢稳定性和酶促动力学,确定参与其代谢的Ⅰ相反应酶表型,为深入认识欧前胡素的代谢消除机制以及为指导临床合理用药提供科学依据。
1 材料与方法
1.1 药品、试剂和仪器
欧前胡素(批号:110816-201224)、咪达唑仑(CYP3A4)、奎尼丁(CYP2D6)和酮康唑(CYP3A4)均购自中国药品生物制品检定院;各CYP同工酶的特异性底物(CYP1A2:非那西丁;CYP2B6:安非他酮;CYP2C8:吉非贝齐;CYP2C9:甲苯磺丁脲;CYP2C19:S-美芬妥因和CYP2D6:右美沙芬)。CYP同工酶特异性抑制剂(CYP1A2:α-萘黄酮;CYP2B6:噻氯吡啶;CYP2C8:诺卡酮;CYP2C9:磺胺苯吡唑和CYP2C19:槲皮素),以及7-羟基香豆素、尿苷二磷酸葡糖醛酸(uridine diphosphate glucuronic acid,UDPGA)、聚二乙醇十六烷基醚58(Brij 58)和D-葡萄糖二酸-1,4-内酯均购自美国Sigma公司;甲醇(色谱纯)和乙腈(色谱纯)为美国Fisher公司产品。还原性辅酶Ⅱ(nicotinamide ad⁃enine dinucleotide phosphate,NADPH)为瑞士Roche公司产品。混合HLM(蛋白含量20 g·L-1,批号34689)、重组人源CYP同工酶(CYP1A2,CYP2B6,CYP2C8,CYP2C9,CYP2C19,CYP2D6和CYP3A4)购自美国BD Gentest公司。RLM为实验室自制,使用军事医学科学院实验动物中心提供的清洁级雄性SD大鼠,体质量200 ~240 g,动物许可证号SCXK(军)2015-004;制得的RLM经二喹啉甲酸(bicinchoninic acid,BCA)法测得蛋白质含量为20 g·L-1。
美国Agilent 6410B三重四级杆串联质谱,配备Agilent 1290超高压液相色谱和CAPCELL PAK MGⅡC18(2.0 mm×100 mm,3 μm)色谱柱。
1.2 LC-MS/MS定量检测欧前胡素
色谱条件:以流动相A(含0.1%甲酸和5mmol·L-1甲酸铵的纯水)和B(含0.1%甲酸的乙腈)按如下梯度洗脱:30%B(0-1.0 min),30%→50%B(1.0-4.3 min),58%→90%B(4.3-4.7 min),90%→75%B(4.7-5.0 min),75%→30%B(5.0-5.5 min),流速0.3 mL·min-1,运行时间6.8 min,柱温25℃,进样5 μL,内标为茴芹内酯(100 μg·L-1)。质谱条件:离子源为电喷雾离子源,正离子模式下采用多反应监测方式检测,毛细管温度为350℃,干燥气流速为10 L·min-1,毛细管电压为4000 V,雾化电压为172 kPa,欧前胡素和内标的的检测离子对分别为271→203和247→232,碰撞能量分别为36 V和30 V。
1.3 欧前胡素的肝微粒体孵育和代谢稳定性
孵育体系为200 μL K2HPO4缓冲液(5 mmol·L-1,pH 7.4)、内含RLM或HLM(蛋白质含量0.5 g·L-1)、欧前胡素1 μmol·L-1、辅酶NADPH 1 mmol·L-1和UDPGA 5 mmol·L-1。实验分为以下4组:NADPH组、UDPGA组、NADPH+UDPGA组和NADPH加热组(50℃水浴90 s)。按参考文献[16]的代谢稳定性方法,在加或不加NADPH的HLM孵育体系中,观察CYP介导的欧前胡素Ⅰ相代谢消除;微粒体中还含有尿苷二磷酸葡糖醛酸转移酶(UDP-glucurono⁃syltransferase,UGT),是否加入UDPGA观察UGT介导的欧前胡素Ⅱ相代谢消除;NADPH加热组50℃通过水浴90 s,使肝微粒体中的黄素单加氧酶(flavin-containing monooxygenase,FMO)失活,排除其对实验结果的影响。UDPGA组和NADPH+UD⁃PGA组还需加入聚氧乙烯20(HLM或RLM蛋白0.5 mg·g-1)和葡糖醛酸结合物水解抑制剂D-葡萄糖二酸-1,4-内酯5 mmol·L-1。上述各组将欧前胡素与RLM或HLM在37℃预孵育5 min后,加入同法预孵育的辅酶溶液启动反应,继续在37℃孵育,分别于0,2,5,15,30和60 min时,立即加入600 μL预冷的含茴芹内酯100 μg·L-1(内标)的乙腈溶液终止反应,涡旋2 min,离心10 min(18 800×g,4℃),取上清进样检测剩余的欧前胡素浓度。实验平行设置不加辅酶的空白对照组、加入CYP底物普萘洛尔和UGT底物7-羟基香豆素的阳性对照组。各组设3个平行样品。
1.4 欧前胡素在RLM和HLM的酶促动力学
首先在上述孵育体系,选取代谢稳定性实验中观察到的呈线性消除范围的时间点(HLM孵育为5 min,RLM孵育为2 min),通过不同肝微粒体蛋白浓度(0.1 ~1.0 g·L-1)的预实验,选择原型药物呈线性消除的RLM或HLM蛋白质浓度(0.5 g·L-1),进行酶促动力学研究[17]。为测定欧前胡素的酶促动力学参数:米氏常数(Km)和最大反应速率(Vmax),在上述加入NADPH的Ⅰ相代谢孵育体系中加入系列浓度的欧前胡素(0.5,1,2.5,5,10,25和50 μmol·L-1),同1.3项下方法,分别与HLM孵育2 min与RLM孵育5 min后终止反应,应用LC-MS/MS法检测剩余的欧前胡素浓度。
1.5 欧前胡素的CYP代谢酶表型
1.5.1 重组人源CYP同工酶法
孵育体系为 200 μL的 K2HPO4缓冲液(5 mmol·L-1,pH 7.4),体系内分别含重组酶(蛋白质浓度50 pmol·L-1)(CYP1A2,CYP2B6,CYP2C8,CYP2C9,CYP2C19,CYP2D6和CYP3A4),欧前胡素1 μmol·L-1,37℃预孵育5 min后加入NADPH溶液启动反应,37℃孵育10 min后加入预冷的含100 μg·L-1茴芹内酯(内标)的乙腈溶液终止反应,涡旋2 min,离心10 min(18 800×g,4℃),取上清进样定量测定欧前胡素的剩余量,计算转化率和初始消除速率。实验平行设置的空白对照组(不加入NADPH孵育),零时组(在反应启动前先加入600 μL用于灭活酶的沉淀剂),每组设3个平行样品[18]。在欧前胡素实验前应用实验室已建立的LC-MS/MS法[19],分析7个同工酶的探针底物(5 μmol·L-1)在上述孵育体系中代谢产物的生成率,评价各重组酶的活性。
1.5.2 CYP酶特异化学抑制剂法
在HLM孵育体系中,将CYP同工酶特异性化学抑制剂与欧前胡素共同孵育,评价抑制剂对欧前胡素代谢转化的影响。孵育体系为200 μL的K2HPO4缓冲液(5 mmol·L-1,pH 7.4),欧前胡素(1 μmol·L-1),HLM(蛋白质浓度0.5 g·L-1),各CYP同工酶的特异性抑制剂(CYP1A2:α-萘黄酮;CYP2B6:噻氯吡啶;CYP2C8:诺卡酮;CYP2C9:磺胺苯吡唑;CYP2C19:槲皮素;CYP2D6:奎尼丁;CYP3A4:酮康唑),37℃水浴预孵育5 min后加入NADPH启动反应,10 min后用预冷的含茴芹内酯100 μg·L-1(内标)的乙腈溶液终止反应,涡旋2 min,离心10 min(18 800×g,4℃),取上清进样定量检测欧前胡素的剩余量。实验平行设置发生完全反应的阳性对照组(不加入抑制剂)和不发生反应的零时组(实验前灭活肝微粒体酶),与实验组同法孵育,上述样品每组设3个平行样品。
1.6 数据处理
代谢半衰期和清除率:将零时的欧前胡素浓度作为100%,由各时间点剩余浓度与零时浓度的比值得到欧前胡素的剩余百分比。将各时间点剩余百分比的自然对数作为纵坐标,各相应的孵育时间点作为横坐标作图,直线回归后得到斜率(-k),在式1中带入斜率(-k)求得欧前胡素的代谢消除半衰期t1/2。应用Well-stirred模型对其数据进行外推,由式2和3求得欧前胡素在HLM和RLM中的固有清除率Clint和肝清除率Clh(mL·min-1·kg-1)[20]。相关动物理化参数的经验值引自文献[21]。

式中,Qh:肝血流量。
整体归一化(total normalized rate,TNR)法评价各同工酶的贡献率:将欧前胡素的初始浓度(c0)和t时剩余浓度(ct)以及孵育液中各CYP酶的含量(ccyp)代入式4计算,分别得到欧前胡素在各重组酶中的初始代谢速率(vm)。

将各CYP同工酶在正常人肝微粒体中的平均特定含量(pmol CYP·mg-1蛋白质)代入式5,评价各人源重组CYP同工酶在欧前胡素肝代谢中的贡献[22-23]。

应用GraphPad Prism 5.0(GraphPad Soft⁃ware Inc.,La Jolla,CA,USA)软件,由欧前胡素的系列浓度(0.5,1,2.5,5,10,25和50 μmol·L-1),及各浓度对应的酶反应速率,计算得到欧前胡素在HLM和RLM中的表观酶促动力学参数:Km和Vmax。
1.7 统计学分析
代谢稳定性实验所得t1/2,Clint和Clh值,以及酶促动力学实验所得Km和Vmax值均用x±s表示。应用SPSS 16.0软件进行单因素方差分析(one-way ANOVA),用最小显著性差异(least significant dif⁃ference,LSD)法进行组间两两比较,以P<0.05表示差异有统计学意义。
2 结果
2.1 欧前胡素定量检测方法的验证
在本研究的分析条件下,微粒体孵育液中的其他物质不干扰欧前胡素及内标的测定。以待测物浓度为横坐标,待测物与内标的峰面积比值为纵坐标,采用最小二乘法进行线性回归,得到线性方程,欧前胡素的线性范围为5 ~2000 nmol·L-1,最低定量限为5 nmol·L-1,在所列的浓度范围内线性关系良好(r2>0.99)。批内和批间精密度<9.8%,准确度在-7.4% ~8.2%之间,提取回收率>95%,且精密度≤15%。表明所建立的方法能满足孵育液中欧前胡素定量检测的要求。
2.2 欧前胡素在大鼠和人肝微粒体中代谢稳定性
图1结果表明,欧前胡素在加入NADPH的HLM和RLM孵育液中可发生明显的代谢消除,在HLM和RLM孵育体系中,欧前胡素在30 min的代谢率分别为69.3%和95.5%,提示欧前胡素在肝微粒体的代谢是NADPH依赖性,且RLM的代谢转化率高于HLM。在人和大鼠UDPGA组中,欧前胡素在孵育60min后的剩余浓度分别为1.04±0.02和(0.98±0.03)μmol·L-1与各零时组0.97±0.11和(1.07±0.09)μmol·L-1相比,均无显著性差异;在人和大鼠NADPH+UDPGA组中,欧前胡素30min的代谢消除率分别为(61.5±5.4)%和(93.8±0.6)%,与NADPH组代谢消除率(69.7±0.4)%和(94.5± 2.8)%相比,无显著性差异。阳性对照组孵育60 min后,UGT底物7-羟基香豆素的代谢转化率为56.8%,可见这两组中均未观察到欧前胡素显著的Ⅱ相代谢消除。人和大鼠NADPH加热组与NADPH组的代谢转化率均无显著性差异,提示欧前胡素的肝微粒体Ⅰ相代谢主要由CYP酶介导,FMO的贡献可忽略。

Fig.1 NADPH dependent metabolic elimination of im⁃peratorin in human liver microsomes(HLM)and rat liver microsomes(RLM).Imperatorin 1 μmol·L-1was mixed with liver microsomes at the protein content of 0.5 g·L-1at 37℃ for 5 min.The mixtures were added with 1 mmol·L-1NADPH after being pre-warmed at 37℃for 5 min to reach the final volume of 200 μL.After 0,2,5,15,30 and 60 min of incuba⁃tion at 37℃,the reactions were stopped by addition of 600 μL acetonitrile containing 100 μg·L-1pimpinellin(internal standard,IS).After vortexing for 2 min,the sample was centrifuged at 18 800×gfor 10 min(4℃).A 5 μL aliquot of the supernatant was analyzed by LC/MS/MS.x±s,n=3.
欧前胡素在HLM和RLM中的Ⅰ相代谢清除参数(表1),其中消除半衰期分别为18.9±0.6和(2.9±0.4)min,提示RLM对化合物的代谢速率明显快于HLM。由Clint外推得到人和大鼠的肝Clh分别为16.9±0.1和(51.9±0.4)mL·min-1·kg-1,分别略低于人和大鼠肝血流20.7和55.2 mL·min-1·kg-1,表明欧前胡素的肝代谢消除较快。
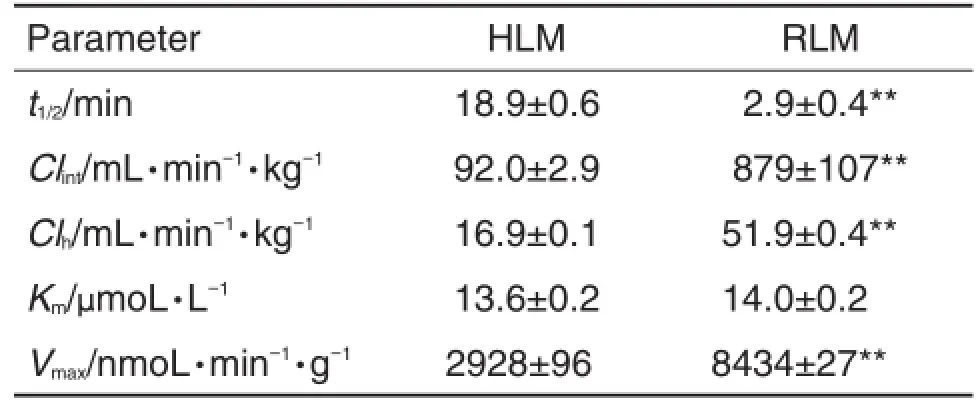
Tab.1 Clearance parameters and apparent enzyme kinetic parameters of imperatorin in HLM and RLM
2.3 欧前胡素在大鼠和人肝微粒体中的表观酶促动力学
结果如表1所示,欧前胡素在HLM和RLM的Km无统计学差异(P>0.05),但RLM的Vmax显著高于HLM(P<0.01)。
2.4 欧前胡素的CYP代谢酶表型
在肝微粒孵育体系中,欧前胡素主要发生依赖于NADPH的Ⅰ相代谢。为此,本研究进一步应用人源重组CYP酶和HML孵育体系,确定欧前胡素的CYP代谢表型。实验前通过特异性探针底物的代谢转化率评价重组酶的活性,进行质量控制。结果表明,重组酶的活性符合供货商的质量指标,表明此CYP同工酶孵育体系满足欧前胡素代谢表型研究的要求。

Fig.2 Metabolic rate(MR)of imperatorin in human recombinant CYPs(rCYPs).See Fig.1 for the incubation system and procedure.Imperatorin 1 μmol·L-1was incubated with human rCYPs 50 pmol·L-1for 10 min.x±s,n=3.
图2结果显示,欧前胡素主要由CYP3A4,CYP1A2,CYP2C19和CYP2B6介导代谢,代谢转化率分别为85.0%,77.4%,73.9%和57.8%,表明欧前胡素的Ⅰ相代谢是由多酶介导的。由于在肝中各同工酶的含量有较大差别,由同工酶孵育得到的代谢转化率无法判断各酶在欧前胡素肝代谢中的实际贡献。为此,本研究结合各同工酶在正常HML的平均特定含量,进一步对欧前胡素在各同工酶孵育液的初始代谢速率进行整体归一化,得到各个CYP同工酶对欧前胡素代谢的贡献率(表2),其中CYP3A4的贡献率为61.8%,CYP1A2为20.4%,它们均是主要参与欧前胡素代谢的CYP同工酶。
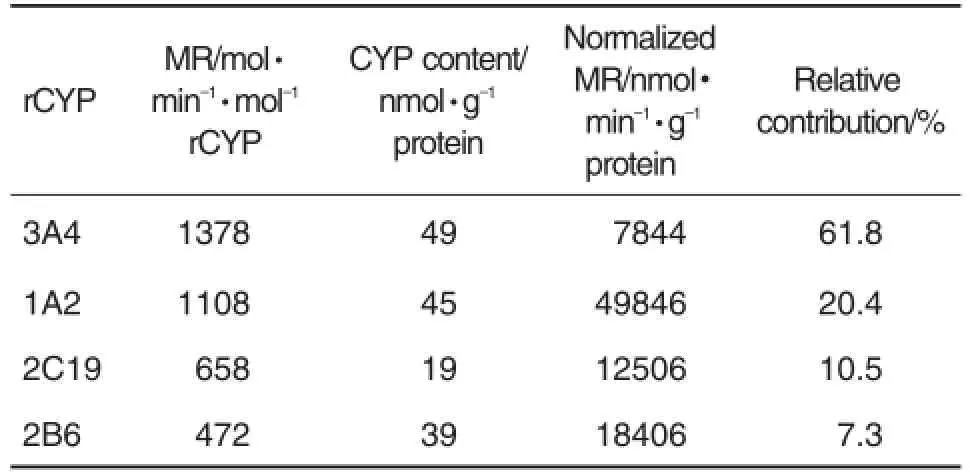
Tab.2 Contribution of rCYPs to imperatorin metabo⁃lism assessed with total normalized MR method
本研究进一步在人肝微粒体孵育体系中,将欧前胡素与CYP同工酶特异性化学抑制剂共孵育,对同工酶法确定的代谢表型进行验证。各CYP酶特异性抑制剂对欧前胡素在HLM中代谢的影响见表3,CYP3A4,CYP1A2,CYP2C19和CYP2B6的特异性抑制剂酮康唑、噻氯吡啶、α-萘黄酮和槲皮素对欧前胡素的抑制率均>15%,表明它们均是介导欧前胡素Ⅰ相代谢的主要同工酶,与重组同工酶孵育得到的结果相符。

Tab.3 EffectofCYP inhibitors on imperatorin metabolism in human liver microsomes
3 讨论
本研究结果表明,欧前胡素在HLM和RLM中主要发生CYP酶介导的Ⅰ相代谢反应。应用LC-MS/MS的选择离子扫描,可在HLM和RLM孵育液中发现多个氧化产物,包括文献报道的独活素[6]。对比欧前胡素在两个种属肝微粒体的代谢消除参数和表观酶促动力学参数可见,其在HLM和RLM中具有相近的表观亲和力,但RLM代谢转化欧前胡素的速率较快,转化率也显著高于HLM,提示欧前胡素在大鼠的代谢清除可能比人快。
欧前胡素在肝微粒体中Ⅰ相代谢消除反应是由多个CYP酶亚型介导的,主要的亚型是CYP3A4,CYP1A2,CYP2C19和CYP2B6,其中CYP3A4和CYP1A2的贡献率>20%。欧前胡素既是它们的底物,同时也是它们的抑制剂,欧前胡素与CYP同工酶之间的相互作用较为复杂,既能对自身代谢形成抑制,使自身代谢清除变慢,也会抑制合用的CYP酶底物药物。由于欧前胡素具有较高的口服生物利用度,作为主要药效成分在服用白芷等中药后能达到较高的血药浓度,在临床应用时,应关注抑制CYP3A4,CYP1A2和CYP2B6等CYP酶相关药物的相互作用风险,必要时调整给药剂量,避免因酶抑制引起的血药浓度变化和毒性作用。
[1]Wu YY,Jiang GH,Ma YY,Gao Y.Research advancement on pharmacological effect of Radix Angelicae Dahuricae[J].LishizhenMedMater Med Res(时珍国医国药),2009,20(3):625-627.
[2]Wang MY,Jia MR,Ma YY,Li XB.Pharmacological effectoffourlinearfurocoumarins in Radix Angelicae Dahuricae[J].Nat Prod Res Dev(天然产物研究与开发)2010,22(3):485-489.
[3]Yang XH,Hu X.Research advancement on phar⁃macological effect of imperatorin and isoimperatorin[J].Acta Acad Med Jiangxi(南昌大学学报,医学版),2012,52(3):95-97.
[4]Liu XX,Cao W,Wang SW.Method of extraction and isolation of imperatorin and its advances in pharmacology[J].Prog Mod Biomed(现代生物医学进展),2010,10(20):3954-3956.
[5]Chen L,Jian Y,Wei N,Yuan M,Zhuang X,Li H. Separation and simultaneous quantification of nine furanocoumarins from Radix Angelicae Dahuricae using liquid chromatography with tandem mass spectrometry for bioavailability determination in rats[J].J Sep Sci,2015,38(24):4216-4224.
[6]Zhao G,Peng C,Du W,Wang S.Simultaneous determination of imperatorin and its metabolitesin vitroandin vivoby a GC-MS method:application to a bioavailability and protein binding ability study in rat plasma[J].Biomed Chromatogr,2014,28(7):947-956.
[7]Chang YX,Zhang QH,Li J,Zhang L,Guo XR,He J,et al.Simultaneous determination of scopo⁃letin,psoralen,bergapten,xanthotoxin,columbi⁃anetin acetate,imperatorin,osthole and isoimper⁃atorin in rat plasma by LC-MS/MS for pharmacoki⁃netic studies following oral administration of Radix Angelicae Pubescentis extract[J].J Pharm Biomed Anal,2013,77:71-75.
[8]Qiao S,Shi X,Shi R,Liu M,Liu T,Zhang K,et al.Identification of urinary metabolites of impera⁃torin with a single run on an LC/triple TOF system based on multiple mass defect filter data acquisition and multiple data mining techniques[J].Anal Bioanal Chem,2013,405(21):6721-6738.
[9]Yang SL,Xiong YJ,Fang PF,Zhao XY.Research advancementon furanocoumarin affecting the metabolism of cytochrome P450[J].Cent South Pharm(中南药学),2011,9(1):45-49.
[10]Zhong YH,Shen GL,Yuan M,Liu WH,Li H. Evaluation ofcytochrome P450 inhibition and induction by psoralen and isopsoralenin vitro[J].Chin J Pharmacol Toxicity(中国药理学与毒理学杂志),2012,26(4):522-528.
[11]Zhuang XM,Zhong YH,Xiao WB,Li H,Lu C. Identification and characterization of psoralen and isopsoralen as potent CYP1A2 reversible and timedependent inhibitors in human and rat preclinical studies[J].Drug Metab Dispos,2013,41(11):1914-1922.
[12]Baumgart A,Schmidt M,Schmitz HJ,Schrenk D. Natural furocoumarins as inducers and inhibitors of cytochrome P450 1A1 in rathepatocytes[J].Biochem Pharmacol,2005,69(4):657-667.
[13]Iwanaga K,Hayashi M,Hamahata Y,Miyazaki M,Shibano M,Taniguchi M,et al.Furanocoumarin derivatives in Kampo extract medicines inhibit cytochrome P450 3A4 and P-glycoprotein[J].Drug Metab Dispos,2010,38(8):1286-1294.
[14]Paine MF,Criss AB,Watkins PB.Two major grapefruit juice components differ in time to onset of intestinal CYP3A4 inhibition[J].J Pharmacol Exp Ther,2005,312(3):1151-1160.
[15]Cao Y,Zhong YH,Yuan M,Li H,Zhao CJ.Inhibitory effect of imperatorin and isoimperatorin on activity of cytochrome P450 enzyme in human and rat liver microsomes[J].Chin J Chin Med Mater(中国中药杂志),2013,38(8):1237-1241.
[16]Tan Y,Shen GL,Zhuang XM,Yuan M,Li H,Gao Y.Metabolic characteristic of paeoniflorinin vitro[J].J Int Pharm Res(国际药学研究杂志),2013,40(5):625-633.
[17]Yang HY,Zhong YH,Chen L,Li H,Zhuang XM. Enzyme kinetics of psoralen and isopsoralen in rat and human liver microsomes[J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2015,29(6):924-930.
[18]Jiang R,Yamaori S,Takeda S,Yamamoto I,Watanabe K.Identification of cytochrome P450 enzymes responsible for metabolism of cannabidiol by human liver microsomes[J].Life Sci,2011,89(5-6):165-170.
[19]Shen GL,Zhong YH,Yuan M,Zhuang XM,Li H. Simultaneous quantitation of six cytochrome P450 enzyme probe metabolites by ultra-high perfor⁃mance liquid chromatography tandem mass spec⁃trometry[J].Chin J Anal Chem(分析化学),2013,41(4):488-493.
[20]Obach RS.Prediction of human clearance of twentynine drugs from hepatic microsomal intrinsic clear⁃ance data:an examination ofin vitrohalf-life approach and nonspecific binding to microsomes[J].Drug Metab Dispos,1999,27(11):1350-1359.
[21]Zhuang XM,Lin QH,Li CZ,Deng JT,Li H.In vitrocomparison of rotundine metabolism in liver micro⁃somes of human,dog and rat[J].Chin Phar⁃macol Bull(中国药理学通报),2009,25(9):1147-1152.
[22]Li CZ,Lin QH,Zhuang XM,Xie JW,Li H.In vitroO-demethylation of rotundine by recombinant human CYP isoenzymes[J].Acta Pharm Sin(药学学报),2010,45(3):307-313.
[23] Rodrigues AD.Integrated cytochrome P450 reaction phenotyping:attempting to bridge the gap between cDNA-expressed cytochromes P450 and native human liver microsomes[J].Biochem Pharmacol,1999,57(5):465-480.
Enzyme kinetics of imperatorin and its cytochrome P450 phenotyping in liver microsomes
JIAN Yang,CHEN Lin,YUAN Mei,ZHUANG Xiao-mei,LI Hua
(State Key Laboratory of Toxicology and Medical Countermeasures,Institute of Pharmacology and Toxicology,Academy of Military Medical Sciences,Beijing 100850,China)
OBJECTIVE To investigate enzyme kinetic characteristics of imperatorin in rat liver microsomes(RLM)or human liver microsomes(HLM),and to identify the reaction phenotyping of human recombinant cytochrome P450 enzyme(CYP)mediated phaseⅠ metabolism.METHODS Imperatorin was incubated at 37℃with HLM or RLM in the presence or absence of nicotinamide ade⁃nine dinucleotide phosphate(NADPH)or uridine 5′-diphosphoglucuronic acid(UDGPA).The con⁃centrations of imperatorin in the incubation systems were determined with LC-MS/MS to evaluate its met⁃abolic stability and enzymatic kinetics.The CYP phenotyping of imperatorin was identified using a panel of human recombinant CYP isoforms(CYP1A2,CYP2B6,CYP2C8,CYP2C9,CYP2C19,CYP2D6 and CYP3A4)and also using a group of specific inhibitors in HLM.RESULTS Imperatorin was meta⁃bolically eliminated in the presence of NADPH in HLM or RLM.The elimination rates for HLM and RLM in 30 min were 69.7%and 94.5%,respectively,and elimination half-life(t1/2)values were 18.9±0.6 and(2.8±0.4)min,respectively.The extrapolated hepatic clearance parameters(Clh)were 16.9±0.1 and(51.9±0.4)mL·min-1·kg-1.The Michaelism-Menten parameters(Km)were 13.60±0.16 and(14.00± 0.24)μmol·L-1,and maximum velocity(Vmax)were(2928±96)and(8434±27)nmol·min-1·g-1,respec⁃tively.The metabolic elimination of imperatorin in RLM was quicker than in HLM.The results of CYP phenotyping indicated that CYP1A2,CYP2B6,CYP2C19 and CYP3A4 were the major CYP isoforms involved in the imperatorin metabolism.Their individual contributions assessed using the method of to⁃tal normalized rate were 20.4%,7.3%,10.5%and 61.8%,respectively.CONCLUSION Imperatorin is mainly eliminated by CYP mediated metabolism in HLM and RLM.CYP1A2 and CYP3A4 are the major responsible enzymes with a contribution rate above 20%.
imperatorin;liver microsomes;cytochrome P450 enzyme;metabolism
LI Hua,E-mail:amms_hli@126.com,Tel:(010)66930664
R969.1
A
1000-3002-(2016)08-0848-07
10.3867/j.issn.1000-3002.2016.08.008
Foundation item:The project supported by National Science and Technology Major Project(2012ZX09301003-001);and National Science and Technology Major Project of China(2015ZX09J15104)
2016-01-28接受日期:2016-05-26)
(本文编辑:沈海南)
国家科技重大专项(2012ZX09301003-001);国家科技重大专项(2015ZX09J15104)
蹇 阳,男,硕士研究生,主要从事药物代谢研究,E-mail:jianyang425@163.com
李 桦,E-mail:amms_hli@126.com,Tel:(010)66930664
