人免疫系统重建NPG小鼠不能诱发直接腘窝淋巴结试验阳性反应
2016-02-14郭岩乳曾繁光姚景春刘兆华
郭岩乳,曾繁光,姚景春,孙 蓉,刘兆华
(1.山东大学药学院新药评价中心,山东济南 250012;2.鲁南制药集团股份有限公司,山东临沂273400;3.山东省中医研究院,山东济南 250014)
人免疫系统重建NPG小鼠不能诱发直接腘窝淋巴结试验阳性反应
郭岩乳1,曾繁光1,姚景春2,孙 蓉3,刘兆华1
(1.山东大学药学院新药评价中心,山东济南 250012;2.鲁南制药集团股份有限公司,山东临沂273400;3.山东省中医研究院,山东济南 250014)
目的 观察阳性药物D-盐酸青霉胺(D-pen)和链脲佐菌素(STZ)诱发的人免疫系统重建NPG(hu-NPG)小鼠的直接腘窝淋巴结试验(d-PLNA)反应,并比较其与NPG和BALB/c小鼠反应的异同,探索可提高药物超敏反应预测价值的模型动物。方法 雌性NPG小鼠,1.8 Gy的X线辐照后,植入人脐血造血干细胞,制备hu-NPG小鼠,取外周血,进行淋巴细胞表型分析及淋巴细胞增殖实验。hu-NPG,NPG和BALB/c小鼠各10只,每种小鼠随机分成D-pen和STZ组,每组5只。各组分别在右后肢足趾部sc给予D-pen每只1 mg或STZ 0.75 mg,左后肢不做处理作为对照。注射后7 d处死小鼠,取左、右侧腘窝淋巴结称重,计算质量指数;将淋巴结制成单细胞悬液,计算细胞指数,并对部分淋巴结进行组织病理学检查,以比较d-PLNA反应。结果 注射阳性药物D-pen和STZ后,各组小鼠一般状态良好,均未见全身毒性,且至处死时局部炎性刺激症状消失。D-pen和STZ均能诱导BALB/c小鼠出现典型的d-PLNA阳性反应,表现为注射侧淋巴结质量和细胞数量比对照侧增加,平均质量指数≥2或平均细胞指数≥5。而NPG小鼠和hu-NPG小鼠均未出现阳性反应。病理学检查发现,NPG和hu-NPG小鼠的腘窝淋巴结体积明显小于BALB/c小鼠,发育不完善。淋巴细胞表型分析发现,NPG小鼠仅有少量淋巴细胞,而hu-NPG小鼠外周血中人源性淋巴细胞以CD45+CD19+的B细胞为主,CD45+CD3+T细胞较少,且丝裂原不能刺激NPG和hu-NPG小鼠体内的人源或鼠源性淋巴细胞增殖。结论 D-pen和STZ所致的小鼠d-PLNA阳性反应依赖于体内正常的淋巴细胞数量及功能。NPG小鼠缺乏正常淋巴细胞,d-PLNA反应阴性。hu-NPG小鼠体内的人淋巴细胞功能不全,也不能诱发阳性反应。因此,hu-NPG小鼠尚不能成为d-PLNA的敏感动物。
药物超敏反应;直接腘窝淋巴结试验;人源化小鼠
药物超敏反应(drug hypersensitivity reaction,DHR)是药物正常使用过程中出现的一种免疫激活性病理综合征。该综合征与药物的药理作用无直接关系,常在治疗剂量下产生且无剂量依赖性,即具有B型药物不良反应的特征[1-2]。它的临床表现和症状与多种疾病相似,缺乏有效的诊断方法,极易被误诊或漏诊[3-4];DHR可通过免疫或非免疫机制介导发生,同时还易受多种因素影响,这种复杂性致使目前尚无有效的临床前评价方法准确预测其发生,使之成为临床用药及药物研发的瓶颈而广受重视[5-6]。准确预测DHR发生以及发现特异性诊断生物标志物,需要新的评价模型。腘窝淋巴结试验(popliteal lymph node assay,PLNA)是一种预测小分子药物致敏潜能的常用模型,尽管其机制不清,但目前被认为是唯一可靠的有效模型。本实验室已成功构建了小鼠的PLNA模型,并用于探索了中药注射剂的致敏性[7-8]。但因动物和人之间存在着种属差异,妨碍了实验结果外推至临床。本研究用人免疫系统重建NPG小鼠(humanized NPG mice with a reconstituted immune system,hu-NPG小鼠)复制直接PLNA(direct PLNA,d-PLNA)模型,比较其与NPG和BALB/c小鼠反应的异同,探索寻找能消除种属差异、提高DHR预测值的敏感动物。
1 材料与方法
1.1 动物、药品、试剂和仪器
8周龄雌性NPG小鼠,体质量22 ~24 g,购自北京维通达生物技术有限公司,质量合格证号:11806300000184;BALB/c小鼠,购自北京维通利华实验动物技术有限公司,实验动物许可证号:SCXK(京)2012-0001。D-盐酸青霉胺(D-penicil⁃lamine hydrochloride,D-pen),美国Mp Biomedi⁃cals公司,批号151806;链脲佐菌素(streptozoto⁃cin,STZ)(批号S0130)、植物血凝素(phytohae⁃magglutinin,PHA)(批号L1668)和脂多糖(lipo⁃polysaccarides,LPS)(批号L4391),美国Sigma公司;PANSORBIN®细胞〔金黄色葡萄球菌细胞(Staphylococcus aureus cells,SAC)〕(批号507858),美国Millipore公司;抗小鼠流式检测抗体:APC-CD45(103112),FITC-CD3(100203),APC-B220(103311),APC-CD4(100411)和PE/ Cy5-CD8a(100709)为美国Biolegend产品;抗人流式检测抗体:FITC-CD45(555482),PE-CD19(555413),FITC-CD3(347344),APC-CD4(317415)和PE-CD8a(340046)为美国BD Biosciences产品;部分人脐带血由济南赛尔生物科技有限公司惠赠。AB135-S型分析天平,瑞士梅特勒公司;Minispin型离 心机 ,德 国 Appendorf公司 ;CYT-1000型细胞计数仪,美国CytoreconTM公司;RS2000型X-ray生物学辐照仪,美国Rad Source公司。
1.2 hu-NPG小鼠的构建和筛选
取采集好的人脐带血样品,分别用无菌PBS溶液稀释2倍,缓慢加入预装15 mL淋巴细胞分离液的离心管液面上,室温下500×g离心25 min;收集单个核细胞富集的液体;加PBS洗涤1次,再用含0.1%BSA的PBS(BSA-PBS)离心洗涤1次后计数。按每2×108细胞加BSA-PBS 300 μL、阻断液100 μL和CD34抗体磁珠100 μL,4 ~8℃保温30 min,期间不断摇动混匀,PBS洗涤,离心。每2×108标记的单个核细胞加入BSA-PBS 0.5 mL使分散成为单细胞悬液。将液体加入置于磁架上的预湿磁珠分离柱内,待液体不再滴落后,用BSA-PBS 0.5 mL洗脱3次。将分离柱从磁铁上取下,放在离心管中,加BSA-PBS 1.0 mL以筒芯推出,收集并计数细胞,备用。
取NPG小鼠35只,X-ray生物学辐照仪照射1.8 Gy。小鼠辐照处理后4 ~24 h内,ip给予三溴乙醇(tribromethanol,Avertin)溶液20 mL·kg-1麻醉。用1 mL精细刻度胰岛素注射器先在小鼠膝关节股骨面向骨髓腔钻孔,然后用另一只相同规格注射器吸取20 μL上述制备的细胞悬浮液,从孔内把人脐带血CD34+细胞注射植入骨髓腔内(每鼠1× 105细胞)。小鼠苏醒后放回笼内,在SPF环境下饲养,观察并记录小鼠的一般状态。
照射处理的NPG小鼠移植人CD34+细胞12周,采血约50 μL放入肝素抗凝的1.5 mL离心管中,分别加入不同荧光标记的抗小鼠或抗人的流式抗体对细胞进行染色。利用BD FACSCalibur流式细胞仪检测分析。以有核细胞群设门,分析小鼠外周血中人CD45+细胞占有核细胞的比例。选择人CD45+细胞>20%的hu-NPG小鼠进行d-PLNA。
1.3 直接腘窝淋巴结试验
NPG,hu-NPG和BALB/c小鼠各10只,每种小鼠均随机分为D-pen和STZ组,每组5只,共6组。每组小鼠右后肢足趾部以75%乙醇消毒,用胰岛素注射器分别皮下注射阳性药物D-pen每只1 mg或STZ每只0.75 mg,给药体积为50 μL,以0.9%生理盐水为溶媒,左侧不做处理。给药后记录小鼠一般状态,用数显游标卡尺测量足趾厚度。给药后7 d,颈椎脱臼法处死小鼠;迅速取出左、右侧腘窝淋巴结(popliteal lymph node,PLN),放入置于冰上盛有1%BSA-PBS的培养皿中,去除脂肪组织,吸干水分,称重。制备单细胞悬液。计算淋巴结质量指数(mass index,MI)和细胞指数(cellularity index,CI)。MI=右侧PLN质量/左侧PLN质量,CI=右侧PLN细胞计数/左侧PLN细胞计数。
1.4 流式检测外周血淋巴细胞增殖
照射处理的NPG小鼠移植人CD34+细胞12周,取肝素抗凝血约100 μL,加入PBS 1 mL,离心去上清,加入红细胞裂解液0.6 mL,作用10 min。加入0.6 mL冲洗液离心去上清;PBS洗涤1次。用1 mL含5 μmol·L-1CFSE荧光染料的PBS悬浮细胞,室温避光15 min。用10 mL PBS洗涤1次。以5 mL含10%胎牛血清的RPMI 1640培养液悬浮细胞;37℃温育30 min。培养液洗涤细胞1次,调细胞密度为1×109L-1。每孔加入100 μL。每份样品接种3孔。一孔加入100 μL培养液稀释的PHA,终浓度为5 mg·L-1;一孔加入100 μL培养液稀释的0.01% PANSORBIN®细胞,终浓度为0.005%;另一空孔加入100 μL培养液作为空白对照。37℃,5%CO2的二氧化碳培养箱中孵育72 h;收集细胞,加入抗CD45或CD19流式抗体,BD FACSCalibur流式细胞仪检测分析人CD45+细胞在PHA刺激下有无CFSE荧光强度的倍减,及人CD19+B细胞在SAC刺激下有无CFSE荧光强度的倍减,计算荧光强度倍减细胞的比例。同样检测BALB/c和空白NPG小鼠外周血的淋巴细胞增殖,刺激B细胞的丝裂原为LPS 50 mg·L-1。
1.5 脏器系数和病理学检查
各组小鼠均于给药前和处死前称量体质量。给药后每日用游标卡尺测量足趾厚度。摘取心、肝、脾和肾等器官织称重,计算脏器系数〔脏器湿重(g)/动物体质量(g)×100〕。组织病理学检查时,标本迅速投入4%中性多聚甲醛溶液中固定,石蜡包埋、手动轮转切片机制片,切片厚度3 μm,常规HE染色,光学显微镜下观察。
1.6 统计学分析
结果数据用x±s表示,采用SPSS11.5软件进行统计学分析,组间比较采用t检验。与对照侧比较出现统计学差异(P<0.05)且平均MI≥2或平均CI≥5时为PLNA反应阳性。
2 结果
2.1 hu-NPG小鼠外周血淋巴细胞表型分析
35只NPG小鼠照射并移植人脐血来源的CD34+造血干细胞,至实验结束存活率为85.7%(5只小鼠因照射死亡),存活小鼠的一般状态良好。移植后12周,流式细胞术检查可见26只小鼠外周血有核细胞中可见人CD45+阳性细胞,提示这些小鼠体内不同程度地重建了人的免疫系统,其中10只小鼠人CD45+阳性细胞数>20%(29.8±4.7)%,达到本研究预定的hu-NPG小鼠标准。
10只hu-NPG小鼠外周血人源和鼠源T、B淋巴细胞表型分析发现,人的淋巴细胞以CD45+CD19+的B细胞为主,约为(75.5±6.6)%,CD45+CD3+T细胞占(17.1±6.6)%,其中CD45+CD3+CD4+T细胞为(11.6±3.7)%和CD45+CD3+CD8+T为细胞(5.5±3.1)%,即人T细胞的比例仅为hu-NPG小鼠外周血有核细胞总数的(5.0±1.7)%。同时,hu-NPG小鼠体内也含有少量的鼠源性CD3+T和B220+B细胞,二者占有核细胞的比例分别约为(3.6±2.7)%和(0.1±0.2)%,这与NPG小鼠体内鼠源性CD3+T(2.34±0.49)%和B220+B(0.40± 0.28)%占有核细胞的比例基本接近,但显著低于BALB/c小鼠(P<0.01)(图1)。
2.2 d-PLNA小鼠一般状态、脏器系数、组织病理和足趾厚度的变化
表1数据显示,足趾部sc给予两种阳性药物后7 d,NPG,hu-NPG和BALB/c小鼠一般状态良好。与给药前比较,同种小鼠之间体质量比较未见明显改变,且其心、肝和肾的湿重及脏器系数组间未见明显差异。但NPG和hu-NPG小鼠的脾系数明显低于BALB/c小鼠(P<0.01),且hu-NPG小鼠的脾系数显著高于NPG小鼠(P<0.01)。组织病理学检查发现,NPG小鼠脾缺乏脾小体和动脉周围淋巴鞘,细胞密度明显减少,白髓和红髓分界模糊。尽管hu-NPG小鼠脾淋巴细胞数量比BALB/c小鼠少,但比NPG小鼠明显增多,且有明显的脾白髓重建形成(图2)。
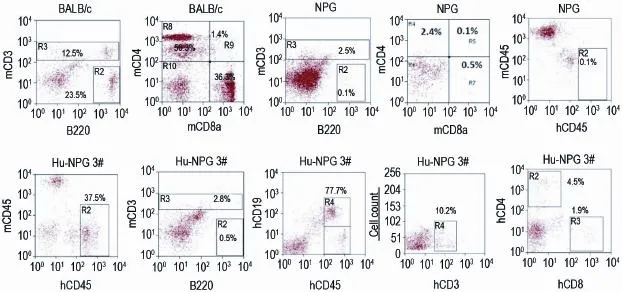
Fig.1 Phenotype analysis of human or mouse derived lymphocytes in peripheral blood from humanized NPG mice with reconstituted immune system(hu-NPG),NPG and BALB/c mice.

Tab.1 Effect of D-pen and STZ treatment on body mass and organ coefficient in different strains of mice
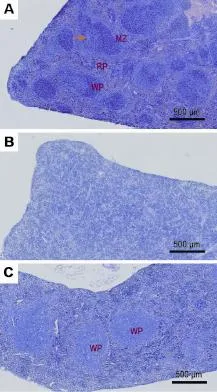
Fig.2 Histopathology of spleen in direct popliteal lymph node assay(d-PLNA)in different strains of mice.See Tab.1 for the mouse treatment.A:spleen of normal BALB/c mice;B:spleen of NPG mice,lack of white pulp;C:spleen of hu-NPG mice,reconstitution ofwhitepulp.WP:white pulp;RP:red pulp;MZ:marginal zone.The arrow indicates periarterial lymphatic sheath around the central artery.
给药局部观察显示(图3),各组给药前足趾部厚度左、右后肢无显著差异;给药后前4 d,与对照侧比较,给药侧足趾厚度明显肿胀增厚(P<0.05,P<0.01),主要表现为局部急性炎症反应,且BALB/c小鼠右侧测量数值明显大于NPG或hu-NPG小鼠右侧数值(P<0.01),随时间延长,局部炎症逐渐消退,至给药后6 d时,给药局部已基本恢复正常,与左侧比较无显著差异。
2.3 阳性药物注射后的d-PLNA

Fig.3 Effect of STZ(A)and D-pen(B)on thickness of lateral hind foot pad in direct popliteal lymph node assay in different strains of mice.See Tab.1 for the mouse treatment.*P<0.05,**P<0.01,compared with control lateral hind foot pad.
阳性药物D-pen和STZ注射后,BALB/c小鼠出现典型的d-PLNA阳性反应,表现为与对照侧比较,给药侧PLN体积明显增大,质量增加(P<0.05)且组平均MI≥2(表2)。细胞计数发现,阳性对照药可致PLN细胞增生,数量增多,细胞大小不一致,PLN单细胞悬液中可见体积较大的转化淋巴细胞,给药侧淋巴结细胞数量比对照侧显著增多(P< 0.05),组平均CI≥5(表3,图4)。显微镜观察可见,未给药侧BALB/c小鼠PLN的皮质、副皮质区与髓质界线清楚,不含或很少淋巴滤泡,无明显生发中心;副皮质区内高内皮小静脉(high endothelial ven⁃ule,HEV)较小,内皮低矮,腔内几乎不含细胞成分;髓质不含或含有很少数量的组织细胞、小淋巴细胞、浆细胞和肥大细胞。与前期实验结果相同,STZ或D-pen均可致BALB/c小鼠给药侧PLN淋巴滤泡数量增加,生发中心明显,致使PLN表面呈凹凸不平状;细胞密度和HEV横断面增多,HEV的上皮呈高柱状凸入血管腔中,且腔内含有较多的淋巴细胞(图5A,B)。NPG及hu-NPG小鼠给药侧,对照侧PLN未见差异,二者均体积较小,仅为正常BALB/c小鼠的约1/3,辨认困难,易遗漏。镜下检查发现,PLN缺乏正常的组织结构,皮髓质分界不清且表面光滑,淋巴结发育不完善(图4,图5C)。提示D-pen和STZ不能诱导NPG及hu-NPG小鼠产生d-PLNA阳性反应。

Tab.2 Average popliteal lymph node(PLN)mass index(MI)of different mice

Tab.3 Average PLN cellularity index(CI)of different mice

Fig.4 Volume and lymphocyte changes of PLN in d-PLNA in different strains of mice.A:the photos from left to right are 2 PLN of NPG mice treated with STZ,hu-NPG mice treated with STZ,BALB/c mice treated with D-pen and BALB/c mice treated with STZ,respectively.Upper:treated lateral PLN;lower:control lateral PLN.The arrow indicates enlarged treated lateral PLN with STZ in BALB/c mice.B:cell counting of control lateral PLN in BALB/c mice;C:cell counting of STZ treated lateral PLN in BALB/c mice.The arrow indicates enlarged lymphocyte.
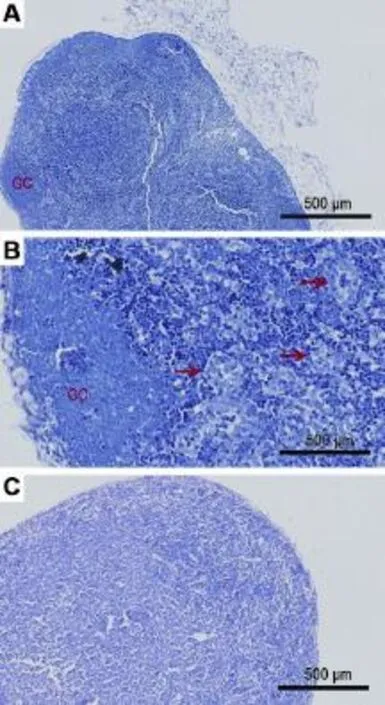
Fig.5 Histopathology of PLN in direct popliteal lymph node assay in different strains of mice.GC:germinal center.A:STZ treated lateral PLN of BALB/c mice,positive PLNA responses;B:same lymph node as Fig.A,lymphoid follicle formation and high endothelial venule(HEV)increase(arrow). There were obvious lymphocytes in HEV;C:STZ treated lateral PLN of hu-NPG mice,lack of lymphoid tissue.
2.4 丝裂原不能刺激NPG和hu-NPG小鼠外周血中人源或鼠源性淋巴细胞增殖

Fig.6 Lymphocyte transformation in hu-NPG mice. Lymphocytes were incubated with PHA 5 mg·L-1or 0.005% PANSORBIN®cells for 72 h.

Fig.7 Lymphocyte transformation in BALB/c mice and NPG mice.Lymphocytes were incubated with PHA 5 mg·L-1or LPS 50 mg·L-1for 72 h.
图6结果显示,hu-NPG小鼠的外周血人CD45+或CD19+单核细胞的CFSE荧光强度减弱,细胞的比例分别为(1.2±0.7)%和(0.5±0.3)%,与未加丝裂原刺激的细胞对照组比较未见显著性差异(n=5),提示丝裂原未能刺激hu-NPG小鼠的外周血人源性淋巴细胞发生明显增殖。图7结果显示,NPG小鼠外周血鼠源CD45+单核细胞的CFSE荧光强度减弱,细胞的比例分别为(1.3±0.6)%和(1.8±1.3)%,与未加丝裂原刺激的细胞对照组比较未见显著性差异(n=5)。而BALB/c小鼠外周血鼠源性CD45+单核细胞与PHA或LPS共孵育72 h后,CFSE荧光强度减弱,细胞的比例分别为(2.9± 0.6)%和(12.4±1.8)%,与未加丝裂原刺激的对照组比较显著增加(n=5,P<0.01),表明丝裂原可刺激BALB/c小鼠淋巴细胞产生明显的增殖反应。提示BALB/c小鼠体内淋巴细胞功能正常,但NPG和hu-NPG小鼠外周血中无论是人源还是鼠源性淋巴细胞的功能均有缺陷。
3 讨论
小分子药物所致的DHR目前尚无公认有效的预测方法。对于静脉给药的这些化合物,国际上通常应用PLNA研究评价其致敏性潜能,被公认为是目前唯一可靠的致敏性检测方法[9]。根据给药处理方式的不同,PLNA可分为d-PLNA、间接PLNA等多种类型。其中d-PLNA周期短,操作简单,实验结果与人临床DHR间具有较好的一致性和可重复性,最有可能通过验证而广泛用于全身给药新药的DHR筛选和研究。然而d-PLNA阳性反应的机制不清楚,易产生假阴性结果,不易区分免疫机制介导的反应和刺激性因素引起的炎症反应,妨碍了d-PLNA结果的外推至人。已证实,对氨基苯可诱导严重的DHR,却不能诱发d-PLNA阳性反应,而非致敏物丙酮或乙醇却能诱导明显的d-PLNA阳性反应[10-14]。因此,d-PLNA作为常规评价方法还需要进一步的发展和完善。近年来应用人源化动物对药物进行快速、准确的毒性测试取得了较大进展[15-16],但尚无人源化小鼠用于d-PLNA的报道。
NOD-PrkdcscidIl2rgnull小鼠由于突变基因而影响到自身淋巴细胞的分化和发育,但是其淋巴细胞发育微环境正常,成为目前国际公认的免疫缺陷程度最高、最适合人源细胞移植的工具小鼠,为在小鼠体内重建人的免疫系统和功能奠定了基础[17]。NPG小鼠是北京维通达生物技术有限公司自主研发的同类小鼠。为了消除种属差异,提高临床前预测DHR的能力及阐明d-PLNA反应机制,本研究将人脐血CD34+造血干细胞移植入照射后NPG小鼠体内,以期在免疫缺陷小鼠体内重建人的免疫系统和功能。实验结果证实,接受人脐血移植的小鼠外周血中可检测到人CD45+白细胞表型,且有人的B和T细胞分化,表明hu-NPG小鼠模型复制成功。但hu-NPG小鼠体内的人源性细胞以B细胞为主,T细胞仅为少数(约5%)。而正常人外周血中以T为主,B细胞仅占淋巴细胞总数的10% ~20%,这种明显差异提示hu-NPG小鼠重建的免疫系统与人的免疫系统之间存在较大差异。进一步利用淋巴细胞增殖实验检测hu-NPG小鼠体内人源化T和B细胞的功能发现,PHA和SAC均不能诱导人源性细胞发生明显增殖反应,表明这些淋巴细胞尽管具有人淋巴细胞的表面标志物,但免疫功能却不完善,这可能与该小鼠缺乏主要组织相容性复合体分子,T细胞不能在胸腺选择成熟有关[17]。同时也发现NPG小鼠和hu-NPG小鼠的外周血内含有少量鼠源性T和B细胞,但这些鼠源性T和B细胞也均不能对有丝分裂原刺激产生增殖反应。上述结果表明hu-NPG小鼠的免疫功能不全。这与重建具有一定人免疫功能的人源化小鼠还需提供人淋巴细胞发育相关因子的文献报道相一致[17-20]。鉴于缺乏有效免疫功能,提示hu-NPG小鼠不能对药物产生特异性的免疫应答反应。
1981年Gleichmann等[21]首次将苯妥英注射入小鼠足趾部发现,PLN产生与移植物抗宿主反应相似的病变,由此开始了PLNA在DHR研究中的应用。不同实验室间已经用PLNA检测了130余个已知具有致敏性的小分子化合物,获得了较好的实验结果。PLNA以药物在致敏诱导阶段局部引流淋巴结细胞的增殖为观察终点。因此,动物的免疫功能或局部炎症反应可以影响PLNA反应。前期我们已经成功建立了BALB/c小鼠d-PLNA模型,并研究了中药注射剂的致敏性[8,22-23]。本研究进一步利用可致敏的阳性药物在hu-NPG小鼠中复制d-PLNA模型,观察比较其与NPG小鼠和BALB/c小鼠的反应差异。分别以STZ和D-pen为阳性药物,是因为它们可分别诱导Th1和Th2型免疫反应,利于进一步利用报告抗原PLNA阐明药物引起d-PLNA阳性反应的发生机制[24-25]。研究结果显示,BALB/c,NPG和hu-NPG小鼠足趾部注射阳性药物后,小鼠一般状态良好,给药前后体质量没有明显变化。尽管因年龄、种系差异,BALB/c,NPG和hu-NPG小鼠的体质量有一定差异,但其心、肝、肾的脏器系数之间比较未见统计学差异,结合病理组织学检查未见异常,表明阳性药物无全身毒性作用。给药局部观察显示,实验结束时局部炎症反应消失,足趾厚度恢复正常,表明本试验的阳性反应与炎症刺激无关,即所选的剂量不会产生明显的局部刺激。上述结果表明,本研究的剂量和时间选择符合d-PLNA要求。实验结果表明,阳性药物可引起BALB/c小鼠产生显著的d-PLNA反应,但却不能诱导NPG和hu-NPG小鼠产生阳性反应。结合前述淋巴细胞增殖实验结果,表明STZ和D-pen所致小鼠d-PLNA反应与体内淋巴细胞的数量和功能密切相关,缺少淋巴细胞或淋巴细胞功能不正常均不能诱导d-PLNA阳性反应。故这种hu-NPG小鼠尚不适用于d-PLNA。最近有文献报道,免疫缺陷小鼠同时移植人胚胎胸腺组织和肝组织或敲入人细胞因子基因可产生具有一定功能的T细胞,并可产生T细胞介导的迟发型超敏反应[17-18],这为进一步完善d-PLNA提供了新模型动物。
实验还发现,NPG和hu-NPG小鼠脾系数明显低于BALB/c小鼠,且肉眼检查可见NPG小鼠和hu-NPG小鼠的脾均显著小于BALB/c小鼠。组织病理学检查可见,NPG小鼠脾缺乏脾小体和动脉周围淋巴鞘,细胞密度明显减少,白髓和红髓分界模糊,这与这些小鼠的自身免疫系统功能缺陷有关。值得注意的是,hu-NPG小鼠的脾系数尽管低于正常BALB/c小鼠,但却显著大于NPG小鼠,脾细胞数量尽管比BALB/c小鼠少,但比NPG小鼠明显增多,且有脾小体和动脉周围淋巴鞘形成。考虑到NPG和hu-NPG小鼠淋巴结大小未见区别,提示hu-NPG小鼠脾的免疫结构或功能重建比淋巴结重建更完善。事实上,已有一些实验证实免疫缺陷小鼠脾内人造血细胞出现多系重建,可检测到人CD45+,CD4+和CD8+表达细胞[18,20]。因为脾可以认为是静脉给药的引流淋巴结,静脉给药是否较易引起hu-NPG小鼠脾发生免疫应答反应,尚需进一步验证。
[1]Pirmohamed M,Ostrov DA,Park BK.New genetic findings lead the way to a better understanding of fundamental mechanisms of drug hypersensitivity[J].J Allergy Clin Immunol,2015,136(2):236-244.
[2]Makowska JL,Lewandowska-Polak A,Kowalski ML. Hypersensitivity to aspirin and other NSAIDs:diag-nostic approach in patients with chronic rhinosinus itis[J].Curr Allergy Asthma Rep,2015,15(8):47.
[3]Duranfigueroa N,Badillocorona JA,Naisbitt DJ,Castrejonflores JL.Towards the development of mechanism-based biomarkers to diagnose drug hypersensitivity[J].Toxicol Res,2015,4(4):777-795.
[4]Ratajczak HV.Drug-induced hypersensitivity:role in drug development[J].Toxicol Rev,2004,23(4):265-280.
[5]Pichler WJ.Immune mechanism of drug hypersen⁃sitivity[J].Immunol Allergy Clin North Am,2004,24(3):373-397.
[6]Ebo DG,Leysen J,Mayorga C,Rozieres A,Knol EF.Thein vitrodiagnosis of drug allergy:status and perspectives[J].Allergy,2011,66(10):1275-1286.
[7]Liu ZH,Liu ZP,Zhou GY.Application of popliteal lymph node assay in study of drug hypersensitivity[J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2009,23(1):70-75.
[8]Liu Z,Liu Z,Shi Y,Zhou G.Evaluation of the immunosensitizing potential of chlorogenic acid using a popliteal lymph node assay in BALB/c mice[J].Food Chem Toxicol,2010,48(4):1059-1065.
[9]Tuschl H,Landsteiner HT,Kovac R.Application of the popliteal lymph node assay in immunotoxicity testing:complementation of the direct popliteal lymph node assay with flow cytometric analyses[J].Toxicology,2002,172(1):35-48.
[10]Aida T,Kimura T,Ishikawa N,Shinkai K.Evaluation of allergenic potential of low-molecular compounds by mouse popliteal lymph node assay[J].J Toxicol Sci,1998,23(5):425-432.
[11]Løvik M,Alberg T,Nygaard UC,Samuelsen M,Groeng EC,Gaarder PI.Popliteal lymph node(PLN)assay to study adjuvant effects on respiratory allergy[J].Methods,2007,41(1):72-79.
[12]Ravel G,Descotes J.Popliteal lymph node assay:facts and perspectives[J].J Appl Toxicol,2005,25(6):451-458.
[13]Gutting BW,Schomaker SJ,Kaplan AH,Amacher DE. A comparison of the direct and reporter antigen popliteal lymph node assay for the detection of immunomodulation by low molecular weight com⁃pounds[J].Toxicol Sci,1999,51(1):71-79.
[14]Shinkai K,Nakamura K,Tsutsui N,Kuninishi Y,Iwaki Y,Nishida H,et al.Mouse popliteal lymph node assay for assessment of allergic and autoimmunity-inducing potentials of low-molecular-weight drugs[J].J Toxicol Sci,1999,24(2):95-102.
[15]Kalscheuer H,Danzl N,OnoeT,FaustT,Winchester R,Goland R,et al.A model for per⁃sonalizedin vivoanalysis of human immune respon⁃siveness[J].Sci Transl Med,2012,4(125):125ra30.
[16]Zhang B,Duan Z,Zhao Y.Mouse models with human immunity and their application in biomedical research[J].J Cell Mol Med,2009,13(6):1043-1058.
[17]Liu K,Fang RG,Li HB,Yang WF,Miao ZC,Wen JH,et al.Efficient derivation of embryonic stem cells from NOD-scid Il2rg(-/-)mice[J].Pro⁃tein Cell,2015,6(12):916-918.
[18]Rajesh D,Zhou Y,Jankowska-Gan E,Roenneburg DA,Dart ML,Torrealba J,et al.Th1 and Th17 immuno⁃competence in humanized NOD/SCID/IL2r gamma(null)mice[J].Hum Immunol,2010,71(6):551-559.
[19]Martinez-Torres F,Nochi T,Wahl A,Garcia JV,Denton PW.Hypogammaglobulinemia in BLT humanized mice-an animal model of primary anti⁃body deficiency[J].PLoS One,2014,9(10):e108663.
[20]Shultz LD,Lyons BL,Burzenski LM,Gott B,Chen X,Chaleff S,et al.Human lymphoid and myeloid cell development in NOD/LtSz-scid IL2R gamma(null)mice engrafted with mobilized human hemopoietic stem cells[J].J Immunol,2005,174(10):6477-6489.
[21]Gleichmann H.Studies on the mechanism of drug sensitization:T-cell-dependent popliteal lymph node reaction to diphenylhydantoin[J].ClinImmunol Immunopathol,1981,18(2):203-211.
[22]Liu ZH,Cheng F,Zhou GY.Study on the sensitizing potential of Shuanghuanglian injection using popliteal lymph node assay in C57BL/6J mice[J].Chin J Integrated Tradit Chin West Med(中国中西医结合杂志),2010,30(1):64-67.
[23]Wang HH, Liu ZP.Establishmentof popliteal lymph node assay model and application to evalua⁃tion of Qingkailing Injection sensitivity[J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2012,26(2):183-188.
[24]Choquet-Kastylevsky G, Descotes J. Popliteal lymph node responses to acetone and ethanol differ from those induced by streptozotocin[J].Arch Toxicol,2004,78(11):649-654.
[25]Nierkens S,Pieters R.The Reporter Antigen Popliteal Lymph Node Assay[M]∥Current Protocols in Toxicol⁃ogy.New Jersey.John Wiley&Sons Inc.,2006:557-559.
Positive reaction of direct popliteal lymph node assay isn′t induced in humanized NPG mice with reconstituted immune system
GUO Yan-ru1,ZENG Fan-guang1,YAO Jing-chun2,SUN Rong3,LIU Zhao-hua1
(Center for New Drug Evaluation School,of Pharmaceutical Sciences of Shandong University,Jinan 250012,China;2.Lunan Pharmaceutical Group Co.,Ltd.,Linyi 273400,China;3.Shandong Academy of Chinese Medicine,Jinan 250014,China)
OBJECTIVE To perform direct popliteal lymph node assay(d-PLNA)induced by D-penicillamine hydrochloride(D-pen)or streptozotocin(STZ)in humanized NPG(hu-NPG)mice with a reconstituted immune system,NPG mice and BALB/c mice respectively,and to compare the responses in these mice to elucidate the mechanism of d-PLNA.METHODS Female NPG mice were ir⁃radiated and transplanted with human hematopoietic stem cells isolated from cord blood to form hu-NPG mice.The number and function of peripheral blood lymphocytes in hu-NPG mice were detected by flow cytometry and lymphocyte proliferation test.The hu-NPG,NPG and BALB/c mice were randomly divided into D-pen group and STZ group(5 mice per group),respectively.Then,the positive chemical D-pen(1 mg per mouse)or STZ(0.75 mg per mouse)was injected subcutaneously into the right hind footpad of these mice using the established d-PLNA protocol.On the 7thday after injection,the mice were sacrificed.The bilateral popliteal lymph nodes(PLNs)were weighed.The difference of d-PLNA response was evaluated at 7 d after the injection of positive drugs.RESULTS All the NPG,hu-NPG and BALB/c mice behaved normally after the injection of positive drugs.No systemic toxicity was observed.The symptom of local irritation disappeared within 7 d.As in previous studies,the BALB/c mice showed a typical positive response of d-PLNA,as evidenced by the increase in both mass and cell count of the PLNs in the treated lateral(mass index>2 and cellularity index>5),while NPG mice and hu-NPG mice showed a negative resoponse.Pathological examinations demonstrated that the PLNs of NPG mice and hu-NPG mice had developmental defect in lymphoid tissue and were smaller in size than BALB/c mice.Phenotypic analysis of the peripheral blood lymphocytes in hu-NPG mice showed that the majority of human lymphocytes expressed B cell markers CD45+CD19+(75.5±6.6)%,and only about(17.1±6.6)%of the lymphocytes expressed T cell markers CD45+CD3+.There were few lymphocytes in NPG mice.In addition,these cells did not proliferate with mitogen stimulation in the lymphocyte proliferation test.CONCLUSION The d-PLNA reaction induced by D-pen or STZ in mice is closely related to the number and normal function of lymphocytesin vivo.Negative d-PLNA reaction results from a lack of normal lymphocytes in NPG mice or from defected human lymphocyte function in hu-NPG mice.Thus hu-NPG mice are currently not suitable for d-PLNA.
drug hypersensitivity reaction;direct popliteal lymph node assay;humanized mice
LIU Zhao-hua,E-mail:liuzhaohua@sdu.edu.cn,Tel:(0531)88382186
R967
A
1000-3002-(2016)08-0839-09
10.3867/j.issn.1000-3002.2016.08.007
Foundation item:The project supported by Shandong Provincial Natural Science Foundation(ZR2012HM056);and Shandong Provincial Independent Innovation and Transformation of Achievements Foundation(2014ZZCX02104)
2015-10-23接受日期:2016-07-15)
(本文编辑:齐春会)
山东省自然科学基金(ZR2012HM056);山东省自主创新及成果转化专项(2014ZZCX02104)
郭岩乳,女,硕士研究生,主要从事药物免疫毒性研究;刘兆华,男,高级工程师,硕士生导师,主要从事药物免疫毒性和毒性病理学研究。
刘兆华,E-mail:liuzhaohua@sdu.edu.cn,Tel:(0531)88382186
