黄药子水提物对小鼠肝毒性及其线粒体ATP酶和超氧化物歧化酶的抗氧化机制
2016-02-14侯红平张广平杨依霏马丽娜叶祖光
齐 静*,侯红平*,张广平,杨依霏,马丽娜,杨 红,叶祖光
(1.辽宁师范大学生命科学学院,辽宁大连 116000;2.中国中医科学院中药研究所,北京 100700)
·中药毒理学前沿—消化系统毒性·
黄药子水提物对小鼠肝毒性及其线粒体ATP酶和超氧化物歧化酶的抗氧化机制
齐 静1*,侯红平2*,张广平2,杨依霏2,马丽娜2,杨 红1,叶祖光2
(1.辽宁师范大学生命科学学院,辽宁大连 116000;2.中国中医科学院中药研究所,北京 100700)
目的 探讨黄药子水提物(WED)对小鼠肝毒性,以及线粒体三磷酸腺苷(ATP)酶和超氧化物歧化酶(SOD)的抗氧化作用机制。方法 雄性ICR小鼠分别ig给予WED 19.6,28.0和40.0 g·kg-1连续给药14 d,检测肝系数,血清中碱性磷酸酶(ALP)、谷丙转氨酶(GPT)和谷草转氨酶(GOT)活性,肝组织中ATP、活性氧(ROS)和脂质过氧化物丙二醛(MDA)的含量以及总SOD酶活性;同时,检测肝组织线粒体Na+-K+-ATP酶、Ca2+-Mg2+-ATP酶和Mn2+-SOD酶活性。结果 与正常对照组相比,WED 28.0和40.0 g·kg-1组小鼠肝系数升高(P<0.01),WED 40.0 g·kg-1组小鼠血清中ALP,GPT和GOT活性增加(P<0.05),WED 19.6,28.0和40.0 g·kg-1组小鼠肝组织ATP含量降低(P<0.01),MDA和ROS含量升高(P<0.05);WED 40.0 g·kg-1组肝线粒体Na+-K+-ATP酶和Ca2+-Mg2+-ATP酶活性降低(P<0.05),Mn2+-SOD酶活性升高(P<0.05)。结论WED引起小鼠肝损伤的机制与ATP合成减弱、线粒体抗氧化损伤增强等相关,线粒体损伤可能是黄药子造成肝毒性的重要作用机制。
黄药子;肝毒性;线粒体;氧化损伤
黄药子原名黄独,始载于《唐本草》;《本草图经》名黄药子,《本草纲目》称之为木药子、大苦[1],为薯蓣科植物黄药子(Dioscorea bulbiferaL.)块茎,对甲状腺疾病和癌症的疗效尤为明显。近年来对黄药子水提物的毒副作用尤其是肝毒性屡有报道,在临床使用不当可引起肝功能异常[2-3]。研究表明,黄药子可引起急性中毒,长期服用可引起肝窦扩张淤血,肝细胞呈空泡样变和气球样变,汇管区可见淋巴细胞的浸润[4-5]。临床上,黄药子煎汤内服常用量为每天生药3 ~9 g·kg-1体质量[6],大多数患者在服用黄药子总量达500 ~1500 g后出现不良反应,以肝炎症状较为常见[7]。
目前,国内外研究认为,黄药子配伍甘草或当归能有效地减轻肝毒性,显著增强体外肝细胞存活率[8]。卓实等[9]研究报道,黄药子能明显抑制肝细胞线粒体呼吸链复合物Ⅰ和Ⅳ的活性,通过甘草配伍黄药子能缓解这种抑制作用,表明其可通过抑制呼吸链复合物酶的活性引起肝中毒,配伍甘草则毒性减弱。黄药子造成肝损伤的机制主要集中在肝细胞膜的氧化损伤和肝在药物代谢过程中生物转化功能异常[10]。线粒体为肝细胞代谢脂质提供能量,是肝细胞代谢的中枢,肝中许多重要的代谢途径均依赖线粒体的完整功能来实现。本研究以黄药子水提物ig给予小鼠,研究其水提物对小鼠肝毒性的作用,并以线粒体抗氧化作用为切入点研究其肝毒性的作用机制。
1 材料与方法
1.1 动物、药物、试剂和主要仪器
SPF级雄性ICR小鼠,体质量20 ~22 g,购自北京维通利华实验动物技术有限公司,动物许可证号:SCXK(京)2013-0001。饲养环境:人工光照12 h明暗周期,温度控制在20 ~26℃范围,相对湿度控制范围为40% ~70%。所有动物实验操作符合中国中医科学院中药研究所的动物伦理。
黄药子购于北京仟草中药饮片有限公司,产地湖南,生产批号140120002,经中国中医科学院中药所生药室鉴定为黄药子(D.bulbiferaL.)。黄药子水提物(water extraction ofD.bulbiferaL.,WED)的制备在文献[11]的基础上有所改动,具体方法为:将黄药子干燥块茎饮片加8倍量的水(质量kg:体积L),常温浸泡4 h,加热煎沸20 min,4层纱布过滤得滤液;药渣再加5倍量的水加热煮沸20 min,4层纱布过滤得滤液;将2次滤液合并加热浓缩至2 kg·L-1(按生药量计算),4℃保存备用。
碱性磷酸酶(alkaline phosphatase,ALP)试剂盒(货号:A059-2)、谷丙转移酶(glutamic-pyruvic transaminase,GPT)试剂盒(货号:C009-2)和谷草转氨酶(glutamic-oxaloacetic transaminase,GOT)试剂盒(货号:C010-2),ATP酶测试盒(货号:A016-1)和Cu-Zn、Mn及总超氧化物歧化酶(superoxide dismutase,SOD)分型测试盒(羟胺法)(货号:A001-2)均由南京建成生物工程研究所提供。三磷酸腺苷(adenosine triphosphate,ATP)含量测试剂盒(货号:A095)、丙二醛(malondialdehyde,MDA)检测试剂盒(货号:S0131)、活性氧(reactive oxygen species,ROS)测试盒(货号:E004)和组织线粒体分离试剂盒(货号:C3606)均由碧云天生物技术研究所提供。
Thermo Varioskan Flash多功能酶标仪(Thermo Fisher Scientific,美国);40FR全自动生化测试仪(东芝,日本);DM2000Leica显微镜(Leica,德国)。
1.2 小鼠分组及给药
36只雄性ICR小鼠,正常饮食适应性喂养3 d,按体质量随机分为4组:正常对照组(给予同等体积蒸馏水)及WED 19.6,28.0和40.0 g·kg-1组;每组9只,ig给药,连续14 d。参照《药典》的无毒剂量、低剂量以及动物的最大给药剂量设计剂量[1]。
1.3 肝系数测定
于末次给药24 h后(禁食不禁水12 h)称取小鼠体质量,解剖取肝称重,计算肝系数。肝系数=小鼠肝质量(g)/小鼠体质量(g)×100。
1.4 血清ALP,GTP和GOT活性测定
连续ig WED 14 d后,眼眶取血,800×g,4℃离心15 min制备血清,生化仪检测ALP,GPT和GOT活性。
1.5 HE染色观察肝组织病变
取部分肝组织用4%甲醛固定进行组织病理学检查。肝损害病理分为5个等级[12],具体如下:0,汇管区及周围无炎症,小叶内干细胞形态正常,排列规则,结构完整,无炎症;Ⅰ,汇管区有炎症,小叶内轻度变性及少数坏死灶;Ⅱ,汇管区轻度受累,界板破坏范围小,小叶内轻度变性,点、灶状坏死或嗜酸小体;Ⅲ,大部分汇管区受累,界板破坏范围达50%,小叶周边炎症明显,小叶内变性,坏死;Ⅳ,汇管区周围坏死严重,可深达小叶中带,小叶边界严重不齐,叶结构失常,多小叶坏死。
1.6 肝组织中ATP,MDA和ROS含量及总SOD活性测定
取肝组织悬液,参照试剂盒测定肝组织中ATP,MDA和ROS含量以及总SOD活性。ATP和MDA含量以单位质量蛋白的浓度表示,即m(μ)mol·g-1蛋白质;ROS含量以单位质量蛋白的荧光强度表示,即荧光强度·μg-1蛋白质,荧光强度越高,则表示ROS的含量越高;总SOD酶活性以每毫克蛋白质在肝组织反应液中SOD抑制率达50%时所对应的SOD量为一个SOD活性单位,即U·μg-1蛋白,反应肝组织抗氧化能力。
1.7 线粒体中ATP酶活性和Mn2+-SOD酶活性测定
参照碧云天组织线粒体提取试剂盒的方法提取线粒体,参照试剂盒检测线粒体中Na+-K+-ATP酶、Ca2+-Mg2+-ATP酶和Mn2+-SOD的活性。ATP酶活性以每小时每毫克蛋白质分解ATP产生1 μmol无机磷的量为一个ATP酶活性单位,即U·mg-1蛋白质,Mn2+-SOD酶活性以每毫克蛋白质在线粒体反应液中SOD抑制率达50%时所对应的SOD量为一个SOD活性单位,即U·mg-1蛋白质,反映线粒体抗氧化能力。
1.8 统计学分析
本研究结果所有计量资料用x±s表示,应用统计软件SPSS 20.0,组间比较采用单因素方差分析;组间两两比较方差齐性时用LSD方法分析,方差不齐时用Tamhane方法分析。P<0.05认为差异具有统计学意义。
2 结果
2.1 黄药子水提物对小鼠体质量和肝系数的影响
表1结果显示,与正常对照组相比,WED 40.0 g·kg-1组小鼠体质量明显下降(P<0.05),WED 19.6和28.0 g·kg-1组小鼠体质量下降无统计学差异;WED 28.0和40.0 g·kg-1组小鼠肝系数升高(P<0.01),WED 19.6 g·kg-1组小鼠肝系数升高无统计学差异。

Tab.1 Effect of water extraction ofDioscorea bul⁃bifera L(WED)on body mass and hepatic index in mice
2.2 黄药子水提物对小鼠肝组织ALP,GPT和GOT活性的影响
表2结果显示,与正常对照组相比,WED 40.0 g·kg-1组ALP,GPT和GOT活性增加(P< 0.05,P<0.01),而WED 19.6和28.0 g·kg-1组3种酶活性变化无统计学差异。
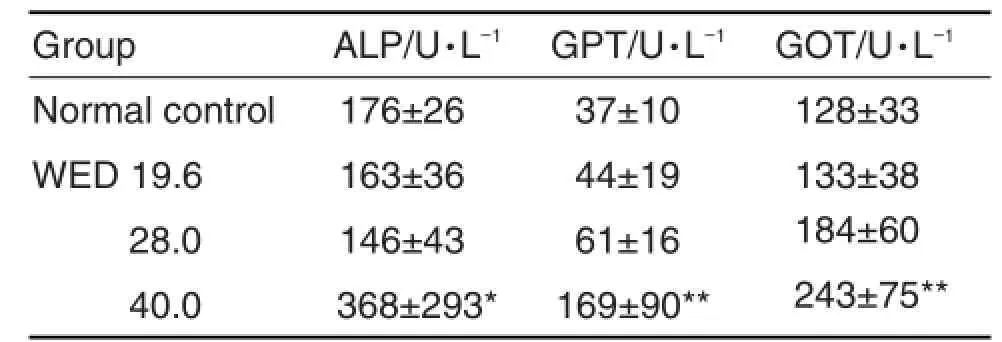
Tab.2Effect of WED on activity of ALP,GPT and GOT in liver tissue of mice
2.3 黄药子水提物对小鼠肝组织结构的影响
图1结果显示,正常对照组和WED 19.6 g·kg-1组小鼠未见肝组织结构异常;WED 28.0 g·kg-1组小鼠肝细胞汇管区出现微小肉芽肿;WED 40.0 g·kg-1组小鼠肝汇管区附近肝细胞局灶性肿胀,胞浆空化,部分肝细胞,细胞形态消失,并出现坏死、纤维轻度增生现象。
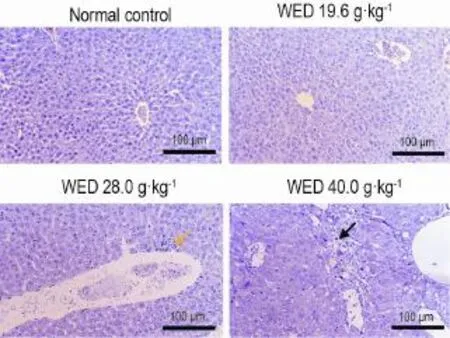
Fig.1 Effect of WED on pathological changes of liver tissue in mice by HE staining.See Tab.1 for the mouse treatment.Black arrow shows tiny granuloma appearing in portal area;Yellow arrow shows swelling,cytoplasm cavitation,necrosis and light hyperplasia in cells near the portal area.
2.4 黄药子水提物对小鼠肝组织ATP、MDA和ROS含量及总SOD活性的影响
表3结果显示,与正常对照组相比,WED 19.6,28.0和40.0 g·kg-1组ATP含量均明显降低(P<0.01);WED 40 g·kg-1组MDA和ROS含量及总SOD活性均升高(P<0.05),提示WED高剂量对肝组织的ATP和氧化损伤的影响较大。
2.5 黄药子水提物对小鼠肝线粒体ATP酶和Mn2+-SOD酶活性的影响
表4结果显示,与正常对照组相比,WED 40.0 g·kg-1组小鼠肝线粒体Na+-K+-ATP和Ca2+-Mg2+-ATP酶活性降低(P<0.01,P<0.05),Mn2+-SOD活性升高(P<0.01);WED 19.6和28.0 g·kg-1组小鼠肝线粒体Ca2+-Mg2+-ATP酶活性下降(P< 0.01),Mn2+-SOD活性升高(P<0.01)。

Tab.3 Effect of WED on content of ATP,MDA and ROS,and activity of T-SOD in mice
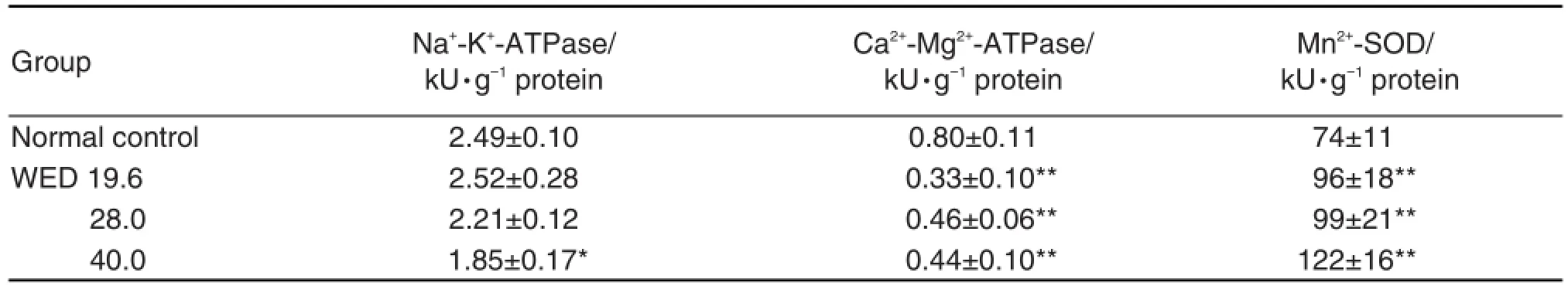
Tab.4 Effect of WED on activity of Na+-K+-ATPase,Ca2+-Mg2+-ATPase and Mn2+-SOD in mitochondria of liver tissue in mice
3 讨论
预实验发现小鼠较大鼠对黄药子肝毒性的敏感性高,因此本研究选择小鼠作为药物毒性的受试动物,这与文献[13]研究报道一致。前期研究发现,吴茱萸水提物诱导了小鼠CYP3A活性,对大鼠CYP3A活性无明显影响,对小鼠肝ALP,GPT和GOT活性的影响更为敏感。本研究结果显示,黄药子水提物对反映肝功能的3项指标均有明显的影响,其中GPT和GOT 2项肝功指标变化更为明显,并且WED 40.0 g·kg-1组肝细胞结构出现病变。
近年来研究发现,线粒体是肝[14]、肾[15]、脑[16]和心[17]等多种脏器毒性的作用靶点,在药物毒性和创新药物安全性评价中起着非常重要的作用。本研究结果表明,黄药子水提物对小鼠的肝产生了损伤,合成ATP的能力减弱。
本研究还发现,黄药子水提物对Na+-K+-ATP酶与Ca2+-Mg2+-ATP酶活性有影响,使酶活性降低。两种酶活性的降低会造成线粒体膜内外离子稳态的失衡,对线粒体结构和功能造成损伤。
线粒体呼吸链电子漏可产生超氧自由基从而形成ROS。研究表明,线粒体呼吸链电子漏是机体≥95%ROS的恒定来源[18]。本研究发现,WED剂量增加会导致ROS含量随之增加。ROS在肝中的增多不仅导致肝细胞中线粒体DNA基因(mtDNA)的损伤,还影响线粒体膜的脂质和蛋白质的稳定性,对线粒体膜造成不可逆的损伤,使线粒体功能发生障碍继而产生更多的ROS,形成一个恶性循环过程[19]。ROS不仅能直接使线粒体电子传递化合物失活,还能间接使线粒体出现功能障碍[20]。
本研究发现,WED 28.0和40.0 g·kg-1组MDA含量增高。龙建纲等[21]报道,MDA对线粒体呼吸链复合物及线粒体内关键酶活性有不同程度的损伤作用,影响线粒体的功能。本研究检测了肝细胞中总SOD活性和线粒体中的Mn2+-SOD活性,表明WED引起肝线粒体的氧化损伤,进而负向调控SOD酶活性的增强。
综上所述,WED可能通过降低肝细胞ATP含量和线粒体ATP酶活性、增强抗氧化损伤等造成肝毒性,线粒体损伤是黄药子造成肝毒性的重要靶点。
[1]Jiangsu New Medical College.Dictionary of Chinese Materia Medica:Vol.2(中药大辞典:下册)[M]. Shanghai:Shanghai Science and Technology Pub⁃lishers,1977:2059-2061.
[2]Shang LQ,Zhang J,Hao WD.Mechanism research of hepatotoxicity of water extraction ofDioscorea bulbiferaL.in mice[J].J Peking Univ:Health Sci(北京大学学报:医学版),2007,39(02):200-202.
[3]Li YJ,Liu SM,Luo MM,Liu HF.The expression and principle study of liver toxicity ofDioscorea bul⁃biferaL.[J].Chin J Exp Tradit Med Form(中国实验方剂学杂志),2005,11(01):40-42.
[4]Song CS,Liu XF,Du YT,Zhao FZ,Wang SH,Ji DG,et al.Preliminary experiments on the liver and kidney toxicity ofDioscorea bulbiferaL.[J].Bull Chin Mater Med(中药通报),1983,8(4):34-36.
[5]Su L,Zhu JH,Cheng LB,Li YH.Experimental pathologicalstudy ofsubacute intoxication byDioscorea bulbiferaL.[J].J Forensic Med(法医学杂志),2003,19(02):81-83.
[6]Wang JT,Chen RS.Dictionary of clinical practical Chinese Materia Medica(临床实用中药辞典)[M]. Beijing:The Golden Shield Press,2003:691-692.
[7]Chen CW.Drug-induced and toxic liver disease:Second Edition[J].Liver(肝脏),2013,18(09):652.
[8]Suo Q.Study on toxicity decrease and effect improvement ofDioscorea dulbiferaand its combi⁃nation withAngelicabased on serum pharmacolo⁃gy of TCM[D].Heilongjiang University of Chinese Medicine(黑龙江中医药大学),2008.
[9] Zhuo S.The study on mechanism of decreasedtoxicity byGlycyrrhiza UralensisFisch.combined withDioscorea BulbiferaRhizome based on the theory of″gan can relieve detoxication″(基于“甘缓解毒”理论的甘草减轻黄药子肝毒性机理研究)[D]. Fujian University of Traditional Chinese Medicine(福建中医药大学),2012.
[10]de Meis L,Arruda AP,da Costa RM,Benchimol M. Identification of a Ca2+-ATPase in brown adipose tissue mitochondria:regulation of thermogenesis by ATP and Ca2+[J].J Biol Chem,2006,281(24):16384-16390.
[11]Zhao LG,Liu RN,Shi L,Li Yue,Xu L.Study on the″dosage-time-toxicity″relationship of hepatotox⁃icity induced by the decoction of Rhizone Dioscorea Bulbifera(airpotato Yam)in mice[J].Pharmacol Clin Chin Mater Med(中药药理与临床),2013,29(4):96-98.
[12]Hu JJ,Cha YF,Zhang X,Zhang GY.Pathological study of liver lesion caused by antitubercular drugs in rats[J].Hebei Med J(河北医药),2007,29(09):911-913.
[13]Zhou L,Xu TT,Jin RM,Yao GT,Mao YC,Hu ZH. A comparative study of effect of Euodiae Fructus decoction on activity of drug-metabolism enzymes in rat and mouse live microsome[J].Chin Pharmacol Bull(中国药理学通报),2014,30(2):279-282.
[14]Guo JB,Peng H,Wang YM,Peng SQ.Signifi⁃cance of mitochondrial toxicity testing in the safety evaluation of innovative drugs[J].Chin New Drugs J(中国新药杂志),2012,21(16):1867-1871.
[15]Zhao NQ,Yu YR,Tan HW.Role of apoptosis and mitochondrial apoptotic pathway in glucolipotoxicityinduced islet β-cell dysfunction[J].J South Med Univ(南方医科大学学报),2008,28(11):2009-2013.
[16]Zheng M,Pan DS,Zhang J,Song DM,Fan SG. Mitochondrial inhibition induces glutamate excito⁃toxicity mediated motor neuron death[J].China J Neurol(中华神经科杂志),2006,39(11):771-775.
[17]Fan Y,Cai LP,Yu CN,Xu D,Lin ZR.Effects of Shenfu decoction,Qifu decoction,Jiangfu decoc⁃tion on cardiomyocyte apoptosis through mitochon⁃drion signaling pathway of cardial injury model induced by adriamycin in rats[J].Chin J Exp Tradit Med Form(中国实验方剂学杂志),2010,16(8):135-138.
[18] Zhang C,Liu J,Pan H,Yang X,Bian K.Mito⁃chondrial dysfunction induced by excess ROS/ RNS and metabolic cardiovascular disease and traditional Chinese medicine intervention[J].China J Chin Mater Med(中国中药杂志),2011,36(17):2423-2428.
[19]Dykens JA,Will Y.The significance of mitochondrial toxicity testing in drug development[J].Drug Discov Today,2007,12(17-18):777-785.
[20]Dong L,He ZY,Wang YL,Dong ZY.Research progress in application of superoxide dismutase(SOD)[J].J Agr Sci Technol(中国农业科技导报),2013,15(5):53-58.
[21]Long JG,Wang XM,Gao HX,Liu CS,Liu Z,Miao MY,et al.Malonaldehyde inhibits respiratory function and enzyme activities in isolated rat liver mitochondria[J].Acad J Second Mil Med Univ(第二军医大学学报),2005,26(10):1131-1135.
Hepatotoxicity and anti-oxidative mechanism of mitochondrial ATPase and superoxide dismutase of Dioscorea bulbifera L.in mice
QI Jing1*,HOU Hong-ping2*,ZHANG Guang-ping2,YANG Yi-fei2,MA Li-na2,YANG Hong1,YE Zu-guang2
(1.School of Life Sciences,Liaoning Normal University,Dalian 116000,China;2.Institute of Chinese Materia Medica,China Academy of Chinese Medical Sciences,Beijing 100700,China)
OBJECTIVE To discuss the effect of hepatotoxicity of water extraction ofDioscorea bulbiferaL.(WED)and anti-oxidative mechanism of mitochondrial adenosine triphosphate(ATP)and superoxide dismutase(SOD).METHODS Thirty-six male ICR mice were divided into four groups:normal control(water),and WED 19.6,28.0 and 40.0 g·kg-1(ig)for 14 d,before the activity of serumalkaline phosphatase(ALP),glutamic-pyruvic transaminase(GPT)and glutamic-oxaloacetic transferase(GOT)was detected.The content of ATP,reactive oxygen species(ROS)and malondialdehyde(MDA)and the activity of total SOD in liver tissue of mice were detected,so were the activities of Na+-K+-ATPase,Ca2+-Mg2+-ATPase and Mn2+-SOD in mitochondria of liver tissue.RESULTS Compared with normal control group,liver indexes of WED 28.0 and 40.0 g·kg-1groups were increased(P<0.01). The activity of serum GPT,GOT and ALP in WED 40.0 g·kg-1group was increased(P<0.05),but the content of ATP in WED 19.6,28.0 and 40.0 g·kg-1groups was decreased(P<0.01).The content of MDA and ROS in WED 40.0 g·kg-1group was increased(P<0.05).The activity of Na+-K+-ATPase and Ca2+-Mg2+-ATPase in WED 40.0 g·kg-1group was decreased in mitochondria of liver tissue(P<0.05),but the activity of Mn2+-SOD was increased(P<0.05).CONCLUSION WED may induce liver injury and the mechanism is possibly related to mitochondria injury by weakening ATP synthesis and oxidative damage.
Dioscorea bulbiferaL.;hepatotoxicity;mitochondria;oxidative damage
s:YE Zu-guang,E-mail:yezuguang@sina.com,Tel:(010)84212805;YANG Hong,E-mail:3410692599@qq.com,Tel:13609848936
R285.1
A
1000-3002-(2016)08-0802-06
10.3867/j.issn.1000-3002.2016.08.002
Foundation item:The project supported by Basic Research of Institute of Chinese Materia Medica of China Academy of Chinese Medical Sciences(ZXKT15023);and National Science and Tehcnology Major Project of China(2014ZX09304307-001)
2016-07-18接受日期:2016-08-19)
(本文编辑:贺云霞)
中国中医科学院中药研究所基本科研业务费自主选题(ZXKT15023);国家科技重大专项(2014ZX09304307-001)
齐 静,女,硕士研究生,主要从事中药安全性及毒性研究;侯红平,女,助理研究员,主要从事中药安全性及毒性研究。
叶祖光,E-mail:yezuguang@sina.com,Tel:(010)84212805;杨 红,E-mail:3410692599@qq.com,Tel:13609848936
*共同第一作者。
*Co-first author.
