补元清脑颗粒对APP/PS1双转基因小鼠学习记忆及Bax、Bcl-2表达的影响
2016-02-10潘怡宏王
潘怡宏王 平
补元清脑颗粒对APP/PS1双转基因小鼠学习记忆及Bax、Bcl-2表达的影响
潘怡宏1王 平2
目的观察补元清脑颗粒对APP/PS1双转基因小鼠学习记忆能力及Bax、Bcl-2表达的影响。方法将40只APP/PS1双转基因小鼠随机分为模型组、多奈哌齐组、补元清脑颗粒高剂量组和低剂量组,每组10只,同月龄相同遗传背景C57BL/6J小鼠10只为空白组。从5月龄开始分别灌胃,1天1次。空白组、模型组均给予等容积生理盐水灌胃。连续灌胃30天后进行Morris水迷宫测试评定各组小鼠学习记忆能力;采用Western Blot法检测小鼠海马组织Bax、Bcl-2蛋白的表达。结果与模型组比较,补元清脑颗粒高、低剂量组均可减少小鼠Morris水迷宫测试的上平台潜伏期[(37.90±20.10)s比(66.98±21.00)s,P<0.01;(47.65±22.93)s比(66.98±21.00)s,P<0.05]、减少游泳总路程[(414.94±171.10)cm、(559.72±178.76)cm比(1032.12±118.66)cm,P<0.01]和第一次抵原平台时间[(21.36±20.22)s、(27.82±21.96)s比(51.71±20.96)s,P<0.01],增加穿越平台次数[(5.90±1.60)次比(1.80±1.41)次,P<0.01;(4.60±1.71)次比(1.80±1.41)次,P<0.05]和目标象限时间[(17.71±7.58)s、(14.07±7.08)s比(5.55±4.42)s,P<0.01],增加小鼠海马组织Bcl-2蛋白相对表达量(0.52±0.07比0.15±0.06,P<0.01;0.42±0.06比0.15±0.06,P<0.05)。结论补元清脑颗粒对APP/PS1双转基因小鼠的学习记忆能力具有改善作用,及有一定的抗神经元凋亡作用。
小鼠;阿尔茨海默病;补元清脑颗粒;Morris水迷宫;Western Blot
阿尔茨海默病(alzheimer's disease,AD)是老年人常见的一种与衰老相关的神经系统退行性疾病,起病隐匿,呈进行性发展。随着全球人口老龄化的发展,AD的发病率不断上升,为家庭和社会带来沉重的负担。研究如何延缓衰老和防治老年病,通过预见其发生而进行有针对性、个体化的防治,使“健康老龄化”成为一种医学发展的方向。中医认为,AD的病因病机多为年迈体衰,元气亏虚,髓海不足,脑失所养,神机失用,清窍不明。研究元气与AD病因病机的关系及培元固本法对AD的治疗作用对于AD的防治具有重要意义。本研究选用APP/PS1双转基因小鼠作为AD动物模型,从行为学、Bax及Bcl-2蛋白的表达入手,研究补元清脑颗粒对APP/ PS1双转基因小鼠学习记忆及Bax、Bcl-2表达的影响。
1 实验材料
1.1 实验动物 SPF级5月龄APP/PS1双转基因小鼠40只,雄性,中国医学科学院实验动物研究所订购,许可证号:SCXK(京)2013-0002。SPF级5月龄相同遗传背景C57BL/6J小鼠10只,雄性,中国医学科学院实验动物研究所订购,许可证号:SCXK(京)2012-0001。
1.2 药 品 补元清脑颗粒(由石菖蒲、远志、人参、茯苓、熟地等组成,湖北虎泉药业有限公司加工成为中药颗粒中试产品,批号201305。纯水配成0.39g/ mL,冰箱4℃储存备用)。多奈哌齐(盐酸多奈哌齐片,卫材药业有限公司,批号H20050978)。
1.3 仪器与试剂 小鼠独立通气系统(型号:S8智能型,苏州市苏杭科技器材有限公司)。Morris水迷宫(型号:DMS-2,中国医学科学院药物研究所)。蛋白电泳仪(美国Bio-Rad公司)。凝胶图像成像分析仪(美国Bio-Rad公司)。SDS-PAGE凝胶配制试剂盒(批号P0012A,上海碧云天生物技术有限公司)。一抗(兔抗鼠GAPDH抗体,批号ABS16;兔抗鼠Bax抗体,批号AB2915;兔抗鼠Bcl-2抗体,批号AB10546,均购自美国millipore公司)。二抗(羊抗兔二抗,购自武汉科瑞生物技术有限公司)。
2 实验方法
2.1 动物分组及给药 用SPSS19.0统计软件产生一组随机数字表,将5月龄APP/PS1双转基因小鼠随机分成5组,即模型组、多奈哌齐组、补元清脑颗粒高剂量组(以下简称高剂量组)和补元清脑颗粒低剂量组(以下简称低剂量组),每组10只。同月龄C57BL/6J小鼠10只作为空白组。空白组和模型组每天灌胃生理盐水,其余各组分别灌胃相应药物,多奈哌齐组0.65mg/(kg·d),补元清脑颗粒高剂量组15.6g/(kg·d),补元清脑颗粒低剂量组7.8g/(kg·d)。正常适应性喂养1周后开始灌胃,各组小鼠均灌胃20mL/kg,每天灌胃1次,连续灌胃30天。
2.2 Morris水迷宫测试 各组小鼠均进行Morris水迷宫测试,末次给药结束后24h进行。参照文献Morris水迷宫[1]方法。Morris水迷宫主要由一个圆形水池、一个圆形平台和自动录像及分析系统三部分组成。水池高70cm,直径100cm,由于APP/PS1双转基因小鼠皮毛为黑色,为了使自动录像及分析系统能够识别小鼠游泳轨迹,预先在水池中加入奶粉-清水混悬液,搅拌均匀,使池水呈乳白色,平台位于第一象限中央。调整水池上方的摄像机位置,使其能拍摄到整个水池,同步采集记录小鼠游泳轨迹。通过定位航行试验(place navigation)和空间探索试验(spatial probe)来分析小鼠的学习获取能力和空间记忆能力。
2.2.1 定位航行试验 将小鼠面向池壁,每天分别从平台对侧象限(第四象限)的两个顶点处放入水中,记录其在90s内寻找到平台的时间(即上平台潜伏期),历时2天。当小鼠在设定的训练时间90s内找到并爬上平台,且停留时间达3s时,计算机停止跟踪,记录下游泳轨迹,并自动计算出动物的上平台潜伏期及游泳总路程等指标;若小鼠在90s之内尚未找到平台,则上平台潜伏期按90s记录,同时将小鼠引至平台停留20s引导其学习与记忆。第3天随机选取其中一个点入水,训练成绩即为定位航行试验结果,以上平台潜伏期和游泳总路程作为衡量其学习记忆能力的指标。
2.2.2 空间探索试验 第4天将平台撤除,进行空间探索试验,任选平台对侧象限(第四象限)的一个入水点将小鼠放入水中,开始90s的空间探索试验。记录动物在90s内穿越平台次数、目标象限时间和第1次抵原平台时间,以此作为空间记忆的检测指标。
2.3 Western Blot法检测Bax及Bcl-2蛋白的表达 小鼠Morris水迷宫测试结束后立即颈椎脱臼法处死,冰上断头,剥开头颈部皮毛,暴露颅骨,沿枕骨大孔剪开,取出鼠脑,分离两侧海马组织,放入冻存管,浸入液氮急冻,立即放入超低温冰箱-80℃冻存。RIPA法提取小鼠海马总蛋白,BCA法测定蛋白浓度,进行蛋白凝胶电泳,运行Bio-Rad凝胶图像成像分析系统,曝光获得各组蛋白条带,拍照,采用Bio-Rad凝胶图像成像分析系统分析各组条带灰度值,并作统计分析。
2.4 统计学方法 应用SPSS19.0统计软件进行分析,结果以(±s) 表示,两组比较采用t检验,多重比较采用单因素方差分析。
3 实验结果
3.1 Morris水迷宫测试
3.1.1 各组小鼠定位航行试验结果 与空白组比较,模型组小鼠上平台潜伏期明显延长(P<0.01),游泳总路程明显增加(P<0.01);与模型组比较,各组小鼠的上平台潜伏期均缩短(P<0.01,P<0.05),游泳总路程均减少(P<0.01,P<0.05),且补元清脑颗粒高剂量组和低剂量组间呈现出一定的量效关系;与多奈哌齐组比较,补元清脑颗粒高剂量组和低剂量组小鼠的游泳总路程明显减少(P<0.01)见表1。
表1 各组小鼠定位航行试验结果比较(±s)
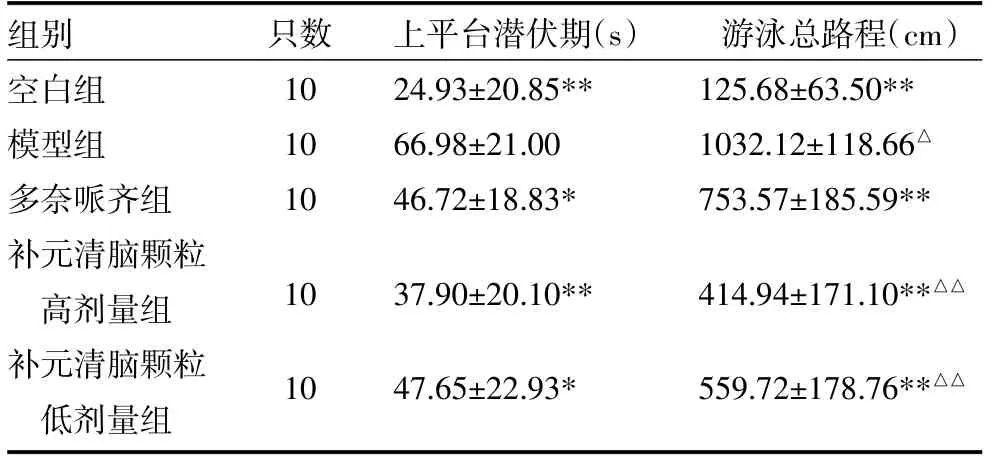
表1 各组小鼠定位航行试验结果比较(±s)
注:与模型组比较,*P<0.05,**P<0.01;与多奈哌齐组比较,△P<0.05,△△P<0.01
组别空白组模型组多奈哌齐组补元清脑颗粒高剂量组补元清脑颗粒低剂量组只数10 10 10上平台潜伏期(s)24.93±20.85** 66.98±21.00 46.72±18.83*游泳总路程(cm)125.68±63.50** 1032.12±118.66△753.57±185.59** 1037.90±20.10**414.94±171.10**△△1047.65±22.93*559.72±178.76**△△
3.1.2 各组小鼠空间探索试验 与空白组比较,模型组小鼠的穿越平台次数、目标象限时间均明显减少(P<0.01),第1次抵原平台时间明显延长(P<0.01);与模型组比较,补元清脑颗粒高剂量组和低剂量组小鼠穿越平台次数增加(P<0.01,P<0.05),各组小鼠的目标象限时间增加(P<0.01,P<0.05),第1次抵原平台时间缩短(P<0.01,P<0.05)见表2。
表2 各组小鼠空间探索试验结果比较(±s)

表2 各组小鼠空间探索试验结果比较(±s)
注:与模型组比较,*P<0.05,**P<0.01
组别空白组模型组多奈哌齐组补元清脑颗粒高剂量组补元清脑颗粒低剂量组只数10 10 10穿越平台次数6.10±1.70** 1.80±1.41 3.70±1.72*目标象限时间(s)17.83±6.96** 5.55±4.42 12.60±6.58* 第1次抵原平台时间(s)6.87±3.72** 51.71±20.96 27.85±20.69** 105.90±1.60**17.71±7.58**21.36±20.22** 104.60±1.71*14.07±7.08**27.82±21.96**
3.2 Western Blot法检测各组小鼠Bax及Bcl-2蛋白表达 与空白组比较,模型组小鼠海马组织Bcl-2蛋白相对表达量减少(P<0.05),Bcl-2/Bax比值增加(P<0.01);与模型组比较,各组小鼠海马组织Bcl-2蛋白相对表达量增加(P<0.01,P<0.05),Bcl-2/Bax比值均增加(P<0.01,P<0.05)。补元清脑颗粒高、低剂量组各指标与多奈哌齐组比较差异无统计学意义(P>0.05)见表3,图1。
表3 各组小鼠海马组织Bax、Bcl-2蛋白相对表达量比较(s)
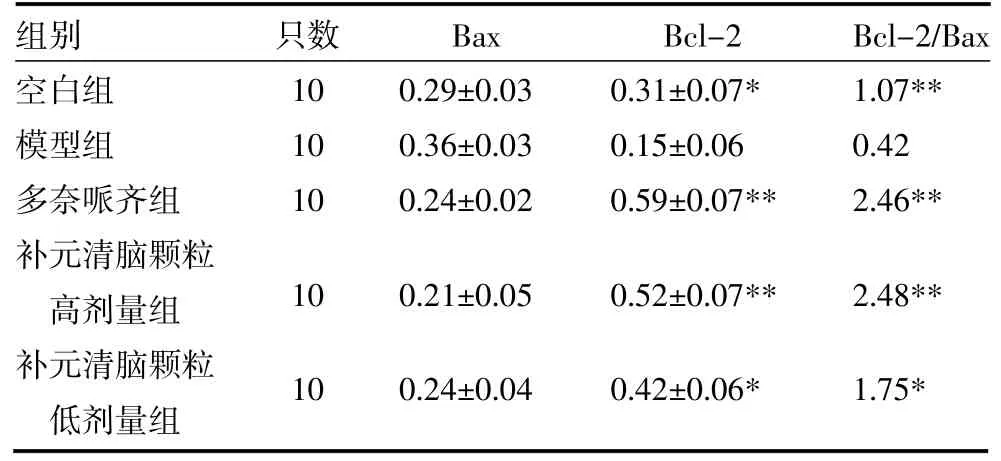
表3 各组小鼠海马组织Bax、Bcl-2蛋白相对表达量比较(s)
注:与模型组比较,*P<0.05,**P<0.01
只数10 10 10 Bax 0.29±0.03 0.36±0.03 0.24±0.02 Bcl-2/Bax 1.07** 0.42 2.46** 0.52±0.07** Bcl-2 0.31±0.07* 0.15±0.06 0.59±0.07** 2.48** 0.21±0.05 10 0.24±0.04 100.42±0.06*1.75*组别空白组模型组多奈哌齐组补元清脑颗粒高剂量组补元清脑颗粒低剂量组

图1 APP/PS1双转基因小鼠海马组织Western Blot结果
4 讨论
AD是一种不可逆的神经退行性疾病,临床表现为进行性记忆和认知障碍。AD的发病原因尚不明确,其主要的病理表现为β-淀粉样蛋白(β-Amyloid,Aβ)沉积,老年斑(senile plaque,SP)形成,tau蛋白过度磷酸化和神经纤维缠结(neurofibrillary tangles,NFTs)[2]。AD的特征是大脑皮层及某些皮层下区域的神经元和神经突触丧失,在AD早期就出现突触和神经元的大量丢失,中期AD病人内嗅区皮质神经元丢失达50%。尸检报告提示,AD患者脑中一些神经元通过凋亡机制蜕变,在AD相当早期阶段,神经元已经普遍出现DNA损伤,这种损伤甚至也可在无神经纤维缠结的神经元见到,而且似乎在疾病全程中都存在[3]。最新的研究[4]表明,Aβ相关的神经细胞凋亡是AD发病的重要环节。老年斑的主要成分Aβ是各种原因诱发AD的共同通路,聚集的Aβ是一种毒性蛋白,使细胞的钙离子稳态发生紊乱,从而诱导细胞凋亡[5]。Bcl-2/Bax是凋亡的各种信号转导途径的共同交汇点[6]。
Bax被认为是线粒体损伤的重要诱导分子,当死亡信号刺激后,激活的Bax移动到线粒体的外膜上,改变线粒体膜的通透性,Bax还能直接结合到线粒体膜通透性转运孔(MPTP),增强线粒体膜的通透性,促进凋亡因子(AIF)释放,从而启动凋亡信号途径。Bcl-2是一种抗细胞凋亡蛋白,与促凋亡蛋白Bax结合成异二聚体,具有抑制Bax的促凋亡作用[7]。实验证明,Aβ诱导的海马神经元凋亡是通过下调Bcl-2表达和上调Bax的表达实现,通过Bax抑制剂的使用,或敲除Bax基因,可以显著减少Aβ诱导的细胞凋亡[8]。
研究指出,APP/PS1双转基因小鼠在3月龄就出现认知行为学变化,5月龄出现老年斑,6~7月龄的小鼠脑内会形成Aβ沉淀,12月龄有大量老年斑形成,其空间学习能力明显受损[9]。APP/PS1双转基因小鼠作为AD动物模型已被广泛应用于研究PS1 在Aβ沉积中的作用,以及Aβ在AD发病过程中的作用,是研究AD病情进展和预防治疗的理想动物模型[10]。
补元清脑颗粒是导师王平教授根据老年性痴呆元气亏虚、痰浊蒙窍的病机,结合多年临床经验组方而成,由石菖蒲、远志、人参、茯苓、熟地等中药组成,具有培元固本,化痰清脑的作用。本实验结果表明,补元清脑颗粒可以明显提高APP/PS1双转基因小鼠学习记忆能力,提高APP/PS1双转基因小鼠海马组织Bcl-2蛋白相对表达量,且结果与多奈哌齐无明显差别,说明补元清脑颗粒对AD模型小鼠的学习记忆能力具有较好的改善作用,且具有一定的抗神经元凋亡作用。
[1]Vorhees CV,Williams MT.Morris water maze:proced ures for assessing spatial and related forms of learning and memory [J].Nat Protoc,2006,1(2):848-858.
[2]Hawkes N.Amyloid plaques are still main target for Alzheimer's drugs[J].BMJ,2016,13(352):214-223.
[3]Margaret ME,Virginia MY Lee,John Q,et al.The Neuropathology of Dementia,Second Edition[M].London:Cambridge University Press,2004:465-466.
[4]Cinzia S,Carla P,Pietro C.Substance P and Alzheimer's disease:emerging novel roles[J].Curr Alzheimer Res,2016,13 (12):1567-1574.
[5]Guglielmotto M,Monteleone D,Piras A,et al.Aβ1-42 monomers or oligomers have different effects on autophagy and apoptosis[J].Autophagy,2014,10(10):1827-1843.
[6]Tian X,Zeng G,Li X,et al.Cantharidin inhibits cell proliferation and promotes apoptosis in tongue squamous cell carcinoma through suppression of miR-214 and regulation of p53 and Bcl-2/Bax[J].Oncol Rep,2015,33(6):3061-3068.
[7]Jia DP,Wang S,Zhang BC,et al.Paraptosis triggers mitochondrial pathway-mediated apoptosis in Alzheimer's disease [J].Exp Ther Med,2015,10(2):804-808.
[8]Zhang J,Ke KF,Liu Z,et al.Th17 Cell-Mediated Neuroinflammation Is Involved in Neurodegeneration of Aβ1-42-Induced Alzheimer's Disease Model Rats[J].PLoS One,2013,8(10):7578-7586.
[9]宗园媛,王晓映,王海林,等.APP/PS1双转基因阿尔茨海默病小鼠模型的老年斑及行为学动态分析[J].中国比较医学杂志,2008,18(9):8-12.
[10]Lok K,Zhao H,Shen H,et al.Characterization of the APP/ PS1 mouse model of Alzheimer's disease in senescence accelerated background[J].Neurosci Lett,2013,17(557):84-89.
(收稿:2016-04-09 修回:2016-06-22)
Effect of Buyuanqingnaokeli on the Ability of Learning and Memory and the Expression of Bax and Bcl-2 in APP/PS1DoubleTransgenicMice
PAN Yihong1,WANG Ping2. 1DepartmentofChineseMedicine,Hangzhou First People's Hospital,Hangzhou(310006),China;2 Institute of Geratology,Hubei University of Chinese Medicine,Wuhan(430065),China
ObjectiveTo investigate the effect of buyuanqingnaokeli on the ability of learning and memory and the expression of Bax and Bcl-2 in APP/PS1 double transgenic mice.MethodsForty APP/PS1 double transgenic mouse models were established and divided into 4 groups:model group,western medicine(donepezil)group, buyuanqingnaokeli (BYQNK)high-dose and low-dose groups,with 10 mice in each.Ten C57BL/6J mice with the same months of age and genetic background served as blank group.The equivalent volume of saline was given to model and blank groups.After gavage the corresponding drugs once a day for 30 days,Morris test was measured to assess the ability of learning and memory,and Bax and Bcl-2 in the hippocampus tissue of different groups were detected with Western Blot.ResultsCompared to model group,BYQNKL high-dose and low-dose groups had reduced platform latency(37.90±20.10s vs 66.98±21.00s,P<0.01;47.65±22.93s vs 66.98±21.00s,P<0.05),total swimming distance(414.94±171.10cm,559.72±178.76cm vs 1032.12±118.66cm,P<0.01)and the time to reach the original platform for the first time(21.36±20.22s,27.82±21.96s vs 51.71±20.96s,P<0.01),target quadrant time (17.71±7.58s,14.07±7.08s vs 5.55±4.42s,P<0.01)and increased through platform number (5.90±1.60,4.60±1.71 vs 1.80±1.41,P<0.01 or P<0.05)and the relative transcript level of Bcl-2(0.52±0.07,0.42±0.06 vs 0.15±0.06,P<0.01 or P<0.05).ConclusionBYQNKL can improve the ability of learning and memory of APP/PS1 doubletransgenic mice,showing certain anti-apoptosis effects.
Mice;Buyuanqingnaokeli;Alzheimer's disease;Morris test;Western Blot
国家自然科学基金重点项目(No.81130064)
1杭州市第一人民医院中医科(杭州 310006);2湖北中医药大学(武汉 430065)
王平,Tel:027-68890008;E-mail:pwang@aliyun.com
