无溃疡样变Stanford B型主动脉壁间血肿的治疗
2016-02-06王志伟化召辉刘仕睿张林枫
李 浩 王志伟 化召辉 徐 鹏 曹 辉 刘仕睿 马 珂 张林枫 李 震
郑州大学第一附属医院腔内血管外科,郑州 450052
•临床论著•
无溃疡样变Stanford B型主动脉壁间血肿的治疗
李 浩 王志伟 化召辉 徐 鹏 曹 辉 刘仕睿 马 珂 张林枫 李 震*
郑州大学第一附属医院腔内血管外科,郑州 450052
目的 探讨主动脉壁无溃疡样变的Stanford B型主动脉壁间血肿(intramural hematoma,IMH)的保守治疗效果。方法 回顾性分析2013年9月至2015年9月郑州大学第一附属医院收治的28例无溃疡样变的Stanford B型IMH患者的临床资料。所有患者均采用药物保守治疗,在出院前、出院后3、6个月和1年复查主动脉计算机体层摄影血管造影(computed tomography angiography,CTA),观察有无症状复发和血肿的厚度、范围变化情况。结果 28例患者均无症状出院。随访期间,3个月时,17例IMH完全吸收;6个月和1年时,28例IMH完全吸收,无症状复发者。结论 对主动脉壁无溃疡样变的Stanford B型IMH患者进行严格的药物治疗能够取得满意的效果。
急性主动脉综合征;壁间血肿;溃疡样变;假性动脉瘤
IMH是临床上少见的急性主动脉综合征,急性IMH起病急、症状重,以主动脉无明显撕裂口和无真假腔血液直接流动为特点。随着人们对此病认识的提高以及影像学技术的发展,IMH的诊断逐渐增多。目前对IMH的发生、发展及转归了解不多,也没有统一的治疗方法。本文回顾性分析了28例无溃疡样变的Stanford B型IMH患者的临床资料,并总结治疗经验,现报道如下。
1 资料与方法
1.1 一般资料
选择2013年9月至2015年9月郑州大学第一附属医院收治的28例Stanford B型IMH患者,其中男15例,女13例,年龄范围为42~81岁,平均年龄为56.93岁。合并高血压23例,糖尿病4例,冠心病1例,脑梗塞1例。所有患者均接受64排全主动脉CTA扫描,CT图像横断面层厚0.8 mm,经连续观察薄层CT,所有患者的IMH病变段均无溃疡样变。
主动脉溃疡样变(ulcer-like projection,ULP)的影像学诊断标准参照Wu等[1]定义:局灶性的球形对比剂聚集,位于IMH中,龛影口部与主动脉腔相连,内膜破损缺口>3 mm。IMH纳入标准:主动脉壁呈环形或新月形增厚,厚度>5 mm,无内膜破口或真假腔血流交通。血肿最厚处直径为6.74~17.33 mm,平均直径为10.49 mm,血肿最厚处主动脉内径为20.31~32.68 mm,平均内径为24.52 mm。其中10例出现左侧胸腔积液;5例IMH内可见分支动脉假性动脉瘤(branch artery pseudoaneurysms,BAP),其中4例位于胸主动脉,1例位于腹主动脉。
1.2 治疗
确诊后,将患者送入监护室严密监测生命体征,包括心率、血压、氧饱和等,同时给予吸氧、镇静、止疼等处理,静脉给予血管紧张素转换酶抑制剂/血管紧张素受体拮抗剂(ACEI/ARB)、钙离子拮抗剂、β-受体阻滞剂等,单独或联合微量泵泵入,使收缩压控制在90~120 mm Hg,心率控制在60~80次/min,充分降低左心室收缩力,减小左心室射血分数,以减轻血流搏动对主动脉壁的冲击,预防内膜撕裂及其他并发症。保守治疗2周,待病情稳定出院后,改口服降压、降心率药物,维持血压在目标值,3、6个月和1年后定期来院复查。
2 结果
28例患者经治疗后胸背痛或腰腹痛完全缓解,均顺利出院,无症状复发者。所有患者均得到随访,无失访者。随访3个月,17例IMH完全吸收,10例左侧胸腔积液吸收,2例肋间动脉瘤大部分血栓化。随访6个月,28例IMH完全吸收,4例肋间动脉瘤或腰动脉瘤血栓化,无继续扩展者。随访1年,IMH均吸收,无症状复发,无夹层形成者。其中1例IMH患者治疗前后的CT影像学表现,见图1。
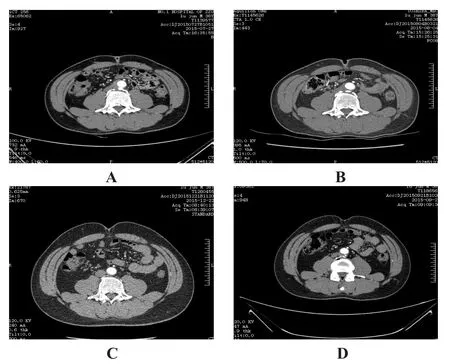
图1 IMH患者的CT表现
3 讨论
急性主动脉综合征是一组以主动脉源性胸背痛和高血压为主要特点的疾病,包括IMH和典型的主动脉夹层(aortic dissection,AD),虽然二者有相似的症状,但IMH与AD的发病机制、发展、治疗及转归却有着明显区别。AD需在早期进行腔内干预治疗且临床效果已得到临床医学者的认可,然而IMH的治疗方式及是否需要手术干预还存在很大分歧。IMH若处理不当,可进展为AD[2,3],但如果进行合适的治疗,那么IMH可以被吸收,出现典型夹层的机会并不大[4,5]。
IMH的发病原因有2种:⑴ 主动脉壁滋养血管破裂;⑵ ULP。目前认为ULP具有“恶性”的特点,如果仅行内科保守治疗,大部分患者将进展为AD、囊性动脉瘤或者破裂[6]。近年来随着影像技术的提高,尤其是64排CT血管造影的应用,使得ULP的诊断较为容易[6]。ULP的直接影像征象是主动脉壁上的溃疡状突起[7],类似消化道溃疡的“龛影”,“龛影”口与主动脉腔相通,呈“狭颈症”。ULP的发生有2种机制:⑴ 主动脉管壁上粥样硬化斑块脱落破溃所致,溃疡周围可见钙化斑;⑵ 主动脉内膜的局灶性炎症或退变引起[8]。文献[9]报道,约40%的IMH合并ULP。溃疡的存在往往影响IMH的治疗,合并ULP提示IMH的不稳定性,不稳定的IMH可进一步发展为致命性AD。而无溃疡样变的Stanford B型IMH患者,由于缺乏撕裂的内膜瓣和真假腔的血液流动,患者的血流动力学改变较AD的改变小,可选择保守治疗[10]。此类IMH的发生可能是由于主动脉内膜微小的撕裂口形成,血流灌注入动脉壁间至IMH发生后撕裂口闭合,无法观察到明显的破裂口;也可能是因为患者突然血压升高,主动脉管壁及中膜平滑肌细胞收缩,压迫中膜内穿行的滋养动脉,同时主动脉内血液高速灌注入滋养动脉内,滋养动脉内压力骤升、破裂,血液破入动脉壁内形成IMH。因此,此类IMH的血肿位于中膜与外膜之间,而且更靠近外膜,与病理上的表现相一致[11]。由于内膜是完整的,IMH发生后进行如下处理可取得满意效果[12]:立即给予降压、扩血管、降心率等处理,充分减小血流对动脉壁的冲击,同时消除患者紧张情绪,降低交感神经对平滑肌细胞的影响,使得滋养动脉内压力减低,血肿局限化。唐兴奎等[13]分析了28例急性Stanford B型IMH患者的临床资料,结果显示多数IMH能在12个月内完全吸收,近中期效果良好,血肿最大厚度≤10 mm的患者吸收速度和吸收率均高于血肿最大厚度>10 mm的患者。血肿厚度和内膜侵蚀情况是判断IMH预后的重要因素。本组患者严格保守治疗2周后行全主动脉CTA复查,示IMH厚度、范围未继续增大,3个月时17例IMH完全吸收,6个月时28例IMH完全吸收,无并发症发生。
本研究中有4例血肿内出现局限性强化灶,表现为突出于主动脉腔外但局限于外膜内的增强影,在增强CT中与主动脉等强度,连续观察CT发现强化灶与主动脉有细小的交通,远端延续为分支动脉(支气管动脉、腰动脉),这种局限性强化灶需要与ULP相鉴别。Williams等[14,15]发现,假性动脉瘤的分布与主动脉分支动脉的分布相一致,而ULP无此特征,认为IMH内假性动脉瘤来源于主动脉小分支动脉,是夹层或血肿撕裂至分支动脉开口处时,主动脉内膜被掀起,分支小动脉受损甚至断裂,血流破出动脉外但被周围血肿和主动脉外膜局限在主动脉壁间而形成,属于BAP。Williams等认为,BAP与ULP的根本区别在于强化灶是否与主动脉腔有明显的交通,ULP与主动脉腔有明显的缺口,而BAP的主动脉内膜是完整的,在任何水平都无法看到明显的破口。Cronin等[16]进一步细化了BAP与ULP的区别,认为诊断ULP的标准是其与主动脉腔的破口直径>3 mm。
有研究[17,18]表明,血肿内局限性强化灶的有无对IMH的吸收并无明显影响,急性期的血肿内强化可进行密切的影像学监测,并不需要介入干预。由于BAP有良好的流出道(支气管动脉、肋间动脉、腰动脉),所以在严格控制血压的情况下BAP内可血栓化,其继续进展的风险并不大。本组4例患者出现BAP,经保守治疗后,6个月时BAP内血栓化,IMH完全吸收。
综上,对于病变段无溃疡样变的Stanford B型IMH,采用严格的保守治疗可取得满意的效果。同时,在IMH患者中鉴别BAP与ULP非常重要,BAP有良好的预后, 并不影响IMH的吸收。
[1] Wu MT, Wang YC, Huang YL, et al. Intramural blood pools accompanying aortic intramural hematoma: CT appearance and natural course[J]. Radiology, 2011, 258 (3): 705-713.
[2] Eggebrecht H, Plicht B, Kahlert P, et al. Intramural hematoma and penetrating ulcers: indications to endovascular treatment[J]. Eur J vasc Endovasc Surg, 2009, 38 (6): 659-665.
[3] Evangelista A, Eagle KA. Is the optimal management of acute type a aortic intramural hematoma evolving[J]. Circulation, 2009, 120 (21): 2029-2032.
[4] 蒋俊豪,季瀛豪,郭大乔,等. 急性Stanford B型主动脉夹层腔内修复术的指证和治疗时机选择[J]. 中华外科杂志,2009,47(23):1784-1786.
[5] Finn JP, Nael K, Deshpande V, et al. Cardiac MR imaging: state of the technology[J]. Radiology, 2006, 241 (2): 338-354.
[6] 张国飞,倪一鸣. 穿透性主动脉溃疡在主动脉壁间血肿中的作用进展[J]. 中华急诊医学杂志,2011,20(5):549-550.
[7] 杨学东,徐文坚,李绍科,等. 穿透性粥样硬化性主动脉溃疡的MSCTA表现[J]. 临床放射学杂志,2007,26(8):779-782.
[8] 李绍东,张秀莉,徐凯,等. 急性壁间血肿合并穿透性主动脉溃疡的MSCTA诊断[J]. 临床放射学杂志,2012,31(8):1098-1101.
[9] Lee YK, Seo JB, Jang YM, et al. Acute and chronic complications of aortic intramural hematoma on follow-up computed tomography: incidence and predictor analysis[J]. J Comput Assist Tomogr, 2007, 31 (3): 435-440.
[10] Kitai T, Kaji S, Yamamuro A, et al. Impact of new development of ulcer-like projection on clinical outcomes in patients with type B aortic dissection with closed and thrombosed false lumen[J]. Circulation, 2010, 122 (11 Suppl): S74-80.
[11] Uchida K, Imoto K, Takahashi M, et al. Pathologic characteristics and surgical indications of superacute type A intramural hematoma[J]. Ann Thorac Surg, 2005, 79 (5): 1518-1521.
[12] Grimm M, Loewe C, Gottardi R. Novel insights into the mechanisms and treatment of intramural hematoma affecting the entire thoracic aorta[J]. Ann Thorac Surg, 2008, 86 (2): 453-456.
[13] 唐兴奎,熊江,许永乐,等. 急性Stanford B型主动脉壁间血肿患者近中期随访结果及CT形态变化[J]. 中华医学杂志,2013,93(9):649-652.
[14] Williams DM, Cronin P, Dasika N, et al. Aortic branch artery pseudoaneurysms accompanying aortic dissection. Part Ⅰ. Pseudoaneurysm anatomy[J]. J Vasc Interv Radiol, 2006, 17 (5): 765-771.
[15] Williams DM, Cronin P, Dasika N, et al. Aortic branch artery pseudoaneurysms accompanying aortic dissection. Part Ⅱ. Distinction from penetrating atherosclerotic ulcers[J]. J Vasc Interv Radiol, 2006, 17 (5): 773-781.
[16] Cronin P, Carlos RC, Kazerooni EA, et al. Aortic branch artery pseudoaneurysms accompanying aortic dissection. PartⅢ: natural history[J]. J Vasc Interv Radiol, 2012, 23 (7): 859-865.
[17] Park GM, Ahn JM, Kim DH, et al. Distal aortic intramural hematoma: clinical importance of focal contrast enhancement on CT images[J]. Radiology, 2011, 259 (1): 100-108.
[18] 王志伟,王家祥,李震,等. 无钙化B型主动脉壁间血肿的治疗[J]. 介入放射学杂志,2014,23(3):210-213.
Treatment of Stanford B aortic intramural hematoma without ulcer-like projection
LI Hao WANG Zhi-wei HUA Zhao-hui XU Peng CAO Hui LIU Shi-rui MA Ke ZHANG Lin-feng LI Zhen*
Department of Endovascular Surgery, the First Affiliated Hospital of Zhengzhou University, Zhengzhou 450052, China
Objective To explore the effect of conservative treatment for Stanford B aortic intramural hematoma (IMH) without ulcer-like projection. Methods During the period from September 2013 to September 2015, 28 patients with Stanford B aortic IMH without ulcer-like projection were treated in the First Affiliated Hospital of Zhengzhou University, the clinical data were retrospectively analyzed. All the patients received conservative treatment. Computed tomography angiography (CTA) of the aorta was performed before discharge, as well as 3, 6, 12 months postdischarge, in order to observe the symptom recurrence and the changes of the thickness and range of the hematoma. Results All the patients were asymptomatic post-discharge. During the follow-up period, the intramural hematoma was absorbed completely in 17 patients after 3 months; after 6 and 12 months, the intramural hematoma was absorbed in 28 patients and there was no recrudescence patient. Conclusion For Stanford B aortic IMH without ulcer-like projection, conservative treatment can achieve satisfactory results.
acute aortic syndrome; intramural hematoma; ulcer-like projection; pseudoaneurysm
R543.1
A
10.19418/j.cnki.issn2096-0646.2016.06.02
*通信作者:李震,E-mail:lizhen1029@hotmail.com
