抑制HPV18型E7蛋白的表达对Hela 细胞生物学特性及miR-204表达的影响
2016-02-06周燕飞祖月娥
范 幸,周燕飞,祖月娥
(长沙市妇幼保健医院妇科门诊,湖南 长沙 410007 )
抑制HPV18型E7蛋白的表达对Hela 细胞生物学特性及miR-204表达的影响
范 幸,周燕飞,祖月娥
(长沙市妇幼保健医院妇科门诊,湖南 长沙 410007 )
目的 通过小干扰RNA(siRNA)抑制宫颈癌Hela细胞中人乳头瘤病毒(HPV)18型E7的表达,研究E7蛋白对Hela细胞的生物学特性和miR-204表达的影响和关系,探索HPV致癌的分子机制。方法设计合成靶向HPV18型E7基因的siRNA,转染Hela细胞,抑制HPV18-E7的表达;采用RT-PCR和Western blot分别检测Hela细胞中HPV18-E7的mRNA和蛋白水平,用流式细胞术检测Hela细胞的细胞周期和凋亡,通过荧光实时定量PCR检测miR-204的表达水平。结果pRNAT-HPVE7与两个对照组比较,明显抑制了Hela细胞HPV18-E7的mRNA(t值分别为2.69、2.46,均P<0.05)和蛋白(t值分别为3.93、4.20,均P<0.05)的表达,细胞周期趋于正常,凋亡率增高(t值分别为-6.87、-6.92,均P<0.05),miR-204表达水平也明显升高(t值分别为0.26、0.22,均P<0.05)。结论抑制HPV18-E7基因的表达能改变Hela细胞的生物学特性和上调miR-204表达。
小干扰RNA;HPV E7蛋白;miR-204;细胞周期;细胞凋亡
全球每年有50多万例新发的宫颈癌,而我国每年新发宫颈癌也超过13万例,其中约8万例死于宫颈癌,居国内女性恶性肿瘤发病率和死亡率的第2位,且宫颈癌的发病呈逐年上升趋势。研究发现在约90%宫颈癌组织中可检测到人类乳头瘤病毒,其中HPV16/18等高危型HPV感染与宫颈癌密切相关[1]。而人乳头瘤病毒(Human papillomavirus, HPV)的E6、E7蛋白表达是维持肿瘤细胞处于转化活性状态所必须的[2]。miRNA是新近发现的内源性非蛋白编码的单链小分子RNAs,长度18~24nt,广泛存在于动物等多细胞真核生物中。主要通过与靶基因mRNA的3'-非翻译区(3'-UTR)的序列互补而在转录后水平调控靶基因表达。多项研究显示,miRNA表达的改变与人类肿瘤发生、发展和病毒感染密切相关[3]。研究HPV致病蛋白与miRNA的关系是探索宫颈癌的发生发展的分子机制的新途径,为宫颈癌的基因治疗提供了新的可能性。
1 材料与方法
1.1 实验材料
本研究于2014年9月至2015年8月在中南大学肝病研究所完成,相关实验材料包括:胎牛血清购自Gibico公司,DMEM(高糖)细胞培养基购自HyClone公司,胰酶购自Amresco公司,转染阳离子脂质体lipofectemin 2000购于美国Invitrogen公司,G418和MTT试剂购自Promega公司,逆转录聚合酶链反应(Reverse transcription Polymerase Chain Reaction,RT-PCR)试剂盒购自Fermentas公司。鼠抗HPV18 E7单克隆抗体、鼠抗人β-actin单克隆抗体和HRP标记的羊抗鼠IgG均购自Santa Cruz公司,HeLa细胞株为本实验室保存。
1.2 实验方法
1.2.1 小干扰RNA的设计与合成
根据Genebank上公布的HPV18-E7编码基因的序列(Y18491.1),按照小干扰RNA(Small interfering RNA,siRNA)筛选原则获得多个靶点序列,通过同源性验证确定与人类基因并无同源,最后筛选获得一个靶点序列为:CGAGCAATTAAGCGACTCA,再根据靶点序列设计成E7-siRNA:CGAGCAAUUAAGCGACUCA,按照以上步骤设计一条随机序列的阴性对照NC-siRNA:AGUAGUAACGAUGC ̄CACCA,并由上海生工生物工程有限公司合成,并用绿色的异硫氰酸荧光素(Fluorescein isothiocyanate,FITC)作标记,以示踪siRNA的转染效率。
1.2.2 Hela细胞的培养和转染
将宫颈癌Hela细胞株从液氮中取出、复苏,使用完全培养基(含10%胎牛血清的DMEM高糖培养基)重悬,置37℃、5%CO2 的培养箱内培养,细胞贴壁生长至80%~90%融合状态时用0.25%胰酶消化进行传代培养。将培养的Hela细胞分三组接种到60mm培养皿中,按照说明书,使用阳离子脂质体lipofectemin 2000将对照NC-siRNA和靶标E7-siRNA分别转染其中两组细胞,另一个组细胞作为空白对照不作任何处理。细胞转染24h后更换新鲜培养基,继续培养至72h,收集细胞。
1.2.3 人乳头瘤病毒18-E7的mRNA和蛋白表达水平检测
收集细胞,用Trizol试剂吹打溶解细胞,严格按照说明书步骤,提取细胞总RNA。各取2μgRNA进行逆转录,按照RT-PCR试剂盒操作步骤合成cDNA,以cDNA为模板,以GAPDH作为内参照,运用PCR扩增目的基因HPV-E7,HPV-E7的上游引物为:5'- ATGCATGGACCTAAGGCA -3', HPV-E7的下游引物为:5'- TTACTGCTGGGATGCACA -3',扩增片段的长度为318bp;GAPDH的上游引物为:5'- CAAGGTCATCCATGA ̄CAACTTTG -3',GAPDH的下游引物为:5'- GTCCACCACC ̄CTGTTGCTGTAG -3',扩增片段长度为496bp。PCR条件为:94℃预变性3min,进入循环:94℃变性30sec、60℃退火30sec、72℃延伸30sec,共30个循环,然后72℃延伸7min。PCR产物经2%琼脂糖凝胶电泳分析。实验重复3次,电泳图片应用Scion Image软件分析灰度值,并计算相对定量值,公式为:相对定量值=目的基因灰度值/内参基因灰度值。
收集3组Hela细胞,加入细胞裂解液(50mmoL/LTris pH 8.0,150mmol/L NaCl,1%PMSF,0.1% Aprotinin,1% Trinton X-100),混匀后置冰上15 min,13 000rpm,离心5min,收集上清液为胞浆蛋白,BCA蛋白定量法测定蛋白浓度。分别取等量蛋白40ug,12%SDS-PAGE电泳,湿式电转移法把蛋白转移至硝酸纤维素膜(NC膜)上,再用3%脱脂牛奶室温封闭2h。加鼠抗HPV18 E7单克隆抗体为一抗(1:1 000),以鼠抗人β-actin单克隆抗体为内参抗体(1:2 000)。4℃孵育过夜,PBST洗膜3次。加入HRP标记的羊抗鼠IgG为二抗(1:2 000),37℃孵育2 h, PBST洗膜3次。于暗室滴加ECL化学发光液,然后压片、显影、定影。实验重复3次,应用Scion Image软件分析灰度值,并计算相对定量值,公式为:相对定量值=目的基因灰度值/内参基因灰度值。
1.2.4 流式细胞术检测3组细胞的周期变化和凋亡水平
分别转染了对照NC-shRNA和靶标E7-shRNA的细胞和空白对照细胞,培养72h后使用0.25%的胰酶将细胞消化下来,各加入完全培养基终止消化,吹打混匀,2 000rpm离心5min,然后用PBS洗涤细胞一次,2 000rpm离心5min收集细胞沉淀,最后用70%乙醇重悬固定细胞。细胞送北京鼎国生物公司进行细胞流式检测细胞周期和凋亡。
1.2.5 Real-Time检测miR-204在3组细胞中的水平
按照Trizol一步法提取细胞中总RNA,并通过分光光度计定量。各取2μgRNA,加入miR-204及U6逆转录引物进行逆转录,引物序列分别是miR204-RT:5'-GTCGTATCCAGTG ̄CAGGGTCCGAGGTATTCGCACTGGATACGACAGGCAT-3',U6-RT:5'- TTCACGAATTTGCGTGTCAT -3'。转录完成后,取cDNA适量加入miR-204或U6扩增引物,对miR-204和U6进行real-time PCR扩增,引物序列分别是:U6-F:5'- CGCTT ̄CGGCAGCACATATAC-3';U6-R:5'- TTCACGAATTTG ̄CGTGT ̄CAT -3';Mir204 -F:5'-TCGCCTTCCCTTTGTCATCCT-3';Mir204-R:5'-GTGCAGGGTCCGAGGT-3'。PCR仪自动读取荧光数据绘制扩增曲线,最终获得扩增CT值,按照相对定量的数学模型,根据公式:RQ=2-△△CT,计算出miR-204在3组细胞中的相对表达量,并进行比较和统计学分析。
2 结果
2.1 Hela细胞的培养和转染
由于合成的siRNA都标记了绿色荧光素FITC,在siRNA转染后24h即可在荧光显微镜下观察到细胞内的绿色荧光素FITC,而空白对照细胞则无法观察到绿色荧光,证明NC-siRNA和E7-siRNA均已经成功转染到Hela细胞中(图1)。
2.2 RT-PCR和Western Blot分别检测HPV18-E7的mRNA和蛋白表达水平
RT-PCR结果显示,HPV18-E7的mRNA在空白对照组细胞(Blank)和随机对照siRNA转染细胞(NC-siRNA)中均高表达,而E7-siRNA转染细胞中HPV18-E7的mRNA表达水平很低,说明E7-siRNA对HPV18-E7的mRNA起到了RNA干扰作用(图2、图3)。Wester Blot结果显示,在空白对照组细胞(Blank)和随机对照siRNA转染细胞(NC-siRNA)中,HPV18-E7蛋白质的表达水平均很高。而E7-siRNA转染细胞中HPV18-E7的蛋白质表达水平很低,说明E7-siRNA对HPV18-E7的蛋白表达水平也起到了很大的抑制作用(图4、图5)。
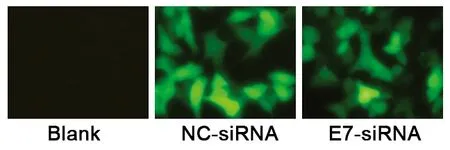
注:Blank为空白对照细胞;NC-siRNA为随机对照siRNA转染细胞;E7-siRNA为HPV-E7的siRNA转染细胞。
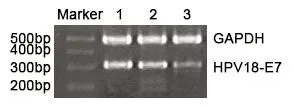
注:1.空白对照细胞;2.随机对照siRNA转染细胞;3.HPV18-E7的siRNA转染细胞。
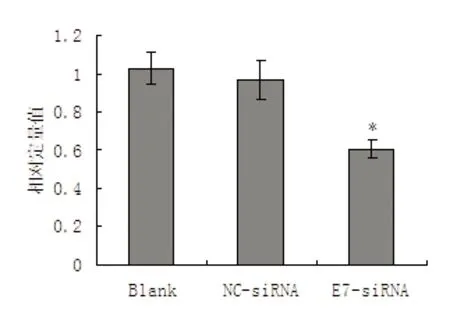
注:* 表示与两个对照组比较,有统计学差异(t值分别为2.69和2.46,均P<0.05)
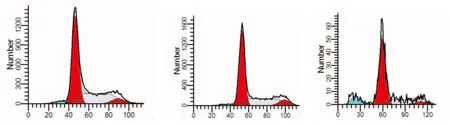
2.3 流式细胞术检测3组细胞的周期变化和凋亡水平
由流式细胞结果可知,两个对照组之间没有显著性差异,而与两个对照组相比,E7-siRNA组细胞的G1期阻滞,G2期和S期比率相应降低,凋亡率却明显升高(见表1、图6)。
2.4 Real-Time PCR检测miR-204在3组细胞中的水平
实验结果显示,对照组之间比较,miR-204的表达水平并无统计学差异,而E7-siRNA组与两个对照组比较,miR-204表达显著升高,这表明HPV18-E7被抑制后上调了miR-204的表达(见图7)。

注:1.空白对照细胞;2.随机对照siRNA转染细胞;3.HPV18-E7的siRNA转染细胞。
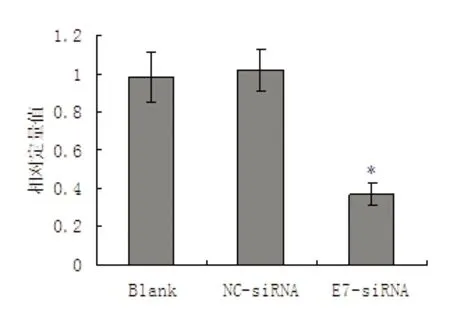
注:*表示与两个对照组比较,有统计学差异(t值分别为3.93和4.20,均P<0.05)
Blank NC-siRNA E7-siRNA
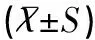
表1 流式细胞术检测3组细胞的细胞周期和凋亡率

注:(Blank:空白对照细胞,NC-siRNA:随机对照siRNA转染细胞;E7-siRNA:HPV-E7的siRNA转染细胞。*表示与两个对照组比较,有统计学差异(t=0.26和0.22,P<0.05)
图7 Real-time PCR检测miR-204在3组细胞中的水平
Fig.7 The levels of miR-204 in cells among three groups detected by Real-time PCR
3 讨论
3.1 靶向siRNA对Hela细胞HPV18-E7的mRNA和蛋白水平的影响
Hela细胞是取自一位美国妇女的子宫颈癌组织,它是被人乳头状病毒第18型(HPV18)感染并转化的永生化细胞系。1984年,德国病毒学家楚尔豪森利用Hela细胞证明了人乳头状病毒(HPV)会导致宫颈癌发生。通过本实验发现该细胞易于培养、转染效率高,非常适合对HPV蛋白的功能研究。
本数据表明,E7-siRNA可在mRNA和蛋白质水平上明显下调HPV18-E7的表达。研究发现,高危型HPV的E6、E7能够增加外源DNA 插入宿主基因组的频率,导致在大多数浸润性宫颈癌均有高危型 HPV 的DNA 插入宿主的基因组;而且高危型HPV的E6和E7整合于宫颈癌宿主细胞基因组后可持续稳定表达E6和E7蛋白,并干扰已发生DNA损伤细胞的依赖于p53的G1期阻滞、DNA修复的过程,从而使宿主DNA不稳定,损伤得以累积,易于致癌[4-5]。HPV18-E7在Hela细胞内高表达,通过下调E7的表达,能观察到细胞生物学特性和某些关键分子的变化,可以初步确定E7在致癌方面的分子机制。
3.2 siRNA靶向HPV18-E7对Hela细胞周期和凋亡的影响
当HPV18-E7蛋白的表达下调后,通过流式细胞术观察到Hela细胞的G1期阻滞,凋亡率明显升高。这可能是因为HPV18-E7被siRNA靶向抑制后可上调P53、pRb、P16等细胞周期及凋亡相关蛋白的表达,从而抑制Hela细胞的生长和增殖,并促进了Hela细胞的凋亡[6]。同时也说明HPV18-E7在改变细胞周期和细胞抗凋亡方面的重要作用。
3.3 si RNA靶向HPV18-E7对Hela细胞miR-204水平的影响
miR-204定位于人类9号染色体上73424891~73425000位置之间。成熟的单链miRNA分子序列为5'UUCCCU ̄UUGUCAUCCU ̄AUGCCU3',miR-204的成熟序列在人、小鼠、大鼠、大象和金鱼等脊椎动物中表现为高度保守。近年研究表明miR-204可能成为一种新的抑癌基因,它通过抑制靶mRNA翻译或诱导靶mRNA降解在转录后水平调控基因表达,具有抑癌基因的功能[7-9]。据报道,miRNA-204等在子宫内膜腺癌中与邻近的非肿瘤性的内膜组织相比,显著低表达,这对于研究miR-204在HPV感染导致的宫颈癌中的作用起到了指导作用[10]。
通过RNA干扰技术下调Hela细胞内源性病毒蛋白HPV18-E7的表达,还观察到具有抑癌作用的miR-204水平随着HPV18-E7蛋白表达的抑制而升高。我们经过软件预测发现与宫颈癌关系密切的癌基因Ezrin[11]的3'非编码序列上有miR-204结合的靶点。因此推断,HPV18-E7可能通过抑制miR-204的表达,来上调Ezrin的表达,这有可能是HPV致宫颈癌的一条分子途径,其分子机制有待我们进一步验证和探索,可能为宫颈癌的基因治疗提供新的靶标。
[1]de Sanjose S, Quint W G, Alemany L,etal.Human papillomavirus genotype attribution in invasive cervical cancer: a retrospective cross-sectional worldwide study[J]. Lancet Oncol,2010,11(11):1048-1056.
[2]任睿,刘会玲,祝秉东,等.高危型HPV E6、E7蛋白致宫颈癌的分子机制研究[J].甘肃中医学院学报,2010,27(4):70-74.
[3]Hu X, Schwarz J K, Lewis J S Jr,etal.A microRNA expression signature for cervical cancer prognosis[J].Cancer Res,2010,70 (4):1441-1448.
[4]孙志辉,岳天孚.人乳头瘤病毒16/18型与宫颈癌[J].国际妇产科学杂志,2010,37(2):119-121,138.
[5]Liu S S,Tsang P C,Chan K Y,etal.Distribution of six oncogenic types of human papillomavirus and type 16 integration analysis in Chinese women with cervical precancerous lesions and carcinomas[J]. Tumour Biol, 2008, 29(2):105-113.
[6]Qi Z, Xu X, Zhang B,etal. Effect of simultaneous silencing of HPV-18 E6 and E7 on inducing apoptosis in HeLa cells[J]. Biochem Cell Biol,2010,88(4):697-704.
[7]Lee Y, Yang X, Huang Y,etal. Network modeling identifies molecular functions targeted by miR-204 to suppress head and neck tumor metastasis[J]. PloS Comput Biol,2010, 6(4):e1000730.
[8]Chung T K,Lau T S,Cheung T H,etal.Dysregulation of microRNA-204 mediates migration and invasion of endometrial cancer by regulating FOXC1[J]. Int J Cancer, 2012, 130(5):1036-1045.
[9]Chen L,Yan H X,Yang W,etal.The role of microRNA expression pattern in human intrahepatic cholangiocarcinoma[J]. J Hepatol, 2009, 50(2):358-369.
[10]Wu W, Lin Z, Zhuang Z,etal. Expression profile of mammalian microRNAs in endometrioid adenocarcinoma[J]. Eur J Cancer Prev, 2009, 18(1):50-55.
[11]Tan J, Zhang C, Qian J.Expression and significance of Six1 and Ezrin in cervical cancer tissue[J].Tumour Biol,2011,32(6):1241-1247.
[专业责任编辑:张忠明]
Effects of inhibiting expression of human papillomavirus type18 E7 protein on biological properties of Hela cells and expression of miR-204
FAN Xing, ZHOU Yan-fei, ZU Yue-e
(OutpatientDepartmentofGynecology,ChangshaHospitalforMaternalandChildHealthCare,HunanChangsha410007,China)
Objective To study on the effects of E7 protein on biological properties of Hela cells and expression of miR-204 through inhibiting the expression of human papillomavirus type 18 E7 (HPV18-E7) protein in cervical cancer Hela cells with small interfering RNA (siRNA) so as to explore the molecular mechanism of HPV carcinogenesis. Methods SiRNA targeting HPV18-E7 was designed and synthesized, and siRNA was transfected into Hela cells to inhibit the expression of HPV18-E7. Reverse transcription-polymerase chain reaction (RT-PCR) and Western blot were used to assess the level of mRNA and protein of HPV18-E7 in Hela cells. In addition, flow cytometry was used to detect cell cycle and apoptosis of Hela cells. Florescent real-time quantitative PCR was used to measure the level of miR-204 expression. Results Compared with two control groups, results showed that pRNAT-HPVE7 could significantly inhibit the expression of mRNA (tvalue was 2.69 and 2.46, respectively, bothP<0.05) and protein (tvalue was 3.93 and 4.20, respectively, bothP<0.05) of HPV18-E7 in Hela cells. Besides, cell cycle showed a tendency to be normal while an increase was witnessed in apoptosis rate (tvalue was -6.87 and -6.92, respectively, bothP<0.05). In addition, a significant increase in miR-204 expression was also seen (tvalue was 0.26 and 0.22, respectively, bothP<0.05).Conclusion Inhibited expression of HPV18-E7 genes can lead to changes in the biological properties of Hela cells and up-regulation of miR-204 expression.
small interfering RNA (siRNA); HPV18-E7 protein; miR-204; cell cycle; apoptosis
2015-09-07
范 幸(1977-),女,副主任医师,在读硕士研究生,主要从事妇科肿瘤的研究。
祖月娥,主任医师。
10.3969/j.issn.1673-5293.2016.06.008
R737.3
A
1673-5293(2016)06-0694-04
