脂联素在糖尿病心肌病心肌纤维化中的抗氧化作用
2016-02-01张伟张静周义文令文萍
张伟 张静 周义文 令文萍
糖尿病的发病率越来越高,已成为社会公共卫生问题。其中,糖尿病心肌病(diabetic cardio myopathy,DCM)是导致糖尿病死亡的主要原因之一[1],DCM作为一种独立的糖尿病并发症,其发病率高,危害性大。目前已受到了广泛关注,然而对其发病机制的研究尚处于初级阶段,因此进一步探索其发病机制,制定更加有效的防治措施,已成为当前糖尿病和心脏病学界关注的热点。大量研究表明,DCM的发生是多因素的,其中,重要因素之一是心肌的纤维化[2]。脂联素(Adiponectin,APN)因其具有通过促进脂肪酸氧化和促进组织葡萄糖利用而降低血糖的作用,从而逐渐被认为是一种糖尿病心脏病的保护性因子[3]。但其在糖尿病心肌病心肌纤维化中的作用效应及其机制尚不十分清楚。因此本研究旨在观察APN是否能够改善糖尿病心肌病心肌纤维化并通过抗氧化实现其作用机制。
资料与方法
1.动物模型制作:雄性wister大鼠60只,体重150~200g(广州中医药大学实验动物中心提供),随机分为APN组、DETC+APN组、Saline组,每组20只。所有大鼠禁食12h后腹腔注射链脲佐菌素(用0.1%枸橼酸-枸橼酸钠缓冲液,Ph4.2配制1%STZ,55mg/kg)(美国Sigrna公司)制备糖尿病模型,造模72h后大鼠尾静脉采血测血糖>16.7mol/L;尿糖(+++~++++),且具有体重减轻、多饮、多食、多尿现象为糖尿病成模。
2.实验分组与药物治疗:三组大鼠于造模后每天分别给予腹腔注射APN、DETC+APN、Saline(APN:1.5×103μg/kg;DETC:750mg/kg;购自Sigma公司),持续至造模后第16周末。空腹麻醉取材。
3.标本采集及实验项目:(1)每组20只,于第16周末清晨空腹称体重,5%水合氯醛(0.5ml/10g体重)腹腔注射麻醉,心内采血,离心后取血清测血糖、APN。
(2)超声心动图测定左心功能:用带有10MHz探头的超声心动图仪(VIVID7,GE,USA)检测左心室功能。测量左心室舒张末期内径(LVEDD),左心室收缩末期内径(LVESD),左心室舒张末期容积(LVEDV),左心室收缩末期容积(LVESV)。短轴缩短率(FS)=[(LVEDD-LVESD)/LVEDD]×100。射血分数(EF)=[(LVEDV-LVESV)/LVEDV]×100。
(3)心肌病理学样本制备:大鼠过量麻醉处死后取出心脏,PBS冲洗后置于10%中性福尔马林溶液中室温下固定12h。脱水处理后按冠状水平将左心室平均切成三段,每段均石蜡包埋切片,厚6μm,脱蜡后行HE染色、Masson′s染色和超氧阴离子特异性荧光探针二氢乙啡啶(DHE)染色。HE染色在光镜下可以观察心肌细胞形态变化。Masson′s染色光镜下观察可见胶原呈绿色、细胞核呈蓝色、心肌纤维呈红色。随机选择每张切片的10个区域应用Image Pro Plus software 6.0图像分析系统计算心肌组织中胶原容积分数(CVF)。
(4)测定心肌胶原总含量:取一定量左心室心肌组织匀浆后酸解并调pH为7,离心取上清加1ml过氧酸(3.15mol/L)混匀放置5min后加10%对二氨苯甲醛1ml,并置于80℃水浴6min,取出后冰水浴30min;分光光度计560nm处比色测定。对照羟脯氨酸标准品绘制的标准曲线得出羟脯氨酸含量,计算心肌胶原总含量。
(5)氧化应激原位检测:心肌切片标本加入DHE(1μmol/L)在黑暗中孵育5min。PBS冲洗后,在激发波长为543nm,激光共聚焦显微镜(Zeiss LSM510)下观察红色荧光,以Zeiss Lsmib图像分析系统分析红色荧光量应评估氧化应激情况。
4.统计学处理:采用SPSS13.0统计学软件进行处理,同一只动物用药前后观察值的比较采用配对t检验,多组样本间的多重比较采用单因素方差分析并采用析因分析Bonferroni检验。所有数据均以均数±标准差(±s)表示。P<0.05为差异有统计学意义。
结 果
1.死亡率与糖尿病发生率:STZ造模后16周时,Saline组和DETC+APN组分别死亡4只和2只,均为12周前死亡,而APN组无死亡发生。在STZ造模后12周时,Saline组和DETC+APN组发生糖尿病大鼠分别为14只(87.5%)和10只(55.5%),而 APN组6只发生糖尿病(30.0%)。
2.左心室功能:与Saline组大鼠相比,APN组和DETC+APN组大鼠左心室舒张末期内径(LVEDD)、左心室收缩末期内径(LVESD)、左心室舒张末期容积(LVEDV)和左心室收缩末期容积(LVESV)均显著减少(P<0.05),短轴缩短率(FS)和射血分数(EF)显著升高(P<0.05)。与APN组大鼠相比,DETC+APN组大鼠LVEDD、LVESD、LVEDV和LVESV均显著增加(P<0.05),FS和EF显著降低(P<0.05)(表1)。
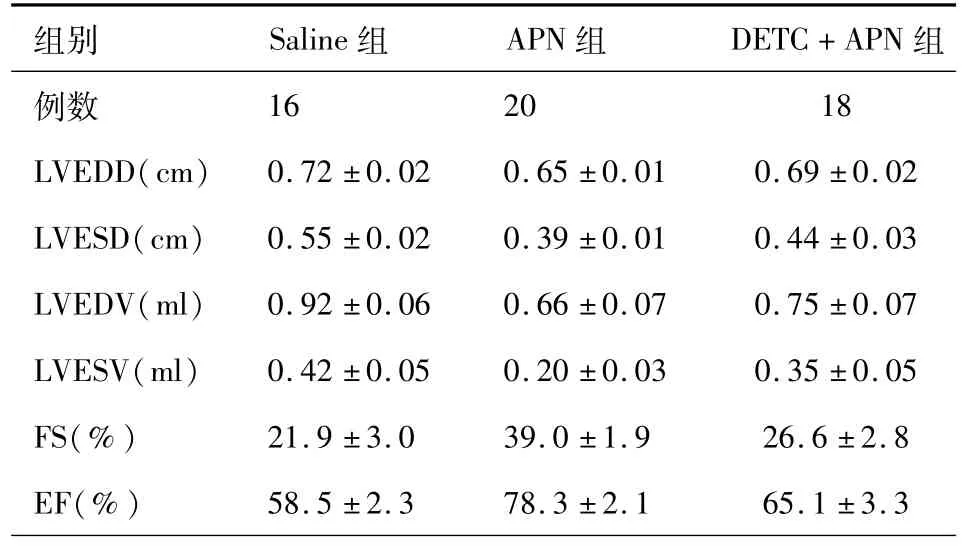
表1 左心功能的超声心动图参数比较
3.心肌纤维化情况:如图1所示,与Saline组大鼠相比,APN组和DETC+APN组大鼠CVF显著降低(P<0.05);与APN组大鼠相比,DETC+APN组大鼠CVF显著增加(P<0.05)。APN组心肌胶原总含量低于Saline组大鼠(3.63±0.32)μg/mgvs(4.68±0.44)μg/mg,(P<0.05),DETC+APN组显著高于APN组心肌胶原总含量(4.29±0.35)μg/mgvs(3.63±0.32)μg/mg,(P<0.05)。
4.心肌氧化应激情况:与Saline组大鼠相比,APN组和DETC+APN组大鼠氧化应激显著降低(P<0.05);与APN组大鼠相比,DETC+APN组大鼠氧化应激显著增加(P<0.05)(图2)。
讨 论
脂联素(Adiponectin,APN)是脂肪细胞分泌的一种脂肪细胞因子,由Scherer等[4]于1995年首先从鼠的脂肪细胞分离出来,是一种胰岛素增敏剂。流行病学调查发现,血浆APN浓度降低是胰岛素抵抗、糖代谢障碍以及2型糖尿病发生的独立预测因素[5]。在不同的胰岛素抵抗(IR)动物模型体内,补充APN能提高胰岛素敏感性[6-7]。多项研究证实APN是2型糖尿病发病的独立危险因素。有研究报道,APN能够影响脂肪和糖类的代谢、血管内皮分泌功能,作为与能量代谢有密切关系的因子,APN与心脏疾患发生和发展有密切关系[8]。Schulze等[9]对已经确诊的2型糖尿病患者进行了为期5年的随访研究,最终的结果显示APN与糖尿病患者心血管事件的发生有关。

图1 心肌纤维化情况
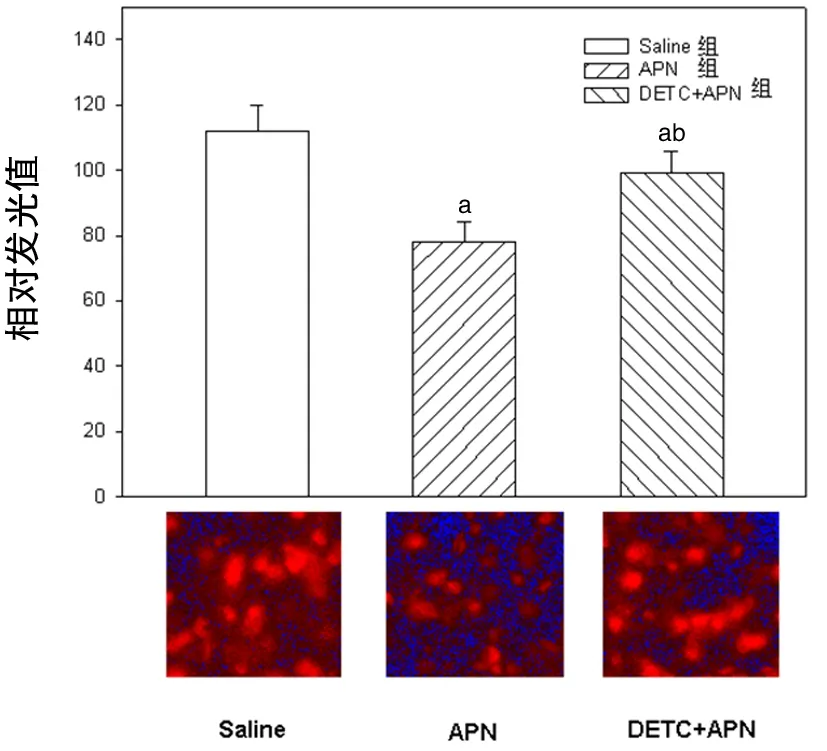
图2 心肌氧化应激情况
糖尿病心肌病的重要特征是间质纤维化,这会降低心室顺应性从而导致心肌收缩和舒张功能障碍[10]。有研究显示,在糖尿病心肌病患者的血浆中APN浓度明显低于正常人。本研究16周末心肌病理结果也显示Saline组大鼠心肌细胞内胶原数量明显增多、间质中胶原沉积增多,各型胶原比率失调和排列紊乱。而APN组显著改善,胶原容量分数(CVF)显著降低,证明APN治疗能够延缓糖尿病心肌病心肌纤维化。另外,有研究发现APN与氧化应激相关。氧化应激参与糖尿病心肌纤维化发生、发展。糖尿病心肌纤维化发生机制包括心肌代谢障碍、肾素-血管紧张素系统(RAS)激活及内皮素增多、细胞因子、微循环障碍等。而RAS激活,尤其是局部RAS激活与心肌纤维化过程密切相关。RAS激活过程中血管紧张素II与AT1受体结合,促进NADPH氧化酶来源的ROS生成增多。国外研究也表明,高血糖诱导的氧化应激通过增加AGEs和AGE受体表达并引起级联信号,最终导致间质性纤维化。脱氢表雄酮(DHEA)治疗通过改善氧化平衡,消除增加的AGE受体激活和增加的血纤维蛋白溶酶原因子,并恢复组织胶原I、胶原IV和纤维结合素达到与正常大鼠同样的水平[11]。Motoshima等[12]研究发现APN可抑制氧化低密度脂蛋白(oxLDL)诱导的内皮细胞的细胞内活性氧(ROS)的产生,减轻内皮细胞oxLDL对内皮源性一氧化氮合酶(eNOS)的抑制,增加NO的生成。另一项血浆APN与氧化应激的相关性研究也表明,APN与氧化应激水平呈负相关[13]。细胞水平实验证实APN能够抑制高脂血症大鼠血管内皮细胞生成超氧化物和过氧亚硝酸盐[14]。本研究也发现腹腔注射STZ诱导的糖尿病大鼠的心肌氧化应激显著增加,而经早期APN干预治疗的大鼠心肌氧化应激减弱。但APN干预是直接降低心肌氧化应激还是通过降低血糖,减弱高血糖刺激从而降低氧化应激,本文未做进一步探讨。有研究报导,给予DETC和APN联合应用能逆转APN的治疗效应。结果发现,促进ROS生成的DETC的应用部分逆转了APN的抗心肌纤维化作用,提示APN的抗心肌纤维化效应是通过抑制氧化应激途径实现的。
综上所述,提示APN早期干预治疗能够通过抗氧化应激降低糖尿病心肌病心肌纤维化和改善心功能。APN治疗在推迟心肌纤维化;延缓DCM的病理进程;改善其预后;降低死亡率中具有重要的临床意义。
[1] Laakso M,Hyperglyeaemia and cardiovascular disease in type 2 diabetes[J].Diabetes,1999,48(5):937-942.
[2] Sajad A,Billal,Rajdeep S,et al.Diabetic cardiomyopathy:mechanisms,diagnosis and treatment[J].Clin Sci,2004,107:539-2557.
[3] Randeva HS,Manu V,Bee KT,et al.Raised plasma adiponectin levels on type 1 diabetic pregnancies[J].Clinical Endocrinology,2006,65:17-21.
[4] Scherer PE,Willians S,FoglianoM,et al.A novel serum protein similar to C1q,produced exclusively in adipocytes[J].J Biol Chem,1995,270(45):2646-2649.
[5] Snijdex MB,Heine RJ,Seidell JC,et al.Associations of Adiponectin Levels with Incident Impaired Glucose Metabolism and Type 2 Diabetes in O1dexMen and Women:the Hoom Study[J].Diabetes Care,2006,29(11):2498-2503.
[6] Yamauchi T,Kamon J,Waki H,et al.The fat-derived hormone adiponectin reverses insulin resistance associated with both 1ipoarophy and obesity[J].Nat Med,2001,7:941-946.
[7] Berg AH,Combs TP,Du X,et al.The adipocyte-secreted protein Acrp30 enhances hepatic insulin action[J].Nat Med,2001,7:947-953.
[8] Gonon AT,Widegren U,Bulhak A,et al.Adiponectin protects against myocardial ischaemia-reperfusion injury via AMP-activated protein kinase,Akt,and nitric oxide[J].Cardiovasc Res,2008,78(1):116-122.
[9] TsaiWC,Lin CC,Chen JY,et al.Association of adiponectin with procollagen type I carboxyterminal propeptide in non-diabetic essential hypertension[J].Blood Press,2008,17(4):233-238.
[10] Fonarow GC,SrikanthanP.Diabetic cardiomyopathy[J].Endocrinol MetabClin North Am,2006,35:575-599.
[11] Manuela Aragno,Raffaella Mastrocola,Giuseppe Alloatti,et al.Oxidative Stress Triggers Cardiac Fibrosis in the Heart of Diabetic Rats[J].Endocrinology,2008,149(1):380-388.
[12] Motoshima H,Wu X,Mahadev K,et al.Adiponectin suppresses proliferation and superoxide generation and enhances eNOS activity in endothelial cells treated with oxidized LDL[J].Biochem Biophys Res Commun,2004,315:264-271.
[13] Nakanishi S,Yamane K,Kamei N,et al.A protective effect of adiponectin against oxidative stress in Japanese Americans:the association between adiponectin or leptin and urinary isoprostane[J].Metabolism,2005,54:194-199.
[14] Li R,WangWQ,Zhang H,etal.Adiponectin improvesendothelial function in hyperlipidemic rats by reducing oxidative/nitrative stress and differential regulation of eNOS/iNOSactivity[J].Am J Physiol Endocrinol Metab,2007,293:1703-1708.
