HPLC-DAD同时测定金蝉花中8种核苷类成分的含量
2016-01-31吕慧慧杨安伦
吕慧慧,杨安伦,张 浩
HPLC-DAD同时测定金蝉花中8种核苷类成分的含量
吕慧慧1*,杨安伦1,张浩2
[摘要]目的建立同时测定金蝉花中腺嘌呤、胞嘧啶、肌苷、尿嘧啶、尿苷、β-胸苷、腺苷和2-脱氧腺苷8种核苷类成分的HPLC测定方法。方法采用Inertsil ODS-SP Extend C18(250 mm×4.6 mm,5.0 μm)色谱柱,流动相:甲醇-水梯度洗脱,流速1 mL/min,检测波长260 nm,柱温25 ℃,进样量10 μL。结果腺嘌呤、胞嘧啶、肌苷、尿嘧啶、尿苷、β-胸苷、腺苷和2-脱氧腺苷8种核苷类成分分别在0.081~1.62、0.074~1.48、0.098~1.85、0.068~1.36、0.071~1.42、0.051~1.01、0.058~1.16、0.068~1.34 μg内呈良好的线性关系(R2≥0.999 0),平均加样回收率分别为97.8%、98.3%、101.5%、98.9%、99.1%、97.3%、100.6%、98.9%,RSD<3.00%。结论该方法简单、重现性良好,准确可靠,可用于金蝉花药材的快速质量评价。
[关键词]金蝉花;核苷类成分;HPLC
[Abstract]ObjectiveTo establish a method for simultaneous determination of 8 nucleosides (Adenine,Cytosine,Inosine,Uracil,Uridine,β-thymidine,Adenosine and 2’-deoxyadenosine) from cordyceps cicadae.MethodsThe analysis was achieved with an Inertsil ODS-SP Extend C18column (250 mm×4.6 mm,5.0 μm) by gradient elution of methanol and water at 25 ℃.The flow rate was 1 mL/min,injection volume was 10 μL,and detection wavelength was set at 260 nm.ResultsAll the active constituents′ calibration curves showed a good linearity (R2≥0.999 0) in a relatively wide concentration range.The liner range of the active constituents was 0.081~1.62,0.074~1.48,0.098~1.85,0.068~1.36,0.071~1.42,0.051~1.01,0.058~1.16,0.068~1.34 μg,respectively.The average recovery rate was 97.8%,98.3%,101.5%,98.9%,99.1%,97.3%,100.6%,98.9%,RSD<3.00%.ConclusionThis method is simple with good reproducibility,accuracy and reliability,it can be used for the rapid quality evaluation of cordyceps cicadae.
收稿日期:2015-06-17
通信作者*
DOI:10.14053/j.cnki.ppcr.201512019
HPLC-DAD method for simultaneous determination of 8 nucleosides in cordyceps cicadaeLÜ Hui-hui1*,YANG An-lun1,ZHANG Hao2(1.Zhejiang Provincial Hospital of TCM,Hangzhou 310018,China;2.Zhejiang Chinese Medical University,Hangzhou 310053,China)
Key words:Cordyceps cicadae;Nucleosides;HPLC
0引言
金蝉花[1](Cordyceps cicadae)为麦角菌科真菌大蝉草(Cordyceps cicadae Shing)寄生于蝉科昆虫的若虫上形成的虫菌复合体,又名蝉花、蝉茸、虫花、蝉虫草、蝉茸菌,其性味甘寒,具散风热、定惊镇痉、明目之功效,属于虫草类药材,主产于浙江、四川等地。金蝉花含有丰富的生物活性成分,如多种生物碱、多糖[2]、核苷类成分[3-4]、虫草酸、多种必需氨基酸[5]等有效成分。现代药理研究表明,金蝉花具有改善肾功能[6]、治疗糖尿病[7]、抗失血性贫血、调解机体免疫功能等临床疗效。 核苷类成分是金蝉花中重要的生物活性物质,既参与胞内遗传物质的合成,又与蛋白质表达及细胞的分裂增殖有关[8]。腺嘌呤参与遗传物质的合成,能促进白细胞增生,用于防治各种原因引起的白细胞减少症,特别是用于肿瘤化学治疗时引起的白细胞减少症,也用于急性粒细胞减少症[9]。胞嘧啶是一种重要的医药中间体,常用于抗艾滋病、慢性乙型肝炎和肿瘤药物的合成[10]。肌苷为辅酶类药物,能参与体内能量代谢及蛋白质合成,具有提高各种酶特别是辅酶Ade 活性、改善抗体代谢作用。尿嘧啶干扰病毒DNA、RNA的复制,抑制病毒增殖,保护细胞免受病毒损害[11]。尿苷有助于提高细胞的耐缺氧能力,并能促进蛋白质、核酸的生物合成,阻断癌细胞和病毒基因合成[12]。β-胸苷是核苷类物质的重要组成部分,也是抗艾滋病药物齐多夫定的合成原料。腺苷是机体内重要的生物活性物质,广泛存在于细胞内液和细胞外液中,在机体的中枢神经、心血管系统、凝血系统等发挥重要作用[13]。2-脱氧腺苷(dAR)是天然的脱氧核苷,具有一定的药用价值,可抑制胰岛素分泌。近年来dAR作为一种合成抗肿瘤、抗病毒核苷类化合物的中间体受到越来越高的关注。
基于金蝉花中核苷类成分种类丰富,疗效显著,本实验对金蝉花中8种核苷类成分含量进行测定,为金蝉花的质量控制提供数据支持。
1仪器与试药
1.1仪器UltiMate 3000戴安液相色谱仪,包括真空脱气泵、四元泵、柱温箱、自动进样器、DAD二极管阵列检测器;KS-80中草药粉碎机(天津泰斯特仪器有限公司);BP210S十万分之一电子天平(Sartorius公司);数控超声波清洗器(昆山市超声仪器有限公司);Inertsil ODS-SP Extend C18(250 mm×4.6 mm,5.0 μm)色谱柱。
1.2试药金蝉花(批号:20140501,产地:杭州,购自浙江中医药大学中药饮片有限公司);腺嘌呤(批号:1108886-201102,100%,中国药品生物制品检定所)、胞嘧啶(C19895,99%,西亚试剂)、肌苷(140669-201305,100%,中国药品生物制品检定所)、尿嘧啶(100469-201312,99.6%,中国药品生物制品检定所)、尿苷(887-200202,100%,中国药品生物制品检定所)、β-胸苷(13650,99%,西亚试剂)、腺苷(110879-200202,中国药品生物制品检定所)、2-脱氧腺苷(U3874,98%,西亚试剂);无水乙醇为分析纯,流动相甲醇为色谱纯,水为纯净水。
2方法与结果
2.1波长的选择用UltiMate 3000 DAD检测器对腺嘌呤、胞嘧啶、肌苷、尿嘧啶、尿苷、β-胸苷、腺苷和2-脱氧腺苷在180~420 nm波段进行扫描,结果表明,选用260 nm为检测波长较为理想。
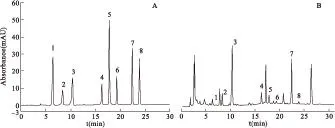
图1核苷类成分对照品和金蝉花样品色谱图
注:A.核苷类成分对照品,B.金蝉花药材;1.腺嘌呤,2.胞嘧啶,3.肌苷,4.尿嘧啶,5.尿苷,6.β-胸苷,7.腺苷,8.2-脱氧腺苷
2.2色谱条件以Inertsil ODS-SP Extend C18(250 mm×4.6 mm,5.0 μm)为色谱柱。甲醇为流动相A,水为流动相B。梯度洗脱:0~10 min,1%~5%A;10~15 min,5%~15% A;15~20 min,15%~20% A;20~30 min,20% A;30~35 min,20%~35% A;35~40 min,35%~1% A。柱温25 ℃,流速1 mL/min,检测波长260 nm。见图1。
2.3对照品溶液的制备精密称取对照品腺嘌呤3.24 mg、胞嘧啶2.96 mg、肌苷3.90 mg、尿嘧啶2.72 mg、尿苷2.84 mg、β-胸苷2.02 mg、腺苷2.32 mg、2-脱氧腺苷2.68 mg分别置于20 mL量瓶中,加甲醇至刻度,溶解摇匀,作为对照品储备液。精密吸取对照品储备液依次稀释成相应对照品溶液,浓度:腺嘌呤8.1、16.2、32.4、81.0、162.0 μg/mL,胞嘧啶7.4、14.8、29.6、74.0、148.0 μg/mL,肌苷9.75、19.5、39.0、97.5、195.0 μg/mL,尿嘧啶6.8、13.6、27.2、68.0、136.0 μg/mL,尿苷7.1、14.2、28.4、56.8、71.0、142.0 μg/mL,β-胸苷5.05、10.1、20.2、50.5、101.0 μg/mL,腺苷5.8、11.6、23.2、58.0、116.0 μg/mL,2-脱氧腺苷6.8、13.4、26.8、68.0、134 μg/mL,进行测定。
2.4供试品溶液的制备称取金蝉花粉末(过三号筛)约0.2 g置具塞锥形瓶中,精密加入20%乙醇溶液25 mL,超声提取30 min,取续滤液,过膜纯化,取供试品液10 μL,注入色谱仪,测定,即得。
2.5线性关系考察将对照品储备液加甲醇稀释2、5、10、20倍制成对照品溶液,精密吸取10 μL,注入液相色谱仪,测得峰面积积分值。以峰面积积分值为纵坐标、8种核苷类对照品进样量(μg)为横坐标,绘制标准曲线,计算回归方程,见表1。
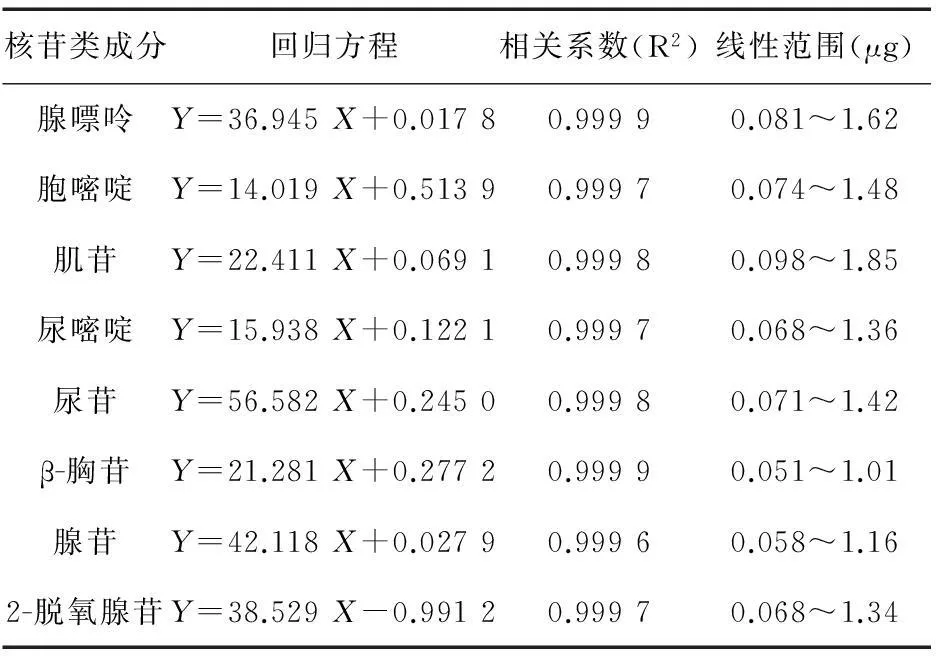
表1 8种核苷类成分线性关系考察结果
结果表明,腺嘌呤在线性范围0.081~1.62 μg、胞嘧啶在线性范围0.074~1.48 μg、肌苷在线性范围0.098~1.95 μg、尿嘧啶在线性范围0.068~1.36 μg、尿苷在线性范围0.071~1.42 μg、β-胸苷在线性范围0.051~1.01 μg、腺苷在线性范围0.058~1.16 μg、2-脱氧腺苷在线性范围0.068~1.34 μg内呈良好的线性关系,符合试验要求。
2.6精密度考察取对照品溶液腺嘌呤32.4 μg/mL、胞嘧啶29.6 μg/mL、肌苷39.0 μg/mL、尿嘧啶27.2 μg/mL、尿苷28.4 μg/mL、β-胸苷20.2 μg/mL、腺苷23.2 μg/mL、2-脱氧腺苷26.8 μg/mL,按上述色谱条件进行进样分析,进样6次,每次10 μL,测定峰面积,并计算RSD分别为腺嘌呤1.58%、胞嘧啶1.17%、肌苷0.86%、尿嘧啶1.94%、尿苷1.28%、β-胸苷1.73%、腺苷0.97%、2-脱氧腺苷1.55%,表明仪器精密度符合试验要求。
2.7加样回收试验取已知含量金蝉花粉末(过三号筛) 0.2 g共6份,分别加入浓度为腺嘌呤32.4 μg/mL、胞嘧啶74.0 μg/mL、肌苷195.0 μg/mL、尿嘧啶68.0 μg/mL、尿苷28.4 μg/mL、β-胸苷20.2 μg/mL、腺苷58.0 μg/mL、2-脱氧腺苷13.4 μg/mL的对照品溶液1 mL,依照上述供试品制备方法及色谱条件制样、测定,并计算回收率、RSD值分别为:腺嘌呤97.8%、2.46%,胞嘧啶98.3%、1.72%,肌苷101.5%、1.04%,尿嘧啶98.9%、2.04%,尿苷99.1%、1.85%,β-胸苷97.3%、2.12%,腺苷100.6%、1.82%,2-脱氧腺苷98.9%、2.83%,结果表明,准确度符合试验要求。
2.8重复性考察取金蝉花粉末(过三号筛)按照上述供试品溶液制备方式平行制备6份供试品溶液,精密吸取10 μL,注入色谱仪,测定并计算。结果样品中腺嘌呤、胞嘧啶、肌苷、尿嘧啶、尿苷、β-胸苷、腺苷、2-脱氧腺苷的平均含量分别为59.08、352.66、1 407.92、319.47、71.23、86.73、467.09、30.39 μg/g、RSD分别为2.37%、1.78%、1.24%、2.12%、2.51%,1.96%、2.09%、2.76%,重复性符合试验要求。
2.9稳定性考察取金蝉花供试品溶液分别于0、5、10、15、20、25、30 h进样,测定腺嘌呤、胞嘧啶、肌苷、尿嘧啶、尿苷、β-胸苷、腺苷、2-脱氧腺苷峰面积值,计算RSD值分别为1.27%、1.84%、0.96%、1.44%、1.73%、1.14%、0.89%、1.92%,表明供试品溶液中核苷类成分在30 h内稳定。
3样品测定
3.1试验样品金蝉花药材分别收购自浙江杭州、台州、安徽亳州、四川成都、江苏常州、江西九江,经浙江中医药大学来平凡教授鉴定,为麦角菌科真菌蝉拟青霉寄生于蝉蛹上的干燥复合体。
3.2含量测定取金蝉花粉末(过三号筛),按上述供试品制备方法制备金蝉花供试液,精密取供试品溶液10 μL,分别进样,记录峰面积,外标定量测得各批次中核苷类成分的含量,结果见表2。
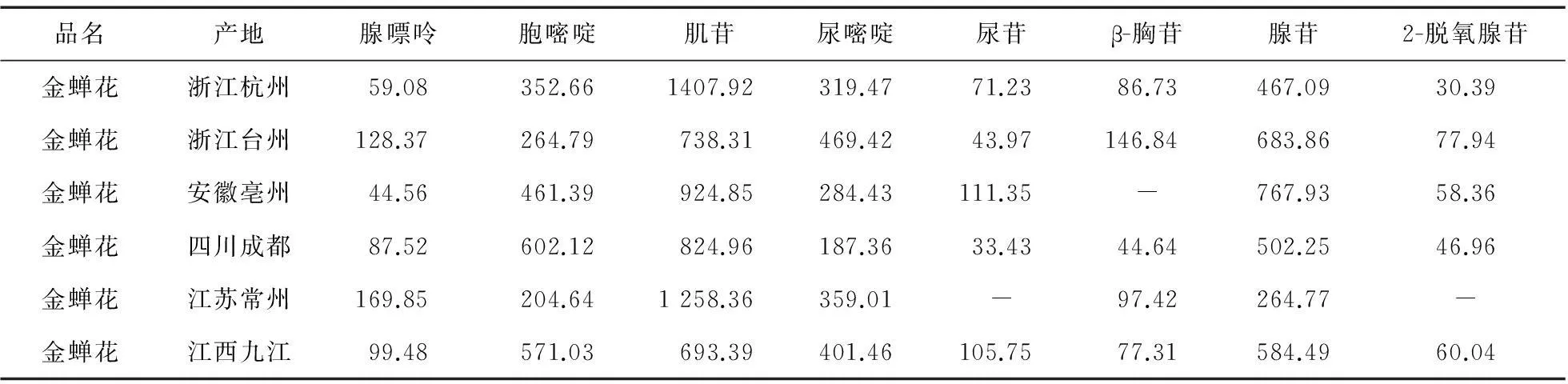
表2 各批次金蝉花核苷类成分含量测定结果(μg/g)
4讨论
4.1检测方法的确定本试验分别对标准品和供试品的线性范围、精密度、准确度、稳定性和重复性进行考察。结果表明,腺嘌呤、胞嘧啶、肌苷、尿嘧啶、尿苷、β-胸苷、腺苷和2-脱氧腺苷8种核苷类成分在相应范围内呈现良好的线性关系(R2≥0.999 0)。加样回收试验显示准确度较高。说明该条件适合对金蝉花核苷类成分进行检测评价。
4.2不同产地金蝉花的比较通过对不同产地金蝉花核苷类成分比较分析,可知不同产地金蝉花核苷类物质组成以及相同物质之间的含量有明显差异,该研究为评价金蝉花质量差异提供依据。
4.3金蝉花的药用前景中医认为,金蝉花是一种功效与冬虫夏草近似的珍贵药材,具有多方面的药用价值。但相较于冬虫夏草对生长环境的要求高、产量少、价格昂贵,金蝉花价格相对低廉,生态要求相对较低,因此可大力开发金蝉花作为冬虫夏草的代用品。
参考文献:
[1]浙江省食品药品监督管理局.浙江省中药炮制规范[S].浙江科学技术出版社,2005:360.
[2]姚婷,罗靖,宋捷民.金蝉花多糖的微波辅助提取工艺研究[J].江西中医学院学报,2012,24(5):73-76.
[3]徐红娟,莫志宏,余佳文.蝉花生物活性物质研究进展[J].中国药业,2009,18(4):19-21.
[4]陈安徽,陈宏伟,徐洋,等.蝉花虫草中核苷类成分的分离纯化和鉴定[J].食品科学,2013,34(1):131-134.
[5]縢晔,官宗华,宋玉良.野生蝉花与人工培养品中氨基酸、无机元素成分的比较[J].浙江中医药大学学报,2012,36(10):1123-1127.
[6]刘玉宁,陈以平,王立红,等.蝉花菌丝对单侧输尿管接扎大鼠肾间质uPA、PAI-1蛋白及mRNA表达的影响[J].中国中西医结合肾病杂志,2012,13(3):197-200.
[7]刘伟敬,赵晓露,谢淑华,等.蝉花通过调控Klotho表达及氧化应激对抗糖尿病大鼠肾小管损伤的研究[J].医学信息,2014,27(10):35-36.
[8]王砚,赵小京,唐法娣.蝉花药理作用的初步探讨[J].浙江中医杂志,2001,36(5):219.
[9]马红霞,周运恒,焦炳华.腺嘌呤核苷受体及其生理学作用[J].医学综述,2004,10(10):589-590.
[10]蔡东,商琳琳,贾云宏,等.胞嘧啶的合成研究进展[J].化工中间体,2009,2(4):14-17.
[11]孙广莲,胡支力,孟红,等.MTT法检测板蓝根抗巨细胞毒效应[J].山东中医药大学学报,2001,24(2):137-138.
[12]王锐.嘧啶核苷的研究进展[J].生物技术通讯,2007,18(3):539-542.
[13]陈霞平,杜士明,王启斌,等.腺苷促进体外培养神经干细胞增殖作用研究[J].医药导报,2008,27(8):911-914.
作者单位:解放军总医院医务部药材处,北京 100853
